El objetivo es describir la tasa de mutaciones de resistencia en los genes de la proteasa y la transcriptasa inversa y la sensibilidad de los diferentes antirretrovirales en nuestro medio.
MétodosEstudio observacional, descriptivo en el cual se estudiaron las muestras remitidas al laboratorio de inmunología clínica desde abril de 2004 hasta abril de 2009. Se analizaron tanto los test de resistencias, como el análisis de sensibilidad a los diferentes fármacos de pacientes en fracaso terapéutico mediante Trugene Hiv-1 Genotyping Kit®.
ResultadosSe registraron las muestras de 242 pacientes, en 61 de ellos no se detectaron resistencias. Las mutaciones más prevalentes según familia de fármacos fueron: para los inhibidores de la transcriptasa inversa análogos nucleosídicos T215a/C/D/F/L/N/S/Y (24,10%), M184g/I/V/W (14,66%), M41j/L/R/T/W (11,24%) y K219e/G/H/N/R/T/W (10,24%). La estavudina y la lamivudina/emtricitabina fueron los que más resistencias presentaron, y el tenofovir es el que tiene menos resistencias en nuestro medio. En cuanto a los no análogos fueron K103N/R (23,98%), V179d/E/I/M/T (10,82%), A98e/G/S (10,53%) y K101e/P/Q/R (9,06%). Nevirapina presentó más resistencias que efavirenz.
Respecto a los inhibidores de la proteasa fueron L10F/I/V (15,95%), M36I/L (13,81%), A71I/T/V (13,10%) y I54l/S/V (7,38%). La combinación darunavir/ritonavir fue la que menos resistencias presentó junto con tipranavir/ritonavir, en contraposición lopinavir/ritonavir fue el que más resistencias obtuvo.
ConclusiónLa resistencia y sensibilidad al tratamiento antirretroviral en nuestro medio fueron similares a las de otros estudios realizados en nuestro país, pero difiere y destaca un alto grado de resistencia a lamivudina/emtricitabina y lopinavir/ritonavir.
The objective is to describe the resistance mutation rate in protease and reverse transcriptase genes and sensitivity to different antiretrovirals in our environment.
MethodsWe performed an observational descriptive study in which we examined the samples provided at the clinical immunology laboratory between April 2004 and April 2009. We analysed both the resistance tests and the sensitivity to different drugs in patients with therapeutic failure using trugene hiv01 genotyping kits®.
ResultsWe registered samples from 242 patients, 61 of which had no detectable resistance. The most prevalent mutations according to drug families were: for nucleoside analog reverse transcriptase inhibitors T215A/C/D/F/L/N/S/Y (24.10%), M184G/I/V/W (14.66%), M41J/L/R/T/W (11.24%) and K219E/G/H/N/R/T/W (10.24%). The highest levels of resistance corresponded to stavudine and lamivudine/emtricitabine, and tenofovir produced the least resistance in our environment. The non-analogues were K103N/R (23.98%), V179D/E/I/M/T (10.82%), A98E/G/S (10.53%) y K101E/P/Q/R (9.06%). Nevirapine presented greater resistance than efavirenz.
Protease inhibitors were L10F/I/V (15.95%), M36I/L (13.81%), A71I/T/V (13.10%) and 154L/S/V (7.38%). The combination darunavir/ritonavir combination was that which presented the least resistance, and tipranavir/ritonavir and lopinavir/ritonavir the most resistance.
ConclusionsAntiretroviral resistance and sensitivity to retroviral treatment in our environment was similar to results from other studies in Spain, but differed in the high level of resistance to lamivudine/emtricitabine and lopinavir/ritonavir.
El síndrome de inmunodeficiencia adquirida (SIDA) se ha cobrado la vida de más de 25 millones de personas desde que fue identificado en 1981, constituyendo un tipo de paciente complejo, cuya efectividad farmacológica es multifactorial1. Las resistencias a los fármacos antirretrovirales son un factor predominante en los pacientes VIH positivos, por lo que es necesario el conocimiento de las mismas para comprender la evolución y el resultado de los tratamientos2. Su análisis mediante pruebas genotípicas y fenotípicas se ha generalizado en los últimos años. La información que proporciona resulta una herramienta crucial en la clínica a la hora de instaurar el tratamiento más idóneo, permitiendo una mayor efectividad3,4. De este modo los test de resistencias son considerados actualmente un procedimiento básico en el seguimiento terapéutico de los pacientes VIH positivos, y se encuentran incluidos en las guías de tratamiento de referencia como de máxima utilidad5–7.
Las resistencias pueden ser transmitidas a otras personas, son variables según área y grupo de pacientes estudiados y método empleado. Las cifras de infección reciente por virus resistente varían entre un 7,7% y un 19,2%8.
El conocimiento de los factores que determinan el desarrollo de resistencias a los distintos fármacos antirretrovirales podría ser de utilidad para comprender los fracasos terapéuticos, y podría ayudar en la planificación de las pautas terapéuticas, a ser posible apoyado en resultados de cada situación local9.
El objetivo del estudio es describir la tasa de mutaciones de resistencia en los genes de la proteasa y la transcriptasa inversa del VIH-1 y la sensibilidad de los diferentes antirretrovirales en nuestro medio, con el fin de conocer la situación real de las resistencias a los fármacos antirretrovirales en nuestro hospital.
MétodoEstudio observacional, descriptivo en el cual se estudiaron las muestras remitidas al laboratorio de Inmunología Clínica desde abril de 2004 hasta abril de 2009. Como población a estudio se tomó la totalidad de pacientes en los cuales se realizó un test de resistencias durante el periodo de inclusión, todos ellos con fracaso terapéutico. Las muestras de plasma fueron separadas en un plazo menor de tres horas desde su extracción y conservadas en alícuotas a −85°C. La carga viral se determinó mediante Branched DNA con el sistema VERSANT 440 Molecular System® (Siemens Medical Solutions Diagnostics, Tarrytown, NY, USA) según las instrucciones proporcionadas por el fabricante. El estudio de resistencias se realizó mediante Trugene Hiv-1 Genotyping Kit® y el sistema de secuenciación de ADN Opengene® (Siemens Healthcare diagnostics, Deerfield, USA) para detectar las mutaciones en la proteasa y transcriptasa inversa del VIH-1 según el protocolo autorizado del fabricante. El ARN se aisló previamente mediante QIAamp Viral RNA mini kit® (Qiagen, Hilden, Germany)10.
Se descargaron los resultados a una base de datos Microsoft office Access® 2007, donde se procesaron, seleccionando solo las mutaciones detectadas con significación clínica. Los datos finales se trataron con el programa estadístico SPSS® versión 12.0.
ResultadosSe registraron las muestras de 242 pacientes, 153 varones (63,22%) y 89 mujeres (36,78%) con una edad media de 43,7±9,8 años. Todos ellos con fracaso virológico de causa multifactorial: falta de adherencia al tratamiento o posible resistencia farmacológica. En 61 (25,20%) no se encontraron mutaciones con significación clínica, ni resistencia a los fármacos antirretrovirales, siendo wild type. Ciento ochenta y un pacientes (74,8%) presentaron mutaciones clínicamente relevantes en alguna de las dos regiones. De estos 153 (63,2%) presentaron alguna mutación en las dos regiones y 28 (11,6%) solamente en una de las regiones.
En las tablas 1 y 2 se recogen las mutaciones detectadas en la región de la transcriptasa inversa y proteasa que afectan a los antirretrovirales.
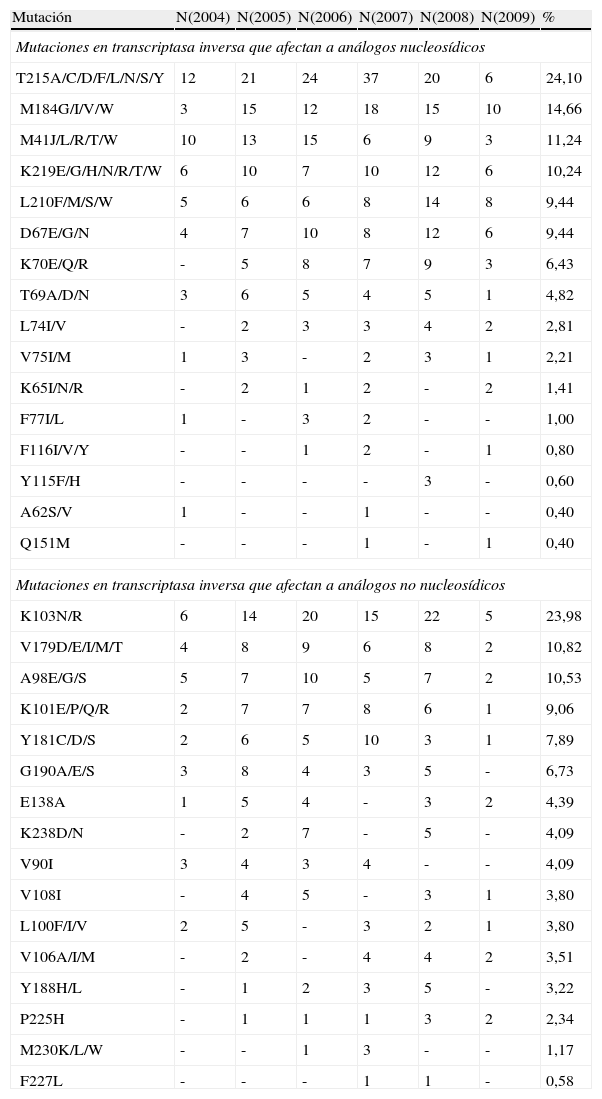
Mutaciones detectadas en las diferentes regiones de la transcriptasa inversa que afectan a los antirretrovirales desde abril de 2004 a abril de 2009
| Mutación | N(2004) | N(2005) | N(2006) | N(2007) | N(2008) | N(2009) | % |
| Mutaciones en transcriptasa inversa que afectan a análogos nucleosídicos | |||||||
| T215A/C/D/F/L/N/S/Y | 12 | 21 | 24 | 37 | 20 | 6 | 24,10 |
| M184G/I/V/W | 3 | 15 | 12 | 18 | 15 | 10 | 14,66 |
| M41J/L/R/T/W | 10 | 13 | 15 | 6 | 9 | 3 | 11,24 |
| K219E/G/H/N/R/T/W | 6 | 10 | 7 | 10 | 12 | 6 | 10,24 |
| L210F/M/S/W | 5 | 6 | 6 | 8 | 14 | 8 | 9,44 |
| D67E/G/N | 4 | 7 | 10 | 8 | 12 | 6 | 9,44 |
| K70E/Q/R | - | 5 | 8 | 7 | 9 | 3 | 6,43 |
| T69A/D/N | 3 | 6 | 5 | 4 | 5 | 1 | 4,82 |
| L74I/V | - | 2 | 3 | 3 | 4 | 2 | 2,81 |
| V75I/M | 1 | 3 | - | 2 | 3 | 1 | 2,21 |
| K65I/N/R | - | 2 | 1 | 2 | - | 2 | 1,41 |
| F77I/L | 1 | - | 3 | 2 | - | - | 1,00 |
| F116I/V/Y | - | - | 1 | 2 | - | 1 | 0,80 |
| Y115F/H | - | - | - | - | 3 | - | 0,60 |
| A62S/V | 1 | - | - | 1 | - | - | 0,40 |
| Q151M | - | - | - | 1 | - | 1 | 0,40 |
| Mutaciones en transcriptasa inversa que afectan a análogos no nucleosídicos | |||||||
| K103N/R | 6 | 14 | 20 | 15 | 22 | 5 | 23,98 |
| V179D/E/I/M/T | 4 | 8 | 9 | 6 | 8 | 2 | 10,82 |
| A98E/G/S | 5 | 7 | 10 | 5 | 7 | 2 | 10,53 |
| K101E/P/Q/R | 2 | 7 | 7 | 8 | 6 | 1 | 9,06 |
| Y181C/D/S | 2 | 6 | 5 | 10 | 3 | 1 | 7,89 |
| G190A/E/S | 3 | 8 | 4 | 3 | 5 | - | 6,73 |
| E138A | 1 | 5 | 4 | - | 3 | 2 | 4,39 |
| K238D/N | - | 2 | 7 | - | 5 | - | 4,09 |
| V90I | 3 | 4 | 3 | 4 | - | - | 4,09 |
| V108I | - | 4 | 5 | - | 3 | 1 | 3,80 |
| L100F/I/V | 2 | 5 | - | 3 | 2 | 1 | 3,80 |
| V106A/I/M | - | 2 | - | 4 | 4 | 2 | 3,51 |
| Y188H/L | - | 1 | 2 | 3 | 5 | - | 3,22 |
| P225H | - | 1 | 1 | 1 | 3 | 2 | 2,34 |
| M230K/L/W | - | - | 1 | 3 | - | - | 1,17 |
| F227L | - | - | - | 1 | 1 | - | 0,58 |
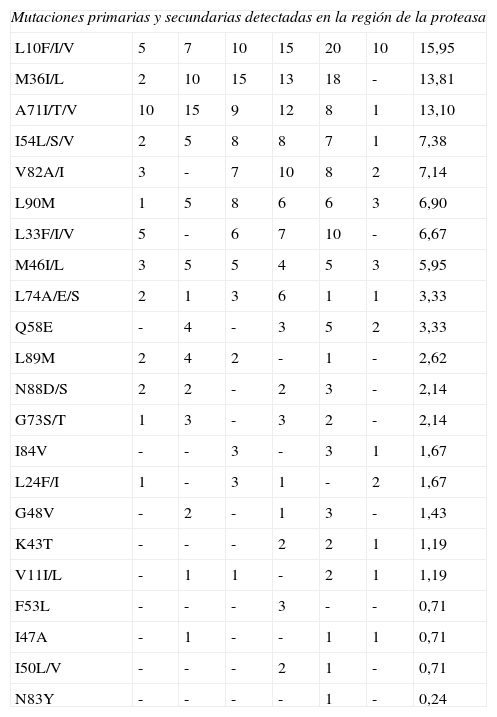
Mutaciones detectadas en la proteasa que afectan a los antirretrovirales desde abril de 2004 a abril de 2009
| Mutaciones primarias y secundarias detectadas en la región de la proteasa | |||||||
| L10F/I/V | 5 | 7 | 10 | 15 | 20 | 10 | 15,95 |
| M36I/L | 2 | 10 | 15 | 13 | 18 | - | 13,81 |
| A71I/T/V | 10 | 15 | 9 | 12 | 8 | 1 | 13,10 |
| I54L/S/V | 2 | 5 | 8 | 8 | 7 | 1 | 7,38 |
| V82A/I | 3 | - | 7 | 10 | 8 | 2 | 7,14 |
| L90M | 1 | 5 | 8 | 6 | 6 | 3 | 6,90 |
| L33F/I/V | 5 | - | 6 | 7 | 10 | - | 6,67 |
| M46I/L | 3 | 5 | 5 | 4 | 5 | 3 | 5,95 |
| L74A/E/S | 2 | 1 | 3 | 6 | 1 | 1 | 3,33 |
| Q58E | - | 4 | - | 3 | 5 | 2 | 3,33 |
| L89M | 2 | 4 | 2 | - | 1 | - | 2,62 |
| N88D/S | 2 | 2 | - | 2 | 3 | - | 2,14 |
| G73S/T | 1 | 3 | - | 3 | 2 | - | 2,14 |
| I84V | - | - | 3 | - | 3 | 1 | 1,67 |
| L24F/I | 1 | - | 3 | 1 | - | 2 | 1,67 |
| G48V | - | 2 | - | 1 | 3 | - | 1,43 |
| K43T | - | - | - | 2 | 2 | 1 | 1,19 |
| V11I/L | - | 1 | 1 | - | 2 | 1 | 1,19 |
| F53L | - | - | - | 3 | - | - | 0,71 |
| I47A | - | 1 | - | - | 1 | 1 | 0,71 |
| I50L/V | - | - | - | 2 | 1 | - | 0,71 |
| N83Y | - | - | - | - | 1 | - | 0,24 |
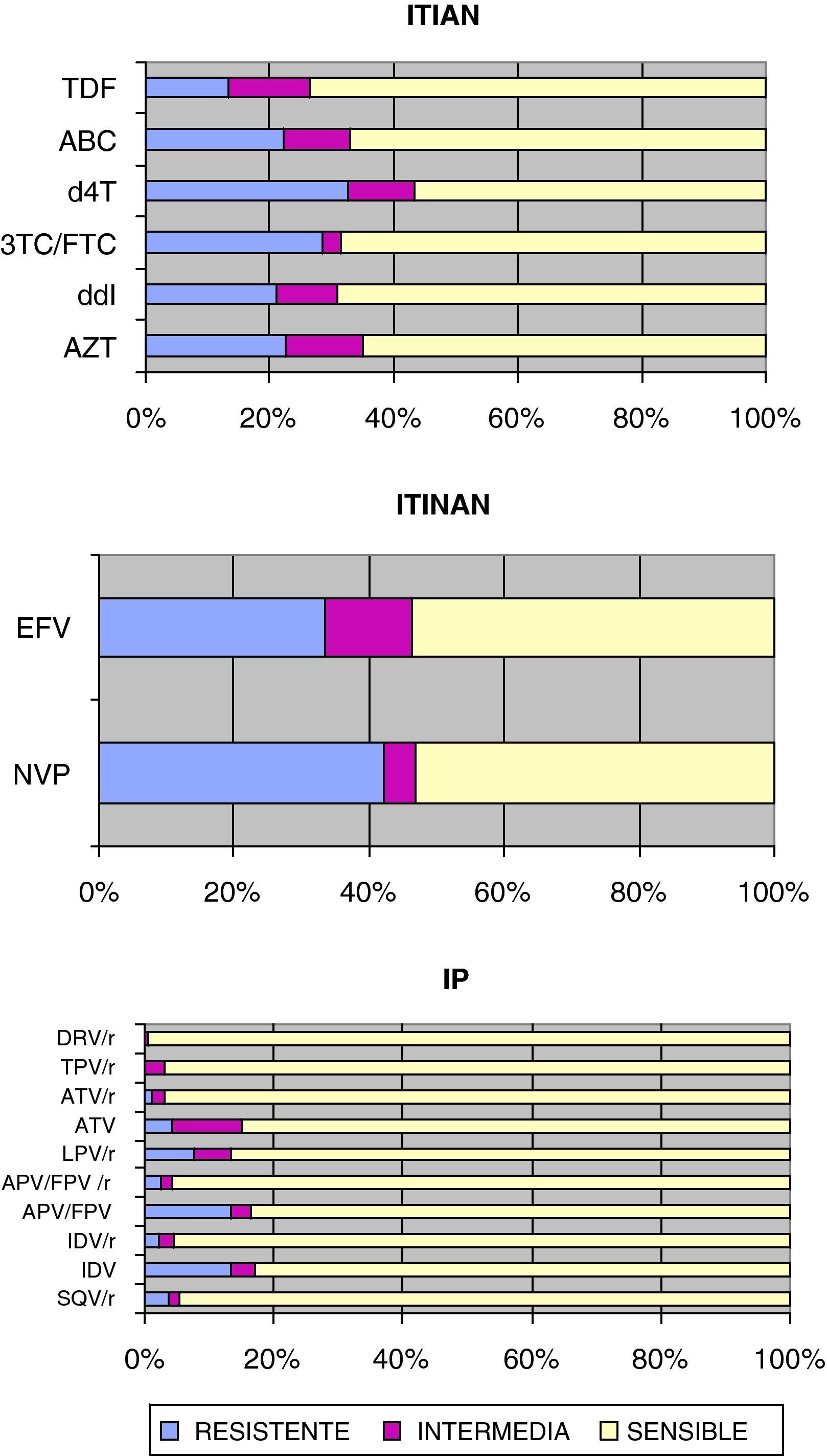
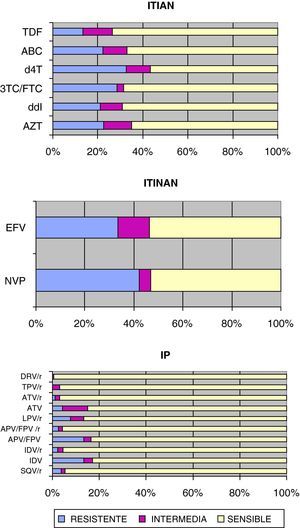
En la figura 1 se determina la sensibilidad del VIH-1 a las diferentes familias de antirretrovirales. En cuanto a los ITIAN, el d4T y el 3TC/FTC son los que más resistencias presentaron, en contraposición el TDF es el de menor número de resistencias en nuestro medio.
Sensibilidad del VIH-1 a los inhibidores de la transcriptasa inversa e inhibidores de la proteasa:
3TC/FTC: lamivudina/emtricitabina; ABC: abacavir; APV/FPV: amprenavir/fosamprenavir; APV/FPV/r: amprenavir/fosamprenavir potenciado con ritonavir; ATV: atazanavir; ATV/r: atazanavir/ritonavir; AZT: zidovudina; d4T: estavudina; ddI: didanosina; DRV/r: darunavir/ritonavir; EFV: efavirenz; IDV: indanavir; IDV/r: indanavir/ritonavir; LPV/r: lopinavir/ritonavir; NVP: nevirapina; SQV/r: saquinavir/ritonavir TDF: tenofovir; TPV/r: tipranavir/ritonavir.
Respecto a los ITINAN, la NVP presenta más resistencias que EFV, aunque ambos son sensibles en un porcentaje muy similar debido al mayor porcentaje de resistencia intermedia de EFV.
En los IP, la combinación DRV/r es la que menos resistencias presentó junto con TPV/r, en contraposición los IP no potenciados son los que más resistencias obtuvieron. Respecto a los potenciados es LPV/r el que más resistencias presentó.
DiscusiónLos pacientes estudiados cumplieron las recomendaciones actuales, por las cuales se realiza un test de resistencias antes de efectuar un cambio de tratamiento tras un fracaso virológico. Sin embargo en los últimos años se empieza a instaurar la tendencia de realizarlo en pacientes naive con el fin de la elección óptima del primer régimen de tratamiento, resultando una opción coste-efectiva5,11.
En el estudio se encontró un porcentaje de pacientes (25,20%) donde no se detectaron resistencias significativas y la sensibilidad a los fármacos fue total, por lo que el fracaso del tratamiento puede ser debido a una falta de adherencia no documentada. Sin embargo no se conoce la exposición farmacológica de los pacientes al tratamiento antirretroviral y se debería tener en cuenta que a mayor exposición, mayor probabilidad de generar mutaciones. Tampoco aparecen datos de viremia, íntimamente relacionada con las resistencias genotípicas12,13.
En cuanto a las mutaciones encontradas en el estudio, las más prevalentes que afectan a ITIAN coinciden con las presentadas en otros estudios4,14. Destacan T215A/C/D/F/L/N/S/Y (24,10%), M184G/I/V/W (14,66%), M41J/L/R/T/W (11,24%) y K219E/G/H/N/R/T/W (10,24%). La mutación T215F/Y afecta a la mayoría de los ITIAN, comprometiendo por sí sola la respuesta a AZT. También la T215C/D/S afecta a AZT y d4T. La mutación M184V/I compromete por sí sola la respuesta a 3TC y FTC, afectando en menor grado a ABC y ddI. Es la primera en aparecer cuando se usan como parte del tratamiento15. Esta mutación se ha asociado más a la combinación AZT+3TC y menos a TDF+FTC16. Además esta produce hipersusceptibilidad a AZT, d4T y TDF. Por su parte la mutación M41L es más específica de d4T y TDF y K219E/R/T/W de AZT y d4T. También cabe destacar al respecto la mutación en L74I/V (2,81%) que por sí sola compromete la respuesta a ddI y K65R (1,41%) que lo hace con TDF.
También destacan las resistencias conocidas como TAM (thymidine analogue mutations), las cuales producen resistencia a AZT, d4T y TDF.
Respecto a los ITINAN, en los últimos años la prevalencia de mutaciones en este grupo ha aumentado considerablemente17. Las más frecuentes fueron K103N/R (23,98%), V179D/E/I/M/T (10,82%), A98E/G/S (10,53%) y K101E/P/Q/R (9,06%), afectando tanto a NVP, como a EFV. La mutación K103N, al igual que los estudios evaluados, es la más frecuente9.
Por su parte las mutaciones que afectaron a los IP son también similares a la de los estudios comparados, aunque a diferencia de estos donde las más frecuentes fueron I54L/V y V82A, en nuestro caso fue L10F/I/V que se asocia a resistencia a cada uno de los IP en presencia de otras mutaciones. L10F/I/V se comporta como un polimorfismo frecuente en subtipos no-B en posiciones de resistencia, del mismo modo que M36I. Por su parte I54L/S/V es característica de la mayoría de los IP. También destacan la detección de mutaciones que por sí solas comprometen la respuesta al fármaco, tales como G48V para SQV, I50L para ATV, I50V para FPV e I47A para LPV, todos ellos potenciados con ritonavir, aunque aparecen en una proporción pequeña.
En cuanto a la sensibilidad a los diferentes fármacos, la relación entre aparición de mutaciones resistentes y fracaso virológico es muy clara en el caso de ITIAN e ITINAN, pero existen datos contradictorios con los IP, en los que se ha constatado fracaso virológico sin evidencia de resistencias18. En este estudio en lo que se refiere a ITIAN es el TDF el más sensible, en parte justificado por ser el de más reciente aparición coincidiendo con el estudio de Molina et al9.
En cuanto a los ITINAN, las mutaciones de resistencia de NVP o EFV causan resistencia cruzada con el otro elemento de la familia, por tanto dejan poco espacio de actuación en caso de detección19. Sin embargo la reciente comercialización de etravirina deja una puerta abierta en esta situación, a expensas de futuros resultados.
Respecto a los IP se debe considerar que los datos de resistencia sin potenciar pertenecieron a los primeros años del estudio7. Referente al estudio de Molina et al, coincide en la mayor eficacia de DRV/r y TPV/r, siendo estos los IP de más reciente aparición9. Sin embargo no ocurre lo mismo con LPV/r que obtiene un alto grado de resistencias en nuestro medio comparado con el resto de IP potenciados, justificado en parte por mutaciones en las posiciones M46, I54 o I84 que reducen la eficacia de LPV/r a menos de un 30%20.
En conclusión, la resistencia y sensibilidad al TARGA en nuestro medio fue similar al de otros estudios realizados en nuestro país, pero difiere y destaca un alto grado de resistencia a 3TC/FTC y LPV/r. Es conveniente realizar un análisis de comportamiento de resistencias a los fármacos antirretrovirales, con el fin de conocer la problemática real en nuestro medio. Los datos pueden ser de gran utilidad para abordar, desde un punto de vista multidisciplinar, la terapia más eficiente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.