estudiar la estabilidad fisicoquímica y microbiológica de 2 colirios de metilprednisolona succinato sódico (MTPSS) a 1 mg/ml y 10 mg/ml sin conservantes durante 90 días para su uso en enfermedades oculares como el síndrome de Sjögren y el síndrome del ojo seco.
Métodolos 2 colirios se elaboraron partiendo de MTPSS inyectable (Solu-moderin® y Urbason®), agua para inyectables y suero salino fisiológico. Posteriormente se almacenaron, según las normas ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) por triplicado en condiciones de refrigeración (5 ± 3 °C), temperatura ambiente (25 ± 2 °C) y a 40 °C (±2 °C). De acuerdo con la USP (United States Pharmacopeia), se realizaron controles fisicoquímicos de contenido en principio activo por HPLC-UV (High Performance Liquid Chromatography-Ultraviolet detector), control de pH, control de osmolalidad y controles visuales. Además, se realizó un estudio de esterilidad microbiológica en las condiciones de refrigeración, tanto en envases abiertos (hasta 30 días), como en envases cerrados (hasta 90 días).
Resultadoslos colirios almacenados a 5 °C fueron los más estables y el principio activo se degradó por debajo del 90% a partir del día 21 en el colirio a 1 mg/ml, y a partir del día 42 en el colirio a 10 mg/ml. La variación del pH no fue ≥1 unidad en las formulaciones almacenadas a 5 °C, al contrario que en el resto. La osmolalidad no presentó cambios superiores al 5% al día 90 en ninguna de las condiciones de almacenamiento. Las muestras de los colirios a 10 mg/ml no refrigerados presentaron un precipitado blanco a partir del día 14 y 28 respectivamente. Los colirios a 1 mg/ml no refrigerados presentaron partículas en suspensión el día 90. No hubo cambios de color. El análisis microbiológico demostró esterilidad durante los 90 días en los envases cerrados, pero en los abiertos se detectó contaminación microbiana a partir del día 21.
Conclusioneslos colirios de MTPSS a 1 mg/ml presentan una estabilidad fisicoquímica y microbiológica de 21 días en refrigeración, frente a los 42 días que admiten los colirios a 10 mg/ml almacenados bajo las mismas condiciones. No obstante, al no incluir conservantes en su composición, no se deben utilizar durante más de 7 días desde su apertura.
To study the physicochemical and microbiological stability over 90 days of two preservative-free methylprednisolone sodium succinate (MTPSS) 1 mg/ml and 10 mg/ml eye drops for use in ocular pathologies such as Sjögren’s syndrome and dry eye syndrome.
MethodThe two eye drops were prepared from injectable MTPSS (Solu-moderin® and Urbason®), water for injection and normal saline solution. In accordance with ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) guidelines, they were then stored in triplicate under refrigerated conditions (5 ±3 °C), at room temperature (25 ± 2 °C), and at 40 °C (±2 °C). In accordance with the USP (United States Pharmacopeia), physicochemical controls of the active ingredient content were carried out by HPLC-UV (High Performance Liquid Chromatography with Ultraviolet detection), together with controls of pH, osmolality, and visual examination. Microbiological sterility was also tested under refrigerated conditions up to 30 days in open containers and up to 90 days in closed ones.
ResultsThe eye drops stored at 5 °C were the most stable; in the 1 mg/ml eye drops, degradation of the drug fell below 90% from day 21, and in the 10 mg/ml eye drops, from day 42. pH change did not vary by ≥1 unit in formulations stored at 5 °C, unlike the other formulations. Changes in osmolality did not exceed 5% on day 90 in any storage conditions. Samples of non refrigerate eye drops at 10 mg/ml, presented a white precipitate from day 14 and 28 respectively. Non-refrigerated 1 mg/ml eye drops presented suspended particles on day 90. There were no color changes. Microbiological analysis showed that sterility was maintained for over 90 days in the closed containers, although microbial contamination was detected from day 21 in the open containers.
Conclusions1 mg/ml MTPSS eye drops show physicochemical and microbiological stability for 21 days under refrigeration, compared to 42 days for 10 mg/ml eye drops stored under the same conditions. However, since they do not include preservatives in their composition, they should not be used for more than 7 days after opening.
El diseño y la elaboración de medicamentos en las áreas de la farmacotecnia es uno de los pilares fundamentales dentro de la farmacia hospitalaria, cuyo objetivo es cubrir las necesidades terapéuticas no cubiertas con el arsenal terapéutico existente en el mercado.
Concretamente, el tratamiento de los trastornos oftalmológicos requiere en muchos casos formular un principio activo en el vehículo y las condiciones idóneas para garantizar su seguridad y eficacia. Este es el caso de la metilprednisolona, cuyas presentaciones comerciales disponibles en la actualidad son comprimidos para administración oral y viales liofilizados para administración intravenosa1, no disponiendo de ninguna forma farmacéutica adecuada para la administración por vía oftálmica.
De acuerdo con la bibliografía, el colirio de metilprednisolona succinato sódico (MTPSS) se puede formular a diferentes concentraciones, desde 1 hasta 10 mg/ml, como corticoide de potencia media y con la gran ventaja de no contener conservantes en su formulación. En terapéutica se utiliza como medicamento en condiciones diferentes a las autorizadas2, para trastornos de la superficie ocular como el síndrome de Sjögren3,4 o en el síndrome del ojo seco, habiéndose demostrado beneficio clínico en este último a baja concentración (0,05%)5. Al diseñar medicamentos de administración por vía oftálmica se deben tener en cuenta las particularidades de la anatomía y fisiología ocular. Existen barreras biológicas como el epitelio córneo no poroso y el aclaramiento mecánico debido a las lágrimas y al parpadeo, por las que solo se consigue una penetración a la córnea de la dosis administrada menor al 5%. El exceso de volumen administrado en el saco conjuntival es rápidamente drenado a través del sistema canalicular lagrimal por el bombeo asociado al pestañeo. Este aumento del drenaje lleva a un incremento en la absorción. Por lo tanto, entre el 50 y el 90% de la dosis entra en la circulación sistémica, lo cual cobra especial importancia en los fármacos que puedan producir efectos colaterales y, más aún, en aquellos destinados a la población pediátrica. Por lo tanto, el exceso de volumen administrado en el saco conjuntival es rápidamente drenado a través del sistema canalicular lagrimal por el bombeo asociado al pestañeo. Este aumento del drenaje lleva a un incremento en la absorción sistémica y por lo tanto en los efectos adversos a nivel sistémico, que pueden ser de especial importancia en la población pediátrica6.
Tanto la tolerancia como la irritabilidad de un colirio vienen principalmente definidos por su osmolaridad, pH y limpidez. De hecho, un colirio mal tolerado es rápidamente eliminado y puede verse comprometida su eficacia. Por ello, entre los requisitos mínimos que debe cumplir un colirio están: limpidez, neutralidad, isotonicidad y esterilidad6,7, asegurando la minimización de irritación que provoque lagrimeo y, por tanto, la eliminación prematura del fármaco.
Para evitar la contaminación microbiológica y preservar la esterilidad, en ocasiones se usan conservantes, aunque los colirios sin conservantes han demostrado un perfil de toxicidad más bajo respecto a los colirios que contienen conservantes8.
El objetivo de este estudio es analizar la estabilidad fisicoquímica y microbiológica de 2 colirios de MTPSS sin conservantes para su uso en trastornos oftalmológicos.
MétodoReactivosLos componentes de las formulaciones fueron metilprednisolona 40 mg (como succinato de sodio, Urbason®,Sanofi-Aventis, Francia), metilprednisolona 500 mg (como succinato de sodio, Solu-moderin®,Pfizer, USA), agua para inyección (Fresenius-Kabi, Alemania) y cloruro sódico 0,9% para inyección (Fresenius-Kabi, Alemania), frasco cuentagotas estéril de polipropileno blanco con tratamiento fotoprotector de 10 ml (Bexen medical, España). Los reactivos utilizados fueron: metilprednisolona calidad analítica, ácido acético glacial y acetonitrilo grado HPLC; se adquirieron a Sigma-Aldrich (Darmstadt, Alemania). Para los análisis por HPLC se utilizó agua ultrapura (tipo I).
Procedimiento general de elaboraciónSe elaboraron sendos colirios de MTPSS a concentraciones de 1 y 10 mg/ml (tabla 1) según las recomendaciones de la Guía de buenas prácticas de preparación de medicamentos en servicios de farmacia7 por personal experto en manipulación de productos estériles.
Procedimiento de elaboración de los colirios de metilprednisolona succinato sódico (MTPSS) al 1 y 10 mg/ml
| Colirio MTPSS 1 mg/ml | Colirio MTPSS 10 mg/ml |
|---|---|
| Metilprednisolona (Urbason®)…………….. 40 mg | Metilprednisolona (Solu-moderin®)… 500 mg |
| Agua para inyección……………………..…..…10 ml | Agua para inyección……………………..……10 ml |
| Cloruro sódico 0,9% csp………..…….…..…40 ml | Cloruro sódico 0,9% csp……..…………..…50 ml |
1. Reconstituir la MTPSS con 10 ml de API.
2. Diluir con cloruro sódico 0,9% en una jeringa de 50 ml hasta 40 ml (fórmula 1 mg/ml) y hasta 50 ml (fórmula 10 mg/ml).
3. Envasar alícuotas de 5 ml en un frasco cuentagotas estéril de polipropileno blanco con tratamiento fotoprotector mediante filtración esterilizante (filtro de jeringa 0,22 μm, 25 mm, PES PharmAssure®, Pall Medical, USA) y trabajando en cabina de flujo laminar.
4. Tapar y etiquetar.
El diseño del estudio se llevó a cabo teniendo en cuenta las condiciones de utilización y almacenamiento de las distintas soluciones en un entorno de trabajo real. Todos los colirios de MTPSS a 1 y 10 mg/ml fueron envasados en frascos de colirio estéril de polipropileno blanco y almacenados en lotes de 3 unidades de acuerdo con las normas ICH9 y en la siguientes condiciones de temperatura y humedad relativa (HR):
- a.
Refrigeración (5 ± 3 °C).
- b.
Temperatura ambiente (25 ± 2 °C)/60 ± 5% HR.
- c.
Condiciones aceleradas (40 ± 2 °C)/75 ± 5% HR.
Para demostrar la estabilidad química de la MTPSS, se tomó como técnica de referencia la cromatografía líquida de alta resolución (HPLC, por sus siglas en inglés), propuesta por la farmacopea europea (Ph. Eur. 10.ª ed)10 y para ello, se utilizó un cromatógrafo Agilent® 1260 Infinity (Waldbronn, Alemania) asociado a un detector ultravioleta de diodos en serie (UV-DAD, por sus siglas en inglés). Las condiciones cromatográficas fueron: flujo de 1,0 ml/min, la fase móvil compuesta por un 2% ácido acético glacial, un 31% de acetonitrilo y un 67% agua ultrapura; el volumen de inyección fue de 20 μl, la temperatura de columna se fijó en 25 °C y la longitud de onda del detector fue 254 nm. La columna utilizada fue una Cortecs® T3 C18 4,6 x 150 mm, 2,7 μm (Waters®). La extracción y análisis de las muestras se hicieron los días 0, 7, 14, 21, 28, 42, 60 y 90.
La validación del método analítico para cuantificar la MTPSS se realizó de acuerdo con las normas ICH11. Para demostrar la linealidad del método se prepararon 6 niveles de concentración a partir de un estándar analítico de MTPSS y los resultados se usaron para confeccionar la recta de calibración, realizándose un análisis de variancia (ANOVA) de la regresión con un nivel de significación estadística de 0,05 (α=0,05). La exactitud y la precisión se expresaron como porcentaje de recuperación y desviaciones estándar relativas a concentraciones bajas, medias y altas dentro del rango de linealidad durante un día de trabajo (intradiario) y después de 5 días de trabajo consecutivos (interdiario). Se calcularon el límite de detección (LOD) y el límite de cuantificación (LOQ), con base en las desviaciones estándar de la respuesta y la pendiente de la recta de calibración. Para analizar la especificidad del método, se realizó un análisis del espectro ultravioleta en 2 dimensiones (2D). Lo propio se hizo para analizar la selectividad del método mediante análisis espectral en 3D.
Condiciones de degradación extremasPara demostrar que el método era indicador de estabilidad para MTPSS y conocer cuáles son las condiciones que predisponían a la mayor degradación del principio activo12, se sometió a cada uno de los colirios durante 48 horas a diferentes condiciones extremas: oxidación (H2O2 15% v/v), básicas (NaOH 1 N), ácidas (HCl 1 N) y térmicas (80 °C). Para ello se tomaron alícuotas de 5 ml de cada uno de los colirios y se mezclaron con alícuotas de 5 ml de cada una de las sustancias degradantes para forzar la reacción de degradación en condiciones extremas, evaluándose la degradación de la MTPSS a las 48 horas por HPLC.
Control de pHSe realizó la determinación del pH a las 2 formulaciones de MTPSS coincidiendo con los días de análisis por HPLC. Para ello se utilizó un pHmetro Crison GLP21 (Crison Instruments S.A., España). El rango de estabilidad de pH establecido por la Farmacopea de los Estados Unidos (USP-43) para MTPSS en solución es de 7,0-8,013.
Control de la osmolaridadSe realizaron medidas de osmolaridad a las 2 formulaciones con un osmómetro OM6050 OsmoStation (AKRAY, Japón) los días 0 y 90, previa calibración del aparato con soluciones de 100 y 1.000 mOsm/kg-H2O.
Control e inspección visualSe realizó un control visual de las muestras almacenadas a cada temperatura de acuerdo con la Farmacopea Europea (Ph. Eur. 10ª ed, capítulo 2.9.20)14 con un aparato para control de partículas visibles Apollo II (Adelphi, Reino Unido).
Análisis de los datosEl objetivo de estabilidad se estableció en un 90-110% de recuperación de MTPSS en cada formulación a lo largo de los 90 días de estudio. Para la obtención y procesamiento de datos se utilizó el software ChemStation v4.03b (Agilent Technologies®, Alemania).
Estudio de estabilidad microbiológicaEl estudio de la estabilidad microbiológica se llevó a cabo de acuerdo a los procedimientos indicados en la USP-43 y en las condiciones fisicoquímicas teóricamente más estables, es decir, en refrigeración (5 ±3 °C). Por un lado, este estudio se desarrolló durante 90 días en envases de colirio cerrados (analizándose los días 0, 7, 14, 21, 30, 42, 60 y 90) y por otro, durante 42 días en envases abiertos (analizándose los días 0, 7, 14, 21, 30 y 42) y emulando la dosificación diaria real del preparado15. Previamente, hubo que determinar la capacidad de crecimiento de los microorganismos en la formulación estudiada, para ello, se seleccionaron cepas control: Pseudomonas aeruginosa (Schroeter), Migula (ATCC® 9027™), Bacillus subtilis subsp. spizizenii, Nakamura et al. (ATCC® 6633™), Candida albicans (Robin), Berkhout (ATCC® 10231™), Aspergillus brasiliensis, Varga et al. (ATCC® 16404™), Staphylococcus aureus subsp. aureus, Rosenbach (ATCC® 6538™), y Clostridium sporogenes (Metchnikoff), Bergey et al. (ATCC® 19404™) (LGC Standards, S.L.U., Barcelona, España). Estas cepas se añadieron en un tubo de tioglicolato (TG) con 1 ml de ambos colirios de MTPSS, incubándose 14 días a 35 °C y adicionalmente, como control se inoculó cada cepa control en TG sin colirio y se incubaron en las mismas condiciones. El ensayo se considera correcto cuando se obtiene crecimiento de las cepas control tanto en el medio TG solo como inoculado con el colirio problema. Para determinar la estabilidad microbiológica de los colirios en los días indicados, la USP-43 establece que debe de haber ausencia de crecimiento de cualquier microorganismo como criterio de aceptación y, por tanto, esterilidad.
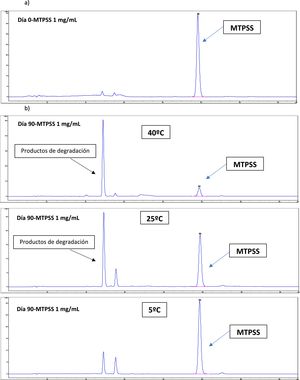
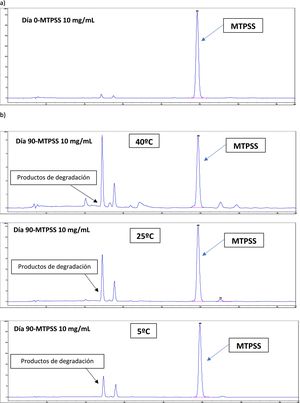
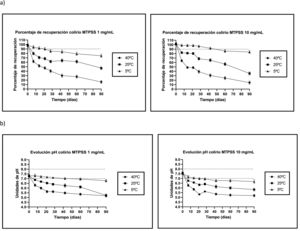
ResultadosEstabilidad fisicoquímicaAnálisis por High Performance Liquid Chromatography (HPLC)El análisis de la variancia de la regresión lineal confirmó la linealidad de la técnica por rechazo de la hipótesis nula de desviación de linealidad. El coeficiente de variación (CV) del método fue menor al 2%. La ecuación de la regresión lineal obtenida se corresponde con la expresión y = 39.229x – 6,6252 (n = 18; R2 >0,9999). La exactitud fue del 99,8–101,1% y la precisión tanto intra como interdiario tuvo un CV inferior al 3%. Los límites de detección y cuantificación fueron de 0,01 y de 0,06 mg/ml, respectivamente. El análisis espectral UV en 2D y 3D confirma la selectividad, pureza de pico y especificidad de la técnica ante la ausencia de picos secundarios e interferentes. Los cromatogramas del día 0 y día 90 de ambos colirios de MTPSS se muestran en la figura 1 para los colirios de 1 mg/ml y figura 2 para los colirios de 10 mg/ml. La evolución de las concentraciones remanentes en ambos colirios muestra una degradación termodependiente (fig. 3). siendo la condición de refrigeración (5 ± 3 °C) la más estable en ambos colirios y adicionalmente son más estables los colirios a 10 mg/ml y que a partir del día 42, ya estarían por debajo del límite de estabilidad establecido (pérdidas por encima del 10% de la concentración nominal), frente a los 21 días de los colirios a 1 mg/ml.
El estudio de degradación en condiciones extremas muestra que el método es indicador de estabilidad, siendo las condiciones ácidas y alcalinas las que inducen una mayor degradación de la MTPSS en las formulaciones estudiadas.
Control del pHEl pH cayó por debajo del límite inferior de estabilidad para MTPSS (pH = 7,0) muy rápidamente en las formulaciones almacenadas a temperatura ambiente (25 ± 2 °C) y aceleradas (40 ± 2 °C) independientemente de la concentración de MTPSS. Sin embargo, en los colirios almacenados en refrigeración (5 ± 3 °C) la bajada fue más paulatina, siendo algo más pronunciada en el colirio de MTPSS a 1 mg/ml que en el colirio de MTPSS a 10 mg/ml, (fig. 3).
Control de la osmolalidadDurante los 90 días de estudio, la osmolalidad no sufrió cambios significativos (<5%) en ninguna de las condiciones de almacenamiento para ambos colirios y se mantuvo en cifras en torno a los 300 mOsm/kg-H2O.
Control visualEn los colirios de MTPSS a 1 mg/ml almacenados en condiciones aceleradas (40 °C ± 2 °C) se observaron precipitados desde el día 14 de estudio y en los colirios a 10 mg/ml estos precipitados aparecieron en el día 90. Sin embargo, a temperatura ambiente (25 ± 2 °C) en los colirios a 1 mg/ml, se observó turbidez a partir del día 28 y en los colirios a 10 mg/ml esta se observó en el día 90 en esta condición.
Estabilidad microbiológicaSe confirmó la aptitud del crecimiento de las cepas ATCC en ambas formulaciones. Asimismo, los colirios de MTPSS a 1 y a 10 mg/ml refrigerados (5 ± 3 °C), cumplieron con el estándar de esterilidad durante los 90 días de estudio en envases cerrados, pero una vez abiertos, cumplieron la condición durante 21 días apareciendo crecimiento microbiano a partir del día 30.
DiscusiónEn este trabajo, se ha estudiado la estabilidad fisicoquímica y microbiológica de 2 colirios de MTPSS a 1 y a 10 mg/ml sin conservantes, en diferentes condiciones de almacenamiento. Se ha demostrado que la estabilidad de ambos colirios es termodependiente (mayor degradación a mayor temperatura) y dependiente de la concentración, ya que la estabilidad aumenta con la concentración de MTPSS.
Otros autores han estudiado la estabilidad y compatibilidad de MTPSS en distintas formulaciones16–19 Pyter et al.20 hicieron lo propio con soluciones inyectables MTPSS a 10 mg/ml y al 5% en suero salino fisiológico (SSF) y suero glucosado al 5%, almacenadas a 25 °C durante 24 horas. En este caso, usaron la nefelometría como técnica para medir la estabilidad y terminaron concluyendo que las soluciones de MTPSS en SSF fueron estables durante 24 horas, siendo más variable en suero glucosado al 5% (entre 8 y 24 horas) y además también dependía de la concentración de MTPSS. Por otro lado, Gupta21 estudió la estabilidad química de MTPSS a 10 mg/ml con alcohol bencílico como conservante, en jeringas de polipropileno durante varios días, a temperaturas de 5 y 25 °C, demostrando la estabilidad durante 4 días a 25 °C y 21 días a 5 °C, datos que coinciden con los hallazgos del presente estudio.
Por otro lado, en un artículo reciente, Ratprasatporn et al.22 estudiaron la estabilidad y esterilidad de varios colirios con diferentes principios activos sin conservantes, entre los que se encuentran el colirio de MTPSS a 10 mg/ml. El estudio se realizó en condiciones de refrigeración (5 °C) y a temperatura ambiente (25 °C), utilizando para el análisis de la concentración de MTPSS la espectrofotometría UV. En este estudio, terminan concluyendo que los colirios de MTPSS a 10 mg/ml almacenados en refrigeración (5 °C) y a temperatura ambiente (25 °C) eran estables (con pérdidas menores al 10%) durante los 28 días de estudio. Estos resultados difieren sensiblemente de los resultados encontrados en nuestro estudio, ya que a temperatura ambiente los colirios de MTPSS a 10 mg/ml, se degradan por encima del límite de estabilidad (pérdidas superiores al 10%) a partir del día 7 de estudio. Esta diferencia, probablemente esté relacionada con la técnica utilizada para determinar la concentración de MTPSS, ya que Ratprasatporn et al. no utilizaron una técnica de separación como puede ser la HPLC, la cual permite la separación de cada uno de los productos de degradación que aparecen a lo largo del tiempo de estudio y cuantificarlos de manera individual. Esta es, probablemente, una de las razones por la que la HPLC es la técnica de referencia para la determinación de MTPSS en las diferentes monografías de varias farmacopeas a nivel global10,13,23.
En cuanto a la estabilidad microbiológica, hay pocos estudios que la hayan evaluado, solo en el estudio desarrollado por Ratprasatporn et al.22 se evaluó durante 28 días y en este caso tampoco utilizaron las recomendaciones descritas en las principales farmacopeas. En cuanto a las limitaciones de este estudio, cabe destacar que, aunque la mayoría de las condiciones controlables estaban parametrizadas y registradas conforme a normativa ICH y farmacopea, podemos destacar que la exposición microbiana al ambiente podría ser variable de un laboratorio a otro, dando lugar a otro perfil de contaminaciones diferentes a las recogidas en este artículo. También hubiera sido interesante desarrollar un estudio a más largo plazo, pero dada la limitación de la estabilidad del principio activo incluso en refrigeración, probablemente no se hubieran obtenidos resultados satisfactorios o útiles, con lo que una propuesta de futuro sería valorar el impacto de la congelación en la estabilidad de estos colirios e incluso estudiar la estabilidad en envases de tipo monodosis, con el objetivo de hacer preparaciones más eficientes desde los servicios de farmacia en función de la demanda asistencial.
En conclusión, la estabilidad de los colirios de MTPSS, permite asignar un periodo de validez en la condición refrigeración (5 °C) en envase cerrado de 42 días para los colirios de MTPSS a 10 mg/ml y de 21 días en los colirios de MTPSS a 1 mg/ml. Aunque como recomendación general, una vez abiertos los colirios (de ambas concentraciones) el periodo de validez no superará los 7 días, debido a la limitación de no contener conservantes. Estos periodos son lo suficientemente aceptables como para que se puedan dispensar en la práctica clínica real con todas las garantías de calidad que debe de cumplir un preparado oftalmológico libre de conservantes.
Aportación a la literatura científicaEste estudio caracteriza la estabilidad fisicoquímica y microbilógica de 2 colirios de metilprednisolona sin conservantes, usando como referencia las técnicas analíticas que dictan las farmacopea de reconocido prestigio, obteniendo mayor precisión en la determinación del periodo de validez de ambas formulaciones respecto de la evidencia previamente publicada.
FinanciaciónEste estudio ha sido financiado por la Sociedad Española de Farmacia Hospitalaria en la convocatoria de ayudas a los grupos de trabajo del año 2018.
Conflicto de interesesNingún autor o coautor manifiesta tener conflicto de intereses con este artículo.
Declaración de contribución de autoría CRediTVicente Merino-Bohórquez: Conceptualization, Data curation, Formal analysis, Funding acquisition, Investigation, Methodology, Project administration, Resources, Software, Supervision, Validation, Visualization, Writing – original draft, Writing – review & editing. Silvia Berisa-Prado: Conceptualization, Data curation, Formal analysis, Funding acquisition, Methodology, Project administration, Supervision, Validation, Visualization. Mercedes Delgado-Valverde: Investigation, Methodology, Supervision. María José Tirado-Pérez: Investigation, Methodology, Supervision. Marta García-Palomo: Methodology, Supervision, Validation. José María Alonso-Herreros: Methodology, Supervision, Validation, Visualization. Carme Cañete-Ramírez: Methodology, Validation, Visualization. María del Dávila-Pousa: Methodology, Supervision, Validation, Visualization.