Definir el papel de los fármacos disponibles para el tratamiento de la hepatitis B y analizar las actuales guías de tratamiento de las principales sociedades científicas relacionadas.
MétodoSe realizaron sendas búsquedas bibliográficas en las bases de datos PubMed y EMBASE con el término hepatitis B, limitado a drug therapy y clinical trial, metaanálisis o guidelines, en el período 1991-2007.
ResultadosActualmente son 6 los fármacos disponibles: interferon alfa (convencional o pegilado), lamivudina, adefovir, entecavir y telbivudina.
En la práctica habitual, el interferón pegilado ha desplazado casi completamente al convencional. Los pacientes con antígeno E del virus de la hepatitis B (VHB) positivo (HBeAg+) con concentraciones elevadas de alaninotransferasa (ALT), cifras bajas de ADN-VHB y genotipos A y B son los que mejor responden al interferón.
Lamivudina consigue una supresión viral más rápida y potente que adefovir; su principal problema es la resistencia que genera. Probablemente, su papel disminuirá con la incorporación de entecavir y telbivudina, asociados con menores resistencias. Adefovir es útil en los pacientes descompensados y/o resistentes a lamivudina.
Debido a las tasas de respuestas obtenidas, entecavir podría ser el fármaco de elección en pacientes HBeAg+, fundamentalmente en los que tienen cargas virales más altas. En HBeAg-, cualquier fármaco podría ser utilizado como primera opción.
Las guías difieren, principalmente, en la definición de la enfermedad y los marcadores séricos que indican replicación activa: cargas virales y positividad del HBeAg.
ConclusionesTodos los fármacos son capaces de alcanzar los objetivos bioquímicos, virales e histológicos a corto plazo. No hay unanimidad acerca de qué pacientes tratar, con qué fármacos, durante cuánto tiempo y cuáles son los objetivos perseguidos.
To define the role of those drugs available for hepatitis B treatment and analyse current treatment guides prepared by the leading scientific societies in the field.
MethodsBibliographic searches were carried out in the databases PubMed and EMBASE, using the search word «hepatitis B», limited by «drug therapy» plus «clinical trial», «meta-analysis» or «guidelines», within the period 1991-2007.
ResultsSix drugs are currently available: interferon alpha (conventional or pegylated), lamivudine, adefovir, entecavir and telbivudine. In normal practice, pegylated interferon has almost completely displaced the conventional variety. HBeAg+ patients with high ALT levels, low HBV DNA counts and genotypes A and B show the best response to interferon.
Lamivudine achieves faster and more potent viral suppression than adefovir; its principal drawback is the resistance that some patients develop. Its role will probably decrease as entecavir and telbivudine become more idespread, as they are associated with less resistance. Adefovir is useful in decompensated patients and/or those resistant to lamivudine.
Because of the response rates it obtains, entecavir could be the drug of choice for HBeAG+ patients, particularly those with higher viral loads. For HBeAg– cases, any drug can be used as a first-choice drug. The main difference between the treatment guides lies in the way they define the illness and the serum markers that indicate active replication: viral loads and HBeAG positivity.
ConclusionsAll of the drugs are capable of accomplishing shortterm biochemical, viral and histological objectives. There is no unanimous opinion on which patients should be treated with which drugs, during what length of time, and what objectives are to be reached.
Actualmente, la infección por virus de la hepatitis B (VHB) sigue siendo un grave problema de salud pública mundial, pese a los últimos avances en el tratamiento y la prevención de esta enfermedad. En la actualidad, hay más de 2.000 millones de personas que han sido infectadas por el VHB y, entre ellos, casi una cuarta parte presenta enfermedad crónica. Igualmente se estima que medio millón de personas mueren al año debido a las complicaciones generadas por VHB, fundamentalmente, hepatocarcinoma y cirrosis hepática1.
La distribución del VHB es universal, pero varía geográficamente según su prevalencia y mecanismo de transmisión. En África y Asia, la prevalencia es del 8% y su transmisión es, fundamentalmente, perinatal u horizontal en la infancia. En Europa, Norteamérica y Australia, la prevalencia es inferior al 1% y las vías más frecuentes son la sexual y el uso de drogas por vía parenteral. En la zona mediterránea, la prevalencia es de aproximadamente el 1-8%. En España, casi la mitad de los infectados contrae la enfermedad en la adolescencia o la edad adulta, principalmente por vía parenteral, seguido de la transmisión sexual y la infección a causa de la profesión sanitaria2,3.
Dentro de su curso dinámico, la infección puede presentarse de diversas formas, por lo que es fundamental su clasificación a la hora de realizar el abordaje terapéutico. Suele hacerse referencia a una clínica en fases. En primer lugar se encuentra la fase de inmunotolerancia, caracterizada por concentraciones séricas altas de ADN-VHB (≥ 100.000 copias/ml), antígeno E del VHB positivo (HBeAg+), valores prácticamente normales de transaminasas, sobre todo alaninotransferasa (ALT), y una mínima actividad histológica hepática. Esta fase suele durar más en neonatos o niños. Por contra, es corta en adolescentes y adultos. A continuación tiene lugar la fase de inmunoactividad, denominada así por los intentos del sistema inmunológico de controlar la infección en los hepatocitos. Se caracteriza por elevación de las transaminasas y la actividad histológica, y por un descenso del ADN-VHB. En esta fase puede producirse la seroconversión del HBeAg en antiHBe, momento crítico en la historia natural del VHB. Tras la seroconversión, la ALT se normaliza, la inflamación hepática remite y el ADN-VHB es ≤ 100.000 cop/ml, hablándose de portador inactivo. Un porcentaje de estos pacientes desarrolla mutaciones en la región del core o el promotor del core del VHB y provoca una elevación del ADN-VHB, el anti-HBeAg progresa a HBeAg+, refiriéndose entonces a la fase de reactivación que cursa con una afectación necroinflamatoria4.
Se sabe que hay numerosos y variados factores que intervienen en la progresión de la enfermedad. Por un lado se encuentran los sociales, demográficos y ambientales: edad, sexo, momento de la infección, zona geográfica e ingesta de alcohol, y por otro, los virales: genotipo, presencia de mutaciones en las regiones core y pre-core, carga viral, coinfección con otros virus y positividad o no del HBeAg del virus5-8.
Aunque en los últimos tiempos, con los avances en el tratamiento, se ha logrado que la infección crónica por VHB sea una enfermedad prevenible y tratable, lo que ha provocado un renovado interés por esta enfermedad, el porcentaje de pacientes que alcanza los objetivos terapéuticos sigue siendo bajo9-12. En la actualidad, a pesar de las opciones terapéuticas disponibles, la efectividad que se consigue sigue siendo limitada y el riesgo de presentar efectos adversos es alto. Sigue habiendo cuestiones por resolver, como cuándo y con qué tratar a los pacientes, pero las distintas guías de tratamiento de las sociedades científicas implicadas en el tema no han logrado ponerse de acuerdo; además, varios autores se han lanzado a proponer diferentes algoritmos de tratamiento.
El objetivo de la presente revisión es aclarar y discutir ambos temas; para ello se determinan los objetivos en esta enfermedad y el papel de las opciones terapéuticas disponibles en nuestro país, y se establecen los puntos más controvertidos entre las guías de práctica clínica más relevantes disponibles en la actualidad.
MÉTODOSe realizaron sendas búsquedas bibliográficas en las bases de datos biomédicas PubMed y EMBASE con los términos hepatitis B, limitado a drug therapy y clinical trial, metaanálisis, revisiones o guidelines, entre 1991 y 2007. De los 763 artículos recogidos, se seleccionaron únicamente los ensayos clínicos en fases II y III publicados en revistas de alto impacto, metaanálisis que estudiaban el tratamiento farmacológico de la hepatitis B, así como las últimas guías de práctica clínica de las sociedades más relevantes en este ámbito: American Association for the Study of Liver Diseases (AASLD), European Association for the Study of the Liver (EASL), Asociación Española para el Estudio del Hígado (AEEH) y la Asian Pacific Association for the Study of the Liver (APASL), y otros algoritmos de tratamiento. Asimismo, se recogieron para su análisis algunos artículos de revisión adicionales considerados de interés para responder a cuestiones no dilucidadas en los ensayos clínicos previamente seleccionados. Se excluyeron todas las publicaciones que hacían referencia exclusiva a vacunación o trasplante. Igualmente, se revisaron los abstracts de los congresos de la AASLD y EASL, desde 2004 hasta 2007. Sólo se incluyeron publicaciones escritas en inglés o castellano.
RESULTADOSObjetivos del tratamiento y control de la respuestaDadas las características de la infección, el objetivo del tratamiento puede subdividirse en varias metas que es preciso alcanzar en distintos plazos13. En primera instancia, el objetivo debe ser la inhibición de la replicación viral activa, ya que ésta es indispensable para que se produzca enfermedad. A continuación deben cumplirse otros objetivos intermedios, como disminuir la infectividad, suprimir la actividad histológica para evitar la progresión de la enfermedad y, por último, reducir el riesgo de desarrollo de cirrosis y hepatocarcinoma, aumentando de esa manera la supervivencia14.
En la práctica habitual no es fácil usar estos objetivos finales como criterios de respuesta, excepto en sujetos con cirrosis descompensada, dada la lenta evolución de la enfermedad crónica compensada. Además, la eliminación del VHB (definida como pérdida de HBsAg y seroconversión posterior a antiHBs) ocurre, según la bibliografía, en menos del 10% de los pacientes con los fármacos actualmente disponibles15. Incluso cuando se alcanza esta situación, no se logra la completa erradicación viral, ya que la replicación se mantiene por la presencia en el núcleo del hepatocito de copias de ADN circular covalentemente cerrado, que es la especie de ADN más resistente al tratamiento. Sólo un proceso de apoptosis de las células infectadas podría lograr una verdadera resolución de la infección.
Por tanto, se han utilizado otras definiciones de respuesta en los distintos ensayos desarrollados para valorar la eficacia de los fármacos disponibles en la actualidad. Entre ellas se encuentra la respuesta histológica (disminución ≥ 2 puntos en la puntuación necroinflamatoria sin empeoramiento de la puntuación de fibrosis del índice de Knodell) que, sin embargo, es muy criticada por los expertos, ya que presenta numerosas limitaciones a la hora de su valoración, como que no permite predecir de forma temprana la respuesta a los tratamientos16. Por ello, no se recomienda su uso sistemático. La respuesta bioquímica se define como la normalización de las concentraciones de ALT, y la respuesta virológica se contempla como la pérdida de HBeAg con o sin seroconversión a anti-HBe o la disminución del ADN-VHB (definida según las distintas guías como el descenso hasta valores < 100.000 cop/ml)17.
La respuesta combinada se define como la combinación de respuesta bioquímica y virológica; la respuesta completa se define como la respuesta combinada con pérdida de HBsAg (considerándose resolución de la infección); han sido herramientas utilizadas recientemente con objeto de determinar la utilidad, de una manera más estricta, de los fármacos a la hora de alcanzar los distintos objetivos propuestos para esta enfermedad.
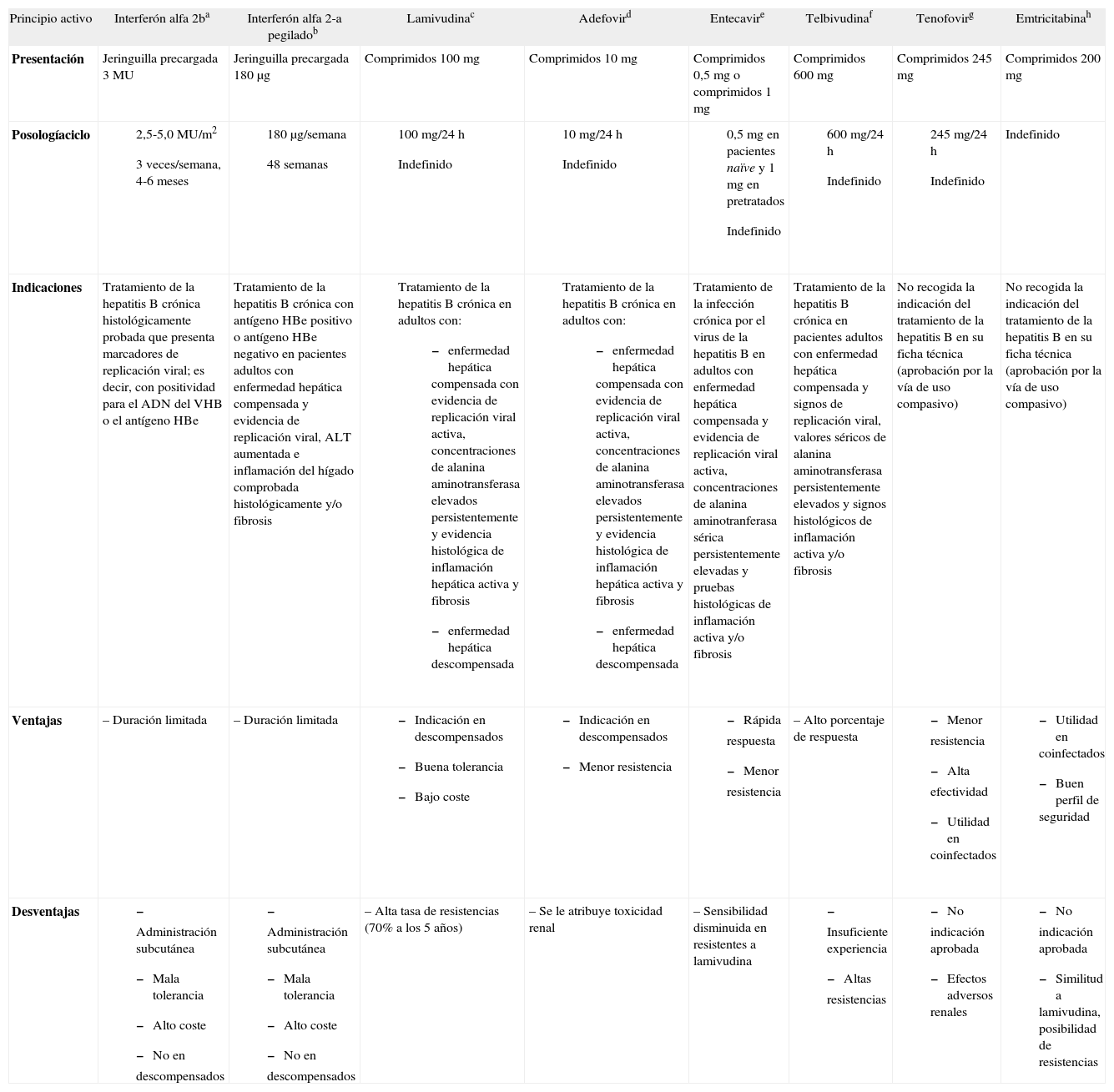
Eficacia de los fármacos disponiblesLas distintas agencias reguladoras (Food and Drug Administration [FDA] y Agencia Europea del Medicamento [EMEA]) han aprobado 6 fármacos para la infección crónica por VHB: interferón alfa 2b (INF-α) y su formulación pegilada alfa 2a (PegINF-α), lamivudina (LAM), adefovir (ADF), entecavir (ENT) y telbivudina (LDT). Además de ellos, otros fármacos con actividad frente al VIH, tenofovir (TDF) y emtricitabina (FTC), han mostrado actividad frente al VHB, aunque en la actualidad carecen de indicación formalmente aprobada para esta enfermedad (tabla 1). Otros muchos principios activos se encuentran en fases más tempranas de investigación.
Fármacos con indicación aprobada o accesibles por la vía off-label para el tratamiento de la hepatitis B en España
| Principio activo | Interferón alfa 2ba | Interferón alfa 2-a pegiladob | Lamivudinac | Adefovird | Entecavire | Telbivudinaf | Tenofovirg | Emtricitabinah |
| Presentación | Jeringuilla precargada 3 MU | Jeringuilla precargada 180 µg | Comprimidos 100 mg | Comprimidos 10 mg | Comprimidos 0,5 mg o comprimidos 1 mg | Comprimidos 600 mg | Comprimidos 245 mg | Comprimidos 200 mg |
| Posologíaciclo |
|
|
|
|
|
|
| Indefinido |
| Indicaciones | Tratamiento de la hepatitis B crónica histológicamente probada que presenta marcadores de replicación viral; es decir, con positividad para el ADN del VHB o el antígeno HBe | Tratamiento de la hepatitis B crónica con antígeno HBe positivo o antígeno HBe negativo en pacientes adultos con enfermedad hepática compensada y evidencia de replicación viral, ALT aumentada e inflamación del hígado comprobada histológicamente y/o fibrosis |
|
| Tratamiento de la infección crónica por el virus de la hepatitis B en adultos con enfermedad hepática compensada y evidencia de replicación viral activa, concentraciones de alanina aminotranferasa sérica persistentemente elevadas y pruebas histológicas de inflamación activa y/o fibrosis | Tratamiento de la hepatitis B crónica en pacientes adultos con enfermedad hepática compensada y signos de replicación viral, valores séricos de alanina aminotransferasa persistentemente elevados y signos histológicos de inflamación activa y/o fibrosis | No recogida la indicación del tratamiento de la hepatitis B en su ficha técnica (aprobación por la vía de uso compasivo) | No recogida la indicación del tratamiento de la hepatitis B en su ficha técnica (aprobación por la vía de uso compasivo) |
| Ventajas | – Duración limitada | – Duración limitada |
|
|
| – Alto porcentaje de respuesta |
|
|
| Desventajas |
|
| – Alta tasa de resistencias (70% a los 5 años) | – Se le atribuye toxicidad renal | – Sensibilidad disminuida en resistentes a lamivudina |
|
|
|
Pese a las teóricas ventajas en la administración y al hecho de que, en la práctica habitual, PegINF-α ha desplazado casi por completo al INF-α, en líneas generales, los ensayos clínicos no han demostrado de forma rotunda una importante mejoría en los resultados de eficacia de esta formulación frente a la tradicional18-23.
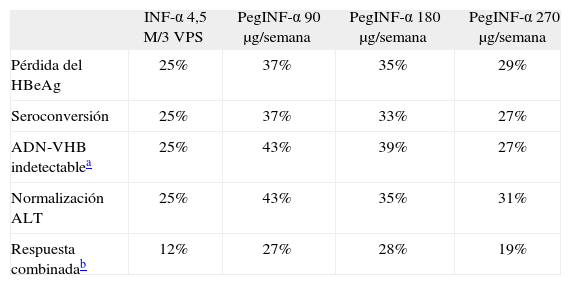
La eficacia del tratamiento con INF-α y PegINF-α en pacientes HbeAg+ ha sido revisada por diversos autores24; sin embargo, en la actualidad, el único estudio en el que se ha comparado directamente la eficacia de ambos interferones ha sido el de Cooksley et al21 (tabla 2). En él se determinó la superioridad del PegINF-α sobre el INF-α, tanto en la negativización del HBeAg como en el descenso o la negativización a largo plazo del ADN-VHB y la normalización persistente de ALT. En dicho estudio se incluyó a 194 pacientes, todos HbeAg+, aleatorizados para recibir INF-α (4,5 MU 3 veces por semana) o PegINF-α (90, 180 o 270 µg/semana). La duración del tratamiento fue de 24 semanas; con posterioridad hubo un período de seguimiento de otras 24 semanas. Curiosamente, los mejores resultados se obtuvieron con las dosis más bajas del PegINF-α.
Resumen de los resultados del estudio de Cooksley et al21 en pacientes HbeAg+ tratados con interferón
| INF-α 4,5 M/3 VPS | PegINF-α 90 µg/semana | PegINF-α 180 µg/semana | PegINF-α 270 µg/semana | |
| Pérdida del HBeAg | 25% | 37% | 35% | 29% |
| Seroconversión | 25% | 37% | 33% | 27% |
| ADN-VHB indetectablea | 25% | 43% | 39% | 27% |
| Normalización ALT | 25% | 43% | 35% | 31% |
| Respuesta combinadab | 12% | 27% | 28% | 19% |
Tomada de: Cooksley et al21.
En pacientes HBeAg−, con INF-α se han encontrando tasas de respuesta muy variadas (40-90%). Sin embargo, el gran problema de fármaco ha sido el alto porcentaje de pacientes, alrededor del 50%, que vuelve a recaer tras el cese del tratamiento25-27. Con PegINF-α, Marcellin et al28 encontraron tasas de respuesta mantenida (incluida la negativización del ADN-VHB y la normalización de las transaminasas) a las 72 semanas del 15%, similares a las obtenidas por uno de los grupos comparadores diseñado en este estudio, PegINF-α + lamivudina (LAM) y superior al grupo tratado con LAM en monoterapia. Recientemente se han conocido los datos de este estudio a las 96 semanas, manteniéndose las respuestas en valores similares29.
En diversos estudios se han intentado identificar los factores predictivos de respuesta al tratamiento, tanto con INF-α30-32 como con PegINF-α. Mientras que para los pacientes HBeAg+ se ha observado que las concentraciones altas de ALT, el bajo número de copias de ADN-VHB y los genotipos A y B son los que predicen una mejor respuesta al tratamiento, no se ha descrito aún ningún parámetro fiable que indique la evolución del tratamiento en pacientes HBeAg−13,24. No obstante, parece que hay una mejor respuesta en los que tienen concentraciones basales de ALT elevadas o que están infectados por el genotipo C33.
LamivudinaLa publicación de los ensayos en fase III, en 2 poblaciones diferentes (asiática y americana), estableció la eficacia de LAM en pacientes HBeAg+34-36. En ellos se determinó una respuesta histológica, tras 52 semanas de tratamiento, del 56%. Igualmente, se obtuvo seroconversión en el 16% de los sujetos. Con la prolongación del tratamiento a 104 semanas37 se consiguió la seroconversión del HBeAg en el 27%, y a los 3 años en el 40%, pero la aparición de resistencias limitaba la posibilidad de respuestas más favorables. La respuesta sostenida, según el período de seguimiento postratamiento tras la seroconversión, se cifra en torno al 38-77%38. La prolongación del tratamiento tras la seroconversión del HBeAg ha demostrado que favorece que sea sostenida en el tiempo39.
En estudios realizados en pacientes HBeAg− tratados durante 48 semanas se han observado tasas de ADN-VHB indetectables del 68-73%40-43. Mientras que la normalización de las transaminasas se correlaciona con la disminución de la carga viral, alcanzándose en más del 60% de los pacientes, el porcentaje de pacientes con resistencias al año es cercano al 18%. Sólo en un estudio, el de Funk et al44, se ha valorado la tasa de respuesta mantenida en pacientes HBeAg− tras un curso de 2 años de tratamiento, observándose una probabilidad de recaída clínica y virológica, tras finalización del tratamiento, del 12 y el 30%, el 18 y el 50%, y el 30 y el 50% a los 6, 12 y 18 meses tras discontinuar el tratamiento con LAM, respectivamente.
En pacientes con hepatopatía avanzada o cirrosis hepática establecida, la principal prueba científica de utilidad de LAM la aportó el estudio de Liaw et al45 realizado en 651 pacientes con un alto grado de fibrosis o cirrosis, en el que se comparó LAM frente a placebo. El 7,8% de los pacientes tratados con LAM alcanzó el objetivo primario, progresión clínica, frente al 17,7% del placebo, para un período de seguimiento medio de 32 meses. El 49% desarrolló mutaciones YMDD, con un menor beneficio clínico respecto a los que se mantuvieron con LAM sin aparición de resistencias. Papatheodoridis et al46 observaron, en un estudio retrospectivo con pacientes anti-HBe+, el mismo beneficio clínico y comprobaron que el inicio precoz del tratamiento con ADF en pacientes resistentes a LAM reducía el riesgo de complicaciones respecto al de pacientes que nunca habían sido tratados o que no respondieron al interferón.
Los valores de ALT pretratamiento parecen ser el factor de mayor utilidad para predecir la seroconversión durante el tratamiento con LAM. Al igual que ocurre con el interferón, los pacientes con valores de ALT normales parecen no beneficiarse del tratamiento con LAM47,48.
Por desgracia, LAM tiene una alta tasa de resistencias, que aparecen como media en un 15-20% de los pacientes/año. Su desarrollo se asocia con pérdida de respuesta clínica, elevación de ALT y empeoramiento de la histología hepática. Por ello, los resultados a largo plazo del tratamiento con LAM son escasos, en especial en la población HBeAg+49,50.
AdefovirLa eficacia de ADF en pacientes HBeAg+ ha sido evaluada en numerosos estudios51 aunque, tal vez, el de mayor relevancia es el ensayo de Marcellin et al52, realizado en 515 pacientes aleatorizados para recibir dosis de 10 o 30 mg, o placebo, cuyo objetivo principal era valorar la mejoría histológica. Como objetivos secundarios también se encontraban la valoración de la respuesta virológica y bioquímica, y la proporción de pacientes con seroconversión HBeAg. A las 48 semanas de tratamiento se obtuvo mejora histológica en el 55 y el 59% de los pacientes que tomaban ADF en dosis de 10 y 30 mg, y en 25% del grupo placebo. El ADN-VHB se hizo indetectable en el 21 y el 39%, respectivamente, y la normalización de ALT ocurrió en el 48 y el 55% de los tratados con 10 y 30 mg, respectivamente. La pérdida del HBeAg se determinó en el 24 y el 27% de los tratados con ADF, y el 12 y el 14% desarrollaron anti-HBe. De los pacientes de este estudio, 309, 296, 231 y 84 continuaron el tratamiento en un nuevo estudio abierto y no controlado, todos con dosis de 10 mg, evaluándose las respuestas a las 48, 96 y 144 semanas, respectivamente. El ADN-VHB se hizo indetectable en el 28% al primer año y hasta en el 45 y el 56% en el segundo y tercer año, respectivamente. La normalización de las cifras de ALT sérica ocurrió en el 58, el 71 y el 81%, respectivamente. La pérdida de HBeAg ocurrió en el 21, el 42 y el 51% de los pacientes tras el primero, segundo y tercer año, con seroconversión anti-HBe hasta en el 12, el 29 y el 43% al cabo de 1, 2 y 3 años de tratamiento, respectivamente53.
En pacientes HBeAg−, el ADF también demostró ser útil según ensayo de Hadziyannis et al54, comparativo con placebo, realizado en 185 pacientes tratados durante 48 semanas, donde el objetivo primario también era la respuesta histológica. A las 48 semanas se alcanzó un 64% de mejoría histológica en el grupo de ADF frente al 33% en el grupo placebo (p < 0,001). Igualmente, se obtuvo un 51% de pacientes tratados con ADF con cifras indetectables de ADN-VHB frente a un 0% para el placebo (p < 0,001). Las concentraciones de ALT se normalizaron en el 72 y el 29% en los grupos de ADF y placebo, respectivamente. Cuando se interrumpió el tratamiento de ADF a las 48 semanas, los pacientes se reasignaron, en un segundo estudio con diseño abierto, a ADF o placebo. A los pacientes que habían recibido placebo inicialmente se les asignó a ADF 10 mg/día. Alas 96 semanas, a los que habían recibido ADF se les propuso continuar con ADF. Para el 71% de los pacientes que recibieron ADF, la carga viral fue menor de 1.000 copias/ml. Por contra, en la mayoría de los pacientes que pasaron de ADF a placebo se observó una pérdida del beneficio del tratamiento ya a partir de la cuarta semana, y sólo un 8% tenía < 1.000 copias/ml en la semana 96. El descenso de las transaminasas fue significativamente mayor en los grupos que continuaron con ADF o pasaron de placebo a ADF que en el grupo que pasó de ADF a placebo (p = 0,01), y en la semana 96, el 73 y el 80% de los grupos que recibían ADF tenían un valor de ALT normal frente al 32% del grupo placebo. En el grupo que continuó hasta la semana 144, la ALT permaneció igual, con normalización en el 69% de estos pacientes55,56.
En pacientes resistentes a LAM, el ADF ha sido evaluado en varios estudios. El de Kim et al57 se llevó a cabo en 46 sujetos con hepatopatía descompensada, HBeAg+ y VHB resistente a LAM, tratándose a los pacientes con ADF o LAM+ADF durante 24 semanas. El 83% de los pacientes del grupo de monoterapia y el 86% del grupo de terapia combinada alcanzaron concentraciones indetectables de ADN-VHB. Las transaminasas se normalizaron en el 78 y el 82% de los pacientes. Peters et al58 seleccionaron a pacientes con enfermedad hepática compensada, HBeAg+ con genotipo resistente a LAM, concentraciones de ALT elevados y ADN-VHB > 1.000.000 copias/ml, y los aleatorizaron para recibir ADF, LAM o LAM + ADF. El objetivo primario era el descenso del ADN-VHB a las 16 semanas. El ADN-VHB descendió −0,07 log10 en el grupo de LAM y fue mayor, pero similar, entre los grupos de ADF y ADF + LAM (−2,45 log10 y −2,46 log10 copias/ml; p < 0,001). A las 48 semanas, el descenso del ADN-VHB fue 0,0 log10; −3,59 log10y −4,04 log10 copias/ml.
En el estudio de Perrillo et al59, controlado frente a placebo, se valoraron la eficacia y la seguridad de añadir ADF a 135 pacientes con YMDD mutante. De los 95 pacientes con hepatitis compensada (grupo A), 46 se asignaron a tratamiento con ADF y 49 a placebo durante 52 semanas, mientras continuaban con LAM; el resto, 40 pacientes con cirrosis descompensada o hepatitis B postrasplante, fue asignado a ADF + LAM (grupo B). El objetivo principal era la frecuencia de descenso de ADN a 100.000 copias/ml o la reducción de 2 log10 copias/ml desde la determinación basal, a las 48 y 52 semanas de tratamiento. El ADN-VHB descendió en el 85% de los pacientes del grupo A de tratamiento combinado y en el 24% de los que recibieron LAM (p < 0,001). En el grupo B, el 92% tuvo respuesta virológica y mejoría de bioquímica (p < 0,001). Por último, el estudio de Schiff et al60 realizado en 324 pacientes resistentes a LAM y en situación tanto de pretrasplante como de postransplante, demostró que la adición de ADF mejora la supervivencia al año de estos pacientes (el 84% para los de pretrasplante y el 93% para los de postransplante) y alcanza buenos grados de respuesta en cuanto a los objetivos virológicos, bioquímicos e histológicos.
No se han descrito, hasta ahora, factores predictivos de repuesta lo suficientemente fiables como para poder predecir los subgrupos de pacientes con alta probabilidad inicial de respuesta a ADF61,62.
Las resistencias al ADF han sido descritas como de aparición lenta. Las mutaciones N236Ty A181Vse han relacionado con la disminución de la sensibilidad a ADF, aunque hay posibilidad de rescate con emtricitabina y LAM en el primero de los casos y con tenofovir en el segundo. Los porcentajes de resistencias que aparecen en los pacientes tratados con ADF son de un grado acumulativo anual del 2,5% los 4 primeros años de tratamiento63.
EntecavirEn el ensayo clínico pivotal realizado en pacientes HBeAg+ se aleatorizó a 715 sujetos con enfermedad hepática compensada a recibir ETV o LAM64,65. Alas 48 semanas se obtuvieron unas tasas de respuesta histológica del 72 y el 62% para los grupos tratados con ETV y LAM, respectivamente. Las tasas de respuesta virológica (ADN-VHB < 0,7 mEq/ml) fueron del 67 y el 36%, y las bioquímicas (normalización de las transaminasas) del 68 y el 60% en cada uno de los grupos. La respuesta completa (definida como la suma de respuesta virológica + antígeno e negativizado) fueron del 21% para el grupo de ETV frente al 19% para LAM a las 48 semanas.
En el estudio diseñado para sujetos HBeAg− se incluyó a un total de 648 pacientes66. La mejoría de las lesiones anatomopatológicas, objetivo principal del estudio, se observó en la semana 48 de tratamiento en el 70% de los pacientes del grupo ETV y en el 61% de los del grupo LAM. Estas diferencias fueron estadísticamente significativas, al igual que los parámetros virológicos (porcentaje de pacientes con ADN viral negativo, 90 frente a 72%) y bioquímicos (normalización de las transaminasas, 78 frente a 71%), para los pacientes de los grupos ETVy LAM, respectivamente. Los porcentajes de respuesta completa (respuesta virológica + antígeno e negativizado) fueron del 85 y el 78%, respectivamente.
También se ha estudiado ETV en pacientes tratados con LAM con anterioridad67-69. En concreto, en el estudio de Tassopoulos et al68, 181 pacientes resistentes a LAM fueron aleatorizados para recibir 3 dosis diferentes de ETV (0,1; 0,5 y 1 mg diarios) o 100 mg de LAM. El porcentaje de pacientes con ADN-VHB indetectable, tras 24 semanas de tratamiento, fue del 19% en el grupo de 0,1 mg de ETV, del 53% en el de 0,5 mg de ETV, del 79% en el de 1 mg de ETV y del 13% en el grupo de LAM (p < 0,0001). Más recientemente, Sherman et al69 han publicado otro ensayo de fase III para determinar la eficacia y la seguridad de ETV en comparación con LAM en pacientes refractarios a LAM. Se incluyó a 240 pacientes, únicamente HBeAg+. Los porcentajes de pacientes con mejora histológica (el 55 frente al 28%), y respuesta virológica (el 19 frente al 1%) y bioquímica (el 61 frente al 15%) fueron significativamente mejores en el grupo de ETV. No así el porcentaje de seroconversión (el 8 frente al 3%).
No se han determinado aún los factores predictivos de respuesta a ETV, ya que este fármaco parece ser igualmente efectivo en pacientes de distintas razas, para los diversos genotipos del VHB y en un amplio intervalo de elevación de las concentraciones de ALT70,71.
Se han descrito tasas de resistencias a ETV en los pacientes naïve de sólo el 3% a las 96 semanas de tratamiento, las cuales se han relacionado con resistencias previas a LAM72,73.
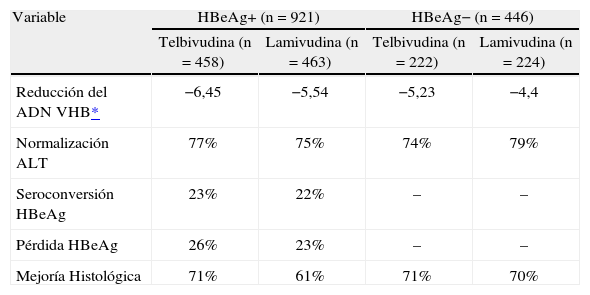
TelbivudinaLa eficacia de LDT se ha comprobado en los estudios pivotales GLOBE 00774 realizados en 1.367 pacientes entre HBeAg+ y HBeAg−, comparados con LAM. En estos estudios, la mayoría de los pacientes era de raza asiática. La variable principal, respuesta terapéutica, fue definida como una combinación de respuesta virológica + pérdida de HBeAg sérico o normalización de ALT.
En pacientes HBeAg+ (n = 921), LDT fue superior a LAM en términos de respuesta terapéutica (el 75,3 frente al 67,0%; p = 0,0047). Sin embargo, para pacientes HBeAg− (n = 446) sólo demostró ser no inferior a LAM (el 75,2 frente al 77,2%; p = 0,6187). En la tabla 3 se exponen otras variables virológicas, bioquímicas y serológicas recogidas a las 52 semanas de tratamiento75.
Variables virológicas, bioquímicas y serológicas en los estudios pivotales de telbivudina
| Variable | HBeAg+ (n = 921) | HBeAg− (n = 446) | ||
| Telbivudina (n = 458) | Lamivudina (n = 463) | Telbivudina (n = 222) | Lamivudina (n = 224) | |
| Reducción del ADN VHB* | −6,45 | −5,54 | −5,23 | −4,4 |
| Normalización ALT | 77% | 75% | 74% | 79% |
| Seroconversión HBeAg | 23% | 22% | – | – |
| Pérdida HBeAg | 26% | 23% | – | – |
| Mejoría Histológica | 71% | 61% | 71% | 70% |
Se ha observado que la raza caucásica se asoció con una respuesta inferior en ambos grupos de tratamiento; sin embargo, la población de pacientes caucásicos incluida era minoritaria (n = 98) respecto al total.
Recientemente, Chan et al76 han comparado LDT y ADF, en un estudio abierto, en pacientes naïve HBeAg+. Los pacientes fueron aleatorizados para recibir LDT, ADF o ADF las primeras 24 semanas y LDT durante las restantes 28, hasta completar un año de tratamiento. LDT demostró una mayor y más consistente disminución de ADN-VHB tras 24 semanas de tratamiento y, al año de tratamiento, la supresión del ADN-VHB fue mayor en el grupo de los pacientes que recibieron LDT de manera continua que en los del grupo de tratamiento alternativo ADF-LDT (valores medios de ADN-VHB en la semana 52 de 3,01 log10 copias/ml [grupo LDT] y 3,02 log10 copias/ml [grupo ADF-LDT] frente a 4,00 log10 cop/ml [grupo ADF]).
El especial mecanismo de acción de LDT teóricamente dificultaría la aparición de mutantes resistentes, ya que actúa inhibiendo la síntesis de la segunda hebra del ADN viral. No obstante, se han comunicado tasas de resistencia del 21% en pacientes tratados durante 2 años con el fármaco77-80.
Fármacos en desarrolloTenofovirEn el más amplio estudio publicado en la actualidad para valorar la utilidad de TDF81 en el tratamiento de la VHB en pacientes coinfectados, Benhamou et al82 mostraron la eficacia del fármaco, en asociación con LAM, tanto en sujetos HBeAg+ como HBeAg−, con la particularidad de que la mayoría de los 65 pacientes incluidos en este estudio retrospectivo mostraba la mutación YMDD, que está asociada con resistencia a LAM. Se determinaron reducciones en el ADN-VHB tras 48 semanas de tratamiento con TDF de 4,56 log10 copias/ml para HBeAg+ y 2,53 log10 copias/ml en HBeAg−. El porcentaje de pacientes con carga viral indetectable fue del 29,6 y el 81,6% en HBeAg+ y HBeAg−, respectivamente. Se recogió una duración de la respuesta virológica del 100 y el 66,6% en los sujetos HBeAg+ y HBeAg−, respectivamente.
A su vez, TDF también se ha mostrado superior, en pequeños estudios comparativos con otros fármacos con actividad frente al VHB83-85, como ADF, en pacientes previamente resistentes a LAM, tanto coinfectados como monoinfectados86-88. En el estudio de Van Bommel et al86 se alcanzó un 100% de pacientes con concentraciones de ADN-VHB <100.000 copias/ml, frente a un 44% de los tratados con ADF, sin la aparición de efectos adversos destacables o resistencias.
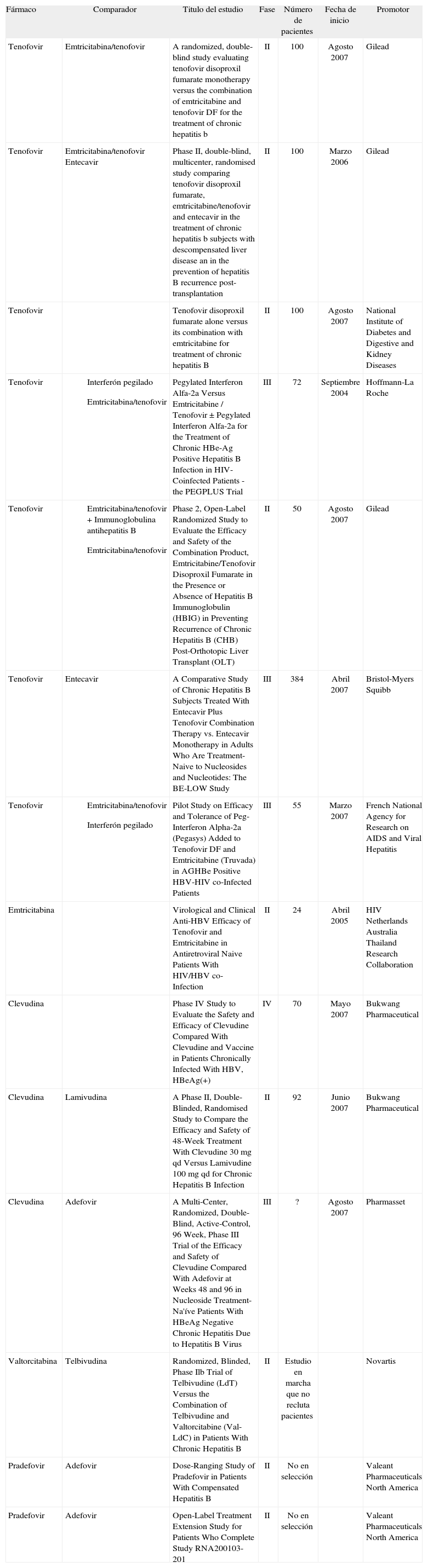
Hasta ahora no se han publicado casos de reactivaciones de la infección por el VHB como consecuencia de resistencias a TDF, aunque siguen siendo necesarios más estudios prospectivos en los que valorar la eficacia del fármaco a largo plazo, la duración de la supresión del ADN-VHB, las tasas de seroconversión y las potenciales resistencias, así como la seguridad a largo plazo cuando se combina con otros fármacos como LAM o FTC89. Actualmente están en curso varios ensayos clínicos de fase III en los que se evalúa la utilidad de TDF en distintos tipos de pacientes y frente a varios comparadores (tabla 4).
Ensayos clínicos en marcha de los nuevos fármacos para el tratamiento de la hepatitis B*
| Fármaco | Comparador | Titulo del estudio | Fase | Número de pacientes | Fecha de inicio | Promotor |
| Tenofovir | Emtricitabina/tenofovir | A randomized, double-blind study evaluating tenofovir disoproxil fumarate monotherapy versus the combination of emtricitabine and tenofovir DF for the treatment of chronic hepatitis b | II | 100 | Agosto 2007 | Gilead |
| Tenofovir | Emtricitabina/tenofovir Entecavir | Phase II, double-blind, multicenter, randomised study comparing tenofovir disoproxil fumarate, emtricitabine/tenofovir and entecavir in the treatment of chronic hepatitis b subjects with descompensated liver disease an in the prevention of hepatitis B recurrence post-transplantation | II | 100 | Marzo 2006 | Gilead |
| Tenofovir | Tenofovir disoproxil fumarate alone versus its combination with emtricitabine for treatment of chronic hepatitis B | II | 100 | Agosto 2007 | National Institute of Diabetes and Digestive and Kidney Diseases | |
| Tenofovir |
| Pegylated Interferon Alfa-2a Versus Emtricitabine / Tenofovir ± Pegylated Interferon Alfa-2a for the Treatment of Chronic HBe-Ag Positive Hepatitis B Infection in HIV-Coinfected Patients - the PEGPLUS Trial | III | 72 | Septiembre 2004 | Hoffmann-La Roche |
| Tenofovir |
| Phase 2, Open-Label Randomized Study to Evaluate the Efficacy and Safety of the Combination Product, Emtricitabine/Tenofovir Disoproxil Fumarate in the Presence or Absence of Hepatitis B Immunoglobulin (HBIG) in Preventing Recurrence of Chronic Hepatitis B (CHB) Post-Orthotopic Liver Transplant (OLT) | II | 50 | Agosto 2007 | Gilead |
| Tenofovir | Entecavir | A Comparative Study of Chronic Hepatitis B Subjects Treated With Entecavir Plus Tenofovir Combination Therapy vs. Entecavir Monotherapy in Adults Who Are Treatment-Naive to Nucleosides and Nucleotides: The BE-LOW Study | III | 384 | Abril 2007 | Bristol-Myers Squibb |
| Tenofovir |
| Pilot Study on Efficacy and Tolerance of Peg-Interferon Alpha-2a (Pegasys) Added to Tenofovir DF and Emtricitabine (Truvada) in AGHBe Positive HBV-HIV co-Infected Patients | III | 55 | Marzo 2007 | French National Agency for Research on AIDS and Viral Hepatitis |
| Emtricitabina | Virological and Clinical Anti-HBV Efficacy of Tenofovir and Emtricitabine in Antiretroviral Naive Patients With HIV/HBV co-Infection | II | 24 | Abril 2005 | HIV Netherlands Australia Thailand Research Collaboration | |
| Clevudina | Phase IV Study to Evaluate the Safety and Efficacy of Clevudine Compared With Clevudine and Vaccine in Patients Chronically Infected With HBV, HBeAg(+) | IV | 70 | Mayo 2007 | Bukwang Pharmaceutical | |
| Clevudina | Lamivudina | A Phase II, Double-Blinded, Randomised Study to Compare the Efficacy and Safety of 48-Week Treatment With Clevudine 30 mg qd Versus Lamivudine 100 mg qd for Chronic Hepatitis B Infection | II | 92 | Junio 2007 | Bukwang Pharmaceutical |
| Clevudina | Adefovir | A Multi-Center, Randomized, Double-Blind, Active-Control, 96 Week, Phase III Trial of the Efficacy and Safety of Clevudine Compared With Adefovir at Weeks 48 and 96 in Nucleoside Treatment-Na'íve Patients With HBeAg Negative Chronic Hepatitis Due to Hepatitis B Virus | III | ? | Agosto 2007 | Pharmasset |
| Valtorcitabina | Telbivudina | Randomized, Blinded, Phase Ilb Trial of Telbivudine (LdT) Versus the Combination of Telbivudine and Valtorcitabine (Val-LdC) in Patients With Chronic Hepatitis B | II | Estudio en marcha que no recluta pacientes | Novartis | |
| Pradefovir | Adefovir | Dose-Ranging Study of Pradefovir in Patients With Compensated Hepatitis B | II | No en selección | Valeant Pharmaceuticals North America | |
| Pradefovir | Adefovir | Open-Label Treatment Extension Study for Patients Who Complete Study RNA200103-201 | II | No en selección | Valeant Pharmaceuticals North America |
El estudio RNA200103-201 es el titulado: Dose ranking study of pradefovir in patients with compensated hepatitis B.
Tomada de Clinical Trials119.
En la actualidad, sólo Jain et al90 han señalado que los pacientes con genotipo A son los que mejor responden al tratamiento con TDF en pacientes infectados por VHB.
El hecho de que TDF haya mostrado una potente actividad frente al VIH y una prometedora eficacia en los estudios realizados en pacientes VHB, tanto monoinfectados como coinfectados, hace que, actualmente, TDF sea considerado el fármaco de elección en el tratamiento de la coinfección VHB/VIH, sobre todo en los pacientes con menos de 350 células/µl CD491-93.
EmtricitabinaEn el estudio de Lim et al94,95 realizado en pacientes monoinfectados por VHB, FTC se comparó con placebo, alcanzándose, a las 48 semanas de tratamiento, un 54% de pacientes con ADN-VHB indetectable (el 39% HbeAg+ y el 79% HbeAg−), un 65% con normalización de las transaminasas y una tasa de seroconversión del 12%. Por el contrario, a la finalización del estudio, un 13% de los pacientes había desarrollado mutaciones que conferían resistencias al fármaco.
También ha resultado útil la combinación con TDF en pacientes en los que ha fallado el tratamiento con ADF96. Por el contrario, la adición de clevudina al tratamiento con FTC no parece aumentar la eficacia del tratamiento97.
ClevudinaHasta ahora, el estudio de mayor interés realizado en pacientes HBeAg+ ha sido el de Yoo et al98 en 243 pacientes asiáticos, en el que se comparó clevudina 30 mg frente a placebo durante 24 semanas de tratamiento. El fármaco fue bien tolerado y disminuyó la viremia de forma marcada (−5,1 frente a −0,2 log10). Al finalizar el estudio, las transaminasas se normalizaron en el 68 frente al 17% de los grupos y se mantuvieron en una proporción similar en las 24 semanas de seguimiento posteriores.
En un estudio de características similares realizado en 86 pacientes HBeAg−99 se observó una marcada disminución de la viremia, que se mantuvo tras la finalización del tratamiento. Alas 24 semanas de la interrupción del tratamiento, el 70% de los pacientes presentaba valores de transaminasas normales.
Aunque las resistencias a la clevudina no han sido aún bien caracterizadas, en los estudios clínicos se han observado algunas mutaciones en la región de la polimerasa, por lo que se ha señalado la posibilidad de que haya resistencias cruzadas con LAM.
ValtorcitabinaEn un estudio de búsqueda de dosis de 4 semanas en pacientes HbeAg+ se evaluó la eficacia de varias presentaciones de valtorcitabina (50, 100, 200, 300, 600, 900 y 1.200 mg/día) administradas por vía oral en una dosis única diaria. Al final del período de tratamiento, todos los grupos consiguieron reducir las concentraciones de ADN-VHB. Destaca que los pacientes con dosis más altas experimentaron un descenso de la viremia inferior al observado con la dosis de 900 mg100.
No se han descrito, hasta el momento, resistencias a valtorcitabina, pero cabe esperar que aparezcan, al compartir mutaciones que confieren resistencias a lamivudina. Durante su desarrollo, valtorcitabina se ha diseñado para su administración en combinación con telbivudina.
PradefovirLos resultados preliminares de un ensayo presentado en el congreso de AASLD pusieron de manifiesto mejores tasas de respuesta para 3 de los 4 grupos de tratamiento con pradefovir frente al grupo de pacientes tratados con el fármaco comparador, ADF, a las 24 semanas desde el inicio del tratamiento, en términos de disminución de carga viral. No se observaron problemas de nefrotoxicidad en ninguno de los grupos. Los pacientes eran en su mayoría HbeAg+ (70%) y había sido pretratados con anterioridad101.
Otros fármacosOtro fármaco con proyección en el tratamiento del VHB pero con menores pruebas científicas es, entre otros, racivir, un inhibidor de la polimerasa del ADN-VHB que en la actualidad se encuentra en estudios de fase II. Estructuralmente es muy similar a LAM y FTC, por lo que se ha observado que, además de actividad frente al VHB, también tiene actividad frente al VIH. La nitazoxanida es un fármaco utilizado para el tratamiento de las parasitosis intestinales en los niños que también podría ser útil frente al VHB y la hepatitis C. El NOV-205 es un agente inmunomodulador que actúa como hepatoprotector, con propiedades antiinflamatorias. Actualmente es un fármaco aprobado en Rusia para las hepatitis C y VHB (Molixan®), pero se desconoce su situación legal en Europa. El EHT899 es una proteína viral que se administra por vía oral, diseñada para eliminar la respuesta inmunitaria indeseable inducida por el VHB. En un ensayo inicial realizado en 42 pacientes con VHB tratados durante 48 semanas se consiguió que en un 46% descendiera el ADN-VHB y que en un 33% disminuyera la inflamación considerada a través de biopsias102.
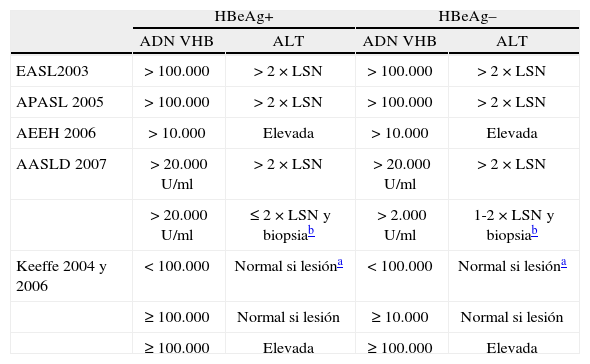
Guías de práctica clínicaEn la actualidad, no hay un criterio universalmente aceptado sobre qué pacientes tratar y con qué fármacos. En este sentido, las más consolidadas guías de tratamiento, como las de AASLD, EASL, AEEH y APASL, difieren respecto al umbral de transaminasas (al menos 2 veces por encima del límite superior de la normalidad) y marcadores séricos (concentraciones elevadas de ADN y positividad del HBeAg)103-106 (tabla 5).
Valoración del inicio de tratamiento según las distintas guías de práctica clínica para el tratamiento de la hepatitis B
| HBeAg+ | HBeAg– | |||
| ADN VHB | ALT | ADN VHB | ALT | |
| EASL2003 | > 100.000 | > 2 × LSN | > 100.000 | > 2 × LSN |
| APASL 2005 | > 100.000 | > 2 × LSN | > 100.000 | > 2 × LSN |
| AEEH 2006 | > 10.000 | Elevada | > 10.000 | Elevada |
| AASLD 2007 | > 20.000 U/ml | > 2 × LSN | > 20.000 U/ml | > 2 × LSN |
| > 20.000 U/ml | ≤ 2 × LSN y biopsiab | > 2.000 U/ml | 1-2 × LSN y biopsiab | |
| Keeffe 2004 y 2006 | < 100.000 | Normal si lesióna | < 100.000 | Normal si lesióna |
| ≥ 100.000 | Normal si lesión | ≥ 10.000 | Normal si lesión | |
| ≥ 100.000 | Elevada | ≥ 100.000 | Elevada | |
Todas estas recomendaciones han sido muy criticadas por diferentes expertos en la materia107-111. Entre los puntos más discutidos se encuentran el hecho de que, por un lado, muchos pacientes con concentraciones de ALT, que no alcanzan el valor de 2 veces el límite superior de la normalidad, o que incluso muestran valores normales de ALT, pueden presentar enfermedad hepática, ya que hay bastantes pruebas científicas que indican que las concentraciones de ALT no se correlacionan con el grado de fibrosis. En el estudio de Yang et al112 se demostró que más del 45% de los pacientes con infección por VHB y concentraciones normales de ALT se encuentran en un estadio 2 o superior de fibrosis. Iloeje et al113 observaron que las concentraciones de ALT no predicen de manera potente con el desarrollo de hepatocarcinoma, cirrosis o muerte. De esa manera, se cree que, aunque las concentraciones de ALT permiten identificar a los pacientes con enfermedad activa114-115, también pueden hacer perder a algunos pacientes con inflamación significativa110. Por otro lado, también se ha criticado el hecho de que una concentración de ADN-VHB de 105 copias/ml, señalada como punto crítico para tratar o no tratar16, podría resultar excesivamente elevado, principalmente en los sujetos HBeAg− con mutación en la región pre-core112,116,117.
Las guías de la AASLD103, las últimas en actualizarse, recomiendan tratar a los pacientes HbeAg+ siempre que presenten cifras > 100.000 cop/ml de ADN-VHB y valores de ALT por encima de 2 veces el límite superior de la normalidad o, si este parámetro es normal, cuando la biopsia marque inflamación moderada/grave o fibrosis significativa. Para los pacientes HBeAg−, los que presenten valores > 100.000 copias/ml de ADN-VHB y ALT por encima de 2 veces el límite superior de la normalidad deben ser tratados. Igualmente, los que presenten cifras entre 10.000 y 100.000 copias/ml deben iniciar tratamiento, siempre y cuando sus cifras superen el doble de la normalidad para la ALT y la biopsia hepática indique una inflamación moderada-grave o aparezca una fibrosis significativa. Hasta ahora, la guía de consenso que indica el tratamiento con valores más bajos de ADN-VHB era la española, ya que sólo se requieren valores > 10.000 copias/ml y elevación de las transaminasas. El resto de documentos, EASL104, APASL105 y los algoritmos propuestos por otros autores, como Keeffe107,108, mantienen que el tratamiento debe iniciarse con valores > 100.000 copias/ml (tabla 5).
En cuanto al otro gran interrogante, con qué fármaco tratar, la elección de una opción terapéutica determinada en detrimento de las otras como tratamiento de primera línea resulta complicado debido, por un lado, a la ausencia de estudios comparativos y, por otro, a que los objetivos primarios de los ensayos clínicos no han sido uniformes, ni tampoco las definiciones de respuesta y la metodología utilizada para cuantificar la replicación viral o para la detección de resistencias.
Es necesario tener en cuenta que un importante número de pacientes conseguirá la seroconversión, con independencia del tratamiento que se utilice. La diferencia radicará en el tiempo del tratamiento, 6-12 meses para INF-α o PegINF-α y 1-4 o más años para los análogos de nucleósidos/nucleótidos.
En HBeAg+, los pacientes con valores elevados de ALT y baja carga viral que son tratados con PegINF-α son los que mejor responden al tratamiento; sin embargo, estas características también permiten identificar a los pacientes que mejor responden a los análogos de los nucleósidos. Además, se ha divulgado el hecho de la que seroconversión inducida por PegINF-α es más duradera que la inducida por LAM o ADF tras un año de tratamiento; sin embargo, resulta complicado sostener esta afirmación, ya que ninguno de estos análogos de nucleósidos se utiliza de esta manera en la práctica clínica. Por tanto, es lógico pensar que el mantenimiento de la seroconversión con fármacos análogos de los nucleósidos tras una duración de tratamiento mayor de un año podría ser superior. Los autores que indican que la pérdida del HBAgs es mayor con PegINF-α que con el resto de análogos sostienen una afirmación parecida110. Si se comparan los datos, no para un año sino para un período mayor, de hasta 4 años, las tasas pueden ser incluso superiores para fármacos como ADF y LAM, y falta saber si también lo serán con ETV y LDT.
De cualquier forma, un porcentaje en torno al 30-40% de los pacientes conseguirá la seroconversión, mientras que quedaría un 60-70% de sujetos que necesitarán otros tratamientos. Aquí cobra vital importancia minimizar la aparición de resistencias. Idealmente, todos los pacientes deben alcanzar cifras de ADN-VHB < 10.000 copias/ml (tablas 6 y 7). En este sentido, pese a que LAM ha demostrado una supresión más rápida y potente que el ADV, su principal problema es la elevada tasa de resistencias que genera, por lo que cabe esperar que su papel en el tratamiento de la hepatitis B disminuya en el futuro, con la incorporación de ETV y LDT, que se asocian con una menor tasa de resistencias. Las tasas de respuestas completas obtenidas indican que ETV podría ser el fármaco de elección en pacientes con HBe-Ag+, sobre todo en los que tienen cifras más altas de ADN-VHB (tabla 8). En HBeAg− y enfermedad compensada, donde resulta fundamental realizar una valoración minuciosa y repetida de la replicación viral, en caso de necesitar tratamiento, INF-α o PegINF-α, LAM, ADF, ETV y LDT podrían utilizarse como primera línea de tratamiento. Sin embargo, el hecho de que la respuesta persistente se alcance raramente en estos pacientes y que se precisen tratamientos a muy largo plazo para mantener la supresión de la replicación viral podrían hacer pensar que, en función de los datos sobre respuestas completas actualmente disponibles y a la espera de más datos sobre subgrupos de pacientes concretos, los sujetos con valores más bajos de ADN-VHB podrían beneficiarse de un tratamiento con PegINF-α, LAM o ADF, y aquellos con cifras de ADN-VHB más altas, del tratamiento con ETV o LDT.
Resistencias documentadas genéticamente a los fármacos disponibles para el tratamiento de la infección crónica por VHB
| Fármaco/Mutación | Lamivudina/L180M + M204V | Adefovir/N236T | Adefovir/A181V |
| Fármacos con resistencias cruzadas (no de elección) |
|
|
|
| Fármacos sin resistencias cruzadas (de elección) |
|
| Tenofovir |
Tomada de Fraga et al61.
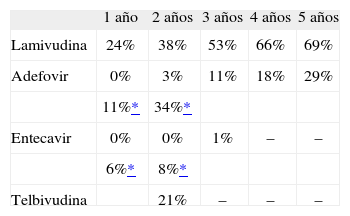
Datos comparativos sobre resistencias documentadas en función del tiempo en tratamiento para algunos de los fármacos disponibles para el tratamiento de la infección crónica por VHB
| 1 año | 2 años | 3 años | 4 años | 5 años | |
| Lamivudina | 24% | 38% | 53% | 66% | 69% |
| Adefovir | 0% | 3% | 11% | 18% | 29% |
| 11%* | 34%* | ||||
| Entecavir | 0% | 0% | 1% | – | – |
| 6%* | 8%* | ||||
| Telbivudina | 21% | – | – | – |
Tomada de Informe EPAR34,51,64,75.
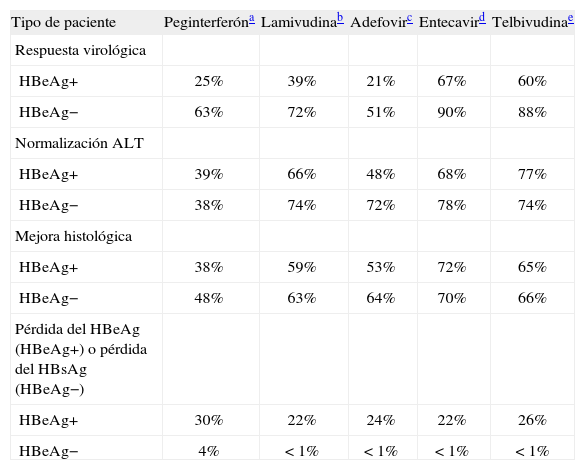
Resultados comparativos obtenidos con los distintos fármacos disponibles para la hepatitis B medidos a un año de tratamiento
| Tipo de paciente | Peginterferóna | Lamivudinab | Adefovirc | Entecavird | Telbivudinae |
| Respuesta virológica | |||||
| HBeAg+ | 25% | 39% | 21% | 67% | 60% |
| HBeAg− | 63% | 72% | 51% | 90% | 88% |
| Normalización ALT | |||||
| HBeAg+ | 39% | 66% | 48% | 68% | 77% |
| HBeAg− | 38% | 74% | 72% | 78% | 74% |
| Mejora histológica | |||||
| HBeAg+ | 38% | 59% | 53% | 72% | 65% |
| HBeAg− | 48% | 63% | 64% | 70% | 66% |
| Pérdida del HBeAg (HBeAg+) o pérdida del HBsAg (HBeAg−) | |||||
| HBeAg+ | 30% | 22% | 24% | 22% | 26% |
| HBeAg− | 4% | < 1% | < 1% | < 1% | < 1% |
Recientemente, Keeffe et al118 han elaborado la llamada «hoja de ruta» para la utilización de los fármacos por vía oral en el tratamiento de la hepatitis B. Dicho protocolo recomienda el control intensivo del ADN-VHB sérico para identificar los resultados del tratamiento, tanto a las 12 como a las 24 semanas desde el inicio del tratamiento, valorando las respuestas como completa, parcial o inadecuada, en función de la rapidez con que se alcance la supresión de la carga viral, intentando así disminuir la aparición de mutaciones que confieran resistencias a los fármacos. Dicho documento, aunque resulta bastante prometedor para maximizar la eficiencia de los distintos tratamientos disponibles, aún debe ser validado en futuros estudios prospectivos diseñados al efecto.
En la cirrosis compensada, tanto HBeAg+ como HBeAg−, ADF parece ser la mejor opción terapéutica en la actualidad, y en la cirrosis descompensada, también para ambos tipos de pacientes, la adición de LAM a ADF parece conseguir los mejores resultados.
DISCUSIÓNA día de hoy, el tratamiento de la hepatitis B crónica sigue siendo un reto sanitario de primera magnitud ya que, pese a la ampliación del abanico de posibilidades terapéuticas que ha tenido lugar recientemente, los resultados terapéuticos todavía siguen siendo limitados.
Asimismo, resulta complejo realizar recomendaciones universales sobre cuáles deben ser los pacientes tratados, con qué fármacos y durante cuánto tiempo. Ello radica en las propias características del virus, que hacen que, incluso en pacientes en los que se alcanza respuesta, no podamos hablar de erradicación. Esto ha provocado que no haya criterios de respuesta adecuados que reflejen fielmente la evolución clínica y que, por ello, durante los últimos años, en los ensayos clínicos de los distintos fármacos que se han ido desarrollando se hayan utilizado distintos criterios de respuesta, lo que ha dificultado su comparación.
En líneas generales, la tendencia debería ser conjugar un mayor porcentaje de respuestas con una menor duración de tratamiento, minimizando los efectos adversos. Adicionalmente, partiendo de la base de que la gran mayoría de los pacientes necesitará más de un fármaco para tratarse, debería elegirse uno con el que, si aparecen resistencias, pudiéramos optar por otra alternativa de rescate.
En este sentido, pese a sus ventajas posológicas, PegINF-α ofrecen unos resultados en los pacientes HBeAg+, en cuanto a negativización del HbeAg, muy similares a los ya obtenidos anteriormente con INF-α convencional, con la diferencia de que el PegINF-α se ha empleado durante 48-52 semanas, mientras que, en general, el IFN-α estándar habitualmente se empleó durante la mitad de tiempo. Además, la adición de LAM al tratamiento con PegINF-α no parece aumentar la eficacia.
La cómoda administración, la rápida y potente inhibición de la replicación del virus y un buen perfil de seguridad hicieron que LAM fuese el fármaco de primera elección, junto con el INF-α, durante años. Sin embargo, la aparición y la selección de mutantes resistentes contrarrestan su buen perfil clínico. Por ello, cabe esperar que, en un futuro próximo, vaya perdiendo importancia ante los nuevos fármacos con igual o mayor actividad antiviral pero con menor desarrollo de resistencias.
En esta línea, ADF sigue siendo un fármaco de gran utilidad, tanto en pacientes naïve como en resistentes a LAM. Por su amplitud de indicaciones y la efectividad demostrada en pacientes cirróticos y descompensados, podría seguir siendo un fármaco de primera elección en este tipo de enfermos.
ETV ha logrado alcanzar, por el momento, el mayor porcentaje de respuestas completas de entre todos los fármacos disponibles. Además, el desarrollo de resistencias es hasta ahora muy infrecuente y únicamente aparece en sujetos con resistencia previa a LAM. Todo ello hace que sea un fármaco preferente en pacientes naïve, fundamentalmente en sujetos HBeAg+.
En cuanto a LDT, pese a que los estudios han mostrado superioridad sobre LAM en HBeAg+ y no inferioridad en HBeAg−, queda pendiente establecer su utilidad en pacientes previamente resistentes a LAM. Asimismo su, a priori, principal punto débil es el alto porcentaje de resistencias que selecciona, mayor incluso que para ADF. Tal vez, en un estudio comparativo directo con ENT podría determinarse si se trata de un fármaco que se debe tener en cuenta como primera línea de tratamiento.
Pese a las buenas expectativas generadas por los nuevos principios activos en desarrollo, aún es pronto para identificar el verdadero papel que puedan representar en un futuro próximo119,120. Por otro lado, cabría pensar que, como en otras enfermedades infecciosas, como el VIH o la hepatitis C, el tratamiento más adecuado podría consistir en combinaciones de fármacos con diferentes mecanismos de acción antiviral, de fácil administración y buenos perfiles de seguridad. En esta línea, la posibilidad de que TDF reemplace ADF en el tratamiento del VHB dependerá de la confirmación de la eficacia en términos de superior respuesta virológica y seguridad comparable, sobre todo sobre la base de la toxicidad renal, la eficacia frente a las cepas salvajes y mutantes (como las que expresan YMDD, que confieren resistencias a LAM, EMT, LDT o clevudina) y una baja tasa de resistencias, tanto en pacientes naïve como en pretratados.
En conclusión, pese a los buenos resultados obtenidos a corto plazo con los fármacos actualmente disponibles, seguimos a la espera de alcanzar la unanimidad en términos de selección de pacientes para tratar y definición de las respuestas perseguidas. En espera de ello, tal vez, la mejor respuesta a estas preocupaciones sea la de realizar una selección pormenorizada, tanto de los pacientes que se va a tratar como de los fármacos disponibles, atendiendo a las peculiaridades de cada caso individual.
AgradecimientosQueremos agradecer a los doctores L. Abdel-Kader Martín y B. Dorantes Calderón los comentarios realizados para la elaboración final del presente manuscrito.