La carcinomatosis peritoneal es una forma de diseminación intraabdominal de diversos tumores, asociada con mal pronóstico. La realización de cirugia citorreductora y administración de quimioterapia intraperitoneal hipertérmica constituye una alternativa para su tratamiento. El objetivo del estudio es describir la toxicidad derivada del procedimiento en pacientes diagnosticados de carcinomatosis peritoneal.
MétodosEstudio descriptivo, retrospectivo, unicéntrico, incluyendo todos los pacientes sometidos al procedimiento, entre diciembre de 2007 y enero de 2010. Se registraron: datos antropométricos, antecedentes personales y quirúrgicos, indicación, tratamientos previos, grado de carcinomatosis, duración de la intervención, estancia hospitalaria, así como el tipo de complicaciones y/o eventos adversos tras la aplicación del tratamiento multidisciplinario. Resultados: Se realizaron 46 intervenciones en 45 pacientes diagnosticados de carcinomatosis peritoneal de diferentes etiologías, mayoritariamente cáncer de ovario (83%). El fármaco más utilizado fue paclitaxel (35 intervenciones). No hubo mortalidad asociada, el tiempo medio de intervención fue 6,4h y la estancia media hospitalaria 7 días. Se registraron eventos adversos en 42 procedimientos, siendo de grado 3-4 en un 28,3% de los pacientes. Las incidencias de reacciones severas fueron: 10,9% gastrointestinales, 10,9% infecciosas, 6,5% hemorragia o sangrado, 6,5% toxicidad medular, 4,4% respiratorias, 2,2% trastornos de la coagulación, y 2,2% hepatobiliares. Un paciente desarrolló neutropenia de grado III, probablemente asociada a cisplatino.
ConclusiónLa morbilidad y mortalidad encontradas se han situado en la media de los trabajos publicados y se ha atribuido principalmente a las complicaciones quirúrgicas. Los datos de toxicidad inferior a otros estudios pueden deberse a la utilización de regímenes de quimioterapia más tolerables, sin asociación de fármacos y con paclitaxel como fármaco mayoritario.
Peritoneal carcinomatosis is a form of intra-abdominal dissemination of several tumours, which is associated with a poor prognosis. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy is an alternative treatment. The aim of this study is to describe the toxicity associated with this procedure in patients with peritoneal carcinomatosis.
MethodWe conducted a descriptive, retrospective, single-centre study, including all patients undergoing this procedure between December 2007 and January 2010. The following data were recorded: anthropometric data, personal and surgical events, indication, previous treatments, extent of carcinomatosis, intervention duration, hospital stay, and type of complications and/or adverse events following application of the multidisciplinary treatment.
ResultsWe performed 46 interventions on 45 patients diagnosed with peritoneal carcinomatosis from different causes, mainly ovarian cancer (83%). Paclitaxel was the most-used drug (35 interventions). There was no associated mortality, the average intervention time was 6.4hours and the average hospital stay 7days. We recorded adverse effects for 42 procedures, being grade 3-4 in 28.3% of the patients. The severe adverse events were: 10.9% gastrointestinal, 10.9% infectious, 6.5% haemorrhage or bleeding, 6.5% medullary toxicity, 4.4% respiratory, 2.2% coagulation and 2.2% hepatobiliary disorders. One patient developed grade III neutropaenia, probably associated with cisplatin.
ConclusionThe morbidity and mortality is in line with the average of published studies, and has mainly been attributed to surgical complications. Toxicity data lower than other studies can be due to using more tolerable chemotherapy regimens, not including drug combinations and given that paclitaxel was the main drug.
La carcinomatosis peritoneal (CP) es una forma de diseminación intraabdominal de los tumores malignos gastrointestinales y ginecológicos, y de los sarcomas abdominopélvicos, con o sin evidencia de enfermedad metastásica sistémica1. Inicialmente puede ser asintomática o presentarse en forma de leves molestias abdominales; en la fase final de la enfermedad los pacientes sufren anorexia severa, disnea y dolor debido a cuadros de obstrucción intestinal, ascitis y derrame pleural como consecuencia del aumento de la carga tumoral2,3.
Tradicionalmente el tratamiento de la CP ha sido paliativo, basado en la quimioterapia sistémica, asociada o no a la cirugía4. Sin embargo, la quimioterapia por vía sistémica tiene un acceso limitado a la cavidad peritoneal, lo que reduce su eficacia, y la cirugía permite eliminar exclusivamente la enfermedad macroscópica, pero no la microscópica, responsable de las recidivas5.
Los resultados del estudio multicéntrico EVOCAPE1 mostraron una supervivencia media en pacientes con carcinomatosis peritoneal de origen no ginecológico de 6 meses6.
Una de las causas mas frecuentes de la CP es el cáncer de ovario. Debido a la ausencia de sintomatología clínica, cerca del 70-80% de las mujeres se diagnostican de cáncer de ovario en estadio III-IV, cuando la CP está ya establecida7. El tratamiento convencional ha consistido en la cirugía de exéresis seguida de la administración sistémica de un compuesto de platino y paclitaxel8. Aunque la mayoría de los pacientes responden al tratamiento, aparecen con frecuencia recaídas peritoneales, hasta en un 50% de las pacientes con cirugía completa inicial, lo que contribuye a los bajos porcentajes de supervivencia a largo plazo. En la enfermedad avanzada se ha estimado una tasa de supervivencia a los 5 años inferior al 25%2.
La administración de quimioterapia por vía intraperitoneal (IP) se ha propuesto como alternativa al tratamiento convencional, pues el fármaco alcanza concentraciones tisulares muy superiores a las conseguidas por vía sistémica3. En el carcinoma de ovario, Amstrong et al8 compararon la administración adyuvante de cisplatino y paclitaxel por vía sistémica frente a los mismos fármacos administrados combinando la vía i.v. y la intraperitoneal; observaron un aumento significativo en la supervivencia del segundo grupo, aunque asociada a un aumento de la toxicidad grado III-IV. Esta modalidad de tratamiento, no obstante, no está exenta de controversias que dificultan considerarla el tratamiento estándar.
A finales de la década de 1980, Sugarbaker9 propuso una nueva modalidad de tratamiento multidisciplinario, consistente en la combinación de cirugía radical seguida de la administración de quimioterapia intraperitoneal hipertérmica intraoperatoria (HIPEC). Tras la realización de los procedimientos de peritonectomía, se distribuye la solución quimioterápica homogéneamente por toda la cavidad abdominal durante 60-90min y se mantiene a una temperatura de 41-42°C7,9. El calor, además de ejercer un efecto citotóxico directo, ha demostrado un sinergismo con varios citostáticos administrados por vía intraperitoneal como oxaliplatino, mitomicina C y cisplatino3. La técnica se fundamenta en el tratamiento del componente microscópico de la enfermedad.
Aunque no existen muchos estudios aleatorizados y controlados que ofrezcan un nivel elevado de evidencia científica, son muchos los trabajos que concluyen en un aumento de la supervivencia a corto y largo plazo5,10–13, así como en la calidad de vida, en pacientes seleccionados con CP de distintos orígenes4,12,14.
El índice de carcinomatosis peritoneal (PCI) es uno de los métodos más utilizados para cuantificar la extensión de la carcinomatosis previa15. Tanto dicha extensión como el tamaño del tumor residual tras la cirugía son factores pronóstico independientes que influyen de forma significativa en la supervivencia de los pacientes10,15,16.
La tasa de complicaciones asociadas al procedimiento de citorreducción y administración de HIPEC se ha situado en un rango del 27 al 56%. Se han descrito con frecuencia abscesos, fístulas, íleo paralítico, neumonía y toxicidad hematológica3. El PCI, la duración de la cirugía y la pérdida de sangre son factores que se han relacionado de forma estadística con la aparición de mayor morbilidad17.
El objetivo de este estudio es describir la toxicidad derivada del procedimiento de cirugía citorreductora (CCR) y la administración de HIPEC en pacientes diagnosticados de carcinomatosis peritoneal.
MétodosEstudio descriptivo, retrospectivo, unicéntrico, en el que se incluyeron todos los pacientes diagnosticados de carcinomatosis peritoneal, a los que se les realizó CCR seguido de HIPEC, desde diciembre de 2007 hasta enero de 2010. Los regímenes utilizados, en función de la indicación, fueron mitomicina C 10-12,5mg/m2, paclitaxel 60mg/m2, cisplatino 75mg/m2 y doxorrubicina 15mg/m2. Todos los pacientes firmaron el consentimiento informado, aplicándose la legislación vigente para la utilización de los fármacos en indicaciones fuera de ficha técnica.
Se registraron los datos antropométricos del paciente, antecedentes personales y quirúrgicos, indicación y tratamientos previos. El grado de carcinomatosis fue cuantificado según el PCI. La cirugía fue considerada óptima Cc-0 cuando tras la citorreducción no había residuo tumoral macroscópico en la cavidad peritoneal y óptima Cc-1 si el residuo tumoral era menor de 2,5mm en su diámetro mayor, acorde con los criterios del Completeness Cytorreductive Score de Sugarbaker7. La aplicación de HIPEC solamente se contempló en aquellos casos considerados cirugía óptima Cc-0 y Cc-1.
Se registraron factores preoperatorios (estado físico del paciente según criterios de la American Society of Anesthesiologists [ASA]18, tiempo transcurrido desde el último ciclo de quimioterapia hasta la cirugía) y post-operatorios (duración de la intervención, necesidad de transfusión de hemoderivados, estancia hospitalaria), así como el tipo de complicaciones post-operatorias y/o acontecimientos adversos posteriores al tratamiento multidisciplinario. La gravedad de las complicaciones fue expresada en función de los Common Terminology Criteria for adverse Events (CTCAE) versión 3.019, ya que es un sistema de clasificación único que puede utilizarse tanto para evaluar la morbilidad de la cirugía como de la toxicidad por la quimioterapia20. Se aplicó el algoritmo de causalidad de Karl-Lasagna modificado21 para las reacciones adversas atribuidas a la administración de medicación concomitante.
Los datos se obtuvieron a través de la revisión de las historias clínicas, del programa del Área de Preparación de Citostáticos Farhos Oncología® y del sistema de información sanitario Estación clínica-Selene®.
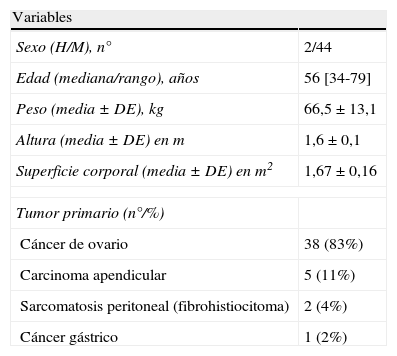
ResultadosDurante el periodo considerado se realizaron 46 intervenciones en 45 pacientes diagnosticados de CP de diferentes etiologías. Todos los resultados se expresan sobre el total de intervenciones realizadas. La tabla 1 recoge las características de los pacientes, incluido el origen de la CP. Todas las enfermedades de origen no ginecológico eran estadios IV limitados a la cavidad peritoneal. En el caso del cáncer de ovario, todos los pacientes presentaban enfermedad confinada en el abdomen en el momento de la intervención. El 76% de los casos intervenidos había recibido quimioterapia sistémica previa (tabla 2) y en el 58,7% se había practicado alguna intervención quirúrgica previa relacionada con su enfermedad oncológica. Sólo en 7 pacientes se utilizó el procedimiento como terapia de primera línea.
Características de los pacientes sometidos a las 46 intervenciones de quimioterapia intraperitoneal hipertérmica intraoperatoria
| Variables | |
| Sexo (H/M), n° | 2/44 |
| Edad (mediana/rango), años | 56 [34-79] |
| Peso (media±DE), kg | 66,5±13,1 |
| Altura (media±DE) en m | 1,6±0,1 |
| Superficie corporal (media±DE) en m2 | 1,67±0,16 |
| Tumor primario (n°/%) | |
| Cáncer de ovario | 38 (83%) |
| Carcinoma apendicular | 5 (11%) |
| Sarcomatosis peritoneal (fibrohistiocitoma) | 2 (4%) |
| Cáncer gástrico | 1 (2%) |
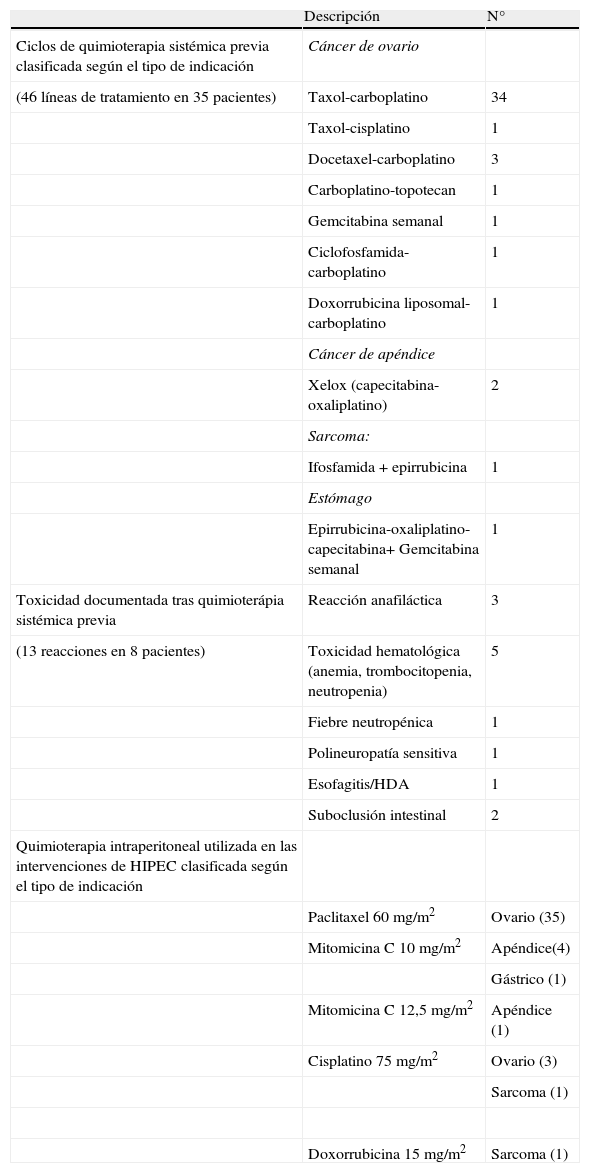
Quimioterapia administrada previamente a quimioterapia intraperitoneal hipertérmica intraoperatoria y durante la intervención quirúrgica
| Descripción | N° | |
| Ciclos de quimioterapia sistémica previa clasificada según el tipo de indicación | Cáncer de ovario | |
| (46 líneas de tratamiento en 35 pacientes) | Taxol-carboplatino | 34 |
| Taxol-cisplatino | 1 | |
| Docetaxel-carboplatino | 3 | |
| Carboplatino-topotecan | 1 | |
| Gemcitabina semanal | 1 | |
| Ciclofosfamida-carboplatino | 1 | |
| Doxorrubicina liposomal-carboplatino | 1 | |
| Cáncer de apéndice | ||
| Xelox (capecitabina-oxaliplatino) | 2 | |
| Sarcoma: | ||
| Ifosfamida + epirrubicina | 1 | |
| Estómago | ||
| Epirrubicina-oxaliplatino-capecitabina+ Gemcitabina semanal | 1 | |
| Toxicidad documentada tras quimioterápia sistémica previa | Reacción anafiláctica | 3 |
| (13 reacciones en 8 pacientes) | Toxicidad hematológica (anemia, trombocitopenia, neutropenia) | 5 |
| Fiebre neutropénica | 1 | |
| Polineuropatía sensitiva | 1 | |
| Esofagitis/HDA | 1 | |
| Suboclusión intestinal | 2 | |
| Quimioterapia intraperitoneal utilizada en las intervenciones de HIPEC clasificada según el tipo de indicación | ||
| Paclitaxel 60 mg/m2 | Ovario (35) | |
| Mitomicina C 10 mg/m2 | Apéndice(4) | |
| Gástrico (1) | ||
| Mitomicina C 12,5 mg/m2 | Apéndice (1) | |
| Cisplatino 75 mg/m2 | Ovario (3) | |
| Sarcoma (1) | ||
| Doxorrubicina 15 mg/m2 | Sarcoma (1) |
De los pacientes que recibieron quimioterapia sistémica previa, la mediana del tiempo desde el último ciclo de quimioterapia hasta la cirugía fue de 6 semanas [3-160 semanas]. El PCI medio fue de 13,6±6,5. No hubo mortalidad intraoperatoria ni reingreso en UCI. El tiempo medio de la intervención quirúrgica fue de 6,4±1,2h.
Se administraron 35 preparaciones con paclitaxel, 6 con mitomicina C, 4 con cisplatino y 1 con doxorrubicina (tabla 2), en un rango de temperatura de 41-42°C y un tiempo de infusión entre 60-90min. El estado físico de los pacientes según criterios ASA fue mayoritariamente de 3 (72%). La estancia media hospitalaria fue de 7±3 días, con una media de estancia en el servicio de reanimación de 1,2±0,6 días.
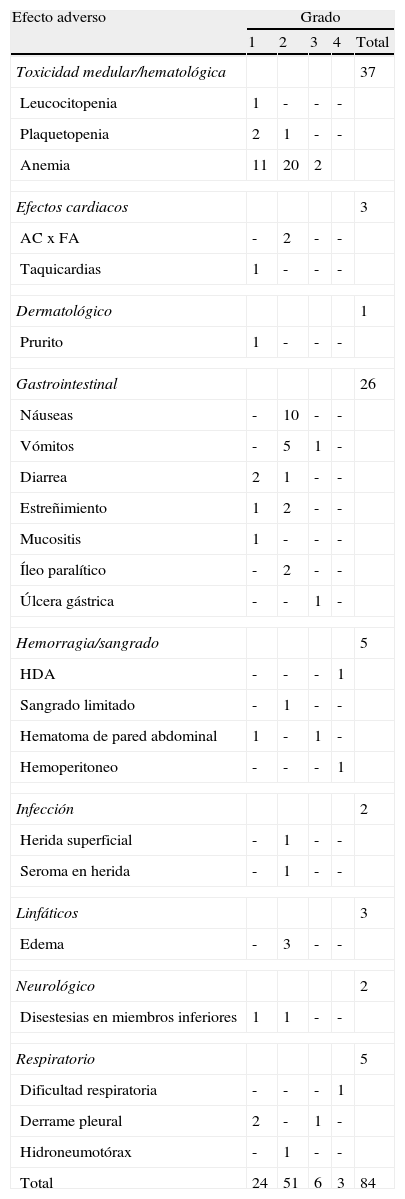
Se registraron eventos adversos en 42 intervenciones, siendo en 13 casos (28,3%) reacciones adversas grado III-IV. Las incidencias de reacciones severas fueron: un 10,9% efectos de tipo gastrointestinal; 10,9%, de tipo infeccioso; 6,5%, hemorragia o sangrado; 6,5%, toxicidad medular; 4,4%, problemas respiratorios; 2,2%, trastornos de la coagulación, y 2,2%, del sistema hepatobiliar. Las tablas 3 y 4 muestran más detalladamente las reacciones observadas durante el ingreso y después del alta.
Reacciones adversas tras quimioterapia intraperitoneal hipertérmica intraoperatoria durante la estancia hospitalaria
| Efecto adverso | Grado | ||||
| 1 | 2 | 3 | 4 | Total | |
| Toxicidad medular/hematológica | 37 | ||||
| Leucocitopenia | 1 | - | - | - | |
| Plaquetopenia | 2 | 1 | - | - | |
| Anemia | 11 | 20 | 2 | ||
| Efectos cardiacos | 3 | ||||
| AC x FA | - | 2 | - | - | |
| Taquicardias | 1 | - | - | - | |
| Dermatológico | 1 | ||||
| Prurito | 1 | - | - | - | |
| Gastrointestinal | 26 | ||||
| Náuseas | - | 10 | - | - | |
| Vómitos | - | 5 | 1 | - | |
| Diarrea | 2 | 1 | - | - | |
| Estreñimiento | 1 | 2 | - | - | |
| Mucositis | 1 | - | - | - | |
| Íleo paralítico | - | 2 | - | - | |
| Úlcera gástrica | - | - | 1 | - | |
| Hemorragia/sangrado | 5 | ||||
| HDA | - | - | - | 1 | |
| Sangrado limitado | - | 1 | - | - | |
| Hematoma de pared abdominal | 1 | - | 1 | - | |
| Hemoperitoneo | - | - | - | 1 | |
| Infección | 2 | ||||
| Herida superficial | - | 1 | - | - | |
| Seroma en herida | - | 1 | - | - | |
| Linfáticos | 3 | ||||
| Edema | - | 3 | - | - | |
| Neurológico | 2 | ||||
| Disestesias en miembros inferiores | 1 | 1 | - | - | |
| Respiratorio | 5 | ||||
| Dificultad respiratoria | - | - | - | 1 | |
| Derrame pleural | 2 | - | 1 | - | |
| Hidroneumotórax | - | 1 | - | - | |
| Total | 24 | 51 | 6 | 3 | 84 |
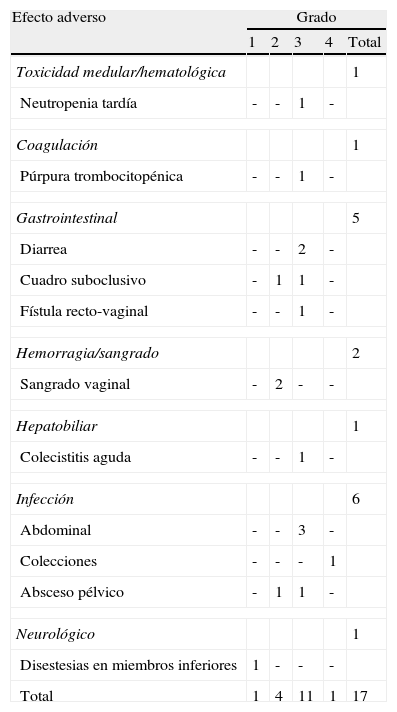
Reacciones adversas tras quimioterapia intraperitoneal hipertérmica intraoperatoria post-ingreso
| Efecto adverso | Grado | ||||
| 1 | 2 | 3 | 4 | Total | |
| Toxicidad medular/hematológica | 1 | ||||
| Neutropenia tardía | - | - | 1 | - | |
| Coagulación | 1 | ||||
| Púrpura trombocitopénica | - | - | 1 | - | |
| Gastrointestinal | 5 | ||||
| Diarrea | - | - | 2 | - | |
| Cuadro suboclusivo | - | 1 | 1 | - | |
| Fístula recto-vaginal | - | - | 1 | - | |
| Hemorragia/sangrado | 2 | ||||
| Sangrado vaginal | - | 2 | - | - | |
| Hepatobiliar | 1 | ||||
| Colecistitis aguda | - | - | 1 | - | |
| Infección | 6 | ||||
| Abdominal | - | - | 3 | - | |
| Colecciones | - | - | - | 1 | |
| Absceso pélvico | - | 1 | 1 | - | |
| Neurológico | 1 | ||||
| Disestesias en miembros inferiores | 1 | - | - | - | |
| Total | 1 | 4 | 11 | 1 | 17 |
Los parámetros analíticos medios recogidos el día antes de la intervención fueron: creatinina 0,83±0,29mg/dl, hemoglobina 11,95±1,4g/dl, hematocrito 36,26±3,97%, plaquetas 246,17±124,1 x 103/ul, leucocitos 6,88±2,59 x 103/ul, neutrófilos 4,2±2,23 x 103/ul y actividad de protrombina 92,02±11,26%. Los parámetros analíticos medios al alta fueron creatinina 0,72±0,31mg/dl, hemoglobina 9,84±1,24g/dl, hematocrito 29,4±3,83%, plaquetas 244±28,48 x 103/ul, leucocitos 7,65±2,68 x 103/ul, neutrófilos 5,39±2,13 x 103/ul y actividad de protrombina 92,63±9,46%. Durante la intervención y el ingreso hospitalario, en 36 episodios los pacientes recibieron transfusiones de concentrados de hematíes: mediana 2 [0-10].
Un paciente ingresó a los 50 días tras el alta por trombocitopenia y petequias en miembros inferiores, diagnosticándose púrpura trombocitopénica idiopática versus secundaria a medicación. El paciente había estado un mes en tratamiento con heparina de bajo peso molecular de manera profiláctica y metamizol a demanda. La aplicación del algoritmo de Karl-Lasagna modificado estableció una imputabilidad de posible para cada medicamento. Otro paciente, tratado con cisplatino IP, desarrolló neutropenia de grado III (870/mm3) a los 20 días post-operatorio. Tras tratamiento con filgrastim y recuperación de la cifra de neutrófilos inició la quimioterapia sistémica adyuvante.
Durante el periodo evaluado, se registraron 2 muertes, por progresión de la enfermedad y recaída peritoneal, con una mediana de supervivencia desde la cirugía de 16 meses [8-24 meses].
DiscusiónLos resultados de las series publicadas con relación a la utilización de CCR, con procedimientos de perinectomía e HIPEC, han llevado a la utilización de esta técnica por numerosos equipos de trabajo en el tratamiento de la CP de diversos orígenes. Conocer las particularidades de utilización y los resultados obtenidos por los diversos equipos (en términos no sólo de eficacia sino también de toxicidad) puede mejorar su utilización.
Cabe destacar que la mayor parte de la información proviene de estudios observacionales descriptivos4,5,10,14,22. En 2003, Verwaal et al11 publicaron el único estudio prospectivo y aleatorizado que existe en la actualidad sobre el tratamiento de la CP de origen colorrectal mediante esta técnica, objetivándose una mejora en la supervivencia tanto libre de enfermedad como global, en comparación con el grupo convencional al que se le administraba exclusivamente quimioterapia sistémica. En CP de origen ovárico, una reciente revisión de Chua2 en pacientes en los que se aplicó HIPEC tras la citorreducción, comunicó supervivencias a 5 años entre el 12 y el 66% en pacientes en los que se logró una citoreducción óptima.
Actualmente no existe, en relación con la vía intraperitoneal, un consenso sobre cuál es el régimen más adecuado de administración, cuáles son los fármacos más activos para cada una de las indicaciones, la modalidad más eficaz (intraoperatoria, post-operatoria precoz, post-operatoria diferida) o la temperatura ideal para aumentar el efecto citotóxico frente a las células tumorales, sin que ello suponga un incremento en la morbilidad y mortalidad.
Las indicaciones de la técnica en los pacientes incluidos en el presente estudio coinciden con las descritas en la bibliografía, aunque los fármacos utilizados y las dosis son muy variables22. La CP por cáncer de ovario ha sido la enfermedad mayoritaria. En esta indicación, se ha utilizado el protocolo propuesto por Muñoz-Casares et al7, administrándose mayoritariamente paclitaxel, fármaco con el que se ha demostrado baja toxicidad y buena tolerancia en administración intraperitoneal. En 3 pacientes se utilizó el cisplatino, por existir contraindicación para paclitaxel por reacción alérgica previa. En la CP de origen apendicular y en el único paciente incluido por carcinoma gástrico se ha utilizado un régimen basado en mitomicina C, siendo este el fármaco mayoritario en los estudios realizados4,22,23. En el caso de la sarcomatosis peritoneal se han administrado los fármacos mayoritariamente utilizados en los estudios previos: cisplatino y doxorrubicina22.
La morbilidad asociada al procedimiento incluye tanto las complicaciones quirúrgicas como la toxicidad sistémica, que se da presumiblemente debido a la absorción de la quimioterapia administrada por vía intraperitoneal24. Chua et al23, en el año 2009, y Baratti et al24 en 2010 publicaron excelentes revisiones en relación a la morbilidad y mortalidad asociada al procedimiento de CCR-HIPEC. Estas revisiones ponen de manifiesto la dificultad para comparar los resultados entre los diversos grupos de trabajo, ya que existen muchas diferencias en cuanto a la indicación, selección de pacientes, temperatura, fármacos, asociaciones, dosis, etc. Otra dificultad añadida para comparar los resultados de toxicidad-morbilidad es el concepto más o menos amplio utilizado por los distintos autores. Por ejemplo, Rufián et al25 describen un porcentaje de morbilidad mayor post-operatoria superior al del presente estudio, a pesar de que sólo incluyen datos de la morbilidad típicamente asociada a la cirugía y no contemplan otro tipo de toxicidades que probablemente también estuvieron presentes (anemia, vómitos, diarrea, etc.), mientras que Kusamura et al26 solo describen la toxicidad sistémica, probablemente asociada a la quimioterapia administrada.
El índice de complicaciones se ha relacionado, además, con el volumen de pacientes intervenidos en cada centro y con la experiencia del equipo quirúrgico23,27.
Los datos publicados sitúan la mortalidad del procedimiento entre el 0 y el 19%, en general, y entre el 0,9 y el 8% en las series con mayor número de pacientes y la estancia en UCI entre 1-5 días23,24. Cabe destacar de los resultados que no ha aparecido mortalidad relacionada con el procedimiento y que la estancia media en el servicio de reanimación ha sido de 1,2 días. La estancia media hospitalaria estuvo en el límite inferior de lo descrito en otros estudios (5-48 días), a pesar de que los datos corresponden a lo que podría denominarse la curva de aprendizaje del centro23,27.
Las complicaciones más comúnmente descritas en la literatura médica son el íleo paralítico, fuga de anastomosis, hemorragias, infecciones, derrame pleural, fístulas, abscesos, toxicidad hematológica e insuficiencia renal16,23,24. La mayoría de autores coinciden en destacar que las complicaciones mayoritarias son las asociadas a la cirugía mayor gastrointestinal realizada16,23. No existen estudios comparativos que permitan determinar si la utilización de HIPEC aumenta la incidencia de estas complicaciones respecto a la cirugía sola.
En nuestro estudio la toxicidad severa, de grado III-IV, se presentó en un 28,3% de los pacientes, situándose dentro del rango descrito en la bibliografía médica, para la CP en general (0% a 54%)23,24 y para la de origen ovárico en particular (0%-40%)2. Las complicaciones severas más relevantes han sido precisamente las asociadas con los procedimientos quirúrgicos realizados: infección abdominal, absceso pélvico, fístulas, cuadro suboclusivo, íleo, etc. El hecho de que la mayoría de complicaciones aparecidas en nuestro estudio sean similares a las comunicadas en diferentes estudios, aun con fármacos y dosis distintas, refuerza su atribución mayoritaria a complicaciones quirúrgicas.
Comentario aparte merece la aparición de complicaciones pulmonares en un 11,1% de los pacientes del estudio. Complicaciones como embolia pulmonar, derrame pleural o neumotórax pueden ser consecuencia de la cirugía diafragmática que reciben algunos pacientes para lograr una citorreducción óptima28. La administración adicional de HIPEC se ha relacionado con mayor incidencia de complicaciones pulmonares24.
Kusamura et al26 publicaron sus resultados en cuanto a toxicidad sistémica relacionada con el procedimiento, que podría tener relación directa con la quimioterapia administrada. La toxicidad sistémica más frecuente fue la renal, asociada al uso de cisplatino en dosis elevadas y unido a otros fármacos. También encontraron un 5,3% de toxicidad hematológica de grado 3-4, a pesar de que excluyeron los datos de anemia como parámetro de mielotoxicidad al considerar que su aparición es consecuencia más del sangrado intraoperatorio que del efecto mielotóxico de los fármacos utilizados. En el presente estudio no ha aparecido ningún caso de toxicidad renal, si bien solamente 4 pacientes fueron tratados con cisplatino, y la dosis utilizada fue significativamente inferior a la empleada por Kusamura. La anemia ha sido frecuente (74%), de forma similar a otros estudios27, aunque solo 2 pacientes la desarrollaron en grado 3 y ambos tenían ya anemia de grado 1 al inicio del procedimiento. Por la relación temporal con la cirugía podría descartarse la asociación con la quimioterapia administrada.
En nuestra serie la toxicidad más claramente asociada a la quimioterapia se detectó en una paciente con CP ovárica en la que se usó cisplatino y que desarrolló neutropenia a los 20 días del procedimiento, coincidiendo con el nadir habitual del fármaco, lo que refuerza la asociación con el mismo24. Otra paciente desarrolló púrpura trombocitopénica 2 meses después de la intervención y aunque no puede descartarse totalmente una posible asociación etiológica con la quimioterapia (paclitaxel), los fármacos más sospechosos de causarla fueron la heparina y el metamizol.
Los efectos gastrointestinales más habituales (náuseas, vómitos, diarrea, estreñimiento), fueron mayoritariamente de grado 1-2 y sería difícil imputar su aparición al uso de HIPEC, ya que se trata de efectos de aparición frecuente tras la cirugía gastrointestinal.
Cabe destacar que la mayoría de los pacientes incluidos presentaban CP de origen ovárico y fueron tratados con paclitaxel IP. Este fármaco presenta la ventaja de tener un peso molecular elevado, lo que le hace menos penetrable en el peritoneo y en consecuencia la toxicidad sistémica esperable es menor. Rufián et al25, usando el mismo esquema, no describieron toxicidades sistémicas atribuibles al fármaco. Bae et al29 y Kim et al30, con dosis muy superiores (175mg/m2), usadas como consolidación, no encontraron toxicidad hematológica asociada a paclitaxel.
Entre los factores de riesgo que mejor se relacionan con la morbilidad y mortalidad del procedimiento se encuentran la extensión de la carcinomatosis (PCI ≥ 16), la duración de la intervención (≥ 9h), y la presencia de enfermedad residual tras la cirugía31. En nuestro estudio la PCI media ha sido de 13,6, la duración media de la intervención de 6,4h y la resección fue óptima en 45 de las 46 intervenciones. Esta distribución de factores de riesgo podría estar relacionada con la menor morbilidad encontrada respecto a otros estudios.
Otros autores también encontraron una correlación estadística entre la morbilidad y las pérdidas hemáticas durante la cirugía17. En nuestro estudio, el 92,3% de los pacientes que presentaron complicaciones de grado III-IV habían recibido una o más transfusiones sanguíneas (mediana 2,5 [1-10]).
La principal limitación del presente estudio sería su diseño retrospectivo. Cabe indicar, no obstante, que dado el carácter excepcional de la técnica, el seguimiento de los pacientes y el registro en la historia clínica fue exhaustivo. También limita la variabilidad de enfermedades y fármacos utilizados, que dificulta la evaluación de toxicidades versus otros estudios con series más homogéneas.
En conclusión, la morbilidad y mortalidad encontradas tras el procedimiento de CCR más HIPEC se ha situado en la media de los trabajos publicados, y se ha atribuido principalmente a las complicaciones quirúrgicas. Los datos de toxicidad inferior a otros estudios pueden deberse a la utilización de regímenes de quimioterapia más tolerables, sin asociación de fármacos y con paclitaxel como fármaco mayoritario.
Por último, cabe señalar que para establecer de forma definitiva la relación beneficio/riesgo de la técnica de Sugarbaker son necesarios estudios comparativos con otros esquemas de combinación de quimioterapia y cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.