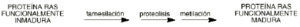REVISIONES
TERAPIA GÉNICA Y BIOLOGICA EN EL TRATAMIENTO DEL CANCER
Del Hoyo Gil, L.*; Sevilla Azzati, E.**; Serrano Garrote, O.*; Campo Angora, M***; Herreros de Tejada y López-Coterilla, A.****
*Residente de tercer año, Servicio de Farmacia. **Farmacéutica adjunta, Servicio de Farmacia. ***Residente de segundo año, Servicio de Farmacia. ****Jefe de Servicio, Servicio de Farmacia
Correspondencia: Luis del Hoyo Gil. Servicio de Farmacia. Hospital «12 de Octubre». Avda. de Andalucía, km. 5,4 28040 Madrid
Fecha de recepción: 19-11-98
Palabras clave:
Terapia génica. Terapia biológica. Cáncer.
Resumen:
El conocimiento sobre los mecanismos genéticos que regulan la división y diferenciación celular ha experimentado grandes avances durante la última década. Por otro lado, los avances que se han producido en la tecnología de recombinación de DNA nos dan la oportunidad de amplificar la respuesta biológica, mediante la identificación, aislamiento y secuenciación de genes funcionales.
La terapia génica se concibió como tratamiento de enfermedads hereditarias con defecto monogénico, como puede ser la enfermedad de Gaucher. Sin embargo, hoy en día casi todos los protocolos de terapia génica están destinados al tratamiento del cáncer.
En este trabajo se definen las estrategias terapéuticas biológicas y genéticas que se están utilizando en los diferentes ensayos clínicos, incluyendo los distintos tipos de vectores usados, así como las tendencias en el estudio de futuras estrategias.
GENE AND BIOLOGICAL THERAPY FOR THE TREATMENT OF CANCER
Key words:
Gene therapy. Biological therapy. Cancer.
Summary:
The last decade has seen great advances in the knowledge of the genetic mechanisms that regulate cell division and differentiation. Progress in recombinat DNA technology has provided researchers with the opportunity to amplify the biological response to treatment through the identification, isolation and sequencing of functional genes.
Gene therapy was conceived as a treatment for hereditary diseases caused by a single-gene defect, such as Gaucher disease. However, almost all gene therapy protocols are currently aimed at the treatment of cancer.
This article defines strategies for biological and gene therapy used in different clinical trials, including different types of vectors, and discusses tendencies in the study of future strategies.
INTRODUCCION
La terapia génica podría considerarse, en sentido amplio, como un conjunto de estrategias terapéuticas por medio de las cuales se intenta corregir un trastorno genético. Inicialmente estas técnicas se desarrollaron para corregir enfermedades genéticas basadas en la alteración de un solo gen. La oportunidad de amplificar la respuesta biológica mediante la identificación, aislamiento y secuencia de genes funcionales constituye la base de la terapia génica.
El descubrimiento del cromosoma Philadelphia en 1960 por Nowell y Hungerford, se asoció con la leucemia mieloide crónica, la primera observación de una implicación genética en una enfermedad tumoral. La terapia génica se basa en la observación de que ciertas enfermedades son causadas por un defecto funcional de un gen hereditario. Teóricamente las enfermedades producidas por un defecto monogénico conocido, tales como la deficiencia de ADA (Adenosina Desaminasa) o el Síndrome de Gaucher, podrían ser tratadas y potencialmente curadas por la inserción y expresión de la copia normal del gen que se habría perdido o habría mutado (1-3). El caso del cáncer es más complejo. La oncogénesis es un proceso por el que a través del tiempo se van acumulando sobre la célula diferentes sucesos genéticos. Además hay que tener en cuenta la existencia de factores predisponentes y factores ambientales que pueden condicionar el resultado final de las alteraciones genéticas. De esta forma una lesión preneoplásica puede o no convertirse en una lesión neoplásica. A pesar de que este modelo ha sido confirmado para algunos tumores como el cáncer colorectal metastásico, múltiples preguntas quedan por resolver en cuanto a la génesis o el origen de las mutaciones desencadenantes. Puesto que en este modelo el resultado es una alteración en los procesos fisiológicos que controlan la división celular, la terapia biológica del cáncer va a intentar que este equilibrio se restablezca.
La utilización de la terapia génica para el tratamiento de enfermedades hereditarias por déficit de algún gen y en el cáncer, necesita salvar algunas barreras. En primer lugar, el planteamiento terapéutico implica la introducción de genes en células diana. Una vez introducidos, estos genes deben expresarse en cantidad suficiente para conseguir un producto con niveles terapéuticos mínimos y, finalmente, la introducción y expresión de los genes introducidos tiene que ser segura para la célula diana y para el paciente.
En este trabajo pretendemos dar una visión amplia de las alternativas terapéuticas que la biología molecular ofrece para el tratamiento de una enfermedad genéticamente compleja como es el cáncer. Curiosamente, a pesar de esta complejidad teórica, la mayoría de los ensayos clínicos aprobados de terapia génica incluyen pacientes oncológicos.
ESTRATEGIAS GEN-TERAPÉUTICASEN EL CÁNCER
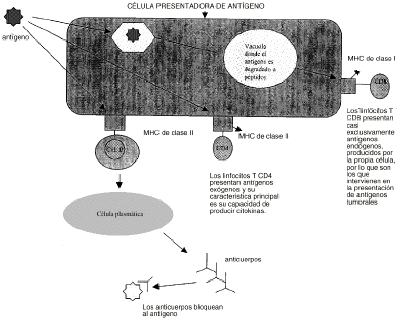
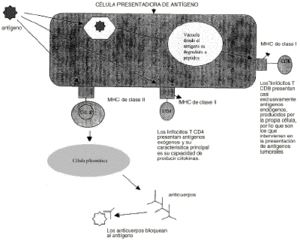
Las estrategias terapéuticas para el tratamiento del cáncer basadas en modificaciones genéticas incluyen diferentes líneas de investigación de tipo inmunológico y quimioterápico. Para poder comprender cuales son las principales estrategias desarrolladas es necesario repasar los principales datos conocidos acerca de la respuesta inmune del organismo frente a las células tumorales. La principal respuesta inmunológica del organismo a la presencia de un tumor es la activación de los linfocitos T CD8+ citotóxicos por la presencia de antígenos tumorales. Sin embargo, esta respuesta es compleja. Las células tumorales humanas son débilmente antigénicas y además los linfocitos T no pueden reconocer por sí solos a estos antígenos. Se requiere la presencia de otras células especializadas en presentar los antígenos a los linfocitos T. Estas células, como los macrófagos, digieren el antígeno tumoral en péptidos que se unen a las moléculas del complejo mayor de histocompatibilidad (sistema HLA). Cada célula T posee un receptor específico que le permite reconocer una determinada asociación péptido-HLA. Sin embargo, esta primera interacción no es suficiente ya que además se necesita la presencia de sustancias coestimulantes como la molécula B7 para desencadenar la respuesta inmune por medio del crecimiento y diferenciación de las células T y la producción de citokinas antitumorales (4) (fig. 1).
Figura 1.--Respuesta inmune.
Debido a la complejidad de este proceso es posible desarrollar diferentes estrategias terapéuticas en cuanto a la estimulación de la inmunogenicidad de los tumores (5, 6).
INMUNOTERAPIA
Inmunoterapia pasiva
Inmunoterapia pasiva con anticuerpos
El desarrollo de la ingeniería genética y las técnicas de DNA recombinante han permitido la obtención de anticuerpos monoclonales dirigidos contra determinados antígenos tumorales. Algunos de ellos como el rituximab (Mabthera®) se encuentran ya aprobados por la FDA para el tratamiento del linforma no Hodgkin de bajo grado, o el Anticuerpo 17 1 A (Panorex®) para el carcinoma de colon. Estos anticuerpos monoclonales presentan el problema de que poca de la dosis administrada consigue llegar al tumor y la difusión de la inmunoglobulina al interior de la masa tumoral es pobre. Sin embargo, en contrapartida, presentan una selectividad relativa hacia el tumor y por tanto son relativamente poco tóxicos. Uno de los problemas es el uso de anticuerpos de origen murino que pueden inducir la producción de anticuerpos del huésped contra ellos que inactiven el tratamiento. Una opción para reducir este problema es el uso de anticuerpos quiméricos con una región constante perteneciente al anticuerpo humano y otra variable de origen murino (7).
Inmunoterapia pasiva por aumento de la capacidad citotóxica del linfocito
La inmunoterapia «adoptiva» consiste en la infusión de células citotóxicas normalmente linfocitos generaldos y/o multiplicados in vitro, sensibilizados por su exposición repetida a péptidos tumorales inmunodominantes o citokinas (6). El interés en esta área resurgió cuando Rosemberg produjo células LAK por exposición de linfocitos de sangre periférica de donantes normales a dosis farmacológicas de IL-2 (factor de crecimiento de linfocitos T). Las células LAK producen la muerte no selectiva de todas las células transformadas (malignas) sin la necesidad de participación del HLA necesaria en el caso de los linfocitos T específicos. Se ha visto que las células LAK administradas junto con IL-2 exógena producen la remisión objetiva en pacientes con melanoma y carcinoma de células renales, si bien las respuestas obtenidas no son duraderas (5).
Siguiendo esta línea de investigación, Rosenberg manipuló genéticamente linfocitos infiltrantes de tumores (TIL), usando retrovirus como vectores, para que produjeran el TNF que es una citoquina con una potente actividad antitumoral (5). Con este procedimiento se consiguen alcanzar concentraciones terapéuticas en el mismo lugar del tumor sin los efectos secundarios de su administración sistémica. En los primeros ensayos realizados, seis pacientes recibieron TIL transducidos con TNF a dosis crecientes con o sin IL-2 (8). Se observaron muy pocos efectos secundarios y un paciente obtuvo una remisión objetiva duradera.
Otra opción es la manipulación genética de los linfocitos que es posible introduciendo en ellos genes como los que codifican IFN-*, IL-2, IL-6, y genes para el receptor de células T (7, 9, 10). El problema que presenta el uso de estos linfocitos infiltrantes de tumores manipulados genéticamente es que no son selectivos para el tumor y su acceso a las metástasis depende de factores como el flujo sanguíneo y su localización. Por otra parte, al ser productores de gran cantidad de citokinas, es posible que se dañen las células normales. A pesar de ello, de los 101 protocolos de ensayo clínicos descritos en enero de 1997, 59 de ellos utilizan inmunoterapia por introducción de genes de citokinas.
Inmunoterapia activa
Uso de vacunas contra el tumor
Aumento de la producción de antígenos tumorales
Las células tumorales son débilmente inmunogénicas. La tecnología molecular permite aumentar la producción de dichos antígenos tumorales o de moléculas inmunogénicas que pueden ser utilizadas para el diseño de vacunas contra el tumor. La síntesis química de estos antígenos es prácticamente imposible por lo que se ha utilizado la ingeniería genética usando hongos, virus y bacterias como vectores de expresión aunque hoy en día se utilizan baculovirus para obtener cantidades suficientes de estos antígenos que permitan realizar ensayos clínicos. Los ensayos que están en curso hoy en día utilizan, entre otros, el PSA (antígeno prostático), el antígeno 17-1A que es un antígeno asociado al cáncer colorrectal, formulados en liposomas, el producto del oncogen RAS o el BCR-ABL. Cuando el antígeno tumoral se utiliza solo, el éxito en el tratamiento depende de la función celular del paciente, puesto que este antígeno necesitará ser presentado a los linfocitos T de forma eficaz (11).
Vacunas víricas con DNA recombinante
Los virus vacunales recombinantes que llevan incorporados en su material genético genes que codifican proteínas, incluyendo antígenos tumorales o moléculas coestimulantes como la B7 se han usado con éxito en experimentos de inmunización. Las células infectadas con este virus recombinante expresan antígenos tumorales codificados por el gen transportado y proteínas virales inmunogénicas. Para que los antígenos tumorales puedan ser presentados a los linfocitos T estos necesitan conjugarse con moléculas HLA (de clase I) y así poder inducir el poder citotóxico de estos linfocitos. El éxito del tratamiento es mayor cuando las proteínas virales actúan como potentes inmunógenos y facilitan la actuación de las citokinas. Se han obtenido resultados prometedores en ratones con virus vacunales recombinantes que expresan antígenos tumorales.
Aumento de la inmunogenicidad del tumor
Las células T reconocen antígenos proteicos, después de que estos se hayan degradado a péptidos que se unen a las moléculas del complejo mayor de histocompatibilidad, siendo entonces transportadas a la superficie de células tumorales. Las células tumorales, sin embargo, pueden ser defectivas en la expresión del HLA-I o HLA-II, produciéndose así una presentación de antígeno defectuosa. Además, hay moléculas coestimulantes como B7-1 y B7-2 que pueden ser necesarias para la inducción efectiva de la respuesta inmune frente a tumores. Las células tumorales también pueden tener un defecto en la expresión de dichas moléculas. Por lo tanto, restableciendo la expresión de dichas moléculas puede aumentar la inmunogenicidad de las células tumorales (9).
Las citokinas producen señales de coestimulación importantes para la activación de los linfocitos T.
La inyección local de citokinas, HLA y otros genes in vitro o mejor aún su producción in vivo pueden producir un aumento de la inmunidad celular contra un tumor.
Para este fin se utilizan células tumorales o fibroblastos genéticamente modificados mediante la introducción de los genes que codifican estas sustancias (12). Se han hecho ensayos para utilizar esta estrategia en inmunoprofilaxis donde animales normales eran inmunizados con células tumorales genéticamente modificadas para producir estas citokinas y después se administran estas células a dosis crecientes. Rosemberg et al (5) fueron los primeros que usaron células tumorales modificadas genéticamente para producir citokinas e inmunizar al paciente (en pacientes con melanoma). Cultivaron células tumorales autólogas a las que se introdujo el gen IL-2 o TNF y se volvieron a introducir en el donante para su inmunización. Como las células tumorales son, en ocasiones difíciles de transducir, otra opción es la preparación de fibroblastos para modificarlos genéticamente y retroinducirlos conjuntamente con células tumorales no modificadas.
La utilización de vectores virales tiene la ventaja adicional de que las proteínas virales son presentadas al huesped en el contexto de las moléculas HLA Clase I lo que aumenta la respuesta inmunitaria. La utilización de células de melanoma humano transfectadas con el gen HLA-B7 puede producir un aumento de la inmunidad y la regresión del tumor.
Hoy en día existen ensayos que siguen esta estrategia en pacientes con cáncer de células renales, neuroblastomas, gliobastomas, cáncer de colon y cáncer microcítico de pulmón (9).
TERAPIA GÉNICA
Genes sensibles a fármacos o genes suicidas
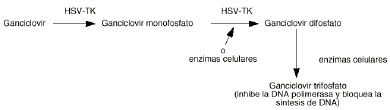
Una de las primeras estrategias propuestas para el uso de DNA recombinante en pacientes con cáncer fue la transducción selectiva de células tumorales con un gen cuyo producto pudiera convertir un profármaco poco tóxico en un metabolito activo frente a las células cancerosas. En el primer protocolo en que se utilizó esta estrategia se introdujo el gen de la timidina quinasa del virus del herpes simple (HSV-TK) en células de tumores cerebrales utilizando un retrovirus como vector (13, 14). La utilización de un profármaco como el ganciclovir, administrado por vía sistémica permite que éste penetre en las células tumorales, metabolizándose a ganciclovir trifosfato en las células que expresan el gen HSV-TK (fig. 2). Este gen es incorporado al DNA celular selectivamente siendo expresado por las células tumorales. La regresión del tumor se produce incluso cuando sólo un pequeño porcentaje de células tumorales son transfectadas con el gen HSV-TK que es lo que se conoce como efecto «bystander» (9, 15, 16). Sin embargo, varios estudios han demostrado que también mueren células no transducidas. Esto parece ser debido a la transferencia del nucleósido fosforilado vía uniones gap entre células que estén en contacto o por la fagocitosis de vesículas apoptóticas de las células tumorales muertas. Esta técnica se ha utilizado en células de gliomas de ratón consiguiéndose la resección total del tumor (11, 13, 17, 18). También se ha utilizado esta técnica en el caso de pacientes con cáncer de ovario (19).
Figura 2.--Metabolismo del ganciclovir
Otra estrategia terapéutica que sigue la misma pauta es el uso de la citosina desaminasa. Esta enzima no se produce en células de mamíferos y su acción consiste en la desaminación de 5-fluocitosina a fluoruracilo. Esta citosina desaminasa posee varias ventajas sobre la HSV-TK y además la 5-fluocitosina puede ser dada a muy altas dosis sin ninguna toxicidad. Sin embargo, se puede producir una transferencia pasiva del sistema citosina desaminasa/5-fluoruracilo mediante uniones gap. La transferencia del gen de la citosina desaminasa se ha hecho mediante vectores viales: retrovirus y adenovirus (11, 14).
Otros genes suicidas utilizados en ensayos clínicos son:
el gpt bacteriano que codifica la xantino-guanina fosforribosil transferasa que convierte la 6-tioxantina en el 6-tioxantina-ribonucleótido.
el deoD bacteriano que codifica la purina nucleotido fosforilasa, que transforma el 6-metil-purina-deoxirribonucleósido en 6-metil-purina, lo que conduce a la síntesis de purinas tóxicas para la célula.
la P450-2B1, que se expresa en células de hígado de mamíferos pero no se expresa o se expresa en otros tejidos. Convierte la ciclofosfamida en mostaza fosforamida.
Genes que codifican resistencia a fármacos
Otra estrategia aplicada en radioterapia y en quimioterapia es la transferencia a células normales de genes que codifican resistencia a agentes citotóxicos, por ejemplo la introducción del gen MDR-1 (Multi drug resistant) en células hemotopoyéticas ex vivo (9). De esta forma se produce una población de células seleccionadas resistentes a la quimioterapia con lo que se podría administrar mayores dosis de quimioterapia con baja toxicidad hematológica. El gen MDR-1 produce glicoproteínas P que funcionan como una bomba de transporte activo de eflujo de algunos fármacos citotóxicos hidrofóbicos, con lo que disminuye su concentración intracelular y por tanto ejercen una menor acción farmacológica. La inserción de genes MDR en stem cells de medula ósea normal produce una población de células seleccionadas por ser resistentes a la administración sistémica de agentes quimioterápicos. La ventaja que produce este método es la posibilidad de poder utilizar dosis más altas de agentes quimioterápicos con menos toxicidad y más eficacia.
Existen, sin embargo, algunos problemas potenciales con esta estrategia como el hecho de que, en algunos tumores, la administración de dosis mayores de quimioterapia no se ha demostrado que corresponda con tasas de respuesta más altas o que para algunos fármacos los efectos tóxicos no hematológicos pueden ser dosis-limitantes. Incluso es posible que las células cancerosas en médula ósea pueden ser transducidos con genes MDR lo cual supondría comprometer el éxito de un tratamiento quimioterápico (11, 18).
Genes supresores de tumores
Los genes supresores de tumores son componentes esenciales del genoma de una célula normal. Su función consiste en la regulación de la proliferación y diferenciación celular. Cuando su funcionamiento es correcto suprimen el desarrollo de células con alteraciones en el DNA y potencialmente malignas. Por ejemplo, el gen supresor de tumores p53 puede detener la replicación de células con DNA dañado hasta que ese DNA sea reparado (20). Si no es reparado, la célula sufre apoptosis y muere. Si una célula es deficitaria del gen p53 podría replicarse produciéndose células transformadas malignas. Los genes supresores de tumores son funcionalmente dominantes, es decir, que deben eliminarse las dos copias del gen para que desaparezca su función de regulación. Así mismo, cuando se inserta una copia funcional del gen se vuelve a restaurar esta función (9, 11). Se ha visto que dicho gen esta ausente en un amplio espectro de tumores. La proteína codificada por este gen produce la supresión de la expresión de genes que llevan al crecimiento celular incontrolado. La inserción del gen funcional p53 es suficiente para producir la apoptosis o detener el crecimiento tumoral. Incluso la presencia de p53 es necesaria para que algunos fármacos quimioterápicos induzcan apoptosis. Varios ensayos se encuentran en fase de realización con el gen p53 en tumores de cabeza y cuello, cáncer de pulmón no microcítico o tumor hepático. La inserción del gen p53 requiere la utilización de vectores del tipo retrovirus, adenovirus o plásmidos por inyección directa en el tumor (15).
Otro gen supresor de tumores es el pRB que se llama así debido a que se identificó en retinoblastomas. Su función es regular el ciclo celular. En particular, su forma activa sirve como un freno a la replicación del DNA.
Aparte del gen p53 y del pRB se han descubierto otros genes supresores de tumores asociados a neoplasias (tabla 1).
Tabla 1 | |
Gen | Tumor asociado |
| RB1 | Retinoblastoma, osteosarcoma, SCLC, sarcoma de tejidos blandos, cáncer de mama, cáncer de véjiga |
| p53 | Afecta a varios tipos (es el más frecuente): NSLC, Ca. De cabeza y cuello,... |
| DCC | Cáncer colorrectal |
| APC | Poliposis adenomatosa, Síndrome de Gardner |
| MTS1 | Melanoma, cáncer de vejiga, otras neoplasias |
| BRCA1 | Cáncer de mama, cáncer de ovario |
| BRCA2 | Cáncer de mama |
| VHL | Feocromocitoma, cáncer de células renales, cáncer de páncreas, carcinomas del SNC |
| WT-1 | Tumor de Wilms |
| NF-1 | Neurofibromatosis de Von Recklinghausen |
| NF-2 | Neurofibromatosis tipo 2 |
Regulación de oncogenes
Los oncogenes, son genes que contribuyen a la carcinogénesis, pero también son constituyentes normales de células no cancerosas. Estos oncogenes que se encuentran presentes en células normales y tienen funciones biológicas se llaman protooncogenes y el producto de su función es esencial para la regulación del crecimiento y diferenciación celular normal (11). Cada protooncogén codifica una proteína que esta relacionada con señales de transducción y transcripción. Una activación inapropiada o la pérdida de dicha función reguladora puede llevar a una transformación maligna de la célula y esto puede suceder por una mutación puntual en un alelo de este gen lo que lleva a cambiar radicalmente la función de la nueva proteína sintetizada. Esto ocurre porque el efecto del oncogén activado es dominante, es decir, con una sola copia del gen mutada produce un efecto positivo sobre el crecimiento celular independientemente de que la otra copia del gen sea normal.
Aunque se han identificado más de 100 oncogenes sólo una pequeña parte parece implicada en la génesis del cáncer en humanos. Los oncogenes activados más comúnmente encontrados en cáncer humano son los de la familia ras de oncogenes (apróximadamente del 20-30 %) (tabla 2), por ejemplo: H-ras, N-ras y K-ras (20). Cada uno codifica una oncoproteína que se localiza en la superficie interna de la membrana plasmática que tiene actividad guanosina trifosfatasa (GTPasa), y que puede participar en transducción de señales (9, 15).
Tabla 2 | |
Oncogén | Tumores asociados |
| HST | Cáncer gástrico |
| KS3 | Sarcoma de Kaposi |
| NEU/ERB-B2 | Cáncer gástrico, de pecho y de ovario |
| ERB-B | Cáncer de mama, gliobastomas |
| TRK | Cáncer de tiroides y de colon |
| Ha-RAS | Cáncer de vejiga |
| Ki-RAS | Cáncer de pulmón y de colon |
| N-RAS | Leucemias |
| GSP | Tumores pituitarios |
| RAF | Cáncer gástrico |
| MET | Osteosarcoma |
| ABL | Leucemias/linfomas |
| MYC | Linfomas |
| N-MYC | Neuroblastomas |
| L-MYC | SCLC |
| BCL-2 | Linfoma folicular indiferenciado |
| MAS | Cáncer de mama |
| RET | Cáncer de tiroides |
Se han descubierto tres mecanismos por los cuales un protooncogén puede transformarse a un oncogén activado.
1. Los oncogenes RAS y GSP se activan simplemente con una mutación puntual que suponga el cambio de un solo nucleótido. El resultado es la incorporación de un aminoácido erróneo y la producción, por tanto, de una proteína alterada estructuralmente.
2. Una translocación recíproca puede yuxtaponer una secuencia promotora a un oncogén, de este modo se aumenta la transcripción de este oncogén. Los oncogenes RET, TRK, RAF y HST son activados de este modo.
También, mediante la translocación, un oncogen puede fusionarse con otro gen para formar otro gen y otro producto génico diferente (bcr-abl).
3. Otro mecanismo consiste en la amplificación, es decir la replicación del gen dando como resultado una producción excesiva de la proteína codificada por el oncogén (erb-2, myc).
Una vez que este oncogén está activado, la célula normal se convierte en una célula con fenotipo neoplásico modificándose los mecanismos de regulación del crecimiento y diferenciación de esta célula. En estos casos un exceso de producción de factores de crecimiento puede aumentar la proliferación celular. Otra posibilidad es la activación constante del crecimiento, incluso sin necesidad de factor de crecimiento, con alteraciones en las proteínas kinasas o los productos de la transcripción que pueden promover la producción de proteínas que se combinen con el DNA y alteren la replicación celular (11).
Las proteínas kinasas pueden llevar una división celular incontroladda por dos mecanismos:
1. Por una excesiva producción de estas kinasas, que mantendrían a las células dividiéndose continuamente. Esto ocurre frecuentemente en el caso del receptor para el factor de crecimiento epidérmico en tumores tisulares.
2. Por una alteración en la estructura de estas proteínas, que produce una estimulación patológica de la división celular.
Para estudiar los efectos de la eliminación de la expresión de un oncogén mutante K-ras en células de cáncer de pulmón se ha utilizado la tecnología antisentido que consiste en introducir en la célula un gen sintético. Dicho gen tiene la secuencia base complementaria al mRNA, se une a él desestabilizándolo y produce la inhibición de la expresión del oncogén (21, 22).
En la transducción con un plásmido o un retrovirus que tenga un DNA complementario antisentido del gen K-ras se bloquea selectivamente la producción del RNAm que se obtiene por transcripción del gen K-ras mutado y reduce el crecimiento de cánceres de pulmón humanos in vitro (23, 24).
Otros métodos para reducir o bloquear la expresión de oncogenes incluyen el uso de oligonucleotidos antisentido exógenos o generados intracelularmente (que producen la degradación del RNAm codificado por el oncogén), ribozimas, y anticuerpos intracelulares de cadena única. Los oligonúclidos antisentido previenen la transcripción del DNA cromosómico a RNAm al unirse al DNA formando una triple hélice e impidiendo, por tanto, la misma, o la traslación del RNAm a una proteína funcional. Estos oligonucleótidos pueden ser administrados por vía sistémica o ser utilizados para tratar células de médula ósea autóloga ex vivo antes de su reinfusión al paciente en un TMO. Aunque su degradación plasmática puede ser retardada por modificaciones químicas, la recaptación celular de los mismos es su mayor obstáculo. Estos oligonúclidos se encuentran en mutaciones del oncogén RAS (que ocurren en los codones 12, 13 y 16) (11).
Otra forma de intervenir en la actuación de estos oncogenes es interrumpir el proceso de maduración de la proteína que codifican. Los oncogenes codifican una proteína que, en principio, es inmadura. Los cambios tienen lugar en uno de los finales del precursor RAS, donde el enzima actúa sobre una región llamada CAAX. Su maduración tiene lugar en tres etapas siendo la más importante la catalizada por un enzima llamada farnesil transferasa, que es específica de este paso, no existiendo en células normales (fig 3). Una estrategia para bloquear la actividad de esta proteína RAS ha sido inhibir esta enzima. Las sustancias inhibidoras de la farnesil transferasa han demostrado que inducen la regresión del tumor existente así como previenen la formación de nuevos tumores, sin producir casi efectos secundarios debido a su alta selectividad sobre este enzima (20).
Figura 3.--Maduración de la proteína RAS
Los inhibidores de la farnesil transferasa se clasifican en dos grupos: competidores del farnesil difosfato y peptidomiméticos de la región CAAX. El primer grupo actúa por inhibición competitiva del enzima con respeto a uno de los substratos, el C terminal de la región CAAX de la proteína RAS. Un ejemplo de un competidor del farnesil difosfato es la manumicina, que es un antibiótico detectado en cultivos de cepas de Streptomyces (25).
Genes que participan en la reparación del DNA
Las células tumorales, frecuentemente tienen defectos en su proceso de reparación del DNA. Por ejemplo, el 10-20 % de los tumores de colon en humanos parecen tener mutaciones en los genes que, normalmente, reparan el DNA: los genes MLH1, MSH2, PMS1 y PMS2.
Otros genes también participan indirectamente en la reparación del DNA como es el gen p53. Estos genes codifican unas «proteínas control» del ciclo celular.
Mutaciones de estos genes codifican «proteínas control» modificadas que no ejercen correctamente sus funciones y los daños en el DNA pasan a las células hijas. Pero si ocurren demasiadas mutaciones y estas no son reparadas, las células hijas no llegan a ser viables y mueren.
Por lo tanto un modo de conseguir que las células tumorales produzcan células hijas que no sean viables es inhibir varios mecanismos control de su ciclo celular simultáneamente. Las sustancias que inhiben estas «proteínas control» llevan a la muerte de las células tumorales, o a hacer estas más sensibles a otros tratamientos (20).
Otras estrategias gen-terapéuticas
Existen en estudio otras estrategias que pueden producir resultados prometedores en los próximos años:
1. Se ha visto que ciertas proteínas pueden mantener las células en un lugar en el cuerpo, por lo tanto estas proteínas prevendrían las metástasis de los tumores (20).
2. Otras sustancias que se están estudiando son los fármacos que inhiben la telomerasa, que es el enzima que juega un papel esencial en la inmortalización celular y puede ser una diana terapéutica molecular específica en células neoplásicas. Esta función la realiza añadiendo secuencias teloméricas en los extremos distales de los cromosomas, siendo estas secuencias las encargadas de proteger la integridad cromosómica (20, 26).
Se han realizado experimentos de transfección con un vector antisentido contra componentes de ARN de telomerasa en células tumorales inmortales. Las células transfectadas reanudaron la pérdida de ADN telomérico con cada división celular y esto se acompañó de muerte celular masiva después de un cierto número de divisiones celulares, cuando los telómeros se habían acortado a una longitud crítica (27).
VECTORES UTILIZADOS EN TRANSFERENCIA GÉNICA
Para la transfección o transferencia génica se utilizan vectores que introducen el material genético en la célula diana. La introducción de genes puede ser de dos maneras: in vivo y ex vivo. La técnica ex vivo consiste en extraer las células diana fuera del cuerpo, introducir el gen terapéutico en ellas, y volver a introducir estas células genéticamente modificadas en el paciente. La técnica in vivo se basa en la introducción de genes en las células diana, dentro del cuerpo, utilizando vectores.
La capacidad de manipular genéticamente las células diana en la técnica ex vivo normalmente produce una mayor eficacia en la transferencia génica que la que se obtiene en la técnica in vivo; además el mantenimiento de las células modificadas ex vivo durante un período de tiempo antes de volver a introducirlas proporciona un cierto nivel de seguridad.
En el caso del cáncer, la modificación genética ex vivo y su reintroducción en el organismo se conoce también con el nombre de «vacuna contra el cáncer» (16). Las células tumorales modificadas capaces de expresar citokinas o moléculas accesorias de estas citokinas estimulan la respuesta inmune antitumoral actuando como unas vacunas. Sin embargo, en el caso de que se quiera erradicar un tumor causado por alteración de la función de un oncogén o un gen supresor de tumores, debería aplicarse la terapia génica in situ ya que de otra forma podrían aparecer alteraciones en células normales. Para aplicar la terapia génica in situ se requieren vectores efectivos para introducir los genes que queremos transferir en las células diana. Además, hay que tener en cuenta que los requerimientos para una masa localizada y para un cáncer metastásico diseminado son diferentes.
Una de las áreas más importantes para la investigación es la designación del vector apropiado que es crítico para la posterior transducción del gen y su expresión, pues todos los vectores tienen sus limitaciones (9) (tabla 3). Estos vectores se dividen en dos grandes grupos: los vectores virales y los vectores no virales.
Tabla 3. | ||
| Vectores | Ventajas | Inconvenientes |
| No virales | ||
| Liposomas | Posibilidad de introducción in vivo. Pequeña inmunogenicidad. | Carece de especificidad. Baja eficacia en la transfección. |
| DNA libre | Posibilidad de transportar DNA de gran tamaño. Posibilidad de transportar DNA de gran tamaño. Baja inmunogenicidad. | Transferencia génica limitada a las células cercanas al sitio de inyección. Baja especificidad. |
| Complejo DNA-ligando Virales | Gran selectividad sobre el tipo de células. Posibilidad de transferir genes de cualquier tamaño. | Corta duración de la expresión génica. |
| Retrovirus | Expresión génica a largo plazo. Requiere células en división. | Baja eficacia en la transducción. Requiere células en división. Limitación en el tamaño de DNA. |
| Adenovirus | Alta eficacia en la transducción en células tanto en división como estáticas. | Falta de especificidad. Gran respuesta inmune frente al virus. |
| Herpes virus | Presenta período de latencia. Neurotropismo que produce selectividad en enfermedades del SNC. | Neurotropismo que puede dar neurotoxicidad. Difícil de manipularlo genéticamente. |
| Virus vacunal | Posibilidad de transportar genes de gran tamaño. Gran estabilidad genética. Bajo coste. Estabilidad al calor. | En pacientes inmunocomprometidos puede ocasionar infecciones fatales. |
| Virales/no virales Plasmovirus | Gran simplicidad. | |
Vectores no virales
Es una de las áreas de desarrollo más prometedoras dentro de los vectores génicos. Este tipo de vectores esta diseñado para introducir genes terapéuticos en células sin la ayuda de virus intactos. Dentro de este grupo de vectores se encuentran los liposomas y el DNA libre desarrollado por métodos mecánicos.
DNA plasmídico libre
El más simple de los sistemas desarrollados para la introducción de genes en la célula es la utilización de DNA libre sin la ayuda de vectores virales o no virales. Esto ha sido posible usando métodos mecánicos, como por ejemplo la inyección directa de DNA en el tejido, la precipitación con fosfato cálcico o el bombardeo de DNA a alta velocidad (9, 28).
Con esta técnica se puede transferir DNA de gran tamaño. Sin embargo, este método tiene el inconveniente de que la transferencia se limita a las células situadas próximas al sitio de inyección, aunque el DNA transferido se degrada rápidamente (13). La ventaja es su escaso potencial patógeno o inmunogénico.
Estos plásmidos se han utilizado recientemente en ensayos con la finalidad de estimular la producción de células rojas sanguíneas después de tratamiento con quimioterapia o radioterapia, introduciendo el gen de la eritropoyetina mediante estos plásmidos (29).
Sin embargo presenta el inconveniente de la poca viabilidad que tiene el DNA tras su administración directa. En su estudio que comparaba la viabilidad del DNA en tumores cuando se inyecta DNA directamente y cuando se utiliza vehiculizado en liposomas, se vio que aproximadamente el 50 % del DNA plasmídico inyectado era eliminado del tumor dos horas después de la inyección sin embargo el 90 % del DNA administrado junto con liposomas era retenido en el tumor (28, 30, 31).
Liposomas
Los liposomas son membranas lipídicas que forman vesículas capaces de transportar en su interior distintas sustancias. Los liposomas se funden con la membrana celular, debido a su composición, depositando directamente su contenido en el citoplasma. La transferencia génica puede realizarse transportando el DNA en el interior del liposoma o formando complejos puesto que los ácidos nucleicos polianiónicos pueden unirse de forma estable con la micela de los liposomas. Cuando los liposomas se unen con DNA de cualquier tamaño, forman un complejo lípido-DNA capaz de introducir este DNA en numerosos tipos de células (13).
La gran cantidad de moléculas lipídicas disponibles, así como la facilidad con la que puede ser formado este tipo de complejos, han hecho posible que se desarrollen gran cantidad de preparados usando como vectores génicos los liposomas. Este sistema también es válido para la introducción de genes in vivo.
Los liposomas son aclarados rápidamente de la circulación sistémica por lo que generalmente es necesaria la administración intratumoral (32).
Otras formas de lípidos, como los glicolípidos, pueden ser usados para actuar sobre órganos específicos, tales como el hígado, sin embargo la presencia de componentes lipídicos en el complejo puede producir un aclaramiento no específico del sistema reticuloendotelial, causando una perdida de especificidad (9).
Recientemente se han comenzado ensayos en humanos utilizando liposomas que contienen el gen para una proteína del sistema inmune conocida como HLA-B7, también llamada complejo mayor de histocompatibilidad en pacientes con cáncer de células renales tratados conjuntamente con IL-2. Cuando las células cancerosas expresan HLA-B7, se estimula el sistema inmunitario del paciente para reconocer esas células como extrañas y provocar su muerte selectiva (29).
Estos liposomas han sido administrados por diferentes vías. En un ensayo con pacientes con melanoma maligno se inyectó el complejo liposomas-DNA directamente en el tumor (31, 33, 34). También se han administrado en infusión, liposomas que contienen el gen para la IL-2 en pacientes con cáncer de riñón, pero sufrieron graves efectos secundarios, que se evitaron inyectando directamente estos liposomas en el tumor. Otra forma de administración de liposomas ha sido en aerosol, en pacientes con fibrosis quística, utilizándose liposomas con el gen de la proteína que se encuentra deficitaria en dicha enfermedad. También han sido usadas como vectores en pacientes con cáncer de cabeza y cuello (35, 36).
Los niveles de expresión génica obtenida con liposomas son, en algunos casos, comparables a los encontrados cuando se han utilizado vectores virales. Otra variante de los liposomas recientemente desarrollada son los llamados poliplexos que son moléculas catiónicas no lipídicas cuyos ensayos en el laboratorio han sido muy prometedores (29).
Complejo DNA-ligando
La necesidad de desarrollar un sistema de transferencia de genes a un determinado tipo de células específicamente ha llevado al desarrollo de conjugados moleculares que consisten en proteínas o ligandos sintéticos, con especificidad hacia algún tipo celular, a los cuales se les une ácidos nucleicos o DNA.
Este sistema de transferencia de genes ha demostrado in vitro tener selectividad sobre un tipo celular dependiendo del tipo de ligando al que vaya unido el DNA o los ácidos nucleicos. También presenta la ventaja de poder transferir genes de cualquier tamaño.
Sin embargo problemas tales como una corta duración de la expresión génica in vivo han limitado su uso (9).
Vectores virales
Retrovirus
Son los vectores virales más ampliamente usados en protocolos de terapia génica contra el cáncer. Los genes extraños o «transgenes» pueden ser integrados en un retrovirus, formados por una cadena simple de virus RNA, del cual se han eliminado uno o más genes estructurales. Algunos retrovirus como el virus de la Leucemia Murina Moloney (MMLV) son altamente eficaces en la transferencia de DNA extraño en células diana (9, 37).
Cuando este virus recombinante infecta una célula diana, se integra en el genoma del huésped y expresa tanto los genes virales como los transgenes. Esta integración en el DNA de la célula diana puede dar lugar a una expresión génica a largo plazo.
Recientemente se han identificado los receptores celulares que median la unión e introducción de retrovirus en la célula. La concentración y accesibilidad de estos receptores son factores fundamentales para conseguir la transferencia génica usando estos retrovirus como vectores (38).
Un inconveniente importante en el uso de estos retrovirus es la posibilidad de replicación aumentando así la carga viral y la patología que lleva asociada. Para evitar esto se produce una modificación del genoma viral por ingeniería genética, eliminando todos los elementos genéticos relacionados con la división celular y con la patogénesis.
Otro inconveniente que presenta es la limitación referente al tamaño de DNA que se puede insertar en el virus-vector. También se requiere que la célula diana este en fase de división para que se produzca la transducción. Aún así esto puede presentar ventajas en algunos tipos de tumores con células en división. Además la selectividad de estos vectores por tipo de célula diana es muy pequeña (13, 37).
Adenovirus
Los adenovirus contienen un DNA de doble cadena formando un complejo con una nucleo-proteína y todo ello envuelto por una proteína o cápside. El genoma adenoviral se transfiere en dos estadios principales. La fase temprana precede a la replicación del DNA y la fase tardía ocurre de seis a ocho horas después.
Existen dos problemas que limitan la realización de ensayos clínicos: uno es la falta de especificidad de este tipo de vectores que infectan a un amplio ámbito de tipos celulares y, otro problema es la gran respuesta inmune, tanto celular como humoral, que se produce frente a este virus, disminuyendo mucho el tiempo disponible para producirse la transferencia génica (3).
Sin embargo, se ha visto que estos adenovirus son eficaces en la transferencia de genes a pulmón (39), vejiga e hígado. Además, estudios en animales han demotrado que los adenovirus recombinantes pueden conseguir grandes niveles de transferencia génica in vivo después de su administración intravenosa. De todos los sistemas virales disponibles, los adenovirus parecen conseguir la transferencia génica más alta in vivo y han sido los más ampliamente utilizados para tumores locales y regionales (6, 9). La transferencia génica se produce tanto en células en fase de división como en células en fase estática.
Los adenovirus no se integran en el genoma celular lo que disminuye la posibilidad de actuación de oncogenes celulares, pero limita el tiempo de actuación del gen terapéutico (3).
Herpes virus
El virus herpes simple (HSV) es un virus con DNA de doble cadena que infecta neuronas y algunos tipos de células epiteliales. Su principal interés es la capacidad de infectar células nerviosas. Este gran neurotropismo podría producir toxicidad y ser un serio inconveniente (9). El HSV experimenta replicación citopática con una fase de latencia en el ciclo replicativo del virus. Debido a este neurotropismo, el HSV puede ser usado en enfermedades del sistema nervioso central, tales como el glioma maligno, la enfermedad del Parkinson o isquemia cerebral (17).
El inconveniente que presenta es que un 9 % de la población presenta anticuerpos contra este virus, por lo que puede llegar a no ser eficaz. También presenta algunos problemas su utilización en clínica como, por ejemplo, la dificultad con que se manipula el virus genéticamente debido al complejo en que esta incluido el genoma viral.
Virus vacunal
El virus vacunal es ideal para la recombinación del DNA debido a que su genoma es relativamente grande y a su estabilidad genética. La capacidad de este virus para la inserción de genes es superior a la de otros vectores usados en células de mamíferos y puede transformar más de una docena de genes de una talla considerable (4). El virus vacunal, cuando se usa como un vector para la inserción de genes, actúa como adyuvante tradicional, así como modificador de la respuesta biológica. Se está usando, hoy en día, para presentar antígenos al sistema inmune, aunque también sufre una rápida respuesta inmune sobre el mismo tras un bajo número de administraciones. Otras ventajas que posee son su bajo precio, estabilidad al calor, y método de administración simple (vía subcutánea o por escarificación) (40, 41).
Su utilización en pacientes inmunocomprometidos es problemática ante la posibilidad de producir infección.
También se han utilizado como vectores otros virus como son virus adenoasociados (38), poxvirus y baculovirus (9).
Vectores virales/no virales
Plasmovirus
Es un vector sintético que combina la simplicidad de los plásmidos con la infectividad y expresión a largo plazo de los retrovirus.
En conjunto, estos plasmovirus combinan las ventajas de los vectores virales con las de los no virales. Deberían ser producidos fácilmente en grandes cantidades y deberían permitir alcanzar células tumorales con eficacia y seguridad (42).
Sin embargo, todavía no hay ningún ensayo en curso que utilice como vectores estos plasmovirus
CONCLUSIONES
La terapia génica es quizás el campo más prometedor para el tratamiento del cáncer y, probablemente, en un futuro, desplazará a los actuales tratamientos farmacológicos y radiológicos, aunque para ello todavía hay que salvar muchos obstáculos como por ejemplo el desarrollo de vectores más selectivos hacia las células tumorales.
También habría que contemplar la posibilidad de orientar estas técnicas hacia la prevención del cáncer, usándolas para detener la progresión de células premalignas a tumores invasivos.
BIBLIOGRAFIA
1.French Anderson W. Gene Therapy. Scientific American. 1995 Sep:124-8.
2.Kohn DB. Gene Therapy for hematopoietic and immune disorders. Bone Marrow Transplantation 1996; 18 Supl. 3:55-8.
3.Douglas JT, Curiel DT. Adenoviruses as vectors for Gene Therapy. Science & Medicine. 1997:44-53.
4.Baltz JK. Vaccines in the treatment of cancer. Am J Health Syst Pharm 1995;52:2574-95.
5.Rosenberg S. Inmunotherapy and Gene therapy of cancer. Cancer Research 1991 51 supl.:5074s-9s.
6.Crystal RG. Transfer of genes to humans: early lessons and obstacles to success. Science 1995;270:404-9.
7.De vita VT. Cancer. Principles and practice of oncology. 5.a Ed.: Philadelphia Lippincott-Raven, 1997.
8.Rosenberg SA, French Anderson W. The development of Gene therapy for the treatment of cancer. Ann Surg 1993;218:455-64.
9.Roth JA, Cristiano RJ. Gene therapy for cancer: What have we done and where are we going? J Natl Cancer Inst 1997;8:21-39.
10.Tan Y, Xu M, Wang W, Zhang F, Li D, Xu X, Gu J, Hoffman RM. IL-2 gene therapy of avanced lung cancer patients. Anticancer Res 1996;16:1993-8.
11.Mastrangelo, Berd D, Nathan FE, Lattime EC. Gene therapy for human cancer: an assay for clinicians. Semin Oncol 1996;23:4-21.
12.Clary BM, Coveney EC, Blazer DG, Philip R, Lyerly HK. Active inmunotherapy of pancreatic cancer with tumor cells genetically engineered to secrete multiple cytokines. Surgery 1996;120:174-81.
13.Weichselbaum R, Kufe D. Gene therapy of cancer. Lancet 1997; 349 supl II:10-2.
14.Moolten FL. Suicide genes for cancer therapy. Science & Medicine. 1997:16-25.
15.Roth JA. Gene replacement strategies for cancer. Isr J Med Sci. 1996;32:89-94.
16.Blaese RM. Gene therapy for cancer. Scientific American. 1997;111-5.
17.Kennedy PG. Potential use of herpes simplex virus (HSV) vectors for gene therapy of neurological disorders. Brain 1997;120:1245-59.
18.Culver KW. Gene therapy for malignant of the CNS. Bone Marrow Transplant 1996;18 supl. 3:6-9.
19.Barnes M, Deshane J, Rosefeld M, Siegal G, Curiel D, Alvarez R. Gene therapy and ovarian cancer: a review. Obstet Gynecol 1997;89:145-55.
20.Oliff A, Gibbs J, McCormick F. New molecular targets for cancer therapy. Sci Am 1996;144-9.
21.Mukhopadhyay T, Tainsky M, Cavender AC, Roth JA. Specific inhibition of K-ras expression and tumorigenicity of lung cancer cells by antisense RNA. Cancer Res 1991;51:1744-8.
22.Curiel DT. Gene Therapy. Science & Medicine. 1996:10-11.
23.Zhang Y, Mukhopadhyay T, Donehower LA, Georges RN, Roth JA. Retroviral vector-mediated transduction of K-ras antisense RNA into human lung cancer cells inhibits expression of the malignant phenotype. Hum Gen Ther 1993;4:451-60.
24.Georges RN, Mukhopadhyay T, Zhang Y, Yen N, Roth JA. Prevention of orthotopic human lung cancer growth by intratracheal instillation of a retroviral antisense K-ras construct. Cancer Res 1993;53:1743-6.
25.Yang W, Del Villar K, Urano J, Mitsuzawa H, Tamanoi F. Advances in the development of farnesyltransferase inhibitors: substrate recognition by protein farnesyltransferase. J Cell Biochem 1997;27 Supl:12-9.
26.Belair CD, Yeager TR, Lopez PM, Reznikoff CA. Telomerase activity: a biomarker of cell proliferation, not malignant transformation. Proc Natl Acad Sci USA 1997;94:13677-82.
27.Nielsen PE. A new target for gene therapeutics: telomerase. Nat Biotechnol 1996;14:620-3.
28.Yang JP, Huang L. Direct gene transfer to mouse melanoma by intratumor injection of free DNA. Gene Ther 1996; 3:542-8.
29.Felgner PL. Nonviral strategies for Gene Therapy. Sci Am 1997:102-6.
30.Noruma T, Takakura Y, Haskida M. Cancer gene therapy by direct intratumoral injection: gene expresion and antitumoral pharmacokinetics of plasmid DNA. Gan To Kagaku Ryoho 1997;24:483-8.
31.Stopeck AT, Hersh EM, Akporiaye ET, Harris DT, Grogan T, Unger E, Warneke J, Schluter SF, Stahl S. Phase I study of direct gene transfer of an allogeneic histocompatibility antigen, HLA-B7, in patients with metastasic melanoma. J Clin Oncol 1997;15:341-9.
32.Thierry AR, Rabinovich P, Peng B, Mahan LC, Bryant JL, Gallo RC. Characterization of liposome-mediated gene delivery: expresion, stability and pharmacokinetics of plasmid DNA. Gene Ther 1997;4:226-37.
33.Green L. Gene therapy for cancer: How far have we gone? J Oncol Pharm Practice 1995;1:53-6.
34.Nabel GJ, Gordon D, Bishop DK, Nickoloff BJ, Yang ZY, Aruga A, Cameron MJ, Nabel EG, Chang AE. Inmune response in human melanoma after transfer of an allogenic class I mayor histocompatibility complex gene with DNA-liposome complex. Proc Natl Acad Sci 1996;93:15388-93.
35.Breau RL, Clayman GL. Gene therapy for head and neck cancer. Curr Opin Oncol 1996;8:227-31.
36.Wollenberg B, Lang S, Schmitt B, Kastenbauer E, Zeidler R. In vitro studies of liposome-mediated gene transfer into head and neck cancer cell lines. Eur Arch Otorhinolaryngol 1997 supl.1:S130-2.
37. Dubé I. Gene Therapy: here to stay. Can Med Assoc J 1995;152:1605-13.
38.Qing K, Bachelot T, Mukherjee P, Wang XS, Peng L, Yoder MC, Leboulch P, Srivasta A. Adeno-associated virus type 2-mediated transfer of ecotropic retrovirus receptor cDNA allows ecotropic retroviral transduction of established and primary human cells. J Virol 1997;71:5663-7.
39.Chapiro J, Palma MD, Mignot L, Lemonnier MP, Beaumelou E, Coulet F, Misset JL, Jasmin C. Gene therapy in oncology: applications to the lung cancer. Rev Mal Respir 1996;13:467-76.
40.Rosenthal FM, Kulmburg P, Fruh R, Pfeifer C, Veelken H, Mackensen A, Kohler G, Lindemann A, Mertelsmann R. Systemic hematological effects of granulocyte colony-stimulating factor produced by irradiated gene-transfected fibroblasts. Hum Genet 1996;7:2147-56.
41.Mulligan RC. The basic science of Gene Therapy. Science 1993;260:926-31.
42.Noguiez Hellin P, Meur MR, Salzmann JL, Klatzmann D. Plasmoviruses: non viral/viral vectors for gene therapy. Proc Natl Acac Sci USA. 1996; 93:4175-80.