Revisar las características y el manejo de las reacciones de hipersensibilidad causadas por agentes antineoplásicos.
MétodoSe realizó una búsqueda bibliográfica en las bases de datos Pubmed y EMBASE de los últimos 10 años.
ResultadosCasi todos los quimioterápicos tienen potencial para causar una reacción de hipersensibilidad, pero determinados grupos han sido asociados con un mayor riesgo, como los derivados del platino, los taxanos, las asparraginasas, los anticuerpos monoclonales y las epipodofilotoxinas. Las manifestaciones clínicas de estas reacciones son variables e impredecibles incluyendo síntomas cutáneos, respiratorios, cardiacos y gastrointestinales. El mecanismo asociado con su desarrollo aún no se conoce en su totalidad. El diagnóstico se basa en los signos y síntomas que desarrolle el paciente y en la realización de pruebas cutáneas. El manejo de los pacientes que sufran una reacción de hipersensibilidad a un quimioterápico variará según el grado de severidad de la reacción, de la necesidad de continuar con el tratamiento y de las alternativas terapéuticas disponibles.
ConclusionesAl producirse un incremento progresivo en la utilización de los agentes quimioterápicos, se puede esperar un aumento de la incidencia de las reacciones de hipersensibilidad. Los protocolos de desensibilización destacan como una alternativa que nos van a permitir reintroducir en la terapia del paciente el agente causal de la reacción de hipersensibilidad. Su utilización debe valorarse individualmente sopesando los beneficios y los riesgos.
To review the characteristics and management of hypersensitivity reactions caused by antineoplastic agents.
MethodWe conducted a search in the Pubmed and EMBASE databases for the last 10 years.
ResultsAlmost all chemotherapeutic agents have the potential to cause hypersensitivity reactions, but some groups have been associated with increased risk, such as platinum compounds, taxanes, asparaginase, monoclonal antibodies and epipodophyllotoxins. The clinical manifestations of these reactions are variable and unpredictable, including symptoms affecting the skin and the pulmonary, cardiac and gastrointestinal systems. The mechanism associated with their development is not yet fully understood. Diagnosis is based on patients’ signs and symptoms and skin testing. The management of patients who suffer a hypersensitivity reaction to a chemotherapeutic agent varies with the severity of the reaction, the need to continue treatment, and the availability of alternative therapies.
ConclusionsDue to a progressive increase in the use of chemotherapeutic agents an increased incidence of hypersensitivity reactions is to be expected. Desensitisation protocols are a noteworthy alternative that make it possible to re-initiate patients’ therapy with the causative agent of the hypersensitivity reaction. Their use should be assessed individually, weighing risks and benefits.
Las reacciones de hipersensibilidad (RH) son definidas como respuestas impredecibles, que no pueden ser explicadas ni por la acción farmacológica ni por el perfil de toxicidad del medicamento, producidas por un mecanismo inmunológico, humoral o celular1,2. Casi todos los quimioterápicos tienen potencial para causar una RH, pero determinados grupos han sido asociados con un mayor riesgo, como los derivados del platino (cisplatino, carboplatino y oxaliplatino), los taxanos (paclitaxel y docetaxel), las asparraginasas, los anticuerpos monoclonales y las epipodofilotoxinas3. Las RH pueden estar causadas por el principio activo, por sus metabolitos o incluso por el propio disolvente.
Las manifestaciones clínicas son variables e impredecibles, incluyendo síntomas cutáneos (prurito, urticaria, rash, eritema palmar, angioedema), respiratorios (broncoespasmo, disnea), cardiacos (alteraciones en la presión sanguínea y frecuencia cardiaca), gastrointestinales (dolor abdominal, náuseas y vómitos) y en el caso de reacciones más severas: dolor en el pecho, angina, anafilaxis y en algunas ocasiones incluso la muerte4.
El mecanismo asociado con el desarrollo de estas reacciones aún no se conoce totalmente y varía de un fármaco a otro. La mayoría de las RH a fármacos antineoplásicos son de tipo I, caracterizadas por la unión de inmunoglobulinas E (IgE) al fármaco y a basófilos y mastocitos, produciendo su degranulación con liberación masiva al torrente sanguíneo de histamina y otros mediadores químicos de la inflamación. Esto provoca una rápida contracción del músculo liso y dilatación de los capilares5.
El diagnóstico de las RH se basa en los signos y síntomas que desarrolle el paciente y en la realización de pruebas cutáneas y test de provocación. En pacientes con cáncer este diagnóstico es especialmente difícil por la existencia de muchos factores de confusión al tratarse de pacientes muy polimedicados4.
El manejo de estos pacientes variará según el grado de severidad de la RH (en la tabla 1 se adjunta la clasificación de las RH según su grado de severidad)6:
- -
Pacientes con RH grado 1 y 2: generalmente pueden continuar con la quimioterapia sin cambios.
- -
Pacientes con RH grado 3: se debe cambiar el tratamiento, pero desgraciadamente está opción a veces esta limitada por la quimiosensibilidad del tumor. En aquellos pacientes que no sea posible discontinuar la terapia, se recomienda disminuir la velocidad de infusión y administrar premedicación o aplicar protocolos de desensibilización.
- -
Pacientes con RH grado 4: es obligatorio suspender la quimioterapia7.
Los protocolos de desensibilización se basan en la reintrodución gradual de pequeñas cantidades del fármaco causante de la RH administrándolo en periodos de tiempo prolongados (4-12 horas), hasta alcanzar la dosis terapéutica. Con la utilización de estos protocolos, se consigue alcanzar una tolerancia temporal en la cual el paciente no reacciona al fármaco, permitiendo así su administración. El mecanismo por el cual el paciente alcanza esta tolerancia temporal no se comprende en su totalidad8,9. La decisión de reexponer a un paciente a un fármaco al que ha desarrollado una RH se debe realizar de forma individualizada valorando en cada caso los riesgos de una nueva reacción frente al potencial beneficio del tratamiento.A continuación revisamos los principales fármacos quimioterápicos responsables de RH, sus características y su manejo.
Sales de platinoSon considerados uno de los grupos con más riesgo de desarrollar una RH. Los principales utilizados en el tratamiento del cáncer son: cisplatino, carboplatino y oxaliplatino.
Cisplatino y carboplatinoAmbos fármacos son ampliamente utilizados para el tratamiento de tumores de pulmón, ovario, testículo, cabeza y cuello y vejiga. El carboplatino tiene un perfil de toxicidad mucho más favorable que el cisplatino siendo menos nefrotóxico, neurotóxico y con menor potencial emetógeno.
La hipersensibilidad a sales de platino fue descrita por primera vez en 1945 en una refinería cuyos trabajadores estaban expuestos a sales de platino. El primer caso descrito de hipersensibilidad a un compuesto de platino usado como quimioterápico fue en 1970 en un paciente tratado con cisplatino10.
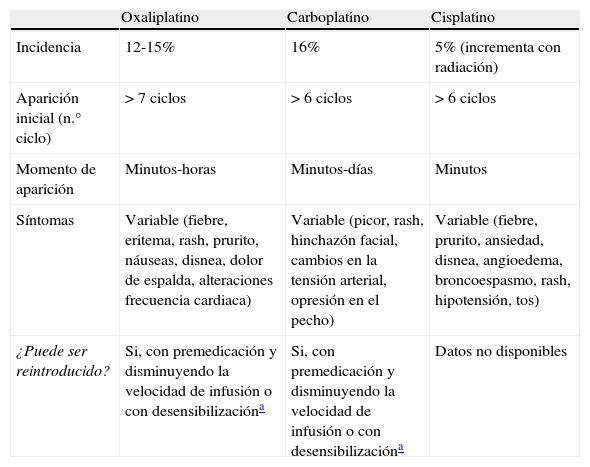
La incidencia de las RH a cisplatino es relativamente baja: entre el 1 y el 5%11. La mayoría de las RH a cisplatino ocurre a los pocos minutos de iniciar la infusión y tras la administración previa de 6 o más ciclos sin complicaciones.
Sin embargo, las RH a carboplatino han sido descritas más frecuentemente debido a su mayor utilización. Su incidencia se correlaciona con el número de ciclos administrados al paciente, cuando el paciente ha recibido menos de 5 ciclos, las RH son relativamente raras (0,92%). Con la sucesiva exposición al fármaco, el riesgo va aumentando hasta situarse en el 20%, cuando el paciente ha recibido el octavo ciclo de tratamiento12,13.
Distintos factores han sido relacionados con una mayor incidencia de RH a carboplatino como por ejemplo un historial previo de alergia a fármacos y/o a componentes ambientales, la administración del quimioterápico a mayor velocidad y los retratamientos con carboplatino después de un periodo libre de carboplatino superior a 12 meses14.
Así pues, los estudios realizados por Sugimoto et al., Schwartz et al. y Gadducci et al. confirman que los pacientes que reciben una segunda línea de tratamiento con carboplatino, con un intervalo de separación entre el primer régimen y el segundo superior a 12 meses, tienen mayor riesgo de sufrir una RH15–17. De acuerdo con estos datos, Markman et al. encuentran en su estudio que un 62,5% de los pacientes que experimentan una RH a carboplatino están recibiendo su segundo régimen de tratamiento con carboplatino18. Por tanto, pacientes que reciban un tercer régimen de tratamiento con carboplatino son considerados de muy alto riesgo para desarrollar una RH a carboplatino.
Navo et al. estudian la utilización de premedicación basada en antagonistas de los receptores H1 y H2 y concluyen que dicha premedicación disminuye el riesgo de hipersensibilidad a carboplatino19.
Las manifestaciones clínicas de las RH a carboplatino y cisplatino son muy variables, pudiendo ser leves (grado 1-2), en un 60-70% de los casos, con sintomatología consistente en rubor facial, rash, prurito, eritema palmar, diarrea, calambres abdominales, dolor de espalda, disnea y ansiedad, o severas (grado 3-4), menos frecuentes, en un 30-40% de los casos, caracterizadas por broncoespasmo, taquicardia, hipo o hipertensión, dolor en el pecho y convulsiones.
En el caso de las RH a carboplatino el inicio de los síntomas puede ocurrir durante la infusión, tras acabar la administración, o incluso días después (RH retardada)4,20,21.
Las RH a carboplatino y cisplatino son de tipo I mediadas por IgE, al ser necesario un periodo de sensibilización previa22,23 (en la tabla 2 se resumen las principales características de las RH a sales de platino).
Características de las RH causadas por las sales de platino
| Oxaliplatino | Carboplatino | Cisplatino | |
| Incidencia | 12-15% | 16% | 5% (incrementa con radiación) |
| Aparición inicial (n.° ciclo) | > 7 ciclos | > 6 ciclos | > 6 ciclos |
| Momento de aparición | Minutos-horas | Minutos-días | Minutos |
| Síntomas | Variable (fiebre, eritema, rash, prurito, náuseas, disnea, dolor de espalda, alteraciones frecuencia cardiaca) | Variable (picor, rash, hinchazón facial, cambios en la tensión arterial, opresión en el pecho) | Variable (fiebre, prurito, ansiedad, disnea, angioedema, broncoespasmo, rash, hipotensión, tos) |
| ¿Puede ser reintroducido? | Si, con premedicación y disminuyendo la velocidad de infusión o con desensibilizacióna | Si, con premedicación y disminuyendo la velocidad de infusión o con desensibilizacióna | Datos no disponibles |
Es un antineoplásico de tercera generación que está indicado en el tratamiento del cáncer colorrectal metastásico en primera línea en combinación con 5-fluorouracilo y ácido folínico. Su toxicidad principal es hematológica (neutropenia y trombopenia), digestiva (náuseas, vómitos, diarrea y mucositis) y neurológica (neuropatía periférica sensitiva).
La incidencia de las RH a oxaliplatino oscila entre el 12 y el 15%, aunque solo en un 0,5% a 2% estas reacciones son severas (grado 3-4)24,25. Debido al incremento progresivo en la utilización de este quimioterápico, es esperable un incremento en la incidencia de las RH.
Las manifestaciones clínicas de las RH consisten en eritema, prurito, rash, náuseas, fiebre, broncoespasmo y alteraciones de la frecuencia cardiaca y de la tensión arterial, en raras ocasiones se han comunicado casos de anafilaxia y muerte23,26,27. Los síntomas pueden desarrollarse al comienzo de la infusión del fármaco, durante la misma o incluso en las horas posteriores a la finalización de la administración. Se ha reportado algún caso de RH a oxaliplatino retardada, donde el comienzo de los síntomas ocurre entre 10 y 20 horas después de la finalización de la administración del fármaco28–30. Estas reacciones ocurren generalmente cuando el paciente ha recibido múltiples ciclos de quimioterapia: de 7 a 9 ciclos31.
La fisiopatología de las RH a oxaliplatino todavía no se conoce en su totalidad. El hecho de que el desarrollo de las RH se produzca cuando el paciente ha recibido ya múltiples ciclos, sugiere la necesidad de sensibilización previa compatible con un mecanismo mediado por IgE, que mediante su unión a basófilos y mastocitos produciría la liberación de histamina, leucotrienos y prostaglandinas (hipersensibilidad tipo I). Otros autores postulan que el oxaliplatino podría actuar como un superantígeno provocando la liberación de citoquinas32.
Diversos investigadores han estudiado los factores que contribuyen a desarrollar una RH a oxaliplatino: la incidencia aumenta con cada ciclo que recibe el paciente y las dosis altas han sido también asociadas a un mayor riesgo de desarrollar una RH33,34. En el estudio realizado por Siu et al. se concluye que los pacientes tratados previamente con otros regímenes de quimioterapia tienen mayor riesgo (casi doble) de desarrollar una RH31. Brandi et al. sugieren que aumentando el tiempo de infusión del fármaco de 2 horas a 6 horas se disminuye el riesgo de desarrollar una RH, aunque el mecanismo por el que se consigue esta disminución de la incidencia no se conoce35. La premedicación con corticoides y antihistamínicos previo a cada ciclo de oxaliplatino no parece que consiga disminuir el riesgo de una RH36.
Manejo de los pacientes que experimentan reacciones de hipersensibilidad a sales de platinoEn pacientes que experimentan una RH leve con síntomas generalmente cutáneos, no es necesario discontinuar la terapia. Se detiene la infusión del fármaco, se administran corticoides y antihistamínicos, y tras la resolución de los síntomas se puede continuar con la infusión del fármaco.
En pacientes que experimentan una RH moderada-severa (grado 3), la reexposición al fármaco debe ser valorada individualmente teniendo en cuenta la gravedad de la reacción inicial y la disponibilidad de otras alternativas terapéuticas. En estos pacientes la reintroducción del fármaco se debe llevar a cabo con una premedicación apropiada previa al ciclo y aumentar los tiempos de infusión o valorar la utilización de protocolos de desensibilización. Si a pesar de todas estas medidas, se repite la RH con igual o mayor severidad que la previa, la recomendación será discontinuar la terapia7,13,23,37,38.
Una alternativa en pacientes que han desarrollado alergia a un componente de platino sería administrar otra sal distinta, lo que nos permitiría continuar con un tratamiento de quimioterapia basado en el platino. En el caso del oxaliplatino, el cambio a otro compuesto está limitado por la quimiosensibilidad del tumor y las indicaciones del fármaco. Pero la sustitución de carboplatino por cisplatino en pacientes que han desarrollado una RH a carboplatino ha sido llevada a cabo con éxito en numerosos pacientes39–42. Sin embargo, en otros casos, se ha producido reactividad cruzada entre las distintas sales de platino, y al reexponer al paciente a otro análogo, se ha producido otra RH e incluso se han reportado casos de muerte43,44. Por tanto antes de sustituir un platino por otro, es necesario realizar pruebas cutáneas para descartar la reactividad cruzada entre las sales de platino45,46. La frecuencia de la reactividad cruzada entre las distintas sales de platino no ha sido establecida aún46.
Un punto crucial sería poder prevenir las RH. En este sentido se han desarrollado tres estrategias: premedicación, realización de pruebas cutáneas y desarrollo de protocolos de desensibilización.
La premediación con corticoides y antihistamínicos ha demostrado que disminuye drásticamente la incidencia de RH en el caso de los taxanos, pero no ha demostrado ser muy efectiva en la prevención de las RH a sales de platino36.
La realización de pruebas cutáneas antes del ciclo de quimioterapia, para predecir una RH, ha sido analizada para el carboplatino y el oxaliplatino. En el estudio realizado por Markman et al. utilizan las pruebas cutáneas como predictores de una RH a carboplatino, a partir del sexto ciclo de tratamiento. Treinta minutos antes del ciclo de carboplatino, se administra intradérmicamente una alícuota de 0,02ml de la solución de carboplatino. Se considera un resultado positivo cuando se produce un habón con bordes enrojecidos de un diámetro igual o mayor a 5 milímetros. Se concluyó que un resultado negativo de las pruebas cutáneas predecía con una razonable fiabilidad, la ausencia de una RH al fármaco. Sin embargo, las implicaciones de un test positivo son menos fiables47. Similares resultados obtiene Zanotti et al.48. Sin embargo, Gómez et al. afirman que las pruebas cutáneas no son buenos predictores de las RH a carboplatino49.
Para el oxaliplatino se han llevado a cabo estudios similares, concluyendo que las pruebas cutáneas en prick y la intradermorreacción son útiles en el diagnóstico de las RH con un valor predictivo negativo de 0,92. Un resultado negativo identificaría a los pacientes candidatos a continuar con la terapia, mientras que en pacientes con un resultado positivo, se debería evitar la administración del fármaco. Si esto no fuera posible por no existir otras alternativas terapéuticas, la reexposición al fármaco se debería realizar con una estrecha monitorización y siguiendo un protocolo de desensibilización46,50,51.
Los protocolos de desensibilización nos permiten continuar con el tratamiento causante de la RH en aquellos pacientes que no dispongan de otras alternativas terapéuticas. Estos esquemas se han desarrollado para múltiples fármacos como antibióticos (penicilinas, cefalosporinas), ácido acetil salicílico, antiinflamatorios no esteroideos, insulina y para quimioterápicos9,52. La desensibilización se basa en inducir un estado de tolerancia temporal al fármaco antigénico mediante la reintroducción gradual de pequeñas cantidades del medicamento hasta alcanzar la dosis terapéutica. Se ha comprobado que después de la desensibilización, las pruebas cutáneas son negativas.
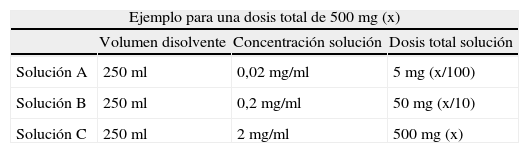
Se han desarrollado múltiples variantes de estos protocolos, pero en general la mayoría se basan en preparar tres soluciones estándar, las cuales se administran en doce pasos en los que se va aumentando de forma progresiva la velocidad de infusión y la concentración del fármaco. La dosis total se administra en un periodo de unas 6 a 8 horas. Las soluciones contienen x/100mg, x/10mg y x mg (siendo x=dosis terapéutica total) diluidos en 250ml del disolvente adecuado. La primera solución se utiliza en los 4 primeros pasos, la segunda en los 4 siguientes, y la tercera solución en los últimos 4 pasos. La velocidad de infusión se cambia cada quince minutos, de forma que con cada paso se administra el doble de dosis que el paso anterior. En el último paso se mantiene la velocidad constante hasta acabar de administrar la dosis total. En la tabla 3 se resume la preparación de las soluciones y la administración del protocolo de desensibilización.
Soluciones y esquema de administración de un ejemplo de protocolo de desensibilización
| Ejemplo para una dosis total de 500mg (x) | |||
| Volumen disolvente | Concentración solución | Dosis total solución | |
| Solución A | 250ml | 0,02mg/ml | 5mg (x/100) |
| Solución B | 250ml | 0,2mg/ml | 50mg (x/10) |
| Solución C | 250ml | 2mg/ml | 500mg (x) |
| Paso | Solución | Velocidad (ml/h) | Tiempo (minutos) | Dosis administrada (mg) | Dosis acumulada (mg) |
| 1 | A | 2 | 15 | 0,010 | 0,010 |
| 2 | A | 5 | 15 | 0,025 | 0,035 |
| 3 | A | 10 | 15 | 0,050 | 0,085 |
| 4 | A | 20 | 15 | 0,100 | 0,185 |
| 5 | B | 5 | 15 | 0,250 | 0,435 |
| 6 | B | 10 | 15 | 0,500 | 0,935 |
| 7 | B | 20 | 15 | 1,000 | 1,935 |
| 8 | B | 40 | 15 | 2,000 | 3,935 |
| 9 | C | 10 | 15 | 5,000 | 8,935 |
| 10 | C | 20 | 15 | 10,000 | 18,935 |
| 11 | C | 40 | 15 | 20,000 | 38,935 |
| 12 | C | 75 | 184.4 | 461,065 | 500,000 |
| Tiempo total 5,82 h | Dosis total 500 mg | Dosis total 500 mg |
Aunque todavía no se conocen los mecanismos moleculares que permiten la desensibilización, se cree que al aplicar el medicamento en dosis graduales, se logra saturar los receptores de IgE evitando la degranulación de los mastocitos y la liberación de mediadores. Por este motivo, los esquemas son aplicados con diluciones muy bajas de manera inicial, y una vez tolerado el fármaco, se permite un gradual incremento en la concentración.
El primer esquema de desensibilización que se realice a un paciente se debe llevar a cabo en una unidad de cuidados intensivos bajo estrecha monitorización, y las siguientes veces se pueden llevar a cabo en el hospital de día, pero siempre bajo la supervisión de una enfermera especializada en la sintomatología de una RH, para poder detectar cualquier reacción que ocurra durante la aplicación de la desensibilización53,54.
La efectividad del tratamiento administrado con un protocolo de desensibilización es la misma que con su administración estándar55.
En la literatura científica se describen múltiples series de pacientes en los que se han aplicado protocolos de desensibilizacion con éxito56–67. La utilización de estos protocolos solo está justificada en aquellos pacientes en los que prescindir de ese tratamiento podría suponer un importante detrimento en su expectativa de vida, y siempre que no existan otras alternativas eficaces, puesto que el riesgo potencial de reacción sistémica severa sigue existiendo.
Taxanos (paclitaxel y docetaxel)Los principales taxanos utilizados en el tratamiento del cáncer son el paclitaxel y el docetaxel.
El paclitaxel está indicado en el tratamiento de tumores ginecológicos, de mama y de pulmón. Puede ser administrado en monoterapia y en combinación con sales de platino, antraciclinas y agentes alquilantes. Sus efectos adversos más frecuentes son mielotoxicidad y alteraciones digestivas.
El docetaxel es un taxano semisintético, con un mecanismo de acción y perfil de efectos adversos similares al paclitaxel. Está indicado en el tratamiento del cáncer de mama, pulmón, próstata, estómago y cabeza y cuello.
La incidencia de las RH con paclitaxel y docetaxel es alta (30%), pero su administración con premedicación de corticoides y antihistamínicos H1 y H2 disminuye esta cifra hasta un rango del 2 al 4%.
Estas reacciones se caracterizan por broncoespasmo, disnea, ansiedad, urticaria, hipotensión, taquicardia y dolor abdominal. En el caso del docetaxel, también se produce retención de fluidos. Suelen ocurrir en los primeros minutos tras comenzar la infusión del fármaco y generalmente en la primera o segunda dosis68–70.
El mecanismo por el que se produce la RH es desconocido y problamente multifactorial. Parece ser secundario a un efecto citotóxico directo no inmunológico (anafilactoide) sobre los basófilos, que genera una liberación de histamina y de sustancias vasoactivas. Al ocurrir en las primeras dosis de administración del fármaco, no requiere una sensibilización previa. No se ha podido confirmar un mecanismo IgE mediado. Aunque Prieto et al. describen un caso aislado donde demuestran una RH a paclitaxel mediada por IgE con pruebas cutáneas positivas4,71.
Tanto el paclitaxel como el docetaxel son compuestos altamente hidrofóbicos, por lo que requieren solubilizarse en disolventes para su administración parenteral. En el caso del paclitaxel, se utiliza como excipiente el Cremophor® (Limburgerhof, Alemania) y en el caso del docetaxel el polisorbato 80. El Cremophor® (Limburgerhof, Alemania) se cree que es en parte responsable de las RH producidas por el paclitaxel, debido a que se ha demostrado que es una sustancia capaz de inducir la liberación de histamina 72. Esta teoría también está avalada por el hecho de que una nueva formulación de paclitaxel sin Cremophor® (Limburgerhof, Alemania), en la que se solubiliza el paclitaxel uniéndolo a albúmina no provoca RH incluso en ausencia de premedicación73. Sería esperable que la incidencia de las RH a docetaxel fuera menor al tener en su formulación un excipiente distinto del Cremophor® (Limburgerhof, Alemania), pero aun así las cifras de hipersensibilidad causada por este compuesto son similares a las causadas por el paclitaxel.
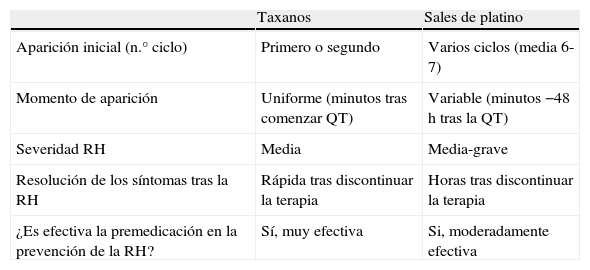
Entre los factores de riesgo asociados con el desarrollo de una RH destacaría: historia previa de alergia y tiempo de administración del fármaco. Se ha comprobado que la incidencia de RH es menor cuando se administra el paclitaxel en 3 horas en lugar de 1 hora74. El paclitaxel se utiliza frecuentemente en combinación con carboplatino, por lo que es importante diferenciar las características de las RH producidas por ambos fármacos, para saber cual es el agente causal de la RH. Las principales diferencias se resumen en la tabla 4.
Características diferenciales entre las RH causadas por platinos y taxanos
| Taxanos | Sales de platino | |
| Aparición inicial (n.° ciclo) | Primero o segundo | Varios ciclos (media 6-7) |
| Momento de aparición | Uniforme (minutos tras comenzar QT) | Variable (minutos −48 h tras la QT) |
| Severidad RH | Media | Media-grave |
| Resolución de los síntomas tras la RH | Rápida tras discontinuar la terapia | Horas tras discontinuar la terapia |
| ¿Es efectiva la premedicación en la prevención de la RH? | Sí, muy efectiva | Si, moderadamente efectiva |
En la gran mayoría de los pacientes, tras la primera RH media-moderada al paclitaxel, es posible reanudar la infusión de forma segura, tras la resolución completa de las manifestaciones clínicas desarrolladas, sin que se produzca una nueva reacción74,75. Markman et al. especulan que esto es posible debido a que los receptores de los mastocitos, o de las células inmunológicas responsables del desarrollo de la hipersensibilidad, están bloqueados por el fármaco administrado en la infusión previa y no están accesibles para volver a reaccionar con el fármaco al reintroducirlo68.
Para pacientes que sufran una segunda RH después de la reintroducción del paclitaxel o sufran una RH severa, se debe utilizar un esquema de desensibilización. Administrando concentraciones muy bajas del fármaco, para conseguir que el sistema inmunológico desarrolle tolerancia al mismo. Distintos autores desarrollan protocolos de diez a doce pasos y de 6 a 7 horas de duración, aplicados con éxito en distintas series de pacientes, proponiéndose como una estrategia segura y efectiva para el retratamiento de pacientes58,76,77. En pacientes que a pesar de seguir este protocolo experimenten nuevamente síntomas de una RH, se debe detener la administración del fármaco y no volver a reintroducirlo.
Una alternativa para pacientes que desarrollen una RH severa a paclitaxel sería la sustitución por docetaxel, si se quiere continuar con una terapia basada en los taxanos, el éxito de esta sustitución se pone de revelancia en algunos estudios78–80. Pero se debe tener precaución debido a la posibilidad de reactividad cruzada entre docetaxel y paclitaxel, cifrada como se observa en el estudio de Dizon et al., en un 90%81. Estos datos sugerirían también que la responsabilidad de la RH recae en el taxano y no en el excipiente, al tener ambos fármacos distinto excipiente, tal como afirman algunos investigadores. Otra alternativa es optar por la nueva formulación de paclitaxel unido a albúmina (Abraxane®; Windsor, Reino Unido). Los estudios sobre el mismo reflejan que no causa RH incluso administrándolo sin premedicación. Pero esta opción está limitada por su alto coste, y porque su actividad clínica todavía no ha sido investigada en la mayoría de los tumores73,82,83.
L-AsparraginasaLa L-Asparraginasa es un agente enzimático antineoplásico de origen bacteriano utilizado en el tratamiento de la leucemia linfoblástica aguda, principalmente en niños. Su origen bacteriano puede ser de Escherichia coli (Kydrolase®; Limonest, Francia) o Erwinia chrysanthemi (Erwinase®; Salisbury, Reino Unido). Existe otra especialidad de L-asparraginasa pegilada que está unida de forma covalente con un grupo polietilenglicol para disminuir su inmunogenicidad y prolongar su vida media plasmática sin modificar su eficacia (Oncaspar®; Hamburgo, Alemania).
Las RH son su toxicidad más frecuente e importante con una incidencia entre el 6 y el 43%, pudiendo tener lugar anafilaxis grave en un 10% de los casos. Su administración vía intravenosa se asocia a una mayor incidencia y gravedad de las RH, por lo que se recomienda su administración por vía intramuscular o subcutánea. También se ha asociado a un mayor riesgo de RH intervalos de administración entre dosis superiores a una semana comparado con su administración diaria. De igual forma sucedería con la exposición previa a L-asparraginasa, dosis superiores a 6.000 UI/m2/día y su administración en monoterapia1,4,84.
Los síntomas de las RH consisten en: urticaria, rash, dolor abdominal, brocoespasmo, hipotensión, y en casos severos, anafilaxia que puede conducir a la muerte del paciente. Normalmente se produce tras varios ciclos administrados y dentro de la primera hora tras la administración del fármaco.
El mecanismo por el que se produce esta reacción no se conoce en su totalidad, se cree que puede ser mediado por IgE o relacionado con la activación del complemento69.
Como consecuencia de la alta incidencia de RH, se recomendaba realizar una prueba cutánea, previa a la administración de la primera dosis de L-asparraginasa y siempre que el intervalo entre dosis sea superior a una semana. Pero actualmente esta prueba está en desuso, porque no está validada y no es muy apropiada para predecir la aparición de una RH por la alta proporción de falsos positivos y negativos69.
Cuando un paciente desarrolla una RH a L-asparraginasa derivada de E. coli (tratamiento convencional) y es necesaria la continuación de la terapia, se discontinua el tratamiento con L-asparraginasa de E.coli y se sustituye por la derivada de Erwinia o por la especialidad pegilada. Hay estudios que muestran tolerancia a estos compuestos en pacientes que desarrollaron alergia a L-asparraginasa de E.coli85. Sin embargo, otros autores indican casos de reactividad cruzada, produciéndose tras la primera dosis de L-asparaginasa de Erwinia una RH en pacientes previamente alérgicos a L-asparaginasa de E. coli86. Otra opción para continuar el tratamiento seria administrar L-asparraginasa derivada de E. coli con un protocolo de desensibilización, basado en la reintroducción gradual de pequeñas cantidades del medicamento hasta alcanzar la dosis terapéutica87,88. Soyer et al. muestran un 70% de éxito en la aplicación de este protocolo a 16 pacientes, considerándolo por tanto una opción aceptable para continuar el tratamiento cuando no hay otra alternativa terapéutica89.
Epipodofilotoxinas (etopósido)El etopósido está indicado en el tratamiento de tumores de testículo y pulmón así como en neoplasias hematológicas.
El etopósido tiene una incidencia de RH del 6%. Su hipersensibilidad también ha sido relacionada con su disolvente (polisorbato 80).
La premedicación con corticoides y antihistamínicos, así como disminuir la velocidad de infusión, han demostrado ser medidas útiles para disminuir la incidencia de RH. También se han llevado a cabo con éxito protocolos de desensibilización90,91.
Anticuerpos monoclonalesLos principales anticuerpos monoclonales utilizados en el tratamiento del cáncer son: rituximab, trastuzumab, cetuximab, bevacizumab y panitumumab.
Estos agentes son en general mejor tolerados y menos tóxicos que la quimioterapia convencional pero también pueden producir RH. En cuanto a su estructura que condiciona su poder inmunogénico cabe destacar que rituximab y cetuximab son anticuerpos quiméricos, trastuzumab y bevacizumab son humanizados y panitumumab es totalmente humano.
Mayoritariamente las RH a anticuerpos monoclonales son leves o medias (grado 1-2) y su incidencia variará de un fármaco a otro (77% para rituximab, 40% para trastuzumab, 19% para cetuximab y 1-3% para bevacizumab y panitumumab). La incidencia de RH severa (grado 3-4) es muy baja. En el caso del rituximab la incidencia de las RH disminuye con las sucesivas administraciones, pasando de un 77% en la primera infusión,a un 30% en la cuarta y a un 14% en la octava. Las RH ocurren mayoritariamente en el primer o segundo ciclo de infusión y entre los 30-120 minutos de comenzar la administración7,92.
El mecanismo por el que se producen estas reacciones no está todavía definido, pero se han sugerido distintas opciones: mediadas por IgE con activación de basófilos y mastocitos, no mediados por IgE (anafilactoides) o inducidas por la liberación de citoquinas. Al producirse las RH mayoritariamente durante la primera infusión del anticuerpo, nos indica que no se requiere un proceso previo de sensibilización1,93,94.
Chung et al. han identificado recientemente en el suero de pacientes IgE contra cetuximab preexistente, antes de recibir el primer ciclo de cetuximab. Estas inmunoglobulinas podrían ser las responsables de la RH que ocurre en la primera infusión del fármaco. Así, pacientes con preexistencia de estas inmunoglobulinas contra cetuximab tienen una incidencia significativamente superior de desarrollar una RH severa95.
A pesar de los distintos mecanismos propuestos, los signos y síntomas desarrollados durante las RH son similares, consistentes en malestar general, náuseas, moderada disnea, enrojecimiento cutáneo, prurito, y fiebre. En muy pocos casos aparecen síntomas más graves como broncoespasmo, angioedema o hipotensión96,97.
La estrategia propuesta para la prevención de las RH sería la administración de antihistamínicos y/o corticoides previo al ciclo en el caso de cetuximab y rituximab. Y en el caso de rituximab además se recomienda una velocidad inicial de perfusión lenta e ir incrementándola paulatinamente98.
El estudio llevado a cabo por Timoney et al. sugiere que la premedicación en el caso del cetuximab puede ser discontinuada de forma segura, en la tercera infusión si el paciente no ha desarrollado síntomas durante las dos primeras. Esta estrategia se apoya en la teoría de que la mayor parte de las reacciones ocurren durante las primeras administraciones de cetuximab99.
La mayoría de los pacientes que experimentan una RH media o moderada, tras la resolución completa de los síntomas, toleran la readministración del fármaco usando una velocidad de infusión menor y premedicación. En pacientes que sufren una reacción severa la recomendación es discontinuar el tratamiento. Si no se disponen de otras alternativas y es indispensable continuar el tratamiento se recomienda recurrir a los esquemas de desensibilización7,100.
Estos protocolos han sido descritos para la mayoría de los anticuerpos56,101. Brennan et al. han llevado a cabo con éxito 105 desensibilizaciones en 23 pacientes a distintos anticuerpos monoclonales como rituximab, trastuzumab y infliximab102.
Diferentes estudios sugieren que pacientes con cáncer colorectal en tratamiento con cetuximab que desarrollen una RH al mismo pueden ser tratados de forma segura con panitumumab103,104. En sentido contrario también se ha comunicado el caso de una paciente tratado exitosamente con un protocolo de desensibilización con cetuximab tras una RH severa a panitumumab105.
ConclusionesLas RH a agentes quimioterápicos han sido observadas con la mayoría de los fármacos utilizados. Al producirse un incremento progresivo en la utilización de los agentes quimioterápicos, se puede esperar un aumento de la incidencia de las RH. Estas reacciones son impredecibles y potencialmente graves. Los mecanismos que las desencadenan no son todavía comprendidos en su totalidad, por lo que se requerirán estudios dirigidos a analizarlos con más detalle. Una diferencia importante entre los distintos agentes es el momento de aparición de los síntomas. La hipersensibilidad a componentes del platino se desarrolla tras múltiples ciclos, lo que nos indica que es necesario un periodo previo de sensibilización (hipersensibilidad tipo I). Por el contrario la hipersensibilidad a taxanos y anticuerpos monoclonales son inmediatas, ocurriendo generalmente en los primeros minutos tras comenzar la primera infusión del fármaco, lo que nos sugiere que estas reacciones ocurren por otros mecanismos alternativos.
El manejo de los pacientes que desarrollan una RH variará según el grado de severidad de la misma. Así pacientes que experimentan una RH leve, con síntomas generalmente cutáneos, no es necesario discontinuar la terapia. Se detiene la infusión del fármaco, se administran corticoides y antihistamínicos, y, tras la resolución de los síntomas, se puede continuar con la infusión del fármaco. Pero en pacientes que experimentan una RH moderada-severa, la reexposición al fármaco debe ser valorada individualmente teniendo en cuenta la gravedad de la reacción inicial y la disponibilidad de otras alternativas terapéuticas. Cuando se decide la reexposición al agente responsable de la RH, esta se debe realizar con las premedicaciones adecuadas y disminuyendo la velocidad de infusión o mediante un esquema de desensibilización. Estos protocolos han sido descritos en la literatura científica, disponiéndose de una amplia experiencia con algunos fármacos como las sales de platino. De cualquier modo, la determinación de realizar o no un proceso de desensibilización, debería hacerse dentro de un equipo multidisciplinar, valorando los factores individuales del paciente y sopesando el balance beneficio-riesgo del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.