ORIGINALES
PARTICIPACIÓN DEL FARMACÉUTICO DE HOSPITALEN LA INVESTIGACIÓN CLÍNICA
Quevedo de Torres, A., Doctora en Farmacia, monitora de investigación clínica;Pérez Bravo, L.,Doctor en Farmacia, monitor de investigación clínica; Fernández Fernández, A.,Licenciado en Biología, monitor de investigación clínica.
Departamento Médico Zéneca Farma S.A.
Correspondencia: Alicia Quevedo, Departamento Médico Zéneca Farma S.A. Josefa Valcárcel, 3-5 28027 Madrid
E-mail: alicia.quevedo@MADRID.ZENECA.com
Fecha de recepción: 14-9-98
Palabras clave: Farmacéutico de hospital. Servicio de farmacia. Ensayos clínicos. Encuesta. Industria farmacéutica.
Resumen: Introducción: Para identificar las funciones básicas del farmacéutico de hospital en los ensayos clínicos, se compararon sus expectativas con las de la industria farmacéutica.
Material y métodos: La información se recogió mediante una encuesta específica para cada uno. En el análisis de los datos se usó el paquete informático R-sigma BABEL.
Resultados: El promotor debe potenciar al farmacéutico del hospital como investigador principal (12% actual), implicándose más en la preparación del protocolo (36%). El farmacéutico deberá asegurar el correcto manejo de las muestras, estableciendo mecanismos de control como caducidad (85,7%), reetiquetado y recuento de la medicación (87,8%). Para ello, serán necesarios recursos tanto personales como económicos (17,9%).
Discusión: El farmacéutico del hospital está implicado en la entrega y dispensación de muestras fundamentalmente, detectándose deficiencias en las fases preliminares y finales del ensayo clínico. Una mejora en la vía de comunicación entre los implicados, facilitará el buen desarrollo del ensayo clínico.
PARTICIPATION OF THE HOSPITAL PHARMACIST IN CLINICAL RESEARCH
Key words: Pharmacy-service hospital. Clinical trial. Questionnaires. Drug industry
Summary: Introduction: In order to identify the role of the hospital pharmacist in the clinical trials, his expectations with the pharmaceutical industry ones were compared.
Material and methods: The information was collected through a customized questionnaire. For data entry and analysis, a R-sigma Babel software package was used.
Results: The sponsor should intensively support the hospital pharmacist as main investigator (actually done in a 12%), encouraging his participation in the protocol design (36%). The pharmacist should ensure a correct handling of the samples, establishing control mechanisms such as expiry dates (85.7%), relabelling and drug accountability (87.8%). In order to achieve this, personal and financial resources are needed (17.9%).
Discussion: The hospital pharmacist is mainly involved in the delivery and dispensing of the trial drugs although there are procedural flaws in the pretrial and closure stages. The communication among all the personnel involved will help in the development of the clinical trial.
Farm Hosp 1999; 23: 24-41
INTRODUCCION
La investigación en ciencias de la salud es un factor estratégico para el desarrollo del sector farmacéutico. Junto a la investigación aeroespacial, electrónica e informática, es uno de los sectores que recibe más fondos para inversión (1). Concretamente, entre 1994 y 1995 la inversión mundial en investigación clínica representó un 36,1% respecto del total invertido en investigación y desarrollo (2).
Las cifras del gasto absoluto de las empresas españolas incluidas en el Plan de Fomento, han ido creciendo en los últimos años, así en 1993 representó una cifra de 15.024 millones de pesetas, 16.234 en 1994 y 16.942 en 1995, según datos del Ministerio de Industria y Energía (1).
El objetivo de dicho Plan es conseguir en España un rigor científico comparable al de otros países desarrollados de nuestro entorno, para poder adquirir un nivel de investigación competitivo, tanto por su desarrollo y tecnología, como por el conocimiento, formación y experiencia de los investigadores.
Durante el período 1994-95, España invirtió un 36% del total de investigación y desarrollo en investigación clínica, muy en línea con las cifras de la Unión Europea, con casi un 39% del total invertido en investigación y desarrollo. En general, la actividad en materia de investigación clínica se halla en aumento ya desde los años 80 (3) manteniéndose dicha tendencia también durante esta década (4, 5).
Si se tiene en cuenta el sector de los ensayos clínicos como proyecto enmarcado dentro del Plan de Fomento, se observa que de 88 ensayos clínicos realizados en España en el período comprendido de 1987 a 1989 se llega a los 164 en 1992 y a unos 350 en 1996.
Por este motivo y por el desarrollo de nueva legislación nacional e internacional en investigación clínica, cada vez se hace más necesario un control exhaustivo de las actividades relacionadas con la investigación clínica.
Los ensayos clínicos son indispensables para determinar la eficacia y seguridad de los medicamentos en el hombre (3, 6-9). Aunque en la legislación y en las recomendaciones existentes relativas a investigación clínica no se designa explícitamente al farmacéutico de hospital como responsable directo del producto en investigación (sino que se habla del investigador principal), sí se contempla que el manejo de la medicación deberá hacerse desde el servicio de farmacia (10, 11).
A este respecto, la Sociedad Canadiense de Farmacéuticos de Hospital ha revisado recientemente los estándares del manejo de medicamentos en investigación en los hospitales, destacando la necesidad de que se involucren los servicios de farmacia (12). Los servicios responsables del desarrollo de medicamentos desempeñan un papel crucial, siendo un factor de expansión en muchos servicios de farmacia y particularmente en áreas como el desarrollo de nuevas formas farmacéuticas o la biotecnología (13).
Dado que no están claramente descritas las responsabilidades ni los procedimientos a seguir por los servicios de farmacia en lo que a ensayos clínicos se refiere, nos pareció interesante establecer cual es el papel que desempeña el farmacéutico de hospital en el desarrollo de los mismos, tanto desde su perspectiva como desde la de la industria farmacéutica, como promotor mayoritario en la realización de ensayos clínicos (14). Asimismo estudiamos los recursos asignados en los servicios de farmacia, viendo su relación con el buen desarrollo de las funciones desempeñadas a tal efecto.
Así, nosotros pensamos que podríamos contribuir a la clarificación de las responsabilidades y la metodología del farmacéutico de hospital en el entorno de los ensayos clínicos.
La realización de los ensayos clínicos se basa en postulados éticos (10, 11, 14, 15), la legislación vigente (16-18), códigos internacionales y otras recomendaciones (19-24) por cuyo cumplimiento se debe velar en beneficio de los individuos participantes en los ensayos clínicos y posteriormente de la humanidad:
«la preocupación por los intereses del sujeto debe prevalecer siempre sobre los intereses de la ciencia y de la sociedad» (10) y, «los intereses y el bienestar de la persona sometida a investigación médica deben prevalecer sobre los intereses de la ciencia y de la sociedad» (19).
MATERIAL Y MÉTODOS
Se ha recogido la opinión de la industria farmacéutica y del farmacéutico de hospital responsable de la realización de ensayos clínicos, mediante dos cuestionarios adaptados a cada propósito que fueron validados por un psicoanalista experto en esta metodología.
El período de envío y recogida de cuestionarios se desarrolló durante un año, coincidiendo con la transición de la denominación de Comité de Ensayos Clínicos a Comité Ético de Investigación Clínica (3, 16, 17).
El primer cuestionario iba dirigido a los farmacéuticos de hospital (servicios de farmacia) y recogía información estructurada sobre las tres etapas básicas de un ensayo clínico: puesta en marcha, desarrollo y finalización, haciendo especial hincapié en el manejo de las muestras clínicas.
Los centros seleccionados para el envío del cuestionario fueron servicios de farmacia de hospitales con Comité de Ensayos Clínicos acreditado en España. Este listado fue proporcionado por la Dirección General de Farmacia y Productos Sanitarios de los Comités de Ensayos Clínicos acreditados a fecha de octubre de 1992.
Así de los 113 servicios de farmacia con estas características, se escogieron 92 centros para el envío del cuestionario; los 21 restantes se desecharon por su baja actividad en la realización de ensayos clínicos.
La selección de las compañías farmacéuticas se hizo en función de un listado de las compañías pertenecientes al Plan de Fomento proporcionado por el Ministerio de Industria y Energía. De estas 50 compañías se seleccionaron 15, revisando los artículos publicados en el periódico «Diario Médico» (1) durante el período de septiembre de 1993 a septiembre de 1994, ya que recogían la opinión de los miembros de los departamentos de investigación que realizaban ensayos clínicos. De esta forma se tenía una aproximación práctica y actual de que la compañía farmacéutica a la que pertenecían, al menos contaba con una infraestructura para la realización de ensayos clínicos. La proporción compañías nacionales frente a multinaciones fue de 1:4.
Este segundo cuestionario estaba dividido en dos secciones: la primera recogía información general sobre las actividades desarrolladas por la compañía farmacéutica en materia de ensayos clínicos, mientras que la segunda era un cuestionario dirigido a los implicados de dicha compañía en actividades relacionadas con los servicios de farmacia en el campo de los ensayos clínicos.
En ambos cuestionarios se hacía referencia directa a las tareas habituales desempeñadas por los farmacéuticos de hospital independientemente de las obligaciones legales, terminando con una valoración personal de su implicación en el desarrollo de los ensayos clínicos.
La recogida de la información se desarrolló en dos fases: una fase inicial o piloto y otra fase final integrando al resto de los encuestados.
Para la fase piloto del cuestionario de los servicios de farmacia, se seleccionaron cinco hospitales con un gran volumen de ensayos clínicos. En ellos, se hizo entrega en mano del cuestionario, formulándose las preguntas directamente al encuestado para asegurar que no hubiese malas interpretaciones, que las preguntas fuesen fácilmente comprensibles y con un enfoque adecuado.
En un total de 30 servicios de farmacia se envió una carta solicitando la cumplimentación del cuestionario, informando del propósito del mismo y garantizando la confidencialidad de la respuesta.
En los otros 57 centros se hizo entrega personal al farmacéutico encargado de los ensayos clínicos en el servicio de farmacia. Si las figuras del farmacéutico responsable de los ensayos clínicos y del jefe del servicio de farmacia no coincidían en la misma persona, éste último debía corroborar con su visto bueno la información facilitada.
En algunos de estos casos fue necesaria una segunda e incluso tercera entrega para poder recoger la respuesta.
Para el estudio piloto del cuestionario de la industria farmacéutica, se seleccionaron tres personas pertenecientes al departamento de investigación clínica de dos compañías farmacéuticas multinaciones implicadas directamente en la realización de ensayos clínicos. Con este estudio piloto se valoraba la legibilidad y comprensibilidad del cuestionario.
El envío por correspondencia tanto a los servicios de farmacia como a la industria farmacéutica, incluía un sobre franqueado con la dirección del remitente para facilitar y asegurar, en la medida de lo posible, la recepción de la información.
Para el análisis estadístico se utilizó el paquete informático R-sigma (versión BABEL) desarrollado por Horus Hardware S.A.
Los datos se incluyeron en dos bases de datos, una diseñada para la industria farmacéutica y la otra para los servicios de farmacia.
Para el análisis de los datos se tuvieron en cuenta tanto variables cualitativas como cuantitativas. Para comparar las variables se utilizaron pruebas paramétricas y no paramétricas en función de la normalidad de su distribución.
Al ser un cuestionario de gran carga subjetiva en su contenido, se describieron más variables cualitativas que cuantitativas. Los comentarios incluidos en el cuestionario se utilizaron para matizar los resultados finales.
Las pruebas empleadas en el análisis de los datos fueron de dos tipos: descriptivas y analíticas. En las descriptivas se hizo una distribución de frecuencias para cada variable introducida, especificándose los porcentajes de respuesta y el total de casos evaluados. En las pruebas analíticas y en función de la normalidad se aplicaron pruebas paramétricas (test de Chi cuadrado para comparar variables cualitativas) o no paramétricas (test de Kruskall-Wallis para comparar variables cualitativas con cuantitativas).
Se estudió la asociación estadísticamente significativa entre las variables que pudieran tener relación, determinándose la p<0,05 y el conficiente de asociación v.
RESULTADOS
A continuación exponemos los resultados obtenidos en función de la participación, actividad investigadora y del papel desempeñado por el farmacéutico de hospital en el inicio, desarrollo y finalización del ensayo clínico tal y como se percibe en las encuestas recibidas.
Participación
Se obtuvo un 45,7% (42 de 92 cuestionarios enviados) de respuesta por parte de los servicios de farmacia, siendo la comunidad catalana la que proporcionó un mayor número de respuestas (tabla 1).
Tabla 1. Tasa de respuesta por comunidades autónomas españolas en el cuestionario del servicio de farmacia | |||
| Comunidad | Media anual de ensayos clínicos (n.o de centros) | Respuesta por comunidades (%) | Respuesta total (%) |
| Cataluña | 19 (12) | 46,2 | 28,6 |
| Madrid | 25,6 (8) | 44,4 | 19 |
| Andalucía | 13,8 (4) | 100 | 9,5 |
| Castilla-León | 4 (3) | 50 | 7,1 |
| Valencia | 23,3 (3) | 23,1 | 7,1 |
| Aragón | 13,7 (2) | 100 | 4,8 |
| Baleares y Canarias | 7,2 (2) | 50 | 4,8 |
| Galicia | 13,5 (2) | 40 | 4,8 |
| Extremadura | 3 (1) | 100 | 2,4 |
| Navarra | 15 (1) | 33,3 | 2,4 |
| Castilla La Mancha | 1 (1) | 33,3 | 2,4 |
| País Vasco | 4 (1) | 20 | 2,4 |
| Sin identificar | 9 (2) | -- | 4,8 |
En el cuestionario enviado a la industria farmacéutica respondió un 66,7% (10 de los 15 cuestionarios) (tabla 2).
Tabla 2. Tasa de respuesta según el origen de las compañías farmacéuticas en el cuestionario de la industria farmacéutica | |||
| Origen del Laboratorio | Media anual de ensayos clínicos (n.o de respuestas) | Respuesta según origen (%) | Respuesta respecto al total (%) |
| Nacional | 11,7 (3) | 100 | 30 |
| Multinacional | 8,3 (8) | 58,3 | 70 |
En estos 10 cuestionarios se recogía la respuesta de 17 miembros de los departamentos de investigación con distintos cargos: director médico (17,7%), médico adjunto (23,5%), monitor (41,1%) y un «otros» equivalente a puestos específicos de algunas compañías tales como gerente de investigación (17,7%).
Actividad investigadora
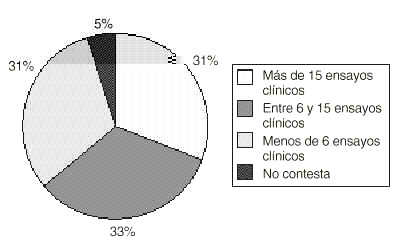
Más de la mitad de los centros a los que pertenecen los farmacéuticos de hospital tienen una media de al menos seis ensayos clínicos al año, destacando en el extremo superior los que realizan en este período hasta 60 y 70 ensayos clínicos (figura 1).
Figura 1.--Actividad investigadora anual de centros con Comité de ensayos clínicos acreditado.
El promedio de ensayos clínicos puestos en marcha por los promotores es de 9,6±1,6 ensayos clínicos anuales.
Papel del farmacéutico de hospital
Tomando como eje principal el trabajo del farmacéutico de hospital en la realización de los ensayos clínicos, vamos a analizar a continuación los resultados recogidos de las encuestas.
Para ello se ha hecho una división del ensayo clínico en cuatro fases (planificación, inicio, desarrollo y finalización), evaluándose al final los recursos destinados y aportando la opinión del personal implicado directamente en la investigación clínica.
Implicación del farmacéutico de hospital
en la planificación y fases previas del ensayo clínico
Dentro de esta etapa, tal y como se percibe en nuestra encuesta, son actividades de especial interés las que se citan a continuación:
-- Investigador principal
-- Autoría y revisión de protocolos
-- Comunicación científica y asesoría al equipo investigador
-- Información al paciente
Investigador principal
La totalidad de las respuestas recibidas indican que su participación a este nivel es relativamente discreta (12%) y está relacionada fundamentalmente con la evaluación de productos sanitarios.
Por otra parte un sector (2,7%) entre los farmacéuticos de hospital consideran al clínico más capacitado para ello.
Autoría y revisión de protocolos
Según nuestros datos, el promotor opina que la aportación del farmacéutico de hospital a la preparación del protocolo no es relevante (64% de las compañías encuestadas, n=17), razón por la cual su participación no les es propuesta.
Esta respuesta contrasta con la opinión recogida en el cuestionario de la industria farmacéutica donde, al margen de las exigencias legales, el promotor insiste en que la presencia del farmacéutico de hospital en las reuniones del Comité Ético de Investigación Clínica para la evaluación del protocolo es necesaria (94%), precisamente por el conocimiento de los fármacos a investigar. Dentro de estos conocimientos, el promotor (n=16) señala que fundamentalmente debería evaluar los aspectos relacionados con la formulación farmacéutica (30,2%) y la dosificación del fármaco (24,5%).
En la actualidad y según datos de nuestra encuesta (n=35) el cargo desempeñado por el farmacéutico de hospital en estas reuniones varía entre los siguientes: presidente (4,8%), secretario (36,5%), vocal (46,3%) y asesor (12,1%).
Comunicación científica y asesoría al equipo
investigador
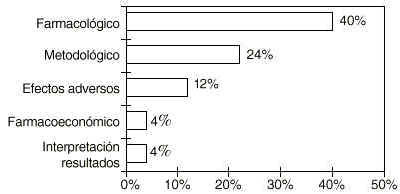
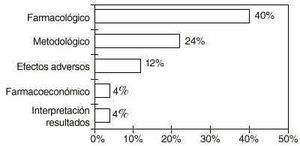
En el campo de la farmacia clínica, el farmacéutico de hospital por sus conocimientos, puede desarrollar tareas relacionadas con la documentación y comunicación científicas entre otras. En este sentido, el farmacéutico de hospital está de acuerdo en potenciar esta faceta, por considerarlo beneficioso en un 89,6% de los casos (n=29) y en los aspectos que se relacionan en la figura 2.
Figura 2.--Conocimientos aportados por el farmacéutico de hospital en la investigación clínica.
Hubo otros beneficios informados aisladamente y que no se referían a conocimientos científicos, entre los que se encuentran beneficios para el investigador y garantía de calidad. Uno de los centros no contestó.
Información al paciente
El farmacéutico de hospital interviene directamente en las funciones relacionadas con la dispensación de medicamentos a pacientes ambulatorios o de día, lo que le confiere una gran proximidad que favorece la relación interpersonal, como se pone de manifiesto en la práctica al hacerse en un 44% de los casos (n = 25).
Implicación del farmacéutico de hospital en el inicio del ensayo clínico
En esta fase está comprendida la preparación del ensayo, entrega del material clínico y la recepción de las muestras.
Preparación del ensayo
Preguntamos acerca de la profundidad y dedicación del farmacéutico de hospital al estudio del protocolo, y vimos que dedicaba un tiempo variable según el centro (n=39) (figura 3), siendo de destacar que alrededor de un 30% dedicaba menos de 30 minutos.
Figura 3.--Dedicación del farmacéutico de hospital al estudio del protocolo.
En el tiempo dedicado por cada farmacéutico de hospital, se estudia exhaustivamente todo el contenido del protocolo (67%).
Entrega de material clínico
La autorización del ensayo clínico por la Dirección General de Farmacia y Productos Sanitarios, que es requisito obligado para aceptar el fármaco en el servicio de farmacia, se entrega en los servicios de farmacia en la totalidad de los casos, comprobándose su existencia por todos los farmacéuticos del hospital (n=42).
Igualmente los promotores dicen entregar el fármaco al servicio de farmacia. Independientemente de que sea una exigencia legal, el 88% de ellos lo consideran como un procedimiento obligatorio para así garantizar la adecuada manipulación de las muestras.
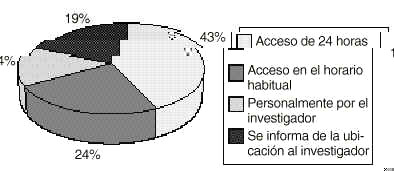
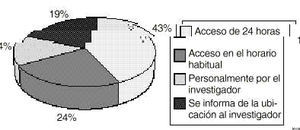
El protocolo sin embargo sólo es entregado en un 67% de los casos al igual que las claves de aleatorización. Con respecto a estas últimas, los farmacéuticos de hospital (n=41) están de acuerdo en que las reciben siempre (34,2%) o casi siempre (58,5%). Asimismo están dotados de un sistema de acceso de urgencia en un 94,1% de los casos, que difiere de unos centros a otros según muestra la figura 4.
Figura 4.--Acceso a los códigos cerrados en el servicio de farmacia.
Recepción de muestras
La recepción de las muestras en el hospital (n=42) es canalizada habitualmente a través del servicio de farmacia (76,2%) con acuse de recibo por escrito (90,4%). Como alternativas, los farmacéuticos de hospital (n=23) declaran poner en marcha mecanismos de seguimiento de las muestras clínicas (39,1%) bien a través del promotor, del investigador o del Comité de Ensayos Clínicos, para garantizar así el control del material antes del inicio del ensayo. Del resto, más de la mitad de los servicioS de farmacia han dirigido esta responsabilidad a otros departamentos, como la administración de secretaría.
De nuevo se observa cierta contradicción entre el relativamente bajo porcentaje de seguimientos sistemáticos y el control realizado por los servicios de farmacia (n=40) de los ensayos clínicos autorizados (82,5%) para poder reclamar las muestras que no lleguen.
Para proceder a la recepción de las muestras en el servicio de farmacia, un 87,2% de los farmacéuticos de hospital (n=34) comprobaron que el etiquetado cumplía los requisitos legales, devolviendo las muestras (44,8%) si no era así, contactando con el promotor (17,2%) para subsanar la anomalía o sin hacer nada al respecto (62%).
Posteriormente, el almacenamiento de las muestras se realizó en condiciones especiales para el material de ensayo clínico en un 92,9% de los servicios de farmacia (n=39), y separadas de los restantes medicamentos en un 91,4% de ellos.
Implicación del farmacéutico de hospital
en el desarrollo del ensayo clínico
Las respuestas recogidas del cuestionario de los servicios de farmacia indican que un tercio de las compañías farmacéuticas visitan el servicio de farmacia exclusivamente al inicio y final del ensayo clínico y sólo un 16,7%, hace un seguimiento regular (n=36).
La respuesta de los promotores, aunque muy limitada, no concuerda con la de los farmacéuticos de hospital, ya que afirman en un 67% de los cuestionarios recibidos (n=6) que visitan el servicio de farmacia en cada monitorización.
Dispensación y recogida
La dispensación de las muestras clínicas se hace contra petición escrita (n=41), siendo mayoritaria la prescripción exclusiva tanto en centros grandes como pequeños (53,7%) frente a los que no precisan prescripción especial (19,5%). Un 29,1% entregan las muestras en mano sin prescripción. El resto corresponde a otros sin identificar.
Pensamos que a más recursos destinados por los servicios de farmacia mayor sería la preocupación del farmacéutico de hospital en conseguir una información adecuada en beneficio del paciente. Aplicando la prueba del chi cuadrado se ha encontrado relación estadísticamente significativa (p<0,04 con un coeficiente de asociación v=0,56), lo que corrobora esta presunción inicial.
La dispensación directa al paciente se realiza en un 59,5% de los centros. En estos casos se le informa de la medicación que va a recibir (53,8%), aunque depende de si se estableció o no previamente con el investigador quién era el responsable de transmitir la información. Sin embargo no se informa regularmente de un tema tan importante como el de las posibles reacciones adversas (68%). Sólo en uno de los centros se explicaba esta falta de información por tratarse de un tema conflictivo como para que fuera facilitado por el farmacéutico de hospital.
En general, la encuesta revela (n=24) que el farmacéutico prefiere realizar la dispensación al paciente (54,2%). Esta preferencia la basan en la consecución de un control más estricto del tratamiento, en un mejor seguimiento del ensayo clínico, en una mayor relación con el paciente y en una dispensación más completa.
Las preferencias por la dispensación al investigador estaban en franca minoría (29,2%), argumentándose en estos casos una mayor simplicidad en la dispensación, ser más lógica y una mayor comunicación de forma verbal y directa con el investigador. Los casos restantes no se decantaban por ninguna en particular.
El promotor (n=17) comparte esta preferencia al establecer como vía principal de dispensación el servicio de farmacia (76,5%) ya que se considera que el farmacéutico de hospital es la persona con más experiencia en el manejo de la medicación. Otro porcentaje bastante menor (11,8%) prefería una dispensación a través del investigador al tener en cuenta que éste mantiene un trato directo con el paciente y por estimar adecuado el modelo secuencial de dispensación «farmacia-investigador-paciente».
A nivel práctico y en los servicios de farmacia que participaron en la encuesta (n=33), el paciente hacía una devolución directa del medicamento al servicio de farmacia y de forma absoluta en un 15,2% y «a veces» en un 30,3%.
La respuesta mayoritaria por contra era la que exponía que no se hacía una dispensación directa al paciente (54,5%).
En cualquier caso, los datos recogidos (n=41) indicaban que el servicio de farmacia se ocupaba de registrar el balance de las muestras (87,8%), documentándose la cuantía de medicación devuelta, para asegurar el buen control de la misma.
Puede ocurrir que una vez recibidas las muestras en el servicio de farmacia se detecte una inmovilidad prolongada de las mismas.
A este respecto hemos analizado la actuación del farmacéutico (n=40), observándose que no en todos los servicios de farmacia se realizaba este seguimiento (aunque sí en la mayoría, ya que se hacía en un 62,5%). El procedimiento seguido para ello (n=25) era a través de una consulta con el investigador (54,5%), con el promotor (18,2%) o con el Comité de Ensayos Clínicos (18,2%).
Pensamos que podía haber una relación entre los centros que realizaban un seguimiento de los ensayos clínicos y la media de los ensayos por centro, lo que nos llevaría a pensar que aquellos con mayor volumen de ensayos (más de 15 al año) no podrían realizar este seguimiento. Sin embargo la prueba Kruskall-wallis (distribución no normal) resultó ser estadísticamente no significativa (p>0,05).
En aquellos servicios de farmacia en los que no siempre se analizaban las causas de la inmovilidad (25%), se argumentó o sobrecarga de trabajo o que se limitaban a informar al investigador para que él determinase la acción a realizar. Por ello, en cualquier caso, era el investigador el responsable de la toma de la decisión final.
Control de caducidad
Nuestros datos (n=36) revelan que en un 85,7% de los servicios de farmacia encuestados, este control se hacía de forma exhaustiva. De los anteriores, en un 89,6% de los casos el control consistía en contactar con el investigador o el promotor en caso de caducidad del fármaco. De confirmarse verbalmente, las muestras eran apartadas y no se dispensaban (76,4%).
Si la confirmación de la caducidad del lote se hacía por escrito, se exigía un certificado de reanálisis en aproximadamente la mitad de los servicios de farmacia (44,8%), antes de proceder a la dispensación de la medicación.
Analizamos la relación entre el control de la caducidad de las muestras y los recursos disponibles en los servicios de farmacia, puesto que pensamos que a mayor dedicación a los ensayos clínicos, más efectivo sería el control de los farmacéuticos de hospital sobre la caducidad de las muestras. Para ello se aplicó la prueba de chi cuadrado, que resultó ser estadísticamente significativa (p=0,02) con un coeficiente de asociación v=0,43.
Hay una discrepancia con la opinión del promotor en cuanto a la asignación de responsabilidades ya que ellos alegaban ser los responsables absolutos del control de la caducidad en la totalidad de las respuestas. Sin embargo la n es lo suficientemente pequeña como para no permitir una comparación entre ambos grupos (n=6) que induzca a una clara respuesta.
Etiquetado
A consecuencia de la modificación de la fecha de caducidad, se debe proceder al reetiquetado de la medicación con la nueva fecha de caducidad.
En la legislación no está bien definido quién es el responsable del reetiquetado, aspecto que ya se refleja en las respuestas recogidas (n=42) desde los servicios de farmacia.
A efectos prácticos, los farmacéuticos de hospital se consideran responsables del proceso en un 30% de los casos. Algunos de ellos aceptaban la responsabilidad en función de la disponibilidad de tiempo, otros se consideraban como principal parte interesada, haciendo incluso que no se dispensaran las muestras hasta la solución del problema.
De los que no se consideraban responsables, un 65% lo atribuían a otro personal del ensayo clínico de la siguiente forma:
-- Un 32,5% atribuye la responsabilidad exclusivamente al promotor.
-- Un 5% consideraron que se trataba de una responsabilidad compartida entre el promotor y el servicio de farmacia.
-- Un 27,5% no concretó esta respuesta.
No contestaron un 5% de los encuestados.
El promotor coincide con el farmacéutico de hospital en ser el responsable de todo el proceso (71,4%), aunque esta respuesta no es muy valorable por el tamaño de la muestra (n=7).
Implicación del farmacéutico de hospitalen la finalización del ensayo clínico
Una vez que los pacientes han completado el ensayo y se han resuelto todas las aclaraciones de los datos, se procede al cierre oficial del ensayo clínico.
En general, los farmacéuticos de hospital (n=40) afirman ser informados de la finalización del ensayo clínico (55%). De acuerdo con los datos de la encuesta, la comunicación del final del ensayo procede en un 32,5% del investigador, un 7,5% del promotor y por ambos conjuntamente en un 15%.
Del resto de las respuestas se recoge que no se informaba del cierre en un 40% de los casos y un 5% no respondieron. Por ello se debe mejorar la comunicación entre el servicio de farmacia y el promotor.
Recursos destinados a los ensayos clínicosen el servicio de farmacia
Un 48,7% de los centros respondieron que dedicaban parcialmente una persona y otro porcentaje equivalente dedicaban más de una. Al no estar delimitada esta parcialidad no podemos establecer los recursos destinados por los servicios de farmacia a los ensayos clínicos.
De todos los centros que respondieron (n=42) sólo un centro con una media anual de 70 ensayos clínicos disponía de una persona completamente dedicada a la investigación clínica.
Las respuestas a los cuestionarios (n=39) mostraron que, además de que no existía una clara asignación de los recursos a los ensayos clínicos, sólo la mitad (47,4%) de los centros invertía tiempo y dinero en la formación del personal en materia de investigación clínica. En el resto de las respuestas (42%), las personas que en algún momento estaban involucradas en los ensayos clínicos se declaraban autodidactas.
Otros de los recursos imprescindibles para la realización del ensayo clínico son los recursos financieros. En los cuestionarios de los servicios de farmacia (n=39), se recibieron distintas respuestas con los mismos comentarios al respecto. Hay centros que respondían que sí recibían algún tipo de financiación del hospital (17,9%), mientras que la mayoría de los centros contestaban que no recibían ningún pago (82,1%). Estos últimos entendían como tal a aquel que realizaba el promotor directamente al sevicio de farmacia y no a través del hospital.
De esta forma se descartaba como un posible pago el procedente del promotor al centro, que cubre tantos gastos como recursos extraordinarios para el estudio, entre los que podrían estar incluidos los costes derivados del servicio de farmacia si realmente se producen.
Los comentarios que se adjuntaban con la respuesta negativa demostraban el descontento del personal del servicio de farmacia. Por ejemplo es de destacar el «sin comentarios», que indirectamente daba a entender que era algo muy discutido por el farmacéutico y al final no tenido en cuenta.
Esta actitud quedaba corroborada con el comentario que hacía referencia a la realización de pagos «esporádicos», señalándose en un centro que el pago sólo se había dado una vez. En la parte contraria, el promotor tenía en cuenta si la participación del servicio de farmacia requería un trabajo extraordinario (fuera de la práctica habitual) o no (tabla 3), para proceder a una remuneración económica.
Tabla 3. Financiación de la industria farmacéutica a los servicios de farmacia en los ensayos clínicos (n=7) | ||
| Tipo de remuneración | Respuesta (%) | Comentarios |
| Como trabajo adicional | 29,4 | Proporcional al trabajo desarrollado |
| Independiente del pago al investigador | 23,5 | Su participación es menor que la del investigador |
| Previa solicitud | 17,7 | |
| Nunca | 29,4 | Es su función habitual |
Cuestionario de opinión acerca del funcionamiento de los servicios de farmacia
Para hacer una valoración a este respecto se contrastaron las respuestas del promotor con las del farmacéutico de hospital, resultando que los promotores (n=17) en un 58,8% de los casos no podían establecer un modelo de funcionamiento común a todos los servicios de farmacia porque éste difería enormemente de unos centros a otros. Las otras respuestas recogidas (n=40) se decantaban a favor de un buen funcionamiento (29,4%) frente a un 11,8% que lo consideraban mejorable.
En cualquiera de los casos los farmacéuticos de hospital implicados en la realización de los ensayos clínicos, opinaban mayoritariamente (92,5%) que su participación en los ensayos clínicos era beneficiosa. Entre las razones expuestas se citaban un mejor seguimiento del ensayo clínico (16%) y el mejor control de las muestras (28%).
DISCUSIÓN
Aunque se obtuvo una tasa de respuesta por debajo de lo deseable en la cumplimentación de los cuestionarios, coincide con la obtenida en encuestas de metodología similar, oscilando entre un 37% y un 68% (9, 12).
Como contrapartida, tanto los servicios de farmacia como las compañías que han respondido a nuestra encuesta poseen una notable experiencia en materia de ensayos clínicos, como se deduce del número de ensayos clínicos anuales realizados (figura 1).
El nivel de actividad investigadora tiene un impacto considerable en la dinámica general del servicio de farmacia (25), al representar un factor de expansión y de diferenciación de relevancia (12).
Tradicionalmente, el farmacéutico de hospital ha demostrado una mayor motivación que el farmacéutico de oficina de farmacia en el campo de la investigación clínica (26), adoptando una actitud orientada a la búsqueda de nuevos campos de actuación y yendo mucho más allá del papel tradicional asignado, basado en la dispensación y manejo de material clínico (27-29).
Pero lo más importante es que la expansión de las funciones del farmacéutico de hospital detalladas en los resultados de este trabajo y en concordancia con lo descrito en la literatura (26, 27, 30-33) no sólo va a favorecer al medio hospitalario, sino también a la industria farmacéutica, y se acepta que al involucrar al farmacéutico de hospital tanto en el diseño como en la ejecución de los ensayos clínicos, estos mejoran en cuanto a éxito y seguridad (34).
Si consideramos su participación en las primeras fases del ensayo, y en particular su desarrollo profesional en el campo de los ensayos, su función como investigador principal es una modalidad relativamente reciente, pues no estaba contemplada inicialmente por la legislación (3). Esta baja participación puede explicarse por varios motivos como la falta de recursos (26, 31), o a que la selección es llevada a cabo generalmente por la industria farmacéutica como promotor de ensayos clínicos (12).
Por ello, si los promotores de ensayos clínicos no están convencidos de la idoneidad del farmacéutico de hospital en su papel de investigador principal, difícilmente podrán requerirlos para desarrollar esta función. En este sentido es posible pensar que actualmente la industria farmacéutica no está suficientemente mentalizada de algunas funciones a desempeñar por los farmacéuticos de hospital en la realización de un ensayo clínico.
A pesar de estos resultados, un artículo publicado en 1988 (35) señalaba que los farmacéuticos de hospital entrenados en la investigación y con experiencia estaban capacitados para participar en todas las fases del proceso del desarrollo de un fármaco ya fuera a nivel de colaborador o incluso a un nivel superior.
El conocimiento del arsenal terapéutico, así como de la dinámica y necesidades de las diversas unidades del hospital, debido a la continua interacción mantenida con ellas, pone al farmacéutico de hospital en una posición privilegiada y por tanto, muy adecuada para aportar conocimientos clave a la hora de diseñar, desarrollar, revisar o colaborar en la elaboración del protocolo (30).
A través de los resultados recogidos en las encuestas, se pone de manifiesto una incoherencia en la actitud de la industria farmacéutica como promotor, al insistir en la participación del farmacéutico de hospital para la valoración de los protocolos, cuando no los consideran relevantes en la elaboración de los mismos. El promotor va más allá, al especificar además que esta valoración debería estar orientada a aspectos relacionados con el fármaco, pudiendo sugerir una cierta desconfianza en la capacidad del farmacéutico de hospital para evaluar la totalidad del ensayo clínico, quizá porque en algunos casos no se han obtenido los resultados esperados (9).
Pensamos que se trata igualmente de una falta de visión estratégica, dado que el farmacéutico de hospital viene a ser un miembro cada vez más importante del Comité Ético de Investigación Clínica (4), cuya participación queda confirmada a través de los cuestionarios de los servicios de farmacia.
Por tanto, creemos que si contamos con su aportación en el diseño del protocolo, se podrían evitar aclaraciones en el momento de su evaluación y que podrían trascender en el dictamen final para obtener la autorización del Comité Ético de Investigación Clínica, contribuyendo a reducir los tiempos.
Algunos problemas que surgen a lo largo del ensayo se pueden deber a fallos de comunicación o del espíritu de equipo que podrían haberse solucionado desde un principio (36). Por ello se debe procurar mantener buenas relaciones a lo largo del proyecto, ya que la falta de rigurosidad a la hora de mantener acuerdos por cualquiera de las partes (37), pueden crear situaciones límite que pueden dar finalmente al traste con el estudio.
La recepción de las muestras por el farmacéutico de hospital (8, 12, 26, 30), y su almacenamiento en un lugar específico redunda en una mejora del funcionamiento del servicio de farmacia, puesto que al estar separadas se evitan confusiones con la dispensación de la medicación habitual y se alerta al mismo tiempo acerca del uso de las muestras para ensayos clínicos y de su dispensación.
Siguiendo con la dinámica del ensayo, una de las principales responsabilidades del farmacéutico de hospital es la dispensación de la medicación (26). Los ensayos clínicos requieren una documentación exhaustiva y específica, lo que conlleva a un esfuerzo suplementario, a añadir a la rutina diaria del servicio de farmacia. Algunos autores piensan que esta dedicación equivale a la tercera parte de un puesto de trabajo a tiempo completo (12), mientras que otros han estimado que podría estar en torno a las 90 horas por ensayo (38).
Nuestros resultados muestran que, en más de la mitad de los centros, el farmacéutico prefiere dispensar la medicación directamente al paciente. Esto demuestra el afán del farmacéutico por involucrarse más activamente en la investigación clínica, ya que esta dispensación requiere más trabajo y más responsabilidad que la que se hace al investigar directamente. Bien a través del investigador o bien directamente al paciente, creemos que el control de la dispensación se debe apoyar en un registro correcto, para así garantizar la máxima seguridad del paciente y del ensayo, según dictan las normas de Buena Práctica Clínica (4, 5, 12, 30, 39).
Como parte de este proceso de control, se debe aclarar desde un principio quién es el responsable del reetiquetado de las muestras en caso necesario, ya que un reetiquetado tardío puede derivar en una interrupción o mal desarrollo del ensayo, pudiendo conducir a una suspensión de la medicación sin consulta previa por parte de los pacientes.
De acuerdo con lo obtenido en nuestra encuesta, se pone de manifiesto que el farmacéutico de hospital se ocupa en profundidad de esta parte del trabajo, no conformándose con el mero trámite. Antes de dispensar un fármaco caducado y para evitar confusiones al paciente, exige por escrito un reanálisis, la confirmación de la extensión de la caducidad de la medicación y el correcto reetiquetado.
Según nuestros resultados, una vez que las muestras se devuelven al servicio de farmacia, en la mayoría de los casos se podría decir que el promotor no lleva un control exhaustivo del medicamento del ensayo clínico. Este aspecto es importante, ya que sobre el promotor recae la responsabilidad de recoger y destruir la medicación sobrante. Sin embargo, no podemos olvidar que en bastante casos la medicación queda en poder del investigador y por lo tanto, fuera del control del servicio de farmacia.
Aunque no podemos llegar a una clara evidencia con las respuestas recogidas, la información obtenida de los cuestionarios de los servicios de farmacia deja entrever la necesidad de un mayor acercamiento entre el promotor y el farmacéutico de hospital responsable de los ensayos clínicos.
Dentro de esta vía de comunicación, la finalización del ensayo clínico es informada con una pequeña mayoría que tiene su lógica, ya que los servicios de farmacia desarrollan una labor cada vez más importante en el estudio clínico, facilitando la comunicación entre los miembros que participan en el mismo.
Por otra parte, el servicio de farmacia debería ser informado del final del estudio para proceder a la devolución o destrucción de las muestras del ensayo y tener un registro del movimiento de las mismas.
Hemos observado una amplia variación en la respuesta de unos servicios de farmacia a otros en cuanto al tiempo transcurrido desde la visita de cierre hasta que el servicio de farmacia recibía la correspondiente notificación, por lo que no parece que el promotor tenga unos procedimientos homogéneos en este aspecto.
En general, se debe aumentar la vía de comunicación entre todas las partes implicadas, principalmente la cadena farmacéutico-promotor-investigador, profundizándose en el manejo y control de las muestras.
Es muy importante por parte de los promotores conocer antes de que comience el estudio los recursos con los que cuentan los servicios de farmacia para poner en marcha un proyecto, ya que un control deficiente sobre el mismo puede comprometer el desarrrollo correcto del ensayo. Por ello, se debería contar con el farmacéutico de hospital para analizar de forma precisa y realista las necesidades del estudio en cuanto a recursos se refiere (38), lo que contribuirá a la reducción de la carga asistencial para el resto del personal implicado.
No podemos olvidar, por el impacto que produce sobre el desarrollo del ensayo, los aspectos relativos a la financiación de los servicios de farmacia (26), que es hoy en día un tema de gran controversia entre las partes implicadas. Ya en 1986, el Dr. Foster analizando los diferentes aspectos derivados de la participación del farmacéutico de hospital en los ensayos clínicos, indicaba que muchos de los problemas que surgen como consecuencia de esta actividad podrían ser solventados con una adecuada remuneración económica (40). En la actualidad, los ensayos clínicos se rigen por un contrato económico firmado entre el promotor y el centro. Sin dicho contrato no es posible la autorización del ensayo, según marca el Real Decreto 561/1993 de 16 de abril (17).
A nuestro entender, la filosofía del cambio respecto a la situación anterior es la mejora del control de los recursos por parte de los centros de investigación, distribuyéndolos en el centro hospitalario con el fin de potenciar y facilitar la investigación clínica sin ánimo de lucro en los centros hospitalarios. Sin embargo en las respuestas recogidas se pone de manifiesto la actitud de cambio.
La financiación del ensayo clínico sigue siendo por lo tanto un tema de discrepancia entre el promotor, farmacéutico e investigador, que va evolucionando paralelamente con otros de los principales aspectos en la realización de los ensayos clínicos.
Queda abierta la posibilidad de una negociación directa del farmacéutico de hospital con el investigador, de forma que parte del pago que le hace el promotor sea recibido, si se considera oportuno, por el servicio de farmacia. El tema puede resultar algo complejo si no se maneja adecuadamente, ya que el no llegar a un acuerdo entre ambas partes, podría afectar las relaciones entre los implicados en el ensayo clínico.
En cualquier caso, parece ser que la participación viene limitada finalmente por la disponibilidad de recursos (31). Para optimizar al máximo los recursos de un ensayo clínico, los servicios de farmacia se deben de involucrar más y colaborar con las exigencias de la industria farmacéutica surgidas como consecuencia del cumplimiento de la normativa vigente. A cambio, la industria deberá hacer más partícipes a los farmacéuticos de hospital desde el inicio del ensayo clínico y apoyarlos con una remuneración económica, ya sea procedente del centro o del promotor directamente, proporcionalmente al trabajo que se vaya desarrollando.
Agradecimientos
A todos los farmacéuticos de los servicios de farmacia de hospital y a los profesionales de la industria farmacéutica que han colaborado en las encuestas aportando la información necesaria para llevar a cabo este trabajo.
A los compañeros de Zéneca que han facilitado la entrega y devolución de los cuestionarios.
BIBLIOGRAFÍA
1. Diario Médico. Recoletos Compañía Editorial, Madrid 25-5-94. Pág. XXVIII.
2. Farmatélex. N.° 201. 1 Nov 97. Pág. 16.
3. Ministerio de Sanidad y Consumo. Ensayos clínicos en España (1982-1988). Monografías técnicas, n.° 17. Madrid, 1990.
4. Idoate A, Giráldez J, Idoipe A y cols. Trials: aplicación informática para dispensación y control de medicamentos en fase de investigación clínica. Farm Hosp 1995;19:24-30.
5. Rothman JJ. Investigational Drug Services-A challenge and opportunity for pharmacists. J Pharm Pract 1996;9:420-36.
6. Bull JP. The historical development of clinical therapeutic trials. J Chron Dis 1959;10:218-48.
7. Montagne M. Issues in the design and conductor of clinical trials. Clin Res Practices & Drug Reg Affaire, 1985;3:23-44.
8. Idoate A, Giráldez J, Inaraja MT y ols. Ensayos clínicos y farmacéutico de hospital. Revista de la A.E.F.H. 1988;XII:59-70.
9. Idoate A, Giraldez J, Jimenez NV y cols. Participación actual del farmacéutico en los ensayos clínicos en España. Rev Soc Farm Hosp 1989;13:5-12.
10. Declaración de Helsinki: recomendaciones para orientar a los médicos en los trabajos de investigación biomédica con sujetos humanos. Adoptada por la 18.a Asamblea Médica Mundial (Tokio, Japón, octubre de 1975), por la 35.a Asamblea Médica Mundial (Venecia, Italia, octubre de 1983) y por la 41.a Asamblea Médica Mundial, Somerset West, República de Sudáfrica, octubre de 1996.
11. Organización Mundial de la Salud (International Conference on Harmonization of technical requirements for registration of pharmaceuticals for human use). Good Clinical Practice: Consolidated Guideline. Documento número E6GCPD12WP6. ICH Secretary. Ginebra, mayo 1996.
12. Cipywnyk DM. A survey of pharmacy-coordinated investigational drug services. Can J Hosp Pharm 1991; 44:183-8.
13. Piascik MM. Research and development of drugs and biologic entities. Am J Hosp Pharm, 1991; 48 supl 1. S4-S13.
14. Consejo de Europa. Convenio para la protección de los derechos humanos y la dignidad del ser humano con respecto a las aplicaciones de la biología y la medicina. En: Serie Monografías y documentos, n.o 1. Asociación de Bioética Fundamental y Clínica. Oviedo, 1997.
15. The Belmont Report: Ethical principles and Guidelines for the protection of human subjects. The National Commision for the protection of human subjects of biomedical and behavioural research. April, 18, 1979.
16. Ministerio de Sanidad y Consumo. Ley 25/1990 de 20 de diciembre del Medicamento. Boletín Oficial del Estado n.o 306; 22 de diciembre de 1990.
17. Ministerio de Sanidad y Consumo. Real Decreto 561/93 del 16 de abril por el que se establecen los requisitos para la realización de ensayos clínicos con medicamentos. Boletín Oficial del Estado n.o 114;13 de mayo de 1993.
18. Consejo de Europa. Directiva 91/507/CEE de la Comisión de 19 de julio de 1991 modificando el anexo a la directiva 75/318/CEE del Consejo sobre aproximación de la legislación de los estados miembros relativa a los aspectos y protocolos analíticos, farmacotóxicos y clínicos de los ensayos de productos medicinales. Diario Oficial de las Comunidades Europeas, número L270 de 26 de junio de 91.
19. Comisión de las Comunidades Europeas. Directrices sobre calidad, seguridad y eficacia de los medicamentos de uso humano. Normas sobre medicamentos de la Comunidad Europea-Volumen III (Addendum). Documento número III/9148/90-ES. Bruselas, julio de 1990.
20. Food and Drug Administration. Department of Heath, Education and Welfare. Clinical investigacions: Proposed establishment of regulations on obligations of sponsor and monitors. Fed Reg 1977; 42:49.612-30.
21. Food and Drug Administration. Department of Heath, Education and Welfare. Protection of human subjects: informed consent and standards for Institutional Review boards for Clinical investigators. Final Rules. Fed 1981;46:8.492-8.979. Fed Reg 1991; 56:28.025-9.
22. Food and Drug Administration. Department of Heath, Education and Welfare. New drugs, antibiotics and biologic drug product regulations. Final Rule. Fed Reg 1987;52:8.798-8.847.
23. Ministère des Affaires Sociales et de l''Emploi, Bonnes Practiques Cliniques. Avis aux promoteurs et aux investigateurs por les essais cliniques de médicaments. Paris: Bulletin Officiel n.o 87-32 bis, 1987.
24. Nordic Council on Medicines and Drug Regulatory Authorities of Denmark, Finland, Iceland, Norway and Sweden. Good Clinical Trial Practice, Nordic Guidelines. Stockolm, Dec 1989.
25. Rodilla F, Magraner J, Fuentes MD y cols. Ensayos clínicos y su repercusión en un servicio de farmacia hospitalaria. Farm Hosp 1994;18:249-54.
26. Eriksen IL, Andrew E. Pharmacist involvement in norwegian clinical drug trials: a questionnay study. Drug Intell Clin Pharm 1986;20:391-5.
27. Graves NM. The role of the pharmacist in investigational AED trials. Epilepsy Res 1993; Suppl 10:201-9.
28. Torud Y. The contribution of European pharmacists to drug research. Eur J Pharm Sci 1994;2:10-1.
29. Rothman JJ. Investigational Drug Services-A challenge and Opportunity for Pharmacists. J Pharm Pract 1996;9:420-36.
30. Gouveia WA. Regulatory Authority affecting american drug trials: role of the hospital pharmacist. Drug Inf J 1993;27:129-34.
31. Idoate A. Los ensayos clínicos después de la Ley del Medicamento. Noticias Farmacoterapéuticas 1993;4: 10-2.
32. Nahata MC. Clinical research by pharmacists. J Clin Pharm Ther 1991;16:145-7.
33. Knapp DA. Pharmacy practice in 2040. Am J Hosp Pharm 1992;49:2457-61.
34. Guidelines for the involvement of hospital pharmacy in the conduct of clinical trials. Pharm J, January 28, 1989.
35. York JM, Alexander JG, Barone JA y cols. The value of the clinical pharmacist in the drug development process. Clin. Research Practices & Drug Reg. Affairs. 1998;6:23-39.
36. Carlier A, Ghislain JC. Le point de vue du pharmacien hospitalier sur les lots d''experimentation clinique. Labo-Pharma. Probl. Tech. 1984;32:321-6.
37. Summerfelt A, Funderburk FR. Implementation of clinical trials: simple, but not easy. Drug Inf J 1987; 21:159- 64.
38. Idoate A, Ortega A, Carrera FJ y cols. Cost-evaluation model for clinical trials in a hospital pharmacy service. Pharm World Sci 1995;17:172-6.
39. Gagnon JP. The role of the pharmacists in a changing environment as seen from the pharmaceutical industry. Int Pharm J 1996;10:16.
40. Hospital Pharmacist Group. Clinical Trials and hospital pharmacy. Pharm J 1986 March 1.
CUESTIONARIO A COMPLETAR POR EL SERVICIO DE FARMACIA
HOSPITAL:
1. ¿Cuál es el promedio de ensayos clínicos que se realizan en el hospital?
2. El farmacéutico como miembro del Comité Ético de Investigación Clínica:
2.1. ¿Qué papel desempeña dentro del Comité Ético de Investigación Clínica?
2.2. ¿Está presente en todas las reuniones de dicho Comité?
[ ] Sí
[ ] No indicar % de asistencia ..........
2.3. ¿Recibe el protocolo previamente a la reunión para su posible estudio?
[ ] Sí .......... días de antelación
[ ] No
2.4. ¿Qué tiempo dedica al estudio de cada protocolo? .......... minutos
2.5. ¿En el estudio del protocolo considera exclusivamente lo relativo a la medicación del ensayo clínico en sí?
[ ] Sí
[ ] No
[ ] No, se hace revisión exhaustiva de todo el protocolo
3. Según la Ley del Medicamento, el farmacéutico puede actuar como investigador principal en ensayos clínicos en humanos, según esto:
3.1. Ha participado algún miembro del servicio de farmacia en los ensayos clínicos como investigador principal?
[ ] Sí n.o de ensayos clínicos ..........
[ ] No Causas
3.2. ¿Piensa que podría aportar dicha participación al desarrollo de la investigación algún beneficio?
[ ] Sí Especificar
[ ] No
4. La Ley del Medicamento obliga la entrega de las muestras en el servicio de farmacia
4.1. ¿Se comprueba que el ensayo clínico está autorizado por el Ministerio de Sanidad?
[ ] Sí
[ ] No
[ ] Otros
4.2. ¿Se reciben en el servicio de farmacia las muestras para la realización de los ensayos clínicos?
[ ] Siempre
[ ] Nunca
[ ] Depende del promotor
[ ] Otros
4.3. En caso de no recibirse, ¿se ocupa el servicio de farmacia de hacer un seguimiento de las mismas?
[ ] Sí
[ ] No
[ ] A veces Comentarios
4.4. ¿Existe un registro de los ensayos clínicos aprobados por el comité Ético de Investigación Clínica para que en un futuro se puedan reclamar aquellas muestras que no pasen por el servicio de farmacia?
[ ] Sí
[ ] No
4.5. ¿Se hace acuse de recibo por escrito de las muestras recibidas en el servicio de farmacia?
[ ] Sí
[ ] No
[ ] Otros
4.6. ¿En el caso de que se haga entrega de recibo, ¿se comprueba que lo indicado en el recibo coincide con la medicación entregada?
[ ] Sí
[ ] No
4.7. ¿Hay un impreso normalizado de recepción/dispensación de medicamentos para ensayos clínicos donde se refleje nombre del laboratorio, lote y fecha de caducidad, n.o de randomización...?
[ ] Sí
[ ] No
[ ] Otros
4.8. Cuando se reciben las muestras en el servicio de farmacia ¿se comprueba que el etiquetado cumple los requisitos marcados por la legislación?
[ ] Sí
[ ] No
Comentarios
4.9. C uando se comprueba que no los cumplen, ¿se devuelven las muestras?
[ ] Sí
[ ] No
[ ] Otros
4.10. ¿Se exige que se adjunten las referencias analíticas de las muestras que se van a entregar?
[ ] Sí
[ ] No
[ ] Otros
4.11. Cuando se hace entrega de las muestras, ¿se encarga el promotor de informar al servicio de farmacia de las condiciones de almacenamiento y conservación de las muestras?
[ ] Sí
[ ] No
Comentarios
4.12 ¿Existen condiciones de almacenamiento especiales para las muestras de ensayos clínicos?
[ ] Sí Especificar
[ ] No
Con respecto a la caducidad de las muestras:
4.13 ¿Hay un control exhaustivo por parte del servicio de farmacia?
[ ] Sí
[ ] No
4.14. ¿Contacta el servicio de farmacia con el investigador/promotor en el caso de que las muestras estén caducadas?
[ ] Sí
[ ] No
[ ] Otros
4.15. ¿Se encarga el servicio de farmacia de hacer el reetiquetado en caso de extensión de la caducidad?
[ ] Sí
[ ] No Especificar responsable
Comentarios
4.16 ¿Se hace entrega de estas muestras si el promotor asegura verbalmente que se extiende la fecha de caducidad?
[ ] Sí
[ ] No
[ ] Otros
4.17. ¿Se pide un certificado de reanálisis que acredite la extensión de la nueva fecha?
[ ] Sí
[ ] No
[ ] Otros
5. Cuando se va a dispensar la medicación del ensayo clínico:
5.1. Si se dispensa al investigador directamente, ¿se hace contra petición escrita?
[ ] Sí, mediante una prescripción especial para ensayos clínicos
[ ] Sí, pero no es necesaria una prescripción especial
[ ] No, se le da al investigador en mano para evitar errores pero no se exige petición escrita
[ ] Otros
Contestar únicamente a las preguntas 5.2 y 5.6 (enmarcado con raya continua) cuando en alguna ocasión se dispense la medicación del ensayo clínico directamente al paciente
5.2. ¿Se informa al paciente de la medicación que va a recibir (medicación concomitante que puede tomar, forma de administración, dosificación...)?
[ ] Sí
[ ] No
Comentarios
5.3. ¿Se le informa de posibles reacciones adversas?
[ ] Sí
[ ] No
Comentarios
5.4. ¿Se comprueba con el protocolo que lo prescrito por el investigador es correcto?
[ ] Sí
[ ] No
[ ] Otros
5.5. Si hay cambios en las dosis prescritas inicialmente (dentro de lo que marca el protocolo) ¿se pregunta la causa de ello?
[ ] Sí
[ ] No
[ ] No siempre
Comentarios
5.6. Usted como farmacéutico, ¿a quién prefiere dispensar la medicación?
[ ] Al investigador del ensayo clínico
[ ] Al paciente
¿Por qué?
6. La devolución de la medicación del ensayo clínico:
6.1. ¿La hace el paciente directamente al servicio de farmacia?
[ ] Sí
[ ] No
[ ] Algunas veces
Comentarios
6.2. ¿Se informa al investigador del cumplimiento en la toma de medicación por parte del paciente?
[ ] Sí
[ ] No
[ ] Otros
6.3. ¿Se comprueba con el paciente la falta/exceso de cumplimiento?
[ ] Sí
[ ] No
[ ] Otros
6.4. Si la medicación devuelta se encuentra en el servicio de farmacia ¿qué control lleva de ella el promotor del estudio?
[ ] Lleva un control regular mientras dura el ensayo clínico
[ ] En muy raras ocasiones
[ ] Al inicio y al final del ensayo clínico
[ ] El promotor contacta al investigador y éste con el servicio de farmacia
[ ] Otros
6.5. ¿Se registra el balance de las muestras recibidas y dispensadas?
[ ] Sí
[ ] No
6.6. ¿Se documenta la cantidad de medicación devuelta por el paciente?
[ ] Sí
[ ] No
6.7. Cuando no hay movimiento de las muestras del ensayo clínico ¿se encarga el servicio de farmacia de analizar las causas de dicha inmovilidad?
[ ] Sí
[ ] No
[ ] No siempre
Comentarios
7. Cuando se va a proceder al cierre del ensayo clínico:
7.1. ¿Se notifica al servicio de farmacia de la finalización/cancelación de un ensayo clínico?
[ ] Sí ¿a través de quién?
[ ] No
7.2. ¿Qué tiempo transcurre desde que se tiene conocimiento del cierre del ensayo clínico hasta que se retira la medicación? .......... días
Comentarios
8. Las claves de randomización
8.1. ¿Se entregan en el servicio de farmacia y se guardan aquí hasta la finalización del ensayo clínico?
[ ] Sí, siempre
[ ] Sí, la mayoría de las veces
[ ] No, están en poder del investigador y el servicio de farmacia tiene acceso a ellas
[ ] No, al servicio de farmacia no se le informa de la existencia de las claves de randomización
8.2. En el caso de que sea el servicio de farmacia el que posea las claves de randomización y el responsable no se encuentre presente, ¿puede el investigador/es acceder en caso de urgencia a dichas claves?
[ ] Sí
[ ] No Explicar el proceso
9. ¿Existe algún tipo de financiación para el servicio de farmacia cuando se encarga de llevar a cabo un ensayo clínico?
[ ] Sí
[ ] No
Comentarios
10. Con referencia a los recursos con los que cuenta el servicio de farmacia para la realización del ensayo clínico:
10.1. Cuántas personas se dedican parcialmente a los ensayos clínicos?
[ ] Una
[ ] Más de una
[ ] Otros
10.2. ¿Hay una formación especial para el que se va a responsabilizar del ensayo clínico?
[ ] Sí, se le prepara e informa de sus funciones así como de lo que exige la legislación española
[ ] No, lo que se conoce de los ensayos clínicos es lo que se aprende con la práctica y en el período de residencia
[ ] Otros
11. ¿Podría señalar en cuál de estas funciones ha participado el servicio de farmacia y en qué medida? (indicar % del total de los ensayos clínicos en los que ha participado el servicio de farmacia)
[ ] Elaboración de placebos .......... %
[ ] Elaboración de formas farmacéuticas .......... %
[ ] Asignación aleatoria al tratamiento .......... %
[ ] Información al paciente .......... %
[ ] Seguimiento y recogida de datos clínicos .......... %
[ ] Registro y evaluación de reacciones adversas .......... %
[ ] Coautor de los resultados de los ensayos clínicos .......... %
[ ] Divulgación de los resultados del ensayo clínico en el hospital .......... %
12. ¿Cree usted que es beneficiosa la participación del servicio de farmacia en el desarrollo de los ensayos clínicos?
[ ] Sí
[ ] No
Indicar las razones
13. ¿Considera que el nivel de participación del servicio de farmacia en la realización de los ensayos clínicos va aumentando con el tiempo?
[ ] Sí
[ ] No
Comentarios
CUESTIONARIO PARA LA INDUSTRIA FARMACÉUTICA
1. Actualmente desempeño el cargo de
2. ¿Cuál es el promedio anual de ensayos clínicos que se ponen en marcha en su empresa?
3. Cuando va a comenzar el ensayo clínico, se hace entrega en el servicio de farmacia de:
-- Rellenen cada casilla:
1. Si se hace siempre
2. Si no se entrega nunca
3. En el caso de que se entregue a veces
* Protocolo
* Aprobación de Sanidad
* Medicación que va a ser dispensada en el estudio
* Códigos cerrados
4. ¿Se les ha propuesto alguna vez a los servicios de farmacia su participación en temas como
-- Señalar lo que proceda:
* El diseño de los ensayos clínicos
* Farmacocinética del producto a ensayar o del comparativo
* Formulación farmacéutica
* Dosificación del producto a ensayar
* Posibles comparativos a introducir en el estudio
* Otros
5. ¿Vd. como promotor, da una explicación detallada en los servicios de farmacia de cómo se va a organizar el ensayo clínico?
* Sí, siempre que se trate de temas que incumban al servicio de farmacia
* No, ya se ha explicado todo lo necesario al investigador
* Sólo cuando el servicio de farmacia muestra interés en el tema
* Otros
6. En los casos que el servicio de farmacia participa activamente en la dispensación/devolución de la medicación, ¿con qué regularidad visita el monitor de ensayos clínicos (promotor) los servicios de farmacia?
* Al inicio y al final del ensayo clínico para la entrega y recogida de la medicación
* En cada visita de monitorización para comprobar la dispensación/devolución de la medicación
* Cuando sea necesario para posibles aclaraciones/anomalías
7. En cuanto a la caducidad de los medicamentos, ¿hace el promotor un seguimiento exhaustivo de ello?
* Sí, se toman las medidas oportunas (reanálisis, nueva medicación...) en el caso que corresponda
* No, puesto que es responsabilidad del servicio de farmacia
* Sí, si se tiene en cuenta y se intenta solucionar siempre que se pueda
* Otros
7.1. Si es necesario hacer un reetiquetado de la medicación aportando una nueva fecha de caducidad
¿Quién se encarga de ello?
TENIENDO EN CUENTA SU OPINION Y EXPERIENCIA EN ENSAYOS CLINICOS:
8. Un miembro del servicio de farmacia ha de estar siempre presente en las reuniones de los Comités Éticos de Investigación Clínica. ¿Cree su presencia necesaria a la hora de evaluar un protocolo?
* Sí
* No
¿Por qué?
8.1. En caso afirmativo, ¿cuáles de los siguientes conocimientos deberían de ser evaluados por un farmacéutico específicamente?
* Formulación farmacéutica
* Dosificación
* Farmacología clínica
* Evaluación de los riesgos considerando datos previos en animales y humanos
* Estudios de toxicidad
* Otros
9. ¿Considera importante la participación de los servicios de farmacia en los ensayos clínicos
a) desde la preparación del protocolo?
* Sí
* No
* Indiferente
¿Por qué?
b) ¿Considera asimismo importante la participación de los servicios de farmacia en la entrega de la medicación de los ensayos clínicos?
* Sí
* No
* Indiferente
¿Por qué?
10. Considerando las posibles diferencias entre unos servicios de farmacia y otros, y siempre que le fuera posible elegir, ¿a quién preferiría dejar la medicación para su posterior dispensación al paciente?
* A la persona encargada en el servicio de farmacia
* Al investigador responsable del ensayo clínico
* Otros ¿Por qué?
11. Consideraría adecuado algún tipo de remuneración económica para los servicios de farmacia que participan en los ensayos clínicos?
* No, es parte de su función
* Sí, proporcionalmente a lo que se paga en el ensayo clínico
* Sí, pero sólo en el caso de que lo soliciten (ayudas a congresos, material para el servicio de farmacia, pago en metálico...)
* Otros
12. ¿Cuál es su opinión personal sobre el funcionamiento de los servicios de farmacia actuales en general?