ORIGINALES
METODOLOGIA BASADA EN LA EVIDENCIA CIENTIFICA: APLICACION EN LA ELABORACION DE UN PROTOCOLO DEL TRATAMIENTO EMPIRICO DE LA FIEBRE EN PACIENTES NEUTROPÉNICAS GINECOLOGICAS
García Pellicer J.,Licenciado en Farmacia. Farmacéutico especialista en Farmacia Hospitalaria.Planells Herrero C.,Doctora en Farmacia. Farmacéutica especialista en Farmacia Hospitalaria.Escrivá Muñoz J. J., Doctor en Farmacia. Jefe de Sección.
Servicio de Farmacia. Hospital Universitari La Fe Valencia.
Correspondencia: Javier García Pellicer. Servicio de Farmacia. Hospital Universitari «La Fe». Avda. Campanar, 21. 46009 Valencia
Fecha de recepción: 14-07-98
Palabras clave:
Neutropenia febril. Terapia empírica. Oncología ginecológica. Medicina basada en la evidencia. Cefepima.
Resumen:
Introducción: La variabilidad en la práctica clínica y la utilización de recursos cuando la eficiencia entre las distintas alternativas terapéuticas no ha sido establecida han motivado el auge actual de la medicina basada en la evidencia científica. La administración empírica de antibióticos de amplio espectro en pacientes con neutropenia febril es una práctica necesaria. Un número elevado de estos episodios febriles es debido a infecciones susceptibles de ser tratadas con terapia antibiótica, que en caso de no hacerse, progresan rápidamente hacia un desenlace fatal en los pacientes neutropénicos.
Objetivo: El objetivo de este estudio es desarrollar una metodología que permita establecer criterios definidos para detrminar los niveles de evidencia científica de los estudios y de este modo realizar un protocolo para el tratamiento de la fiebre en pacientes neutropénicas, según la sensibilidad local a antibióticos y las características propias de las pacientes oncológicas ginecológicas.
Método: Se determina el perfil microbiológico local de resistencias y las características de los pacientes de la unidad de oncología ginecológica. Se desarrolla la metodología aplicada para la evaluación de la evidencia científica de los estudios clínicos sobre terapia empírica a través de la aplicación de una escala definida a los parámetros: espectro antibacteriano, efectos adversos, criterios de respuesta a terapia empírca (EORTC, IHS y Pizzo), eficacia clínica y calidad de la evidencia cintífica del estudio. Por último, se realiza un análisis farmacoeconómico sobre las terapias empíricas mejor situadas.
Resultados: Las infecciones por Gram() predominan frente a las Gram(+), 75 % frente al 25 % siendo el agente causal más frecuente Eschericia Coli. La terapia empírica basada en la evidencia, con máxima puntuación y más coste-efectiva ha sido la monoterapia con cefepima (2g/8 h). En el caso de pacientes con hipersensibilidad a ß-lactámicos la pauta elegida es aztreonam (2g/8 h) y vancomicina (500 mg/6 h). En ambos casos, si a los siete días no hay mejora clínica se añade anfotericina B.
Conclusiones: La metodología descrita ha permitido valorar y definir los criterios para determinar los valores de evidencia científica de los estudios, de modo que las recomendaciones finales del protocolo garantizan que el tratamiento aplicado a las pacientes ginecológicas con neutropenia febril es el más eficaz, seguro y coste-efectivo.
EVIDENCE-BASED MEDICINE: APPLICATION IN THE DEVELOPMENT OF A PROTOCOL FOR EMPIRICAL TREATMENT OF FEVER IN NEUTROPENIC GYNECOLOGICAL PATIENTS
Key words:
Febrile neutropenia. Empirical treatment. Gynecological oncology. Evidence-based medicine. Cefepime.
Summary:
Introduction: The variability of clinical practice and resource use when the relative effectiveness of therapeutic alternatives has not been established has lead to the current popularity of evidence-based medicine. The empirical administration of broad-spectrum antibiotics to patients with febrile neutropenia is necessary. Many of these febrile episodes are due to infections susceptible to antibiotic treatment; such infections, if left untreated, can progress rapidly to death in neutropenic patients.
Objective: The purpose of this study was to develop methods for establishing firm criteria for evaluating the scientific evidence of studies and designing a protocol for treating fever in neutropenic patients in accordance with antibiotic sensitivity and the characteristics of gynecological oncological patients.
Method: The microbiological resistante profile and characteristics of patients in a gynecological oncology unit were determined. A method was developed for evaluating the scientific evidence of clinical studies of empirical therapy by applying a scale to the following parameters: antibacterial spectrum, adverse effects, criteria por response to empirical therapy (EORTC, INS and Pizzo), clinical efficacy, and quality of the study''s scientific evidence. A pharmacoeconomic analysis was made of the most promising empirical therapies.
Results: Gram() infections predominated over Gram(+) infections by 75 % to 25 %. The most frequent causal agent was Escherichia coli. The evidence-based empirical therapy that achieved the highest score and was most cost-effective was cefepime monotherapy (2 g/8 h). In patients with ß-lactam sensitivity, alternative treatments were aztreonam (2 g/8 h) and vancomycin (500 mg/6 h). In both cases, if no clinical improvement is apparent within 7 days, amphotericin B is added.
Conclusions: The method described allowed the assessment and definition of criteria for determining the level of scientific evidence of the studies. Therefore, the final recommendation of the protocol guarantee that the treatment of gynecological patients with febrile neutropenia will be effective, safe and cost-effective.
INTRODUCCION
La variabilidad en la práctica clínica y la utilización de recursos cuando la eficiencia entre distintas alternativas terapéuticas no ha sido establecida han motivado el auge actual de la medicina basada en la evidencia científica. Como evolución natural del sistema farmacoterapéutico, los servicios de farmacia de hospital pueden participar en la optimización de recursos terapéuticos impulsando la realización de protocolos para, de este modo, influir en las etapas iniciales del sistema: la toma de decisiones en la prescripción (1).
La administración empírica de antibióticos de amplio espectro en pacientes con neutropenia febril es una práctica necesaria debido a que las pruebas diagnósticas disponibles en la actualidad no son lo suficientemente rápidas, sensibles o específicas para determinar o excluir el origen bacteriano de un episodio febril (2, 3). Un número elevado de estos episodios febriles es debido a infecciones susceptibles de ser tratadas con terapia antibiótica, que en caso de no hacerse, progresan rápidamente hacia un desenlace fatal en los pacientes neutropénicos. De hecho, la infección, tal como se recoge en la tabla 1, es la principal causa de mortalidad en este grupo de pacientes.
Tabla 1. Causas de muerte en pacientes neutropénicos | |
| Complicación | % de pacientes |
| Infección | 35 |
| Hemorragia | 27 |
| Progresión del cáncer | 18 |
| Varios: insuficiencia renal, infarto de miocardio, edema agudo de pulmón, etc. | 20 |
Sin embargo, aunque la terapia antimicrobiana empírica es necesaria, la prescripción inapropiada de antibióticos, es un asunto delicado ya que el excesivo uso de dichos medicamentos puede estar asociado a colonizaciones por agentes adquiridos en el hospital, aparición de cepas resistentes y efectos adversos, así como costes innecesarios (2). Por otro lado, la ausencia o la incorrecta instauración de una rápida terapia antibiótica produce graves resultados para el paciente. Así, por ejemplo, la tasa de mortalidad por septicemia debida a Pseudomonas aeruginosa en pacientes neutropénicos que no reciben un adecuado tratamiento es del 50 %. También está descrito que la tasa de curación con una terapia adecuada desciende aproximadamente de un 75-80 % a menos de un 50 % cuando ésta no se inicia de forma rápida (4). Es por ello que la terapia empírica debe instaurarse lo más rápidamente posible y con una cobertura antimicrobiana adecuada.
Las definiciones de fiebre y neutropenia pueden variar ligeramente entre diferentes autores. Generalmente, una temperatura oral única superior o igual a 38,3 oC, en ausencia de causas ambientales obvias, se considera fiebre. Además de esta definición, una temperatura superior o igual a 38 oC durante al menos una hora, o tres picos de temperatura superior o igual a 38 oC en 24 horas, también indican un estado febril (2-4). La neutropenia se considera como un recuento de leucocitos polimorfonucleares menor de 1.000/mm3. El diagnóstico de una infección en un paciente neutropénico puede ser debido a que los síntomas clásicos de infección (ejemplo: enrojecimiento, hinchazón, dolor, calor) están ausentes debido a la ausencia de neutrófilos. De hecho, en la mayoría de ocasiones, el único signo de infección es la fiebre. Esta situación se complica más aún debido a que la administración de hemoderivados o medicamentos, pueden provocar fiebre en el paciente neutropénico, así como la existencia de fiebre de origen desconocido. Esto implica con frecuencia que la terapia antibiótica se inicia sin una evidencia documentada de la infección (2, 3).
La aplicación de una terapia empírica con antibióticos de amplio espectro es una práctica bien aceptada. Las infecciones que tienen lugar en las primeras fases de la neutropenia (recuento de neutrófilos menor de 1.000/mm3) son predominantemente de origen bacteriano, y en muchas ocasiones, derivadas de la flora endógena de los pacientes. Por otro lado, en los últimos años se ha experimentado un gran aumento de infecciones por Gram(+) resistentes, debido, al menos en parte, al aumento en el uso de catéteres venosos centrales (5). En la actualidad, la infección está documentada aproximadamente en un 60 % (2, 6) de las neutropenias febriles. De estas, un 80 % de las infecciones documentadas por cultivo son debidas a bacterias Gram(+) o Gram() y el 20 % restante son cultivos positivos de agentes fúngicos, víricos o protozoarios.
Por otro lado, en los pacientes neutropénicos se observan incrementos cuantitativos en los porcentajes de infección en función del recuento de neutrófilos. Los pacientes con un recuento de neutrófilos de 500/mm3 tienen mayor riesgo de infección que aquellos con un recuento de 1.000/mm3. Así mismo, los que tienen un recuento de 100/mm3 presentan mayor riesgo que los que tienen 500/mm3. Además del número de neutrófilos circulantes, el ritmo de disminución en el número de neutrófilos, así como la duración de la neutropenia, también son factores importantes en el desarrollo de las infecciones. Los agentes causales más frecuentes (2, 5-7) se encuentran en la tabla 2.
Tabla 2. Agentes causales más frecuentes de infección en pacientes neutropénicas. | |
| Gram() | Gram(+) |
| Pseudomonas aeruginosa | Staph. Coagulasa (+): Staph. aureus |
| Eschericia Coli | Staph. Coagulasa (): Staph. epidermidis |
| Klebsiella sp. | Streptoc. pneumoniae |
| Streptoc. Pyogenes | |
| Streptoc. viridans | |
| Enterococcus faecalis | |
| Corynebacterium sp. | |
| Cocos y bacilos anaerobios | |
Fundamentos de la terapia empíricapara el tratamiento de la fiebreen pacientes neutropénicas
Existe un gran número de antibióticos disponibles en la actualidad que pueden ser utilizados para el tratamiento empírico de la neutropenia febril. Por ello se hace necesario tener en cuenta una serie de factores que nos permitan diferenciar entre ellos a la hora de determinar la terapia más adecuada. Los factores más importantes se muestran en la tabla 3. Básicamente, se consideran cinco esquemas generales de terapia empírica.
Tabla 3. Factores que influyen en la elección de agentes antimicrobianos | |
| Espectro antimicrobiano | Microflora local del hospital |
| Actividad bactericida | Patrón de resistencias del hospital |
| Capacidad de sinergia | Índice terapéutico |
| Características farmacocinéticas | Toxicidad/Seguridad |
| Eficacia en neutropenia | Coste relativo |
* Aminoglucósico más un ß-lactámico antipseudomonas: Son combinaciones de un aminoglucósido (gentamicina, tobramicina o amikacina) con una carboxi o ureidopenicilina (ticarcilina con o sin ácido clavulánico, azlocilina, mezlocilina o piperacilina), o un aminoglucósido junto con una cefalosporina antipseudomonas de tercera generación (cefoperazona, ceftazidima) (2, 3).
* Combinación de dos ß-lactámicos: Son combinaciones de cefalosporinas de tercera generación como ceftazidima o cefoperazona y una ureidopenicilina como piperacilina o mezlocilina.
* Monoterapia con un único antibiótico: En la actualidad es una pauta aceptada, incluyéndose como tratamiento de primera línea por la sociedad americana de enfermedades infecciosas (3), en este tipo de pacientes. Antibióticos ensayados en monoterapia son ceftazidima e imipenem/cilastatina y los más recientes cefepima y meropenem.
* Terapia de fluoroquinolonas: El uso de las quinolonas como monoterapia en el tratamiento empírico de la neutropenia febril se ha ensayado en diferentes estudios, con resultados dispares (8-10) y en la actualidad no se recomienda esta pauta (3). Asimismo, la terapia combinada de quinolonas con otros antibióticos ha sido estudiada de una forma limitada (11, 12) y los resultados no son concluyentes (3).
* Vancomicina junto con alguna de las pautas especificadas anteriormente, como terapia empírica inicial: La inclusión de vancomicina en la terapia empírica inicial tiene como objeto cubrir desde el principio a Staphylococus aureus meticilín resistente, Corynebacterium sp y Estreptococos beta-hemolíticos.
El objetivo de este estudio es desarrollar una metodología que permita establecer criterios definidos para determinar los niveles de evidencia científica de los estudios y de este modo realizar un protocolo para el tratamiento de la fiebre en pacientes neutropénicas, según la sensibilidad local a antibióticos y a las características propias de las pacientes oncológicas ginecológicas.
MÉTODO
Perfil microbiológico local de resistencias
Para conocer el perfil microbiológico local de la unidad de oncología-ginecológica, se solicitó al servicio de microbiología del hospital un listado con el resultado de todos los hemocultivos realizados en el último año, así como el patrón de sensibilidad-resistencia a antibióticos de la misma unidad, ya que para la selección de los antibióticos, un criterio excluyente es que los microorganismos responsables de la fiebre en las pacientes neutropénicas sean resistentes.
Características de las pacientes de la unidadde oncología ginecológica
Se caracterizan principalmente por ser pacientes que reciben o han recibido quimioterapia que suele incluir derivados del platino. Así, un factor limitante de la terapia empírica ha sido evitar la posibilidad de aumentar el riesgo de nefrotoxicidad, ya de por sí existente.
Metodología aplicada para la evaluaciónde la evidencia científica de los estudios clínicos sobre terapia empírica
Los artículos originales utilizados en la selección de la terapia empírica se han seleccionado tras la realización de una búsqueda bibliográfica de los últimos siete años en la base documental Medline utilizando las palabras claves neutropenia febril, cáncer y tratamiento empírico. Para valorar los niveles de evidencia científica de los estudios se han establecido unos parámetros a los cuales se les ha asignado una escala, elaborada por el personal facultativo del servicio, cuya intensidad oscila desde una validez máxima (++++) a mínima (+), en función de que cada parámetro cumpla con más o menos de los requisitos deseables para su valoración. Los parámetros se han agrupado en cuatro categorías:
Espectro antibacteriano
* Si cubre todos los microorganismos de la institución: ++++
* Si cubre todos los microorganismos menos uno: +++
* Si cubre todos los microorganismos menos dos: criterios de exclusión de la pauta antibiótica.
Efectos adversos
* Nefrotoxicidad: criterio de exclusión.
* Si son estudios comparativos:
No existe diferencias estadísticamente significativas: ++++
Si existen diferencias estadísticamente significativas: se aplica a cada pauta una escala dependiendo de la gravedad de los efectos adversos (graves: +, moderados: ++, leves: +++).
* Si son estudios no comparativos: se aplica la misma escala según la gravedad.
Criterios de respuesta a la terapia empírica
Se han considerado las definiciones descritas en la bibliografía y utilizadas por la mayoría de autores:
EORTC (European Organization Research and Treatment of Cancer). Exitos: resolución de la fiebre y signos clínicos de infección así como la erradicación de los microorganismos causales (si son aislados) sin interrupción del antibiótico asignado y sin añadir ningún otro antibiótico a los estudiados. La respuesta debe mantenerse al menos cuatro días después de suspender el tratamiento. Fracasos: muerte por la infección, persistencia de la bacteriemia después de 24 horas de inicio de la terapia, progresión de la bacteriemia, falta de respuesta a la terapia (definida como persistencia del patógeno y/o fiebre en paciente cuya condición clínica no mejora y requiere discontinuar el tratamiento o añadir otro antibiótico). La adición de un antivírico o antifúngico no se considera fracaso.
IHS (Immunocompromised Host Society). Éxitos: todos los signos, síntomas y evidencias microbiológicas de infección se han resuelto con la terapia inicial. No existe recurrencia de la infección al menos siete días tras el cese del tratamiento. Éxito con modificación de tratamiento: existe respuesta inicial, pero una segunda infección/fiebre se desarrolla y requiere de la adición de otro antimicrobiano (ej. antivíricos, antifúngicos). Fracaso: la adición, modificación o cambio del régimen inicial es necesario para erradicar la infección primaria; muerte causada por la infección. Sin respuesta (sólo aplicable a pacientes con fiebre de origen desconocida): la adición de un antimicrobiano no antibacteriano para una indicación específica o un agente antibacteriano debido a una nueva infección en un paciente con fiebre de origen desconocido.
Pizzo et al. Éxito: Resolución de la fiebre y cuadro clínico sin necesidad de modificar la pauta inicial ni añadir otro antibiótico. También se considera éxito, cuando existe curación pero se requiere una modificación del régimen inicial. Fracaso: muerte como resultado de infección documentada durante el episodio neutropénico.
La escala de valor que se ha aplicado otorga la puntuación según los criterios más o menos estrictos en la definición de éxito o fracaso: EORTC: ++++, IHS: +++, PIZZO: ++. Otros criterios se han agrupado en alguno de los anteriores. Cuando no se especifica la definición de éxitos o fracasos: +.
Eficacia clínica
* Estudios comparativos:
Si existen diferencias estadísticamente significativas: se asigna ++++ a la pauta de mayor eficacia.
No existen diferencias estadísticamente significativas: se asigna igual puntuación que los criterios utilizados.
* Estudios no comparativos: valor del criterio 1.
Calidad de la evidencia científica del estudio
* Resultados de estudios aleatorizados de diseño correcto y tamaño de muestra suficiente: ++++
* Diseño correcto, tamaño de muestra insuficiente: +++
* Estudios comparativos no aleatorizados: ++
* Simple relación de casos tratados sin comparación con controles: +
En el anexo 1 se muestra el protocolo de recogida de datos para la valoración de las pautas de terapia empírica aplicada en los artículos evaluados.
Análisis farmacoeconómico
Después de aplicar los criterios expuestos en la metodología anterior, para discriminar pautas con igual valor en cuanto a eficacia y seguridad, se realiza un análisis de minimización de costes.
RESULTADOS
Agentes causales y perfil de resistencia a antibióticos
En la tabla 4 se indica el porcentaje de cultivos positivos en muestras de sangre, y cuales son los microorganismos aislados en ellos, con su porcentaje relativo. Los datos anteriores indican un claro predominio de infecciones por Gram(), que suponen un 75 % del total de infecciones documentados microbiológicamente, frente al 25 % que suponen las infecciones por Gram(+). También destaca el hecho de que el agente causal más importante y con una clara diferencia sobre el resto es la Eschericia coli. Este predominio de infecciones por Gram() contrasta con la línea general de infecciones por Gram(+) que se refleja en la literatura de los últimos años. Este significativo dato, puede ser debido casi con toda seguridad al escaso uso de catéteres intravenosos centrales en la unidad de oncología ginecológica. Otro dato que llama la atención es el bajo número de infecciones documentadas, un 43 %, respecto al 60 % que es valor referenciado en la literatura general, lo que nos indica un elevado porcentaje de casos donde el origen de la fiebre es desconocido, ya sea debido a la medicación, a agentes no bacterianos, etc.
Tabla 4. Microorganismos aislados en muestras de sangre de la sección de oncología-ginecológica | |||
| n | % | ||
| Cultivo negativo | 21 | 56,76 | |
| Cultivo positivo | 16 | 43,24 | |
| Gram() | Escherichia coli | 7 | 43,75 |
| Pseudomonas aeruginosa | 2 | 12,50 | |
| Proteus mirabilis | 2 | 12,50 | |
| Clostridium spp. | 1 | 6,25 | |
| Gram(+) | Staph. aureus | 1 | 6,25 |
| Staph. coagulasa() | 2 | 12,50 | |
| Staph. Coagulasa(), | 1 | 6,25 | |
| meticilín R | |||
Respecto al patrón de sensibilidad/resistencia a antibióticos hallado en el servicio de oncología-ginecológica, en la tabla 5 se reflejan los porcentajes de resistencia de los microorganismos detectados en los cultivos de las muestras de sangre y en la tabla 6 los porcentajes de sensibilidad. Llama la atención la resistencia existente frente al ciprofloxacino, especialmente por los Gram(), ya que era uno de los componentes de la pauta empírica que venía usándose hasta este momento. Otro punto destacable del patrón de sensibilidad/resistencia es que todas las infecciones por Gram(+) son 100 % sensibles a la vancomicina, no habiéndose detectado ninguna resistencia. Por último, indicar que no se encuentran testados los antibióticos meropenem y cefepima al no estar aún probados en el hospital, durante el período que abarcan los hemocultivos estudiados.
Tabla 5. Porcentajes de resistencia en hemocultivos (no se reflejan los porcentajes de sensibilidad intermedia) | ||||||
| Antibiótico | E. Coli | P. Mirabilis | P. Aeruginosa | S. Aureus | S. coagu() | S.Met R |
| Amoxi/Clavul | 100 | 100 | ||||
| Ampicilina | 66,67 | 100 | ||||
| Cefotaxima | 50 | |||||
| Cefoxitina | 50 | |||||
| Cefradina | 100 | |||||
| Ceftriaxona | 50 | |||||
| Cefuroxima | 50 | |||||
| Ciprofloxacino | 66,67 | 100 | ||||
| Colistina | 100 | |||||
| Cotrimoxazol | 66,67 | 50 | 100 | |||
| Eritromicina | 100 | 100 | ||||
| Fosfomicina | 50 | 50 | 100 | |||
| Gentamicina | 100 | |||||
| Oxacilina | 100 | |||||
| Penicilina | 100 | 100 | 100 | |||
| Tetraciclina | 50 | 100 | ||||
Tabla 6. Porcentajes de sensibilidad en hemocultivos | ||||||
| Antibiótico | E. Coli | P. Mirabilis | P. Aeruginosa | S. Aureus | S. coagu() | S.Met R |
| Amikacina | 100 | 100 | 100 | 100 | 50 | |
| Amoxi/Clavul | 100 | 100 | 100 | 100 | ||
| Ampicilina | 33,33 | 100 | ||||
| Aztreonam | 100 | 100 | 100 | |||
| Cefotaxima | 100 | 100 | ||||
| Cefoxitina | 66,67 | |||||
| Cefradina | 100 | 100 | ||||
| Ceftazidima | 100 | 100 | 100 | |||
| Ceftriaxona | 100 | 100 | ||||
| Cefuroxima | 66,67 | 100 | ||||
| Ciprofloxacino | 33,33 | 100 | 50 | 100 | 100 | |
| Colistina | 100 | 100 | ||||
| Cotrimoxazol | 33,33 | 100 | 100 | 100 | ||
| Eritromicina | 100 | |||||
| Fosfomicina | 100 | 100 | 50 | 100 | 50 | |
| Gentamicina | 100 | |||||
| Imipenem | 100 | 100 | 100 | |||
| Oxacilina | 100 | 100 | ||||
| Penicilina | ||||||
| Piper/Tazobac | 100 | 100 | 100 | |||
| Teicoplanina | 100 | 100 | 100 | |||
| Tetraciclina | 100 | 50 | ||||
| Tobramicina | 100 | 100 | 100 | |||
| Vancomicina | 100 | 100 | 100 | |||
Terapia empírica seleccionada
Tras aplicar la metodología descrita se seleccionan tres posibles pautas en monotrapia y una pauta de doble ß-lactámico, las cuales cumplen con la máxima puntuación en todos los parámetros evaluados:
* Monoterapia:
Imipenem-Cilastatina (Tienam®): 1 g/6 h
Meropenem (Meronem®): 1 g/8 h
Cefepima (Maxipime®): 2 g/8 h
* Doble ß-lactámico:
Ceftazidima 2 g/8 h más Piperacilina 4 g/6 h
Cabe destacar, que se han eliminado todas aquellas combinaciones en las que participaba un aminoglucósido, debido a la nefrotoxicidad intrínseca de este grupo de antibióticos.
Análisis farmacoeconómico
En la aplicación de los criterios de evaluación de la evidencia científica se ha obtenido un valor similar en eficacia de estos tratamientos por lo que se procede a realizar un análisis de minimización de costes de las mismas, a fin de determinar la pauta más adecuada. En la tabla 7 se muestran los resultados obtenidos. En base a la aplicación de este análisis se elige la pauta de cefepima 2 g/8 h.
Tabla 7. Minimización de costes | ||
| Pauta | Coste gramo | Coste día |
| Imipenem-Cilastatina 1g/6h | 3.972 pts | 15.888 pta |
| Total: 15.888 pta | ||
| Ceftazidima 2 g/8 h | 1.175 pts. | 7.050 pta |
| Piperacilina 4 g/6 h | 450 pts. | 7.200 pta |
| Total:14.250 pta | ||
| Cefepima 2 g/8 h | 1.364 pts. | 8.184 pta |
| Total: 8.184 pta | ||
| Meropenem 1 g/8 h | 4.198 pts | 12.594 pta |
| Total: 12.594 pta | ||
| Aztreonam 2 g/8 h | 1.607 pts | 9.642 pta |
| Vancomicina 500 mg/6 h | 2.250 pts | 4.500 pta |
| Total: 14.142 pta | ||
Pacientes con hipersensibilidad a ß-lactámicos
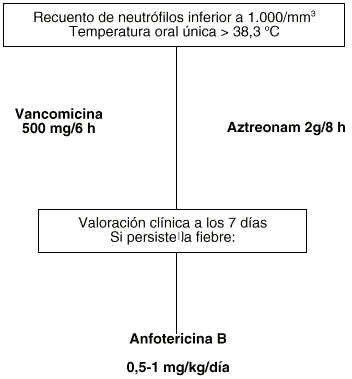
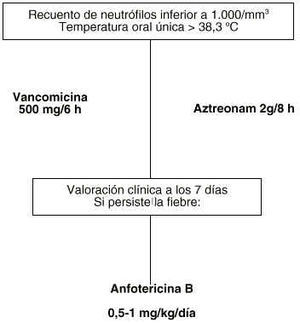
Cuando como factor limitante existe la hipersensibilidad a beta-lactámicos es preceptivo seleccionar una pauta que ofrezca las mayores garantías aunque incumpla algún punto observado, como es la inclusión de la vancomicina en el régimen inicial, o un coste superior a la pauta general determinada. La pauta elegida es: aztreonam 2 g/8 h más vancomicina 500 mg/6 h. El coste de esta pauta seleccionada se muestra en la tabla 7. Esta pauta cubre todo el espectro microbiológico observado en la unidad de ginecología-oncológica y ofrece una garantía terapéutica suficiente en base a los ensayos clínicos comparativos efectuados con la misma, a pesar de la escasez de los mismos (13).
DISCUSION
La evaluación de los estudios que comparan diferentes tratamientos comporta algunas dificultades. Por un lado, la diversidad de los criterios utilizados por los diferentes autores a la hora de definir la efectividad de la terapia, conlleva que los resultados de los estudios no sean comparables entre sí. Por otra parte, la calidad de la evidencia científica de los trabajos que atiende a las características del diseño del estudio (tamaños de muestra, aleatorización, etc.) es un aspecto crucial a tener en cuenta para discriminar entre los diferentes estudios y, por tanto poder emitir unas recomendaciones que garanticen la calidad del protocolo. Aunque existe un acuerdo general de que la mayoría de las pautas son eficaces y no se diferencian mucho respecto a sus efectos adversos, una cuidadosa selección de la terapia más adecuada puede favorecer un aumento de la eficacia y una disminución de los efectos adversos, aumentando de este modo la calidad asistencial al paciente.
Cabe destacar, que se han eliminado todas aquellas combinaciones en las que participaba un aminoglucósido, debido a la nefrotoxicidad intrínseca de este grupo de antibióticos. Una pauta en monoterapia utilizada en la bibliografía, la de ceftazidima, ha quedado por detrás de las pautas seleccionadas en el computo global, al cumplir menos criterios. Tampoco se han seleccionado las pautas con quinolonas debido al perfil de resistencias existente en nuestra institución.
Aminoglucósido+ß-lactámico
Ventajas
Efectos sinérgicos potenciales frente a algunos bacilos Gram().
Actividad frente a anaerobios.
Mínima aparición de cepas resistentes durante el tratamiento.
Desventajas
Falta de actividad frente a algunos Gram(+).
Nefrotoxicidad, ototoxicidad e hipokaliemia asociadas con el aminoglucósido. Necesidad de monitorizar y ajustar la dosis, hasta obtener niveles plasmáticos adecuados.
Los ensayos clínicos realizados con este tipo de pautas son muy numerosos, incluso en la actualidad (14, 15), y en general, esta combinación se prefiere en pacientes con alto riesgo de infección por Pseudomonas aeruginosa. Por otro lado, el uso de un aminoglucósido como monoterapia está completamente desaconsejado (2, 3). En el caso concreto de la unidad de ginecología-oncológica del Hospital Maternal La Fe, este tipo de asociación, una de las más recomendadas y documentadas, no se ha considerado inicialmente debido a la quimioterapia nefrotóxica (fundamentalmente derivados del platino) utilizada frecuentemente en este tipo de pacientes.
Dos beta-lactámicos
Ventajas
Muy baja toxicidad.
Son tan efectivos como el régimen de un aminoglucósido más un ß-lactámico (3).
Desventajas
Aparición de organismos resistentes.
Posibilidad de antagonismo de algunas combinaciones frente a determinados microorganismos, por ejemplo bacilos Gram() mediados a través de ß-lactamasas inducibles cromosomicamente (16).
Coste elevado.
La mayoría de las combinaciones de dos ß-lactámicos son efectivas y seguras. Sin embargo, no son útiles en infecciones por estafilococos meticilín-resistentes. Las penicilinas de amplio espectro tienen actividad frente a bacterias anaerobias y enterococos, no obstante, no ocurre lo mismo con las cefalosporinas de tercera generación. Por otro lado, la aparición de los nuevos carbapenemes les ha hecho perder atractivo (3).
Monoterapia
Ha sido durante mucho tiempo una de las pautas más controvertidas (17), siendo defendida por algunos autores, mientras que otros indicaban que aunque la respuesta inicial pudiera ser buena, la frecuencia con la que se necesitaban cambios de tratamiento, justificaba el inicio con una terapia combinada. Antibióticos ensayados en monoterapia son ceftazidima (18-22) e imipenem/cilastatina (18, 23-31) y los más recientes cefepima (19, 20, 26, 32-38) y meropenem (21, 22, 29, 30). Los resultados muestran una eficacia similar de estas pautas comparadas con las pautas estándar. Así mismo, todas ellas están indicadas en insuficiencia renal leve o moderada, por lo que podrían estar indicadas en pacientes a los que se les estén administrando fármacos nefrotóxicos como cisplatino, ciclosporina o anfotericina B. Del mismo modo, estos pacientes deberían haber tenido un corto período de neutropenia antes de empezar la terapia y que su recuento de neutrófilos estuviera entre 500 y 1.000/mm3. Un aspecto importante a tener en cuenta en esta terapia es que su aspecto no cubre estafilococos coagulasa (), S. aureus meticilín resistente y otras bacterias Gram(+)2. Además, la ceftazidima tiene poco efecto frente a la mayoría de anaerobios.
Figura 1.--Impreso de valoración de pautas posológicas
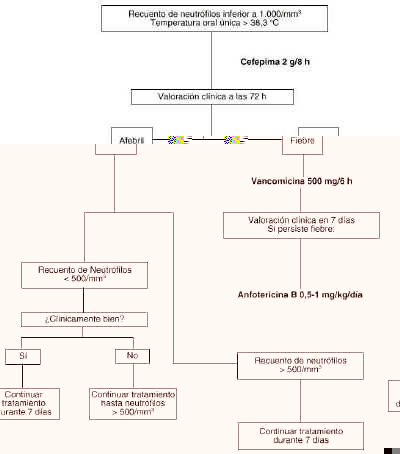
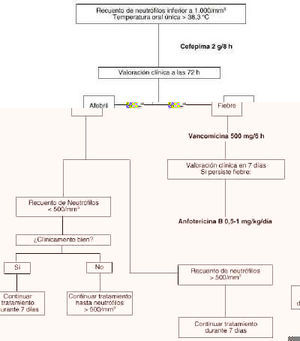
Figura 2.--Tratamiento empírico en pacientes con neutropenia febril no alérgicos a ß-lactámicos.
Quinolonas
El uso de las quinolonas como monoterapia en el tratamiento empírico de la neutropenia febril se ha ensayado en diferentes estudios, con resultados dispares (8-10) y en la actualidad no se recomienda esta pauta (3). Asimismo, las terapias combinadas de quinolonas con otros antibióticos han sido estudiadas de una forma limitada (11, 12) y los resultados no son concluyentes (3).
Estas pautas presentan las siguientes ventajas:
Un importante espectro de actividad, especialmente frente a Gram)().
Acción bactericida.
Baja toxicidad.
Posibilidad de combinarlas con otros agentes antimicrobianos.
Vías de administración tanto oral como intravenosa.
Regímenes de administración única diaria de muchas quinolonas.
Como desventajas principales aparecen:
Escasa actividad frente a estreptococos.
Aparición de resistencias que ocurren con el uso oral de las mismas como terapia profiláctica en estos pacientes.
Sin embargo, los potenciales beneficios de estas combinaciones están limitadas por las resistencias existentes en la unidad de oncología-ginecológica de nuestro hospital a ciprofloxacino, tal como se detalla más adelante, y la existencia de resistencias cruzadas con otras quinolonas como puede ser el ofloxacino.
Figura 3.--Tratamiento empírico en pacientes con neutropenia febril alérgicos a ß-lactámicos.
Vancomicina
Esta terapia ha sido ensayada en numerosos estudios (13, 23, 39-41). La inclusión de vancomicina en el régimen empírico inicial ha sido un tema muy debatido y sólo está justificada en aquellos pacientes en los que S. aureus meticilín resistente, Corynecbacterium sp. y Estreptococos ß-hemolíticos sean causa frecuente de la fiebre. Estas circunstancias pueden ocurrir en hospitales con alto riesgo de infección por estos agentes o cuando hay certeza de colonización en el paciente o en familiares. Esta posibilidad es más probable en aquellos pacientes cuya vía de entrada del microorganismo sea la piel o la boca (2, 3). En el resto de casos, se adicionará posteriormente si se aíslan bacterias Gram(+) en el cultivo o cuando no haya respuesta a la terapia inicial tras pasar unos días.
Aunque es cierto que la exclusión de vancomicina en el régimen inicial puede alargar el inicio del tratamiento para las infecciones por Gram(+), debido al tiempo necesario para el cultivo, este procedimiento permite disminuir los costes de tratamiento, evitar posibles efectos adversos de vancomicina y evitar el potencial desarrollo de resistencias. Por otro lado, teicoplanina se ha estudiado en unos pocos ensayos (41-43) como una posible alternativa a vancomicina, aunque aún necesita de más estudios para definir su papel (3), ello sin tener en cuenta su mayor coste.
Cambio de pauta antibiótica
Tras el inicio de la terapia empírica se debe realizar una evaluación clínica del paciente a los tres días, comprobando si se encuentra en estado febril o no. Si el paciente permanece en estado febril, se debe añadir vancomicina a la pauta propuesta debido a la posible infección por estreptococos meticilín resistentes. Posteriormente, una semana después de haber iniciado la terapia empírica, se vuelve a reevaluar al paciente. Si continua en estado febril, hay que valorar la posibilidad de una infección fúngica por lo que se debe de iniciar el tratamiento con anfotericina B. En los anexos II y III se exponen los algoritmos de decisión en el tratamiento de la fiebre en pacientes con neutropenia.
Terapia antifúngica
La posibilidad de infecciones fúngicas sistémicas es otro punto a tener en cuenta en los pacientes con neutropenia febril. Este riesgo, además, está incrementado de una manera muy elevada en aquellos pacientes con neutropenia prolongada (4, 6), aunque otros factores de riesgo para su desarrollo son la terapia con antibióticos de amplio espectro y el uso de corticosteroides (6). Es por ello que un 33 % de los pacientes (7, 44) con neutropenia febril que no responden a la terapia antibiótica de amplio espectro tras una semana de tratamiento, son candidatos a tener infecciones fúngicas sistémicas. El agente causal más frecuente es Candida albicans, aunque también se han modificado infecciones por especies de Aspergillus, Torulopsis y Cryptococcus (6).
Así, aquellos pacientes que tras una semana de terapia antibiótica de amplio espectro a las dosis adecuadas, mantengan el estado febril y una profunda neutropenia, son candidatos a iniciar una terapia con anfotericina B. Por ello, después de que el paciente haya sido cuidadosamente evaluado para determinar la presencia de una infección fúngica sistémica, o cuando no exista evidencia documentada de infección bacteriana, se debe de comenzar la terapia antifúngica.
Además, dos ensayos clínicos aleatorizados (44, 45) han demostrado que el uso empírico de anfotericina B en pacientes con neutropenia febril persistente o recurrente, disminuye la frecuencia, morbilidad y mortalidad de infecciones fúngicas sistémicas, especialmente en pacientes con neutropenia profunda que no reciben profilaxis antifúngica.
Inicio terapia antifúngica
El fármaco de elección es la anfotericina B, ya que tiene una excelente actividad frente a Candida albicans, aunque su eficacia es más limitada frente a Aspergillus o Cryptococcus.
La pauta de anfotericina B es de 0,5-1 mg/kg/día (4, 6, 7). Debido a que su eliminación es por vía renal, en pacientes con función renal alterada se deben de ajustar las dosis. Por otro lado, ante la sospecha o evidencia de una aspergillosis, o cuando hay una inadecuada respuesta al régimen inicial, se puede administrar una pauta con una dosis de 1,25 mg/kg/día de anfotericina B más 600 mg/día de rifampicina de forma concomitante (7). Esta terapia combinada ha mostrado efectos sinérgicos in vitro (7), aunque no existentes estudios in vivo (6).
Duración terapia antifúngica
En caso de infección confirmada por Candida o Aspergillus se considera prudente mantener la terapia antifúngica entre una y dos semanas tras el retorno del recuento de neutrófilos a valores normales (6). Otra fuente indica que se ha de administrar una dosis total de anfotericina B de entre 2 y 3 gramos (5).
En caso de no existir un diagnóstico positivo de infección fúngica, la terapia antifúngica ha de ser retirada cuando el recuento total de neutrófilos sea superior a 500 por mm3 (5).
Los efectos adversos de la terapia con anfotericina B son de dos tipos, inmediatos y dependientes de la dosis. Los inmediatos incluyen fiebre y escalofríos. Los dependientes de la dosis son nefrotoxicidad y depresión medular. El fallo renal debido a anfotericina B es reversible al discontinuar la terapia (5).
Concluimos indicando que la metodología descrita ha permitido valorar y definir los criterios para determinar los niveles de evidencia científica de los estudios, de modo que las recomendaciones finales del protocolo garantizan que el tratamiento aplicado a las pacientes ginecológicas con neutropenia febril es el más eficaz, seguro y coste-efectivo.
BIBLIOGRAFIA
1. Planells C, Escrivá JJ. Protocolos: nuevas estrategias para nuevas realidades. Noticias Farmacoterapéuticas 1994;8:1-3.
2. Hughes WT, Armstrong D, Bodey GP et al. Guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. J Infect Dis 1990;161:381-96.
3. Hughes WT, Armstrong D, Bodey GP et al. Guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. Clin Infect Dis 1997;25:551-73.
4. Pizzo PA, Rubin M, Freifeld A, Walsh TJ. The child with cancer and infection. Empiric therapy for fever and neutropenia, and preventive strategies. J Pediatr 1991;119:679-94.
5. Rolston K, Bodey GP. Managing infections in the neutropenic patient: Antimicrobial therapy reviewed. Hosp Formul 1987;22:710-9.
6. Clinical Pharmacy and Therapeutics. Erick T, Herfindal, Dick R, Gourley, Linda Lloyd Hart; 5.a ed. Baltimore, Maryland; 1992. p. 1248-60.
7. Armstrong D. Management of fever and sepsis in the immunocompromised host. Hosp Formul 1994;29 Supl.3:S18-S25.
8. Meunier F, Zinner SH, Gaya H et al. Prospective randomized evaluation of ciprofloxacino versus piperacillin plus amikacin for em piric antibiotic therapy of febrile granulocytopenic cancer patients with lymphomas and solid tumors. The European Organization for Research and Treatment of Cancer (EORTC) International Antimicrobial Therapy Cooperative Group. Antimicrob Agents Chemoter 1991;35:873-8.
9. Johnson PRE, Liu Yin JA, Tooht JA. High dose intravenous ciprofloxacin in febrile neutropenic patients. J Antimicrob Chemoter 1990;26 Supl. F:107-7.
10. Johnson PRE, Liu Yin JA, Tooht JA. A randomized trial of high dose ciprofloxacin versus azlocillin and netilmicin in the empirical therapy of febrile neutropenic patients. J Antimicrob Chemoter 1992;30: 203-14.
11. Kelsey SM, Wood ME, Shaw E, Jenkins GC, Newland AC. A comparative study of intravenous ciprofloxacin and benzylpenicillim versus netilmicin and piperacillin for the empirical treatment of fever in neutropenic patients. J Antimicrob Chemoter 1990;25:149-57.
12. Kelsey SM, Weinhardt B, Collins PW, Newland AC. Teicoplanin plus ciprofloxacin versus gentamicin plus piperacillin in the treatment of febrile neutropenic patients. Eur J Clin Microbiol Infect Dis 1992; 11:509-14.
13. Raad II et al. A comparison of aztreonam plus vancomycin and imipenem plus vancomycin as initial therapy for febrile neutropenic cancer patients. Cancer, 1997;77:1386-94.
14. Condonnier C et al. Cefepime/Amikacin Versus Ceftazidima/Amikacin as empirical therapy for febrile episodes in neutropenic patients: a comparative study. The French Cefepime Study Group. Clin Infect Dis 1997;24:41-51.
15. Lazlo D et al. Randomized trial comparing netilmicin plus imipenem-cilastatin versus netilmicin plus ceftazidime as empiric therapy for febrile neutropenic bone marrow transplant recipients. J Chemother, 1997; 9:95-101.
16. Avery''s. Drug Treatment, 4th Edition. Adis International. Barcelona, 1997. Pag:1486.
17. Hathorn JW, Lyke K. Empirical treatment of febrile neutropenia: evolution of current therapeutic approaches. Clin Infect Dis 1997;24 Supl 2:S256-65.
18. Aparicio J et al. Randomised comparison of ceftazidime and imipenem as initial monotherapy for febrile episodes in neutropenic cancer patients. Eur J Cancer 1996;32A(10):1739-43.
19. Double blind comparation of cefepime versus ceftazidime to treat febrile neutropenia. Session 69 (LM), abstract LM22, 36th ICAAC, Nueva Orleans; 1996.
20. Ramphal R, Gucalp R, Rotstein C, Cimino M, Oblon D. Clinical experience with single agent and combination regimens in the management of infection in the febrile neutropenic patient. Am J Med 1996;100 (6A):83S-89S.
21. Equivalent efficacies of meropenem and ceftazidime as empirical monotherapy of febrile neutropenic patients. The Meropenem Study Group of Leuven, London and Nijmegen. J Antimicrob Chemother 1995; 36:185-200.
22. Del Favero A, Bucaneve G, Menichetti F. Empiric monotherapy in neutropenia: a realistic goal? Scand J Infect Dis Supl 1995;96:34-7.
23. Riikonen P. Imipenem compared with ceftazidine plus vancomycin as initial therapy for fever in neutropenic children with cancer. Pediatr Infect Dis J 1991;10:918-23.
24. Leyland MJ, Bayston KF, Cohen J et al. A comparative study of imipenem versus piperacillin plus gentamicin in the initial management of febrile neutropenic patients with haematological malignancies. J Antimicrobial Chemoter 1992;30:843-54.
25. Norrby SR, Vandercam B, Louie T et al. Imipenem/Cilastatin versus Amikacin plus piperacillin in the treatment of infections in neutropenic patients: A prospective, randomized multi-clinic study. Scand J Infect Dis 1987;52 Supl:65-78.
26. Biron P. Cefepime vs Imipenem-cilastatin as empiric monotherapy in 400 febrile patients with short-duration neutropenia.
27. Pérez C et al. Imipenem/cilastatin versus ceftazidime-amikacin in the treatment of febrile neutropenic patients. Rev Med Chil 1995;123:312-20.
28. Engervall P et al. Imipenem/cilastatin monotherapy as salvage treatment in febrile neutropenic patients. J Chemother 1996;8:382-6.
29. Cometta A, Glauser MP. Empiric antibiotic monotherapy with carbapenems in febrile neutropenia: a review. J Chemother 1996;8:375-81.
30. Shah PM et al. Empirical monotherapy with meropenem versus imipenem/cilastatin for febrile episodes in neutropenic patients. Infection 1996;24:480-4.
31. Deaney NB, Tate H. A meta-analysis of clinical studies of imipenem-cilastatin for empirically treating febrile neutropenic patients. J Antimicrob Chemother 1996;37:975-86.
32. Eggimann P, Glauser MP, Aoun M, Meunier F, Calandra T. Cefepime monotherapy for the empirical treatment of fever in granulocytopenic cancer patients. J Antimicrob Chemoter 1993;32 Supl B:151-63.
33. Ramphal R, Gucalp R, Rotstein C, Cimino M, Oblon D. Clinical experience with cefepime as empiric therapy for fever and neutropenia. Am J Med 1993; 95 Supl 4A:48-54.
34. Giamerellou H. Clinical experience with the fourth generation cephalosporins. Journal of Chemotherapy 1996; 8 Supl 2:91-104.
35. Glauser MP. Clinical results with cefepime in patients with fever and neutropenia. Advances in cephalosporin therapy overview of cefepime. Budapest; 1996.
36. Yamamura D et al. Open randomized study of cefepime versus piperacillin-gentamicin for treatment of febrile neutropenic cancer patients. Antimicrob Agents Chemother 1997;41:1704-8.
37. Gerar A, Le Meins V, Maurer P, Witz B, Dopff C. Practical use of cefepime in an University hospital. Retrospective study of 35 cases. Pathol-Biol-Paris 1996;44:138-40.
38. Wynd MA, Paladino JA. Cefepime: A fourth-generation parenteral cephalosporin. Ann Pharmacother 1996;30:1414-24.
39. Lacka J et al. Vancomycin plus imipenem ceftazidime or ciprofloxacin in second line therapy in patients with febrile neutropenia not responding to first line therapy. Chemotherapy 1996;42:146-9.
40. Bodey G, Abi Said D, Rolston K, Raad Y, Whimbey E. Imipenem or cefoperazonesulbactam combined with vancomycin for therapy of presumed or proven infection in neutropenic cancer patients. Eur J Clin Microbiol Infect Dis 1996;15:625-34.
41. Figuera A et al. Imipenem combined with teicoplanin or vancomycin in the initial empirical treatment of febrile neutropenia. Analysis of the primary response and of a global sequential strategy in 126 episodes. Rev Clin Esp 1996;196:515-22.
42. Cony-Makhoul P, Brossard G, Marit G et al. A prospective study comparing vancomycin and teicoplanin as second-line empiric therapy for infection in neutropenic patients. Br J Haematol 1990; 76 Supl 2:35-40.
43. Menichetti F, Martino P, Bucaneve G et al. Effects of teicoplanin and those of vancomycin in initial empiral antibiotic regimen for febrile, neutropenic patients with haematological malignancies. Antimicrob Agents Chemoter 1994;38:2041-6.
44. Pizzo PA, Robichaud KJ, Gill FA, Witebsky FG. Empiric antibiotic and antifungal therapy for cancer patients with prolongued fever and granulocytopenia. Am J Med 1982;72:101-11.
45. European Organization for Research and Treatment of Cancer (EORTC) International Antimicrobial Therapy Cooperative Group. Empiric antifungal therapy in febrile granulocytopenic patients. Am J Med 1989;86:668-72.