INTRODUCCION
Uno de losproblemas más importantes que se plantean después deltrasplante es la prevención y el tratamiento de lasinfecciones, lo que se ve aumentado con los potentes tratamientosinmunosupresores que interfieren con los mecanismos de defensa delhuésped.
Elcitomegalovirus (CMV) es el mayor patógeno viraldespués de un trasplante renal (1). Las complicacionesdebidas al CMV se manifiestan normalmente de uno a cuatro mesesdespués del trasplante (1); se estima que el CMV causaenfermedad sintomática en un porcentaje que varíasegún los trabajos desde un 8 (2) a un 35% (3), llegandohasta el 72% en otras publicaciones (4) y ocasionando la muerte enel 2% de los pacientes (3). El CMV no sólo ocasiona aumentoen la morbi y mortalidad, sino que también se asocia aaumento del rechazo agudo (5) y disfunción crónicadel injerto (1). La infección por CMV se ha estimado queaumenta el coste del trasplante en 2,5 veces (6).
FACTORES DE RIESGO
Los factores deriesgo de la infección por CMV son:
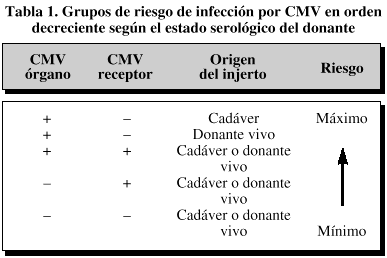
-- Estado serológico del donantey del receptor. El riesgo de padecer infección por CMV es mayor en lostrasplantados de órganos sólidos que en otrapoblación de inmunosuprimidos (por ejemplo, los pacientes decáncer) debido a que el órgano trasplantado (3) y lastransfusiones sanguíneas (2) son fuentes detransmisión del virus. Se estima que la recepción deun órgano seropositivo aumenta cuatro veces el riesgo deenfermedad por CMV (7). Los grupos de riesgo por orden deimportancia decreciente se pueden ver en la tabla 1 (8).
-- Tratamiento inmunosupresor.El uso deanticuerpos antilinfocíticos --globulinaantilinfocítica (GAL), globulina antitimocítica (GAT)u OKT3 (2, 9-11)-- y el tratamiento con micofenolato mofetil (12,13) se han asociado con aumento de la incidencia deinfección viral por CMV. El tratamiento con OKT3 se haestimado que duplica el riesgo de enfermedad por CMV(7).
-- Carga viral. La incidencia deinfección por CMV depende de la carga viral que reciba elpaciente. Esto hace que la profilaxis que sea efectiva entrasplante renal no sea exprapolable al trasplante de pulmóno gastrointestinal, que pueden tener mayor carga viral(2).
INFECCIÓN,SÍNDROME Y ENFERMEDAD POR CMV
Es importantediferenciar entre infección, síndrome y enfermedadpor CMV.
La infección se ha definido como lapresencia de anticuerpos anti-CMV (Ac-CMV) en un pacientepreviamente seronegativo o la elevación de lostítulos de Ac-CMV en cuatro veces los valores previos altrasplante (3). La infección se puede dividir en primaria ysecundaria. La infección primaria se define como lainfección en un paciente no infectado previamente, que eraseronegativo antes del trasplante y que en la mayoría de loscasos se infecta a través del injerto (R/D+). Lainfecciónsecundaria se caracteriza por una elevación de los títulosde Ac-CMV o por aislamiento del virus en pacientes que eranseropositivos. En estos casos es frecuente que el virus se reactivepor los tratamientos inmunosupresores (R+/D), pero el pacientetambién se puede reinfectar por virus del injerto (R+/D+)(3).
Lainfección por CMV clínicamente importante se da conmás frecuencia y mayor severidad en pacientes coninfección primaria que con reactivación osuperinfección (13, 14).
Actualmente sedispone de dos test para la detección rápida de lainfección citomegálica. Se basan en ladetección de antígenos precoces del virus enleucocitos periféricos con anticuerpos monoclonales (unresultado positivo se define como antigenemia), y másprecisamente por la detección de fragmentos del DNAvírico mediante PCR (polymerase chain reaction). Además, lainfección puede demostrarse usando tambiénanticuerpos monoclonales contra antígenos precoces del CMVpara marcar células infectadas cultivadas en shell-vial(15). De las tres técnicas, son la antigenemia y el shellvial las que muestran una mejor correlación entre el valorpredictivo positivo de enfermedad y la sensibilidad de latécnica y son actualmente las más generalizadas en laclínica.
En elsíndrome la infección seacompaña de un cuadro autolimitado, manifestado por fiebreprolongada, leucopenia o trombocitopenia de origen desconocido, yalgún grado de disfunción del órganotrasplantado y del hígado (3).
Los pacientespueden desarrollar enfermedad por CMV; en este caso, además del cuadro descrito comosíndrome, se presenta neumonía, gastritis, hepatitis,supresión médula ósea, retinitis u otrasenfermedades de órganos específicos. Lasmanifestaciones clínicas son fiebre, malestar, cansancio,anorexia, mialgia y artralgia. En la analítica se presentaleucopenia, trombocitopenia, linfocitosis atípica yalteración de las transaminasas. Los órganosmás afectados en trasplantes de riñón son elrespiratorio y el gastrointestinal (3); la gastritis es lamás frecuente, y la retinitis y neumonía son menosfrecuentes (3).
Un problema alrevisar la literatura es que los términos sindrome,infección y enfermedad por CMV se utilizan indistintamente,o su criterio varía de unos estudios a otros.
PROFILAXIS UNIVERSAL,DIRIGIDA O TRATAMIENTO PRECOZ
Laprevención de la infección y/o enfermedad por CMV enel trasplante renal se puede plantear mediante tres estrategiasdiferentes (16):
-- Profilaxisuniversal a todos los pacientes trasplantados.
-- Profilaxisdirigida a los pacientes de alto riesgo.
-- Tratamientoprecoz: el tratamiento se inicia cuando se detecta infecciónpor CMV aunque permanezca asintomática.
Profilaxis universal ydirigida
Implica larealización de un tratamiento profiláctico a todoslos pacientes trasplantados. En la profilaxis dirigida, adiferencia de la profilaxis universal, sólo recibentratamiento profiláctico el grupo de pacientes de mayorriesgo; éste implica menor coste, menos efectos secundariosatribuidos a la medicación y menor riesgo de resistencias,pero requiere seleccionar bien los pacientes de riesgo (17). Laconsideración de paciente de riesgo debe tener en cuenta laserología del órgano trasplantado, la del paciente yel tratamiento inmunosupresor utilizado de inducción o en elrechazo (regímenes que incluyan globulinasantilinfocíticas u OKT3) (7).
Independientemente de la población a la que se dirija,la profilaxis puede ser corta (dos-tres semanas después deltrasplante) o larga (que se mantiene durante tres meses omás).
Unmetaanálisis mostró que la profilaxis con aciclovir oganciclovir en el trasplante de órganos sólidosdisminuía la enfermedad CMV (RR: 0,5; Cl 95%: 0,40-0,62; p< 0,001) y la infección CMV (RR: 0,74; Cl 95%: 0,62-0,88;p < 0,001), aunque no mostró diferencias en lapérdida del injerto ni en el rechazo agudo o en lamortali-dad. Este metaanálisis muestra que la profilaxisuniversal con fármacos antiviriásicos es eficaz, peroes necesario compararla con el tratamiento precoz (18).
Tratamiento precoz
Supone laadministración de fármacos antivirales a un subgrupode pacientes antes de que aparezca la enfermedad. El procesodepende de datos analíticos o clínicos queidentifiquen un subgrupo de individuos con gran riesgo deenfermedad en el momento en el que el tratamiento antiviral tieneuna eficacia máxima para impedir que la enfermedad progrese.El tratamiento después de la detección de CMV en unlugar periférico como la orina o la saliva sedenomina supresión y si se administra después de la detecciónde viremia se denomina preemptive (19).
Actualmente, eldebate de cuando hacer profilaxis o tratamiento precoz estáabierto. Gran parte del problema radica en los costes, ya queMedicare en EE. UU. no costea la profilaxis en este GRD, aunquesí costea el tratamiento (7). Aunque, en principio, laterapia precoz es preferible a la profilaxis universal, no se puedeconsiderar de forma absoluta, dadas las limitaciones de losmarcadores de laboratorio y la de los tratamientosprofilácticos de CMV (17).
Para realizaruna profilaxis coste-efectiva hay que cuantificar el problema. Latasa de infecciones en los pacientes que no reciben tratamientoantilinfocitario es baja, excepto en el grupo D+/R, por lo queno estaría justificado utilizar profilaxis en todos losgrupos, pero sí en los pacientes D+/R (20), asícomo en los que reciben terapia antilinfocitaria o micofenolatomofetil (20).
ESTRATEGIAS PARA LAPROFILAXIS
Hay tres tiposde medidas profilácticas para prevenir la infección yenfermedad por CMV en los pacientes trasplantados (2). Estasmedidas no son excluyentes entre sí y deben utilizarse deforma combinada (7):
Disminución del riesgode adquisición o reactivación del virus
Mediante elmanejo del estado serológico del paciente, del órganotrasplantado y de las trasfusiones de sangre utilizando donantes yproductos sanguíneos seronegativos. Esta medida reduce elriesgo de infección, pero es muy difícil o imposiblepor la escasez de donantes. Actualmente se manejan el filtrado dehemoderivados o la utilización de sangre pobre enleucocitos (leukocyte-poor blood).
Inducción deprotección inmunológica
-- Vacunación de lospacientes seronegativos. A mediados de los añossetenta se ensayó una vacuna de virus atenuados en pacientestrasplantados de riñón. En dos estudios seobservó que no disminuía la incidencia deinfección por CMV, pero sí la gravedad y lossíntomas en el grupo D+/R; se va-loró comomedida a añadir a otras terapias (2, 21).
-- Inmunoprofilaxispasiva. Sehan utilizado inmunoglo-bulinas intravenosas inespecíficas(IGIV) e inmunoglobulinas hiperinmunes anti-CMV (IG-CMV). Losensayos clínicos realizados con estas inmunoglobu-linas hanmostrado disminuir la incidencia de enfermedad por CMV, pero no entodos los casos (2). La FDA tiene aprobados ambos compuestos parala profilaxis de CMV en pacientes de trasplante renal.
Inmunoglobulinasintravenosas (IGIV)
Las IGIV sonhemoderivados que contienen anticuerpos (Ac) naturales contra CMV.Los trabajos iniciales con estos preparados se realizaron entrasplantes de médula ósea (TMO) y después entrasplantes de riñón.
Steinmullervaloró la eficacia de las IGIV frente a un grupo sintratamiento en pacientes con riesgo de infección primaria(D+/R) mostrando una disminución significativa delsíndrome CMV en el grupo de tratamiento (p < 0,02) (3),pero en otro estudio similar no se pudieron encontrar diferenciassignificativas (22). Posteriormente se publicó un ensayo deIGIV comparándolas con un grupo sin tratamiento en laprevención secundaria de infección CMV, mostrando unadisminución de la enfermedad CMV de forma significativa enel grupo tratado (p = 0,02), pero no en el síndrome (p =0,13) (23).
Contipublicó en 1994 un ensayo de IGIV versus ganciclovircomparándolo con un control histórico sintratamiento, observando que no hay diferencia en el síndromeCMV, pero sí en la enfermedad CMV (4 vs 26%, p < 0,05), y mejorsupervivencia del injerto a un año (p < 0,05) en losgrupos de tratamiento (14).
Despuésde analizar estos estudios aleatorizados se ve una tendencia haciael efecto protector de la IGIV en la patología CMV, aunqueno de forma uniforme en todos los trabajos publicados.
Inmunoglobulinasanticitomegalovirus (IG CMV)
Lasinmunoglobulinas hiperinmunes anti-CMV se obtiene seleccionando un5-10% de los donantes con títulos altos de Ac-CMV,consiguiendo inmunoglobulinas con títulos anti-CMV de cuatroa ocho veces más altos que en las inmunoglobulinas noseleccionadas (2).
Las ventajasteóricas de las IG-CMV derivarían de que se requierenvolúmenes menores para conseguir los mismos títulosde Ac-CMV, lo que supondría menor sobrecarga proteica, quees una ventaja en los pacientes con insuficiencia renal(3).
Se han realizadovarios estudios no comparativos de IG-CMV en pacientes detrasplante renal. Wemer no mostró beneficio significativo afavor de la utilización de IG-CMV (24). En el ensayo deSnydman (25) se observó una marcada reducción delsíndrome CMV (p < 0,01) y una continuación de esteestudio publicado en 1991 (26) compara el grupo de tratamiento conIG-CMV con el grupo control del ensayo anterior; muestratambién una disminución en el síndrome CMV (p= 0,03). Se presentaron efectos secundarios relacionados con lainfusión de IG-CMV.
Se han realizadodos ensayos clínicos de IVIG vsIG-CMV. En el primero laincidencia de síndrome CMV fue superior en el grupo IGIV (pno se describe) (3) y en el segundo la incidencia deinfección CMV fue superior en el grupo IG-CMV (p nopublicada) (27).
Por lacomparación de los resultados de los estudios realizados conIG-CMV vs placebo y de los delIGIV vs placebo parecen indicarque la IG-CMV es superior a la IGIV. Pero los resultados sondifíciles de interpretar ya que existen diferenciasimportantes en los resultados de los grupos control en cadaestudio. A pesar de esta falta de datos determinados autoresconsideran justificada la utilizacion de IG-CMV en pacientes detrasplante renal, considerando este tratamiento coste-efectivo enlos pacientes D+/R (2).
Utilización defármacos antivirales
Aciclovir oral
El aciclovirinhibe la síntesis de DNA, reduciendo laproliferación viral. El enzima viral timidin kinasaconvierte el aciclovir en la forma activa de monofosfato, queposteriormente pasa a trifosfato. El aciclovir trifosfato inhibe laDNA polimerasa, pero el CMV no tiene timidin kinasa, por lo que elaciclovir no se activa y no está recomendado en eltratamiento de la infección por CMV y sólo en altasdosis puede tener efecto. El aciclovir se ha utilizado a dosisbajas y altas (200-3.200 mg/día) para la profilaxis de lainfección por CMV (28, 29).
Lautilización del aciclovir para la profilaxis de lainfección por CMV en trasplante renal se debe a un trabajopublicado en 1989 y que sigue siendo el trabajo másimportante en este sentido. Se estudiaron 104 pacientes en unensayo doble ciego frente a placebo en el que se observó unadisminución de infección CMV (31 vs 61%, p < 0,01), delsíndrome (7,5 vs 29%,p < 0,002) y de la enfermedad (2-17%, p < 0,017) en el grupotratado con aciclovir a dosis altas, aunque no se observarondiferencias en cuanto al rechazo de injerto, función delórgano, mortalidad o efectos secundarios (3).
El aciclovirtambién ha demostrado retrasar la aparición de laenfermedad, lo que es importante, ya que la inmunosupresióntiene un máximo inmediatamente después del trasplante(7).
Posteriormentede han publicado datos sobre la falta de eficacia del aciclovir enpacientes de alto riesgo (29, 30). Bertoni utiliza profilaxis conaciclovir oral a altas dosis y no encuentra enfermedad en lospacientes de riesgo bajo, pero observa una gran incidencia deinfección por CMV en los pacientes de alto riesgo (77,7%),considerando como paciente de alto riesgo los receptores CMVnegativos que reciben un órgano de cadáver positivo olos pacientes que reciben globulinas antitimocíticas comotratamiento del rechazo. Este autor concluye que el aciclovir adosis altas es poco eficaz en los pacientes de alto riesgo(30).
Hay autores quecontinúan utilizando aciclovir a dosis altas 3.200mg/día * tres meses a pesar deltratamiento inmunosupresor con globulina antilinfocítica ymicofenolato mofetil (28, 31).
El aciclovirpuede estar indicado en pacientes que no sean de alto riesgo, pero,¿está indicado en estos pacientes hacerprofilaxis?
Ganciclovirintravenoso
El ganciclovirrequiere la fosforilación hasta el compuesto trifosfato paratener actividad antiviral. Esta molécula actúacompitiendo con la deoxiguanosina trifosfato (DGTP), que es unsustrato de la DNA polimerasa; la reducción en laincorporación de DGTP, paralelamente a laincorporación del ganciclovir trifosfato, enlentece oparaliza la extensión de DNA, inhibiendo lareplicación viral (16).
Aunque elganciclovir es el fármaco de primera elección en eltratamiento de la enfermedad por CMV (16), los resultados comofármaco profiláctico vía intravenosa en laprevención de la infección por CMV en trasplanterenal no han sido concluyentes (7), considerándose de pocautilidad (2). Algunos estudios no han mostrado diferencia respectoal control, aunque la enfermedad CMV se manifiesta de formamás leve y se presenta más tarde; otros estudios hantenido resultados más alentadores.
Conti en 1997estudió 150 pacientes transplantados de riñónentre marzo de 1990 y abril de 1995 tratados con ganciclovir i.v.los días del uno al veintiuno después del trasplantecon dosis ajustada para la función renal. Se demostródisminución significativa del síndrome y de laenfermedad invasiva por CMV (pneumonitis, hepatitis, enteritis,SNC) (32).
El mismo autorpublicó en 1998 un trabajo realizado en 55 pacientes detrasplante renal (entre enero de 1994 y diciembre de 1995) querecibieron ganciclovir i.v. 5 mg/kg durante veintiúndías después del trasplante, seguido de nueve semanasde tratamiento oral. Se comparó la eficacia del grupotratado con micofenolato mofetil y el que no. Los resultadosfueron: el síndrome por CMV fue significativamente superioren el grupo de alto riesgo (53%) comparado con el de no alto riesgoque no fue tratado con micofenolato mofetil (10%), p < 0,01. Laenfermedad por CMV fue 12% en el grupo de alto riesgo y 0 en elotro. Este estudio concluye que el tratamiento con ganciclovir essignificativamente menos eficaz en el grupo de pacientes de altoriesgo, lo que hace necesarias otras medidas en este tipo depacientes, como, por ejemplo, la utilización de IG(13).
Ganciclovir oral
Desde laaprobación por la FDA del ganciclovir oral para eltratamiento de mantenimiento de la retinitis por CMV en pacientesHIV se propuso su posible uso para disminuir la infecciónpor CMV en pacientes trasplantados, con la ventaja de sucómoda administración, que permitiría unaadministración más prolongada.
Aunque losniveles séricos obtenidos con la vía oral son menoresa los conseguidos con la vía parenteral, pueden sersuficientes para inhibir la replicación viral despuésdel trasplante. La biodisponibilidad del ganciclovir oral se haestudiado en cuatro pacientes de trasplante renal y se ha estimadoen el 8,4% de la dosis administrada (16).
En primer lugarel ganciclovir oral mostró su eficacia en lareducción de la infección por CMV en el trasplantehepático (4), estudiándose posteriormente en eltrasplante renal.
La eficacia delganciclovir oral en la prevención de la infección porCMV en pacientes de trasplante renal fue demostrada por Ashan es unestudio aleatorizado no ciego en 44 pacientes en el que secomparó ganciclovir oral 750 mg dos veces al díadurante doce semanas frente a un grupo sin tratamiento. Eltratamiento inmunosupresor incluía OKT3, ciclosporina,azatioprina y prednisona. Los resultados mostraron unadisminución de la infección CMV (p < 0,05) en elgrupo tratado (33). Posteriormente, el autor reúne 51pacientes de riesgo, de los cuales 16 no reciben profilaxis, 15ganciclovir oral 750 mg dos veces al día y 20 gancicloviroral 500 mg dos veces al día (33) (este trabajo incluyepacientes ya estudiados en el estudio de Ahsan 97),mostrándose que la dosis menor de ganciclovir reduce deforma eficaz la infección por CMV.
Otro ensayoclínico estudió de forma no ciega dos ramas deprofilaxis en pacientes de trasplante renal (34). Las pautas fueronganciclovir oral 1.000 mg tres veces al día o aciclovir 200mg vía oral dos veces al día, ambas pautas durantedoce semanas, con un tratamiento inmunosupresor con GAT,azatioprina, prednisona y ciclosporina (el micolenolato mofetilsustituyó a azatioprina en los pacientes de alto riesgo).Este estudio mostró
que la profilaxis con ganciclovir oral es segura y previe-ne laenfermedad por CMV totalmente durante la administración delfármaco (p < 0,0001), reduce la incidencia de enfermedaddespués de la profilaxis (p = 0,026) y retrasa suaparición (p < 0,0001). Estos efectos se ve si el donantees seropositivo, pero no si es seronegativo (aunque elnúmero de casos fue muy pequeño).
Somervillerealizó un estudio de cohortes consecutivo de pacientes contrasplante de riñón-páncreas y páncreascomparando ganciclovir i.v. 5 mg/kg seguido de aciclovir oralfrente a ganciclovir i.v. 5 mg/kg seguido de ganciclovir oral. Sepresentó enfermedad por CMV en el 59% de los pacientes en elgrupo de aciclovir y el 13% en el de ganciclovir (p < 0,01). Laprotección es mejor con ganciclovir oral (35).
EL PROBLEMA DE LASRESISTENCIAS
Debido a lafácil administración y al perfil de toxicidadrelativamente benigno se está extendiendo lautilización de ganciclovir oral en los pacientestrasplantados, y un problema asociado a este uso es laaparición de resistencias (36).
Un inconvenientedel ganciclovir es que es el tratamiento de elección para laenfermedad por CMV y siempre plantea dudas el utilizar el mismofármaco para la prevención y el tratamiento(18).
No se dispone dedatos de la incidencia de resistencia a ganciclovir despuésde la profilaxis del CMV en pacientes trasplantados. Se han aisladoun número pequeño de cepas de CMV resistentes aganciclovir después de trasplantes de pulmón,hígado y médula ósea y se ha asociado afracaso terapéutico en dos pacientes (16). En base a losdatos de resistencias publicados después de la utilizacionde ganciclovir oral en pacientes de SIDA se puede estimar que lasresistencias después de tres meses postrasplante sonposibles, pero no frecuentes (16).
Valaciclovir
Recientemente seha publicado un estudio comparando valaciclovir 2 g cuatro veces aldía y placebo en 208 pacientes CMV de donante CMV+(R/D+) y 408 pacientes CMV y donante + o (R+/D±) durante noventa días después deltrasplante. Valaciclovir mostró una reducciónsignificativa de enfermedad por CMV, infección por CMV,rechazo del injerto (37).
Otrosfármacos
Otrosfármacos utilizados en la profilaxis de CMV en otros tiposde trasplantes son foscarnet, Ác. monoclonales,células específicas citotóxicas T y vacunaCMV. El valor de estos compuestos no se ha establecido en eltrasplante de riñón (3).
Tratamiento combinado defármacos
Hay variostrabajos publicados con tratamientos combinados de fármacosen el trasplante renal: bajas dosis de aciclovir + IG-CMV,aciclovir o ganciclovir + IGIV. Los datos son limitados, peroparecen obtenerse algunas ventajas con el tratamiento combinado yse utiliza por algunos autores (7, 17, 38). Los tratamientoscombinados tienen ventajas sobre la monoterapia y hay algunaevidencia de que son sinérgicos (17). Wright utilizaaciclovir altas dosis más IG-CMV en los pacientes de altoriesgo (28).
VALORACIONECONOMICA
El costeaproximado de los tratamientos profilácticos de CMV se puedever en la tabla 2. Hay que tener encuenta que ningún régimen ha mostrado ser máseficaz comparado con los demás, pero también que elcoste de adquisición es una pequeña parte del costeglobal.
GUÍA PARA LAPROFILAXIS DE LA INFECCION POR CMV EN TRASPLANTE RENAL (39, 40)
En base a laevidencia disponible se han publicado algunas guías para laprofilaxis de la infección por CMV en el trasplante renal.Actualmente ganciclovir es el fármaco considerado deelección para la profilaxis, pudiéndose iniciarvía parenteral a dosis de 5 mg/kg en dos dosis divididas (enfunción renal normal) durante tres semanas, pasandoposteriormente a la vía oral con dosis de 1.000 mg tresveces al día durante doce semanas.
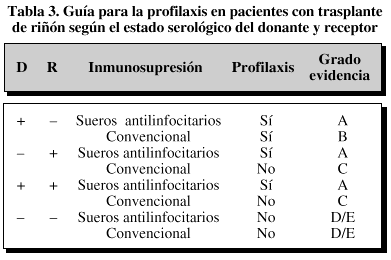
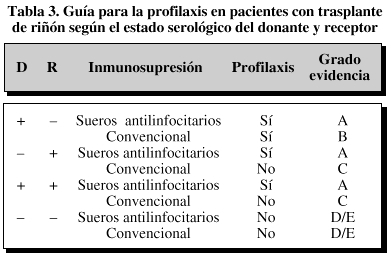
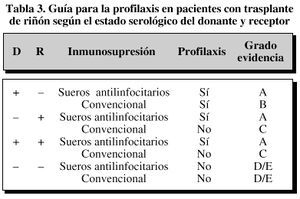
La convenienciade profilaxis según el estado serológico del donantey receptor se puede resumir en la tabla3.
Donante CMV+ y receptorCMV (D+/R): profilaxis recomendada
Riesgo deinfección primaria: del 70-90%; de enfermedad: del50-80%.
Se recomiendahacer profilaxis sea cual sea la pauta inmunosupresora. El grado deevidencia es diferente según la pauta inmunosupresora que seutilize; si se hace con sueros antilinfocíticos--gammaglobilina antilinfocítica (GAL), gammaglobolinaantitimocítica (GAT), muromonab OKT3)-- es grado A y si lainmunosupresión es convencional es grado B.
Donante CMV+ y receptor CMV-(D-/R+): depende
Riesgoreactivación CMV latente por el tratamiento inmunosupresor.Riesgo de infección y/o enfermedad 20% (no tratados conOKT3).
Larecomendación de profilaxis es distinta según lapauta inmunosupresora:
-- Si seutilizan sueros antilinfocitarios se recomienda la profilaxis(grado A).
-- Si se realizainmunosupresión convencional (sin sueros antilinfocitarios)no se realizará profilaxis (grado C). Algunos autoresrealizan profilaxis con este grado de evidencia.
Donante CMV+ y receptor CMV+(D+/R+): depende
Riesgo dereactivación y superinfección.
Larecomendación de profilaxis es distinta según lapauta inmunosupresora.
-- Si seutilizan sueros antilinfocitarios se recomienda la profilaxis(grado A)
-- Si se realizainmunosupresión convencional (sin sueros antilinfocitarios)no se realizará profilaxis (grado C). Algunos autoresrealizan profilaxis con este grado de evidencia.
Donante CMV y receptorCMV (D/R): no hacer profilaxis
Dada la bajaprevalencia de infección no está recomendada laprofilaxis sea cual sea el tratamiento inmunosupresor (gradoD/E).
Así, laprofilaxis está indicada siempre que se utilizen suerosantilinfocíticos (excepto si D/R), y sólosi es D+/R con inmunosupresión convencional.
En el protocolose han utilizado los criterios de grado de evidencia indicados enla tabla 4.