La administración de bifosfonatos requiere un ajuste de dosis en pacientes con insuficiencia renal.
ObjetivosAnalizar la evolución de la función renal tras reducir 2h el tiempo de infusión de pamidronato en pacientes con mieloma múltiple.
MétodosEstudio descriptivo retrospectivo de los pacientes que presentaban mieloma múltiple y metástasis óseas tratados con pamidronato administrado en 4h. Se elaboró un protocolo conjunto con Hematología para administrar pamidronato en 2h, realizándose un seguimiento prospectivo de la función renal de dichos pacientes.
ResultadosUn total de 6 pacientes recibieron pamidronato en 4h. Posteriormente, todos recibieron la administración en 2h, y uno de ellos (16,6%) evidenció alteración de la función renal.
DiscusiónLa reducción en el tiempo de administración de pamidronato no mostró variaciones significativas en la función renal de los pacientes. Esta práctica terapéutica podría mejorar la calidad de vida de los pacientes, al disminuir el tiempo de estancia hospitalaria, sin empeorar su función renal.
Administration of biphosphonates in patients with renal failure requires a dosage adjustment.
ObjectivesAnalyse renal function evolution in multiple myeloma patients after reducing infusion time for 90mg pamidronate by 2h.
MethodsIn 2007, a retrospective study was carried out on all patients who presented multiple myeloma and bone metastasis treated with pamidronate administered every 4h. Following a review of the literature, a protocol for administering pamidronate every 2h was created in partnership with Haematology, and a specific dose reduction framework was established for patients with baseline renal failure. Additionally, a prospective follow-up study of those patients’ renal function was completed to analyse its evolution after the change in infusion time.
ResultsA total of six patients received 90mg pamidronate every 4h. 33.32% of the patients (2/6) presented baseline renal insufficiency, and therefore needed to have the pamidronate dose adjusted according to the new protocol. Subsequently, all of them received the treatment every 2h, and one patient (16.6%) experienced altered renal function after two treatment cycles.
DiscussionReducing administration time for pamidronate from four to 2h did not lead to significant variations in patients’ renal function. This therapeutic practice can improve patients' quality of life by shortening their hospital stay without aggravating their renal function.
Los bifosfonatos son el estándar de tratamiento para la prevención de eventos relacionados con el esqueleto (ERE)1,2 en pacientes con cáncer de mama o mieloma múltiple (MM) con metástasis óseas, complicación que padecen hasta la mitad de dichos pacientes3,4. Numerosos estudios demuestran la efectividad tanto de pamidronato (90mg) como de zoledronato (4mg) en la prevención de ERE5,6,7. Ambos fármacos presentan una eficacia similar, pero la ventaja que presenta zoledronato en cuanto al tiempo de administración frente a pamidronato (15min frente a 2–4h) se ha visto reducida por la aparición de una alerta de seguridad, tanto, que indica que existe un factor de riesgo de 9,5 de desarrollar osteonecrosis mandibular al recibir zoledronato en lugar de pamidronato8,9.
Pero, además, los bifosfonatos pueden producir efectos adversos renales, que en el caso de la administración intravenosa se relacionan con la dosis administrada y el tiempo de perfusión, acrecentándose al aumentar la velocidad de perfusión, lo que implica monitorizar la función renal de los pacientes7,9.
Sin embargo, existe cierta controversia en cuanto a su tiempo de infusión, puesto que, según indica su ficha técnica10, se debe administrar una dosis de 90mg durante 2h en el caso de tratar a pacientes con cáncer de mama, mientras que en pacientes con MM se recomienda administrar los 90mg durante 4h. En cambio, en algunos de los estudios en los que se basó su aprobación para la indicación en MM7 y en la última actualización de la American Society of Clinical Oncology (ASCO)11 se recomienda administrarlo en 2h en pacientes con MM.
Por tanto, nos planteamos como objetivo evaluar la toxicidad renal en pacientes con MM tratados con pamidronato en perfusión intravenosa de 4 y de 2h de duración.
MétodosSe realizó un análisis descriptivo retrospectivo de la toxicidad renal de los pacientes con MM tratados con pamidronato infundido en 4h, obteniéndose vía intranet las analíticas de los pacientes antes de empezar a ser tratados con pamidronato, así como si el recibir el fármaco en 4h había modificado su función renal. Tras una revisión bibliográfica sobre la forma de administración del pamidronato y su toxicidad renal, se realizó una reunión con el Servicio de Hematología consensuando un protocolo, de manera que ambos servicios acordaron utilizar pamidronato para la prevención de ERE en pacientes con MM, infundiéndolos en 2h, en vez de en 4h como se venía haciendo.
Desde ese momento, se realizó un seguimiento prospectivo de la función renal de todos los pacientes previo a cada ciclo de tratamiento (de 2h de infusión).
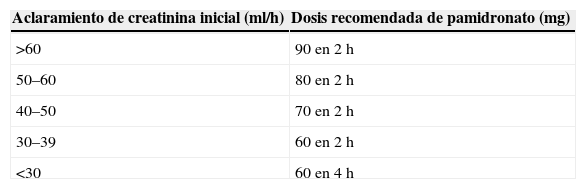
En cuanto al ajuste de dosis por IR, si bien no hay pautas específicas de reducción de dosis según la función renal para pamidronato, la ASCO propone disminuir la dosis estándar de 90mg en caso de IR preexistente, de manera análoga a la disminución de dosis que se introdujo en la ficha técnica de zoledronato, aunque sin especificar cuánto. Por tanto, y sobre la base de la propuesta de la ASCO, acordamos el siguiente protocolo de inicio de dosis (tabla 1). Éste también se aplicó a los pacientes que ya estaban siendo tratados con pamidronato en 4h, según su aclaramiento previo a la administración de la dosis en 2h, ya que, como se ha comentado, la nefrotoxicidad parece relacionada con el tiempo de infusión.
A su vez, en pacientes que desarrollaron IR sin otra causa aparente durante el tratamiento, la ASCO recomienda la supresión radical de pamidronato, pudiendo reiniciarse a la misma dosis inicial (en función del aclaramiento de creatinina basal) cuando se reestablecieran los niveles de creatinina dentro del intervalo del ±10% de los niveles basales. Se consideró IR como el aumento de creatinina sérica en 0,5mg/dl para pacientes con creatinina sérica basal inferior a 1,4mg/dl, y aumentos de 1mg/dl, para pacientes con creatinina sérica basal superior a 1,4mg/dl, definición usada en la mayoría de los ensayos clínicos y adoptada por la propia ASCO.
Puesto que nuestro nuevo tiempo de administración no se ajusta al especificado por la ficha técnica, se redactó un consentimiento informado, que debía ser cumplimentado por el paciente antes de iniciar tratamiento y así poder disminuir el tiempo de administración.
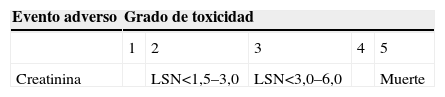
Medida de la toxicidadEn este estudio usamos la última versión de los criterios comunes de toxicidad de la OMS CTCAE v3.0 (Common Terminology Criteria for Adverse Events)12 (tabla 2).
ResultadosEl estudio se realizó en un hospital comarcal de cuarto nivel, en el cual se incluyeron 6 pacientes (3 hombres y 3 mujeres) diagnosticados de MM, con una edad media de 75 años (rango: 69–82) y una media de 11 ciclos (rango: 4–16).
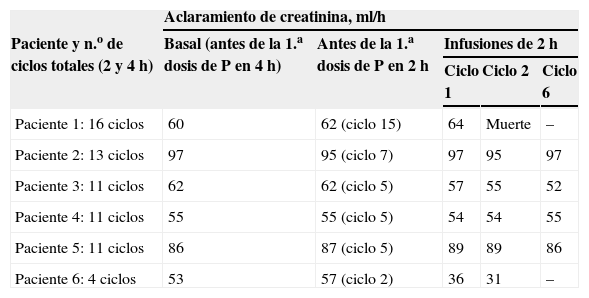
Los datos de función renal previa y posterior a la administración de pamidronato, la dosis recibida y el número de ciclos de cada uno de ellos se presentan en la tabla 3.
Características de los pacientes incluidos
| Aclaramiento de creatinina, ml/h | |||||
| Paciente y n.o de ciclos totales (2 y 4h) | Basal (antes de la 1.a dosis de P en 4h) | Antes de la 1.a dosis de P en 2h | Infusiones de 2h | ||
| Ciclo 1 | Ciclo 2 | Ciclo 6 | |||
| Paciente 1: 16 ciclos | 60 | 62 (ciclo 15) | 64 | Muerte | – |
| Paciente 2: 13 ciclos | 97 | 95 (ciclo 7) | 97 | 95 | 97 |
| Paciente 3: 11 ciclos | 62 | 62 (ciclo 5) | 57 | 55 | 52 |
| Paciente 4: 11 ciclos | 55 | 55 (ciclo 5) | 54 | 54 | 55 |
| Paciente 5: 11 ciclos | 86 | 87 (ciclo 5) | 89 | 89 | 86 |
| Paciente 6: 4 ciclos | 53 | 57 (ciclo 2) | 36 | 31 | – |
El 33,3% (2/6) de los pacientes presentaba una insuficiencia renal basal, por lo que requirieron ajuste de la dosis de pamidronato a 80mg.
De los 6 pacientes, 5 presentaron una función renal muy conservada durante todo el período del estudio, tanto con el fármaco infundido en 4 como en 2h, sin alcanzar variaciones del 10% de la creatinina inicial en ningún momento, si bien en uno de los pacientes la enfermedad progresó causando el fallecimiento de éste.
En el único paciente que sufrió un deterioro de su función renal (paciente 6) que a juicio del clínico también se debía a una progresión de la enfermedad, el aclaramiento disminuyó de 57 a 31ml/h. Si nos fijásemos en la creatinina sérica, pasó de 1,41 a 2,23 (+0,82mg/dl), no aumentando más de 1mg/dl, con lo que teóricamente no estaba indicado el cese del tratamiento. Por tanto, y aplicando la escala de toxicidad de la OMS, sólo un paciente tuvo una toxicidad grado 2, que el clínico no consideró atribuible al pamidronato; aun así, por deterioro general, se decidió suspender el tratamiento.
DiscusiónNuestro estudio revela cómo una estrecha relación entre el Servicio de Farmacia y el de Hematología permitió mejorar la satisfacción de los usuarios al disminuir su tiempo de estancia hospitalaria, sin afectar de una manera significativa la función renal de éstos, ya que pese a que tuvimos una toxicidad grado 2, el clínico no la consideró relacionada con el tratamiento y es similar a los datos de la literatura médica, que la cifran en el 12%14. Simultáneamente, mejora la seguridad del paciente al realizar un seguimiento prospectivo de su función renal, lo que permite disminuir la toxicidad del fármaco. Pensamos que este estudio sirve de punto de partida a posibles investigaciones futuras, sobre todo por el hecho de establecer un cuadro de reducción específico de dosis para el pamidronato en pacientes con IR preexistente, y el de cuestionar algunas de las directrices actuales que no parecen basarse en la mejor evidencia disponible. Así, y aunque usásemos los criterios de la ASCO para definir IR e interrumpir los tratamientos, creemos que esta ley del “todo o nada” alberga importantes limitaciones. Primero, el suspender categóricamente el fármaco si pasa un punto de corte (+0,5 o +1mg/dl respecto al basal) sin recomendar disminuciones de dosis; así, en nuestro paciente, que presentó un deterioro de la función renal, las recomendaciones indican mantener la dosis por no llegar a la definición de IR, siendo quizás más adecuado disminuir la dosis a 60mg, tal y como muestra nuestra tabla de dosis inicial de pamidronato, en vez de esperar a que, o se estabilizara la creatinina y continuara con la dosis plena, o aumentara y se interrumpiera el tratamiento.
Segundo, y aún más llamativo, es que dicho punto de corte se base en la determinación de la creatinina sérica y no del aclaramiento de creatinina, cuando numerosos trabajos15,16 demuestran que hay una mejor correlación entre el aclaramiento de creatinina (calculado con cualquiera de los métodos existentes) y el deterioro de la función renal, que entre la creatinina sérica y dicho daño renal, especialmente en pacientes de edad avanzada, como suelen ser los pacientes con MM. Un ejemplo es el estudio que se realizó en Canadá con 2.781 pacientes, en el que la mitad de los pacientes presentaba valores de creatinina sérica normal y filtrado glomerular disminuido17.
Este estudio presenta numerosas limitaciones, como el bajo número de pacientes debido a la naturaleza del hospital y su prevalencia, lo que impide realizar análisis estadísticos. A su vez, no pasamos ningún cuestionario validado de calidad de vida que pueda refrendar la conclusión de que los pacientes aumentaban su satisfacción al pasar de una infusión del fármaco de 4h a una de 2h, lo que nos impide cuantificarlo, pero sumado a la pequeña casuística que teníamos nos hizo desestimarlo. Aun así, creemos que la interacción con hematología en concreto y con el resto de los servicios en general es fundamental para el desarrollo de la farmacia y permite el uso racional y seguro de los medicamentos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración preliminar: este artículo ha sido parcialmente publicado en el V Congreso de la Sociedad Andaluza de Farmacia Hospitalaria, en Sevilla 2008.