Estimación del impacto presupuestario de la utilización de la combinación fija de efavirenz-emtricitabina-tenofovir en el tratamiento de pacientes infectados por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) para el Sistema Nacional de Salud en España, y evaluación de la repercusión para cada comunidad autónoma en el año 2008.
MétodosSe ha desarrollado un modelo de impacto presupuestario con los costes farmacológicos de las alternativas terapéuticas actualmente disponibles, a partir de las pautas recomendadas por GeSida para el tratamiento de la infección por el VIH-1. En el modelo se han definido 5 posibles escenarios en los que se asumen diferentes posibilidades de sustitución de las distintas asociaciones terapéuticas por la combinación efavirenz + emtricitabina + tenofovir.
ResultadosLa inversión por paciente en el ámbito nacional supone un coste de 7.989 € en el escenario base (sin considerar disponibilidad de la combinación efavirenz-emtricitabina-tenofovir) y de 7.997, 8.424, 7.830, 8.375 y 8.527 € para los escenarios 1 (sustitución de pautas con efavirenz, emtricitabina, tenofovir o efavirenz, lamivudina, tenofovir), 2 (sustitución de pautas con efavirenz), 3 (sustitución de pautas con tenofovir), 4 (sustitución de pautas con tenofovir o zidovudina) y 5 (sustitución total), respectivamente, lo que se traduce en incrementos respecto al escenario base del 0,11, 5,45, —1,99, 4,83 y 6,73 % para los escenarios 1, 2, 3, 4 y 5, respectivamente.
ConclusiónLa utilización de la combinación fija de efavirenz-emtricitabina-tenofovir en el tratamiento de pacientes adultos infectados por el VIH-1 conllevaría ligeros incrementos o incluso ahorros presupuestarios, con disminución del número de tomas diarias, lo que podría mejorar la calidad de vida de los pacientes, el cumplimiento y la adherencia al tratamiento.
Estimate the budgetary impact of using a set-dose combination of efavirenzemtricitabine-tenofovir for the Spanish health care system's treatment of patients infected with HIV-1, while evaluating repercussions for each autonomous community in 2008.
MethodsWe developed a budgetary impact model with pharmacological costs for the different currently available treatment options, based on GeSida's recommended guidelines for treating HIV-positive patients. The model defines five possible scenarios in which various possibilities for substituting different drug cocktails with the efavirenz-emtricitabine-enofovir combination are contemplated.
ResultsThe investment per patient on a national level amounts to €7,989 in the base scenario (without considering the availability of the efavirenz-emtricitabine-tenofovir combination) and to €7,997, €8,424, €7,830, €8,375 and €8,527 for scenario 1 (substitution of recommended drugs with efavirenz, emtricitabine and tenofovir or efavirenz, lamivudine and tenofovir); scenario 2 (substitution of recommended drugs with efavirenz); scenario 3 (substitution of recommended drugs with tenofovir); scenario 4 (substitution of recommended drugs with tenoforvir or zidovudine) and scenario 5 (total substitution), respectively. Compared with the base scenario this means increments of 0.11 %, 5.45 %, —1.99 %, 4.83 % and 6.73 % for scenarios 1, 2, 3, 4 and 5.
ConclusionUse of a set combination of efavirenz, emtricitabine and tenofovir to treat adult patients with the HIV-1 virus would lead to slight surpluses or even budgetary savings by decreasing the number of daily doses, which could increase patients’ quality of life and help them stay on the treatment properly.
El virus de la inmunodeficiencia humana (VIH) es un virus de la familia lentivirus, género retrovirus, que se clasifica en 2 tipos: VIH tipo 1 (VIH-1) y VIH tipo 2 (VIH-2). Es la causa del síndrome de inmunodeficiencia adquirida (sida), una inmunodepresión grave desencadenada como consecuencia de la infección de las células del sistema inmunitario1. El VIH-1 es la causa de la pandemia mundial y, en España, es el responsable de uno de los principales problemas de salud pública en la actualidad2.
La incidencia anual de casos de sida aumentó en España hasta mediados de la década de 1990. En ese momento se detuvo su incremento, probablemente por la reducción en la transmisión del VIH y por la extensión de los tratamientos antirretrovirales (TARV) de gran actividad (TARGA)3. Según los últimos datos del Sistema de Vigilancia Epidemiológica del Instituto de Salud Carlos III, en 2007 se notificaron 1.464 casos de sida en España. Este dato supone un descenso del 78 % respecto a los notificados en 1996. Aun así, a pesar de esta disminución, España sigue siendo uno de los países con una incidencia mayor de sida en Europa occidental4.
El Grupo de Estudio de Sida (GeSida), perteneciente a la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica, junto con el Plan Nacional sobre el Sida (PNS) coordinado por el Ministerio de Sanidad y Consumo, consensúan recomendaciones anuales sobre el TARV en España5. En el momento actual, el tratamiento de elección de la infección por el VIH, denominado TARGA, se basa en combinaciones de al menos 3 fármacos que incluyen 2 análogos de nucleósidos, un inhibidor de la proteasa potenciado o un no análogo de nucleósido5,6.
Atripla® (Bristol-Myers Squibb y Gilead Sciences) es la primera combinación disponible de 3 antirretrovirales de administración diaria en un solo comprimido. Está compuesto por una combinación a dosis fija de efavirenz (EFV) (600 mg), emtricitabina (FTC) (200 mg) y tenofovir disoproxil fumarato (TDF) (245 mg), comercializada en una presentación de 30 comprimidos por envase7,8. La combinación fija de EFV-FTC-TDF ha probado su bioequivalencia frente a sus componentes administrados de forma individual. El régimen EFV + FTC + TDF (administrado por separado, no como combinación fija) ha demostrado su superioridad en términos de supresión virológica respecto a otras pautas antirretrovirales9,10.
Gracias al TARV, en los últimos años, se ha reducido la mortalidad relacionada con el sida, a la vez que ha mejorado la calidad de vida relacionada con la salud de los pacientes11,12. Por otra parte, el TARV, en parte debido al aumento de opciones disponibles y al cambio de monoterapia/biterapia a TARGA, se ha asociado con aumentos considerables en los costes sanitarios directos, lo que supone una inversión importante del gasto farmacéutico total13. Sin embargo, diversos estudios han puesto de manifiesto que, a pesar de su elevado precio, los TARV reducen e incluso podrían ahorrar parte del coste global asociado a los pacientes infectados por el VIH14.
En un entorno con recursos limitados y escasos, es necesario racionalizar la inversión para aunar el tratamiento de los pacientes con una gestión adecuada del gasto5,15. En este sentido, los estudios de impacto presupuestario son herramientas que aportan una información fundamental a los agentes decisores en el área de regulación de precio y financiación, así como en la inclusión de los fármacos en las guías de práctica clínica y farmacoterapéuticas hospitalarias. Por tanto, el objetivo de este análisis es la estimación del impacto presupuestario de la utilización de la combinación fija de EFV-FTC-TDF en el tratamiento de los pacientes infectados por el VIH-1 para el Sistema Nacional de Salud en España, a la vez que se evalúa la repercusión para cada comunidad autónoma en el año 2008.
MétodosModeloEl modelo económico empleado para calcular el impacto presupuestario de la combinación fija de EFV-FTC-TDF se desarrolló con el programa Microsoft Excel 2003, y está estructurado en las secciones siguientes: cálculo de la población diana, características de las alternativas terapéuticas y análisis de impacto presupuestario, basado en las recomendaciones internacionales para el desarrollo de este tipo de análisis16,17.
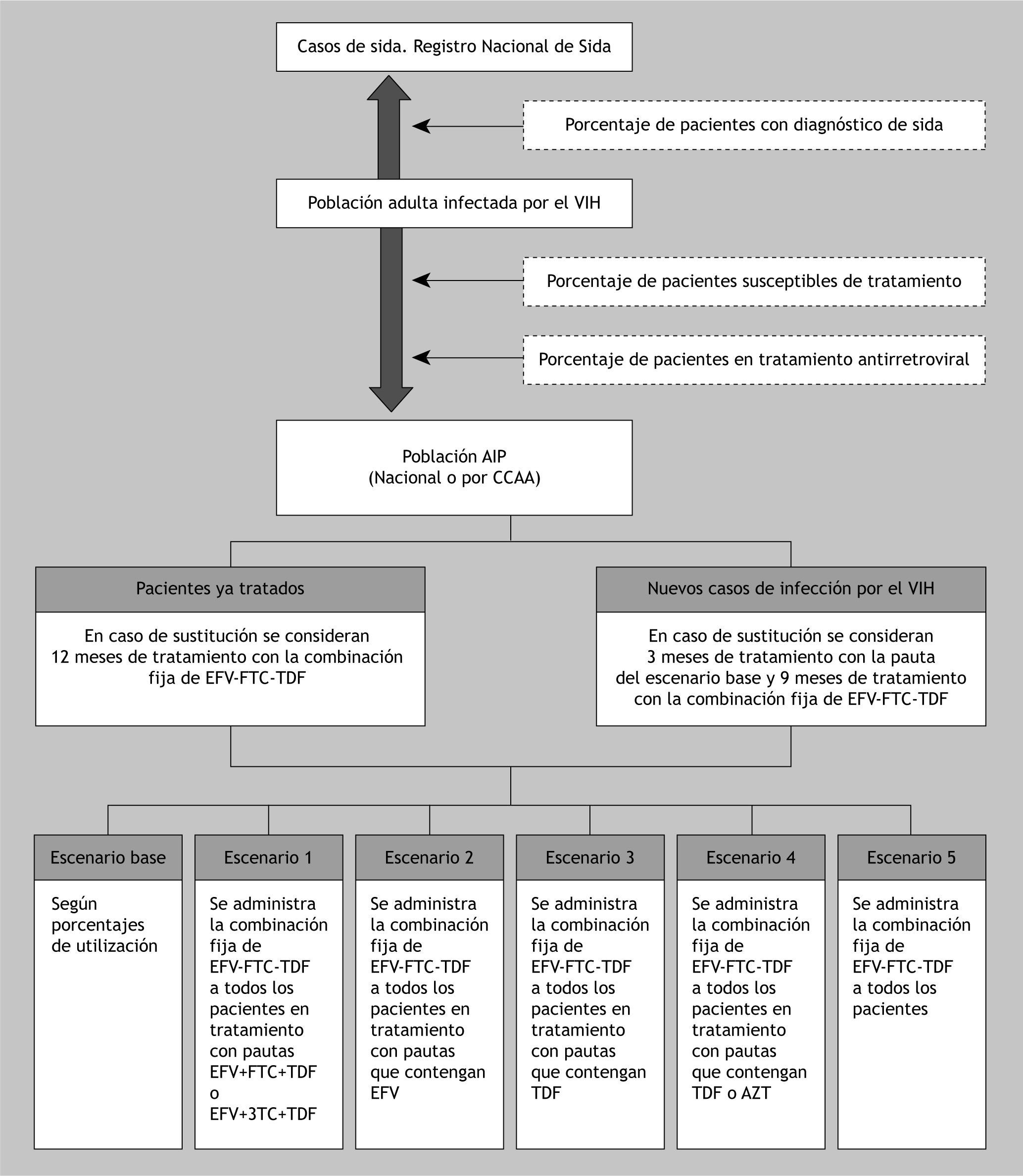
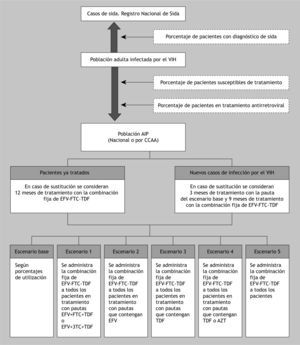
PoblaciónLa población diana del análisis consiste en pacientes adultos (con 15 o más años) infectados con el VIH-1 en tratamiento con TARV. Esta población se obtuvo del registro nacional de casos de sida, que recoge los casos acumulados en el ámbito nacional, por comunidad autónoma y por grupo de edad desde el año 19814, considerado como el año de reconocimiento de la epidemia de sida18.
A partir de los datos de la última encuesta hospitalaria de pacientes VIH/sida, se asumió que esta población supone el 42,9 % del total de casos infectados por el VIH19. Al aplicar este porcentaje, se estableció el total de casos infectados por el VIH, que posteriormente se corrigió con los datos de mortalidad por VIH/sida hasta el año 200520.
Las directrices nacionales e internacionales de tratamiento de pacientes con el VIH recomiendan el inicio del TARV en los pacientes con recuentos de linfocitos CD4 < 350 células/µl5,21. Según los resultados de la encuesta hospitalaria de pacientes de VIH/sida publicados en el 2007, el 60,6 % de los infectados ha tenido algún recuento de CD4 < 200 células/µl19. A partir del grupo de pacientes susceptibles de tratamiento, y suponiendo que el 83,2 %19 está realmente recibiendo TARV, se definió la población diana para el análisis de impacto presupuestario.
La tasa por millón de habitantes de nuevos casos de infección por VIH/sida (69,13 %)22 aplicada en la población mayor o igual de 15 años para el 2008 publicada por el Instituto Nacional de Estadística23, permite calcular la proporción de casos nuevos dentro de la población diana para el análisis. En la figura 1 se representa gráficamente el flujo para el cálculo de la población diana.
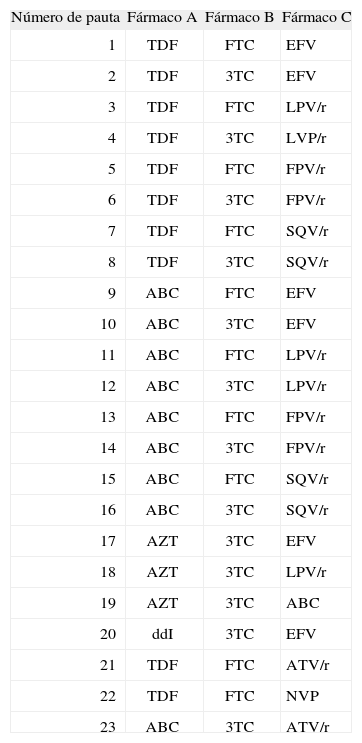
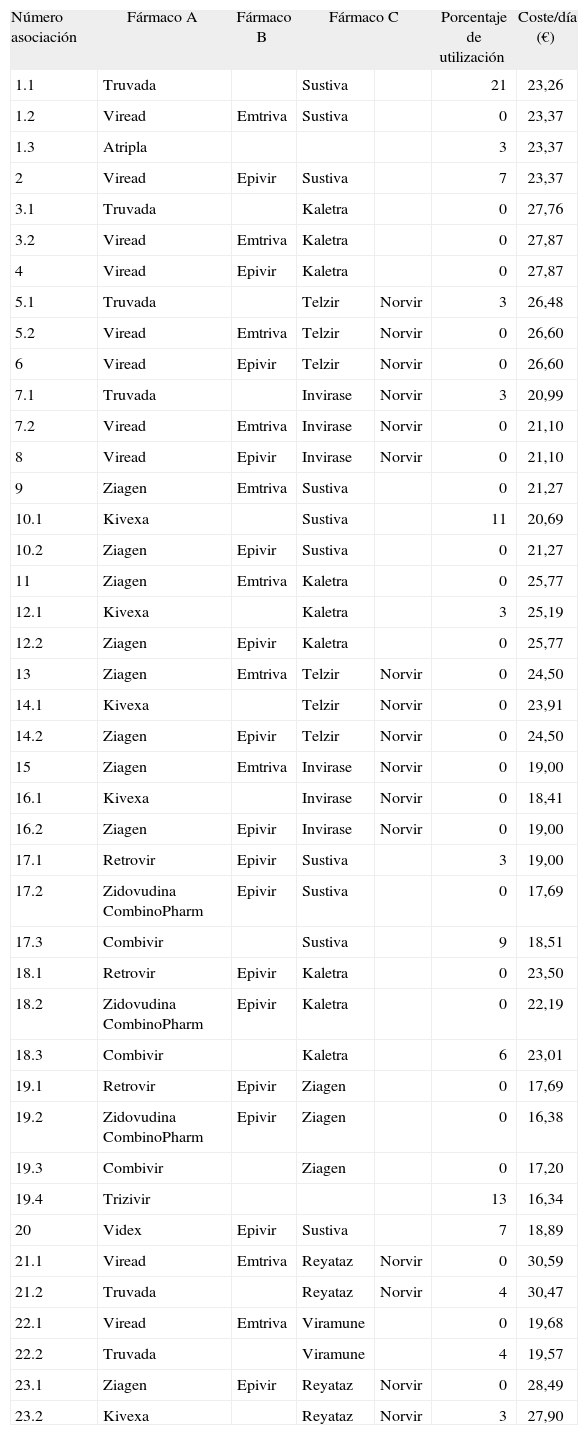
Alternativas terapéuticasLas pautas terapéuticas consideradas en el análisis son las definidas como pautas preferentes en las últimas recomendaciones para el tratamiento de pacientes con VIH elaboradas por GeSida, que son las avaladas por datos de un mayor número de ensayos clínicos de duración prolongada5. Además, se decidió incluir una selección de las pautas definidas como pautas alternativas en las recomendaciones GeSida, que son las que han demostrado su eficacia en ensayos clínicos, pero con menor número de pacientes o durante un tiempo más corto, ya que diversos estudios de mercado han demostrado que, a pesar de no clasificarse como pautas preferentes, se encuentran aún entre las pautas más frecuentemente usadas por los pacientes infectados por el VIH en España. En la tabla 1 se especifican las 23 pautas consideradas y, en la tabla 2, las posibles combinaciones con los medicamentos disponibles para ajustarse a cada pauta, con sus correspondientes porcentajes de utilización obtenidos a partir de estudios de mercado24. Cada asociación se identifica con un código donde la primera cifra indica el número de pauta a la que se refiere y, la segunda cifra, el número correlativo de asociación farmacológica.
Alternativas terapéuticas. Descripción de las pautas consideradas en el análisis
| Número de pauta | Fármaco A | Fármaco B | Fármaco C |
| 1 | TDF | FTC | EFV |
| 2 | TDF | 3TC | EFV |
| 3 | TDF | FTC | LPV/r |
| 4 | TDF | 3TC | LVP/r |
| 5 | TDF | FTC | FPV/r |
| 6 | TDF | 3TC | FPV/r |
| 7 | TDF | FTC | SQV/r |
| 8 | TDF | 3TC | SQV/r |
| 9 | ABC | FTC | EFV |
| 10 | ABC | 3TC | EFV |
| 11 | ABC | FTC | LPV/r |
| 12 | ABC | 3TC | LPV/r |
| 13 | ABC | FTC | FPV/r |
| 14 | ABC | 3TC | FPV/r |
| 15 | ABC | FTC | SQV/r |
| 16 | ABC | 3TC | SQV/r |
| 17 | AZT | 3TC | EFV |
| 18 | AZT | 3TC | LPV/r |
| 19 | AZT | 3TC | ABC |
| 20 | ddI | 3TC | EFV |
| 21 | TDF | FTC | ATV/r |
| 22 | TDF | FTC | NVP |
| 23 | ABC | 3TC | ATV/r |
ABC: abacavir; ATV/r: atazanavir con ritonavir a bajas dosis; AZT: zidovudina; ddI: didanosina; EFV: efavirenz; FPV/r: fosamprenavir con ritonavir a bajas dosis; FTC: emtricitabina; LPV/r: lopinavir con ritonavir a bajas dosis; NVP: nevirapina; SQV/r: saquinavir con ritonavir a bajas dosis; TDF: tenofovir; 3TC: lamivudina.
Combinaciones terapéuticas consideradas. Coste y porcentaje de utilización de cada combinación
| Número asociación | Fármaco A | Fármaco B | Fármaco C | Porcentaje de utilización | Coste/día (€) | |
| 1.1 | Truvada | Sustiva | 21 | 23,26 | ||
| 1.2 | Viread | Emtriva | Sustiva | 0 | 23,37 | |
| 1.3 | Atripla | 3 | 23,37 | |||
| 2 | Viread | Epivir | Sustiva | 7 | 23,37 | |
| 3.1 | Truvada | Kaletra | 0 | 27,76 | ||
| 3.2 | Viread | Emtriva | Kaletra | 0 | 27,87 | |
| 4 | Viread | Epivir | Kaletra | 0 | 27,87 | |
| 5.1 | Truvada | Telzir | Norvir | 3 | 26,48 | |
| 5.2 | Viread | Emtriva | Telzir | Norvir | 0 | 26,60 |
| 6 | Viread | Epivir | Telzir | Norvir | 0 | 26,60 |
| 7.1 | Truvada | Invirase | Norvir | 3 | 20,99 | |
| 7.2 | Viread | Emtriva | Invirase | Norvir | 0 | 21,10 |
| 8 | Viread | Epivir | Invirase | Norvir | 0 | 21,10 |
| 9 | Ziagen | Emtriva | Sustiva | 0 | 21,27 | |
| 10.1 | Kivexa | Sustiva | 11 | 20,69 | ||
| 10.2 | Ziagen | Epivir | Sustiva | 0 | 21,27 | |
| 11 | Ziagen | Emtriva | Kaletra | 0 | 25,77 | |
| 12.1 | Kivexa | Kaletra | 3 | 25,19 | ||
| 12.2 | Ziagen | Epivir | Kaletra | 0 | 25,77 | |
| 13 | Ziagen | Emtriva | Telzir | Norvir | 0 | 24,50 |
| 14.1 | Kivexa | Telzir | Norvir | 0 | 23,91 | |
| 14.2 | Ziagen | Epivir | Telzir | Norvir | 0 | 24,50 |
| 15 | Ziagen | Emtriva | Invirase | Norvir | 0 | 19,00 |
| 16.1 | Kivexa | Invirase | Norvir | 0 | 18,41 | |
| 16.2 | Ziagen | Epivir | Invirase | Norvir | 0 | 19,00 |
| 17.1 | Retrovir | Epivir | Sustiva | 3 | 19,00 | |
| 17.2 | Zidovudina CombinoPharm | Epivir | Sustiva | 0 | 17,69 | |
| 17.3 | Combivir | Sustiva | 9 | 18,51 | ||
| 18.1 | Retrovir | Epivir | Kaletra | 0 | 23,50 | |
| 18.2 | Zidovudina CombinoPharm | Epivir | Kaletra | 0 | 22,19 | |
| 18.3 | Combivir | Kaletra | 6 | 23,01 | ||
| 19.1 | Retrovir | Epivir | Ziagen | 0 | 17,69 | |
| 19.2 | Zidovudina CombinoPharm | Epivir | Ziagen | 0 | 16,38 | |
| 19.3 | Combivir | Ziagen | 0 | 17,20 | ||
| 19.4 | Trizivir | 13 | 16,34 | |||
| 20 | Videx | Epivir | Sustiva | 7 | 18,89 | |
| 21.1 | Viread | Emtriva | Reyataz | Norvir | 0 | 30,59 |
| 21.2 | Truvada | Reyataz | Norvir | 4 | 30,47 | |
| 22.1 | Viread | Emtriva | Viramune | 0 | 19,68 | |
| 22.2 | Truvada | Viramune | 4 | 19,57 | ||
| 23.1 | Ziagen | Epivir | Reyataz | Norvir | 0 | 28,49 |
| 23.2 | Kivexa | Reyataz | Norvir | 3 | 27,90 | |
En el modelo se han considerado un total de 6 escenarios, que puedan representar la situación del tratamiento en España de los pacientes adultos infectados por el VIH-1:
- a)
Escenario base: no considera disponibilidad de la combinación fija de EFV-FTC-TDF en los recursos terapéuticos.
- b)
Escenario 1: considera que los pacientes tratados en el escenario base con las pautas EFV + FTC + TDF o EFV + lamivudina (3TC) + TDF, sustituirían su tratamiento por la combinación fija de EFV-FTC-TDF.
- c)
Escenario 2: los pacientes tratados en el escenario base con alguna pauta que contenga EFV sustituirían la asociación de fármacos por la combinación fija de EFV-FTC-TDF.
- d)
Escenario 3: establece que los pacientes asignados en el escenario base a pautas con TDF sustituirían su tratamiento por la combinación fija de EFV-FTC-TDF.
- e)
Escenario 4: los pacientes tratados con pautas con TDF o zidovudina (AZT) serían tratados con la combinación fija de EFV-FTC-TDF.
- f)
Escenario 5: considera que todos los pacientes se tratarían con la combinación fija de EFV-FTC-TDF.
El análisis de impacto presupuestario se ha elaborado a partir de una perspectiva hospitalaria. Por tanto, los únicos costes incluidos fueron los costes farmacológicos de las asociaciones terapéuticas consideradas. Los resultados obtenidos son los derivados de un año de tratamiento, sin aplicar, por tanto, ninguna tasa de descuento25.
CostesEn línea con la perspectiva hospitalaria del análisis, se han considerado únicamente los costes farmacológicos de los medicamentos necesarios para las posibles combinaciones que permiten cumplir con las pautas consideradas.
El análisis está calculado en función del precio de venta del laboratorio de los medicamentos evaluados. En la tabla 2, se especifica el coste diario del tratamiento con cada combinación terapéutica. Todos los costes se valoran en euros del año 2008.
PremisasEn el análisis se han considerado las premisas siguientes:
- –
El TARV de todos los pacientes en tratamiento consiste en tratamiento triple (combinación de 3 agentes farmacológicos).
- –
El impacto presupuestario considera las posologías autorizadas para cada uno de los medicamentos para tratamientos de mantenimiento, sin considerar ajustes de dosis. En caso de existencia de diferentes presentaciones, se ha escogido la que suponía un número menor de comprimidos/día.
- –
Sobre la población con TARV (población sobre la que se realizan los cálculos del análisis), se ha estimado un porcentaje de casos que correspondería a nuevos pacientes con infección por el VIH. Dado que la combinación fija de EFV-FTC-TDF no tiene indicación en pacientes no tratados previamente, en este subgrupo se han asumido 3 meses de tratamiento con la pauta original y 9 meses de tratamiento con la combinación fija de EFV-FTC-TDF.
- –
Las sustituciones consideradas implican la sustitución de la totalidad de los pacientes asignados a cada pauta terapéutica.
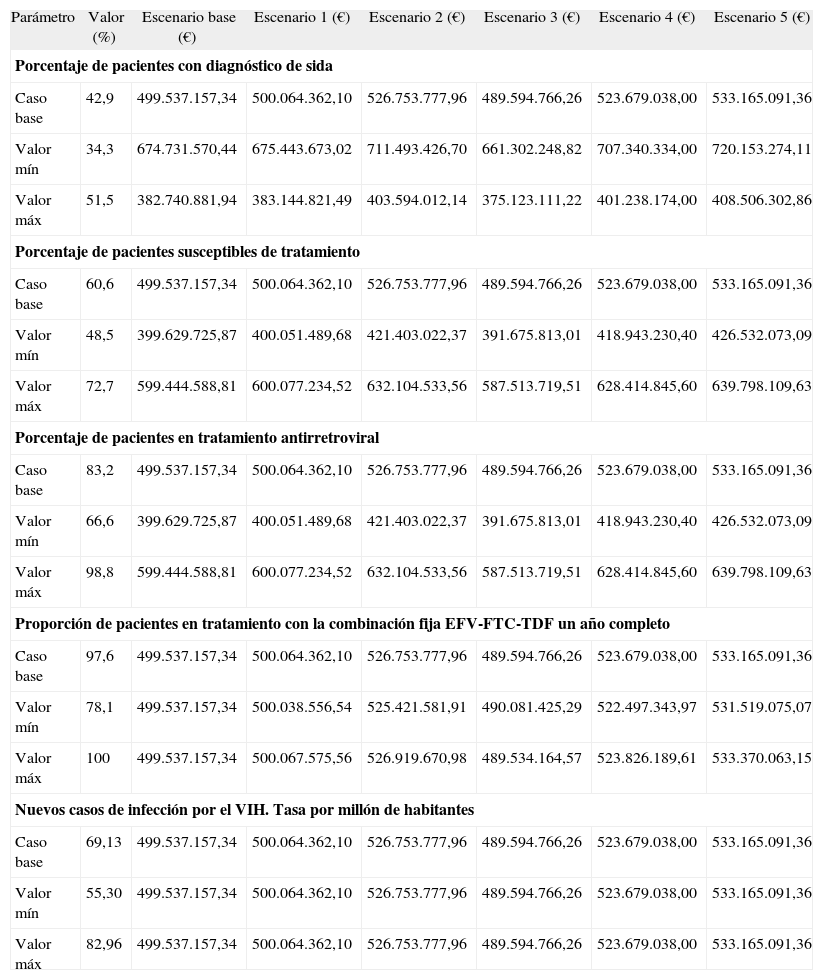
Con objeto de comprobar la robustez del modelo, se ha realizado una serie de análisis de sensibilidad univariantes. El valor de los parámetros con más incertidumbre (porcentaje de pacientes con diagnóstico de sida, porcentaje de pacientes susceptibles de tratamiento, porcentaje de pacientes con TARV, porcentaje de pacientes en tratamiento con la combinación fija de EFV-FTC-TDF un año completo, y tasa por millón de nuevos casos de infección por el VIH) se ha modificado con un incremento o disminución del 20 % para estudiar el efecto en los resultados finales.
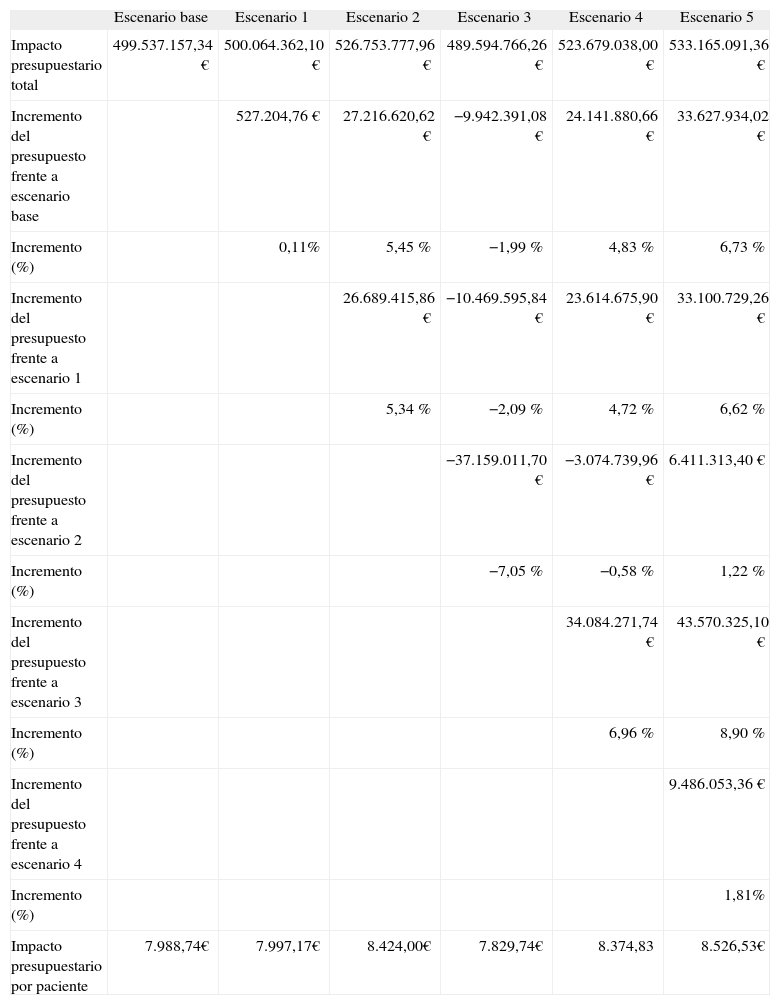
ResultadosCaso baseEn la tabla 3 se muestran los resultados del coste farmacológico total para el sistema sanitario nacional para cada uno de los escenarios evaluados. La inversión por paciente en el ámbito nacional supone 7.988,74 € para el escenario base, 7.997,17; 8424,00; 7.829,74; 8.374,83, y 8.526,53 € para los escenarios 1, 2, 3, 4 y 5, respectivamente, lo que se traduce en un incremento respecto al escenario base del 0,11, el 5,45, el −1,99, el 4,83 y el 6,73 % para los escenarios 1, 2, 3, 4 y 5, respectivamente.
Impacto presupuestario total anual del caso base. Resultados en España
| Escenario base | Escenario 1 | Escenario 2 | Escenario 3 | Escenario 4 | Escenario 5 | |
| Impacto presupuestario total | 499.537.157,34 € | 500.064.362,10 € | 526.753.777,96 € | 489.594.766,26 € | 523.679.038,00 € | 533.165.091,36 € |
| Incremento del presupuesto frente a escenario base | 527.204,76 € | 27.216.620,62 € | −9.942.391,08 € | 24.141.880,66 € | 33.627.934,02 € | |
| Incremento (%) | 0,11% | 5,45 % | −1,99 % | 4,83 % | 6,73 % | |
| Incremento del presupuesto frente a escenario 1 | 26.689.415,86 € | −10.469.595,84 € | 23.614.675,90 € | 33.100.729,26 € | ||
| Incremento (%) | 5,34 % | −2,09 % | 4,72 % | 6,62 % | ||
| Incremento del presupuesto frente a escenario 2 | −37.159.011,70 € | −3.074.739,96 € | 6.411.313,40 € | |||
| Incremento (%) | −7,05 % | −0,58 % | 1,22 % | |||
| Incremento del presupuesto frente a escenario 3 | 34.084.271,74 € | 43.570.325,10 € | ||||
| Incremento (%) | 6,96 % | 8,90 % | ||||
| Incremento del presupuesto frente a escenario 4 | 9.486.053,36 € | |||||
| Incremento (%) | 1,81% | |||||
| Impacto presupuestario por paciente | 7.988,74€ | 7.997,17€ | 8.424,00€ | 7.829,74€ | 8.374,83 | 8.526,53€ |
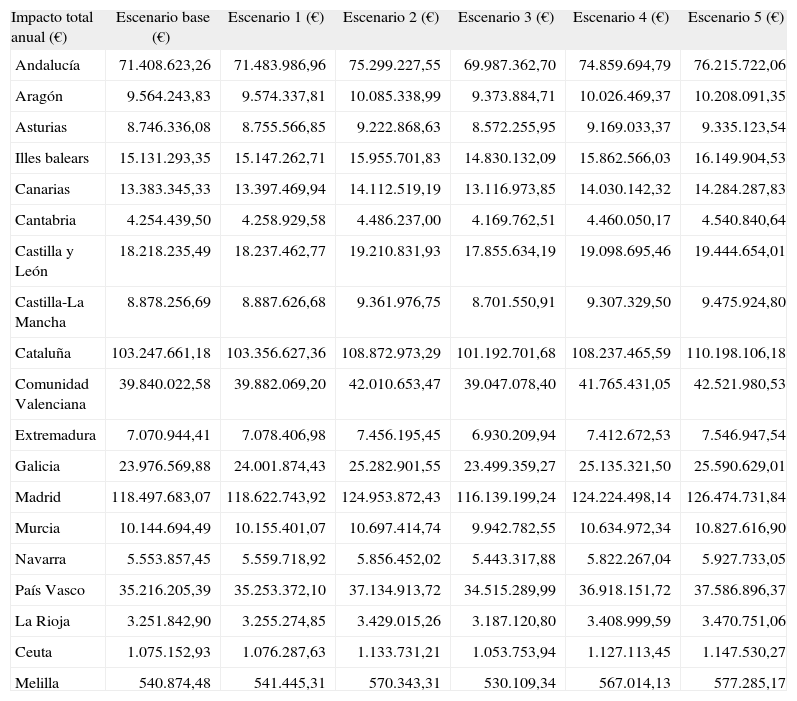
En la tabla 4 se muestran los resultados del análisis de impacto presupuestario por comunidad autónoma.
Impacto presupuestario anual total del caso base. Resultados por comunidad autónoma
| Impacto total anual (€) | Escenario base (€) | Escenario 1 (€) | Escenario 2 (€) | Escenario 3 (€) | Escenario 4 (€) | Escenario 5 (€) |
| Andalucía | 71.408.623,26 | 71.483.986,96 | 75.299.227,55 | 69.987.362,70 | 74.859.694,79 | 76.215.722,06 |
| Aragón | 9.564.243,83 | 9.574.337,81 | 10.085.338,99 | 9.373.884,71 | 10.026.469,37 | 10.208.091,35 |
| Asturias | 8.746.336,08 | 8.755.566,85 | 9.222.868,63 | 8.572.255,95 | 9.169.033,37 | 9.335.123,54 |
| Illes balears | 15.131.293,35 | 15.147.262,71 | 15.955.701,83 | 14.830.132,09 | 15.862.566,03 | 16.149.904,53 |
| Canarias | 13.383.345,33 | 13.397.469,94 | 14.112.519,19 | 13.116.973,85 | 14.030.142,32 | 14.284.287,83 |
| Cantabria | 4.254.439,50 | 4.258.929,58 | 4.486.237,00 | 4.169.762,51 | 4.460.050,17 | 4.540.840,64 |
| Castilla y León | 18.218.235,49 | 18.237.462,77 | 19.210.831,93 | 17.855.634,19 | 19.098.695,46 | 19.444.654,01 |
| Castilla-La Mancha | 8.878.256,69 | 8.887.626,68 | 9.361.976,75 | 8.701.550,91 | 9.307.329,50 | 9.475.924,80 |
| Cataluña | 103.247.661,18 | 103.356.627,36 | 108.872.973,29 | 101.192.701,68 | 108.237.465,59 | 110.198.106,18 |
| Comunidad Valenciana | 39.840.022,58 | 39.882.069,20 | 42.010.653,47 | 39.047.078,40 | 41.765.431,05 | 42.521.980,53 |
| Extremadura | 7.070.944,41 | 7.078.406,98 | 7.456.195,45 | 6.930.209,94 | 7.412.672,53 | 7.546.947,54 |
| Galicia | 23.976.569,88 | 24.001.874,43 | 25.282.901,55 | 23.499.359,27 | 25.135.321,50 | 25.590.629,01 |
| Madrid | 118.497.683,07 | 118.622.743,92 | 124.953.872,43 | 116.139.199,24 | 124.224.498,14 | 126.474.731,84 |
| Murcia | 10.144.694,49 | 10.155.401,07 | 10.697.414,74 | 9.942.782,55 | 10.634.972,34 | 10.827.616,90 |
| Navarra | 5.553.857,45 | 5.559.718,92 | 5.856.452,02 | 5.443.317,88 | 5.822.267,04 | 5.927.733,05 |
| País Vasco | 35.216.205,39 | 35.253.372,10 | 37.134.913,72 | 34.515.289,99 | 36.918.151,72 | 37.586.896,37 |
| La Rioja | 3.251.842,90 | 3.255.274,85 | 3.429.015,26 | 3.187.120,80 | 3.408.999,59 | 3.470.751,06 |
| Ceuta | 1.075.152,93 | 1.076.287,63 | 1.133.731,21 | 1.053.753,94 | 1.127.113,45 | 1.147.530,27 |
| Melilla | 540.874,48 | 541.445,31 | 570.343,31 | 530.109,34 | 567.014,13 | 577.285,17 |
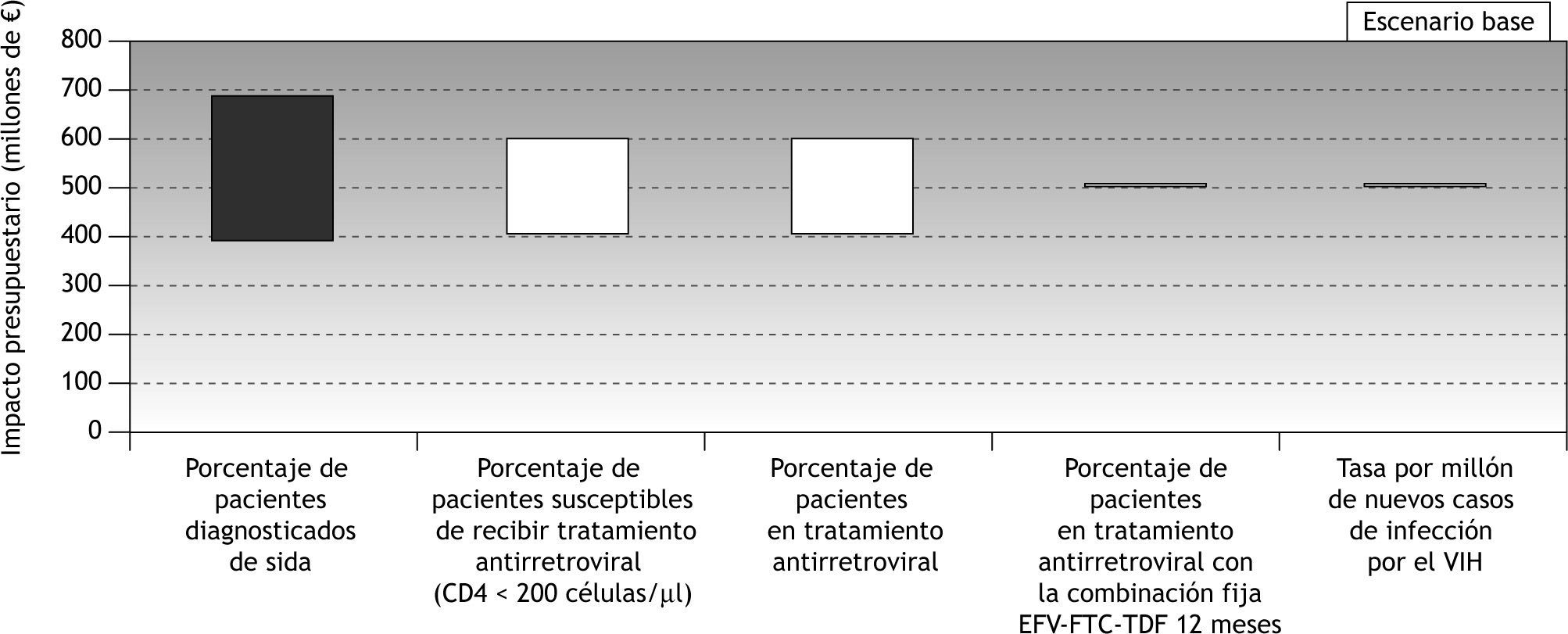
En la tabla 5 se recogen los resultados del análisis de sensibilidad univariante realizado. El análisis avala la robustez del modelo. A partir de estos resultados, se deduce que el parámetro con mayor influencia en el modelo es el número de pacientes con TARV, ya que obviamente en todos los escenarios el impacto presupuestario se incrementa a medida que aumenta el número de pacientes tratados. Por otra parte, ni el porcentaje de pacientes en tratamiento con la combinación fija de EFV-FTC-TDF durante el año completo, ni la tasa por millón de habitantes de nuevos casos de infección por el VIH afectan al impacto presupuestario total. En la figura 2 se representa gráficamente este análisis de sensibilidad en forma de diagrama de tornado.
Impacto presupuestario total anual. Análisis de sensibilidad
| Parámetro | Valor (%) | Escenario base (€) | Escenario 1 (€) | Escenario 2 (€) | Escenario 3 (€) | Escenario 4 (€) | Escenario 5 (€) |
| Porcentaje de pacientes con diagnóstico de sida | |||||||
| Caso base | 42,9 | 499.537.157,34 | 500.064.362,10 | 526.753.777,96 | 489.594.766,26 | 523.679.038,00 | 533.165.091,36 |
| Valor mín | 34,3 | 674.731.570,44 | 675.443.673,02 | 711.493.426,70 | 661.302.248,82 | 707.340.334,00 | 720.153.274,11 |
| Valor máx | 51,5 | 382.740.881,94 | 383.144.821,49 | 403.594.012,14 | 375.123.111,22 | 401.238.174,00 | 408.506.302,86 |
| Porcentaje de pacientes susceptibles de tratamiento | |||||||
| Caso base | 60,6 | 499.537.157,34 | 500.064.362,10 | 526.753.777,96 | 489.594.766,26 | 523.679.038,00 | 533.165.091,36 |
| Valor mín | 48,5 | 399.629.725,87 | 400.051.489,68 | 421.403.022,37 | 391.675.813,01 | 418.943.230,40 | 426.532.073,09 |
| Valor máx | 72,7 | 599.444.588,81 | 600.077.234,52 | 632.104.533,56 | 587.513.719,51 | 628.414.845,60 | 639.798.109,63 |
| Porcentaje de pacientes en tratamiento antirretroviral | |||||||
| Caso base | 83,2 | 499.537.157,34 | 500.064.362,10 | 526.753.777,96 | 489.594.766,26 | 523.679.038,00 | 533.165.091,36 |
| Valor mín | 66,6 | 399.629.725,87 | 400.051.489,68 | 421.403.022,37 | 391.675.813,01 | 418.943.230,40 | 426.532.073,09 |
| Valor máx | 98,8 | 599.444.588,81 | 600.077.234,52 | 632.104.533,56 | 587.513.719,51 | 628.414.845,60 | 639.798.109,63 |
| Proporción de pacientes en tratamiento con la combinación fija EFV-FTC-TDF un año completo | |||||||
| Caso base | 97,6 | 499.537.157,34 | 500.064.362,10 | 526.753.777,96 | 489.594.766,26 | 523.679.038,00 | 533.165.091,36 |
| Valor mín | 78,1 | 499.537.157,34 | 500.038.556,54 | 525.421.581,91 | 490.081.425,29 | 522.497.343,97 | 531.519.075,07 |
| Valor máx | 100 | 499.537.157,34 | 500.067.575,56 | 526.919.670,98 | 489.534.164,57 | 523.826.189,61 | 533.370.063,15 |
| Nuevos casos de infección por el VIH. Tasa por millón de habitantes | |||||||
| Caso base | 69,13 | 499.537.157,34 | 500.064.362,10 | 526.753.777,96 | 489.594.766,26 | 523.679.038,00 | 533.165.091,36 |
| Valor mín | 55,30 | 499.537.157,34 | 500.064.362,10 | 526.753.777,96 | 489.594.766,26 | 523.679.038,00 | 533.165.091,36 |
| Valor máx | 82,96 | 499.537.157,34 | 500.064.362,10 | 526.753.777,96 | 489.594.766,26 | 523.679.038,00 | 533.165.091,36 |
EFV: efavYenz; FTC: emtricitabina; TDF: tenofovY; VIH: vYus de la inmunodeficiencia humana.
Es habitual encontrar en la bibliografía publicaciones de evaluaciones económicas de fármacos antirretrovirales, que demuestran una relación coste-efectividad y/o coste-utilidad inferior al umbral de eficiencia normalmente aceptado en cada país26,27. Sin embargo, la introducción de nuevos medicamentos suele conllevar una financiación adicional que no siempre asegura la maximización de los beneficios en salud. Por este motivo, los decisores necesitan disponer de información complementaria del impacto farmacológico en el presupuesto28.
El presente trabajo, a través de un modelo económico, aporta datos sobre el impacto presupuestario en España, en el ámbito nacional y por comunidad autónoma, de una nueva combinación de fármacos antirretrovirales. El modelo desarrollado para este estudio se ha estructurado en 2 partes, cálculo de la población diana y análisis presupuestario, que se pueden manejar de manera independiente, con lo que así se asegura su sencillez y flexibilidad. Además, el hecho de considerar únicamente los costes directos farmacológicos debe interpretarse como un aval de la transparencia de la herramienta, ya que los resultados aportados no se ven artefactados por ningún otro factor diferente al coste del presupuesto farmacológico.
Los resultados muestran que en el escenario base, considerado como una estimación del impacto del tratamiento de la infección por el VIH-1 en España, el coste anual por paciente es de 7.988,74 €. La sustitución efectuada en el escenario 1, en el que se administra la combinación fija de EFV-FTC-TDF a pacientes en tratamiento con EFV + FTC + TDF o EFV + 3TC + TDF, supone una modificación del tratamiento en el 24 % de los pacientes, y conllevaría un incremento del presupuesto de 8,43 €/paciente/año (coste anual/paciente de 7.997,17 €). La sustitución en el escenario 2 afectaría al 54 % y supondría la administración de la combinación fija de EFV-FTC-TDF a todos los pacientes en tratamiento con alguna pauta que contenga EFV. Esta modificación originaría un incremento en el escenario base de 435,26 €/paciente/año, con un coste anual por paciente de 8.424,00€. El escenario 3 prevé la sustitución por la combinación fija de EFV-FTC-TDF en los pacientes tratados con alguna pauta que incluya TDF. Este escenario afectaría al 45 % de los pacientes, que ocasionaría un ahorro de 159 €/paciente/año, con un coste anual por paciente de 7.829,74 €. En el escenario 4, en el que se plantea la sustitución por la combinación fija de EFV-FTC-TDF de los pacientes tratados con pautas que incluyan TDF o AZT, este cambio afectaría al 76 %, y originaría un incremento del coste respecto al escenario base de 386,09 €/paciente/año (coste anual/paciente de 8.374,83 €). La última situación considerada, el escenario 5, es una situación extrema en la que se asume la administración de la combinación fija de EFV-FTC-TDF al 100 % de los pacientes, con un incremento de 537,79 €/paciente y un coste anual por paciente de 8.526,53 €.
Los resultados por comunidad autónoma son proporcionales el peso relativo a nivel poblacional. Por esta razón, las 3 comunidades autónomas más pobladas (Madrid, Cataluña y Andalucía) suponen el 59 % del impacto presupuestario total del VIH en España. Sin embargo, aunque la infección por el VIH/sida se ha extendido por todas las provincias y comunidades autónomas españolas, los diferentes momentos en los que irrumpió la infección por el VIH, las características sociodemográficas y el grado de penetración de los distintos estilos de vida en cada lugar han contribuido a establecer importantes diferencias geográficas en la incidencia de esta enfermedad. Es el caso del País Vasco, Ceuta y Baleares, comunidades con altas incidencias de sida y en las que la inversión para el tratamiento de la infección por el VIH supone un valor per cápita de 19,11; 18,79, y 17,72 €, respectivamente, en el escenario base, por encima de los 17,24 € per cápita de Cataluña y sólo superados por los 23,13 € per cápita de Madrid.
Los resultados económicos del modelo se basan en la estimación previa del número de pacientes a considerar. El análisis de sensibilidad muestra que el parámetro con una influencia mayor en los resultados es el porcentaje de casos de pacientes diagnosticados de sida. A pesar de la importancia de la epidemia de infección por el VIH y el sida en España, que durante la década de 1990 mantuvo a España en cabeza de los países con mayor incidencia de esta enfermedad3,29, no es fácil determinar un valor fiable y ampliamente aceptado que estime la proporción de casos infectados por el VIH que cumplen con los criterios para ser diagnosticados de sida, y esa dificultad es, por tanto, la principal limitación de nuestro trabajo. Aun así, el dato de 124.021 pacientes vivos con infección por el VIH resultante calculado mediante el modelo interactivo, se encuentra dentro del rango de 110.000 a 150.000 casos estimado por el Centro Nacional de Epidemiología30. De la misma forma, la estimación de 2.600 nuevos casos anuales de infección por el VIH en toda España es similar al dato de 2.300 nuevos casos en el año 2000 proporcionado por el mismo centro3, lo que avala la robustez del modelo a pesar de las limitaciones comentadas.
Otra de las posibles limitaciones de este modelo es la asunción de sustituciones de la totalidad de pacientes tratados en cada pauta, lo que puede no ser totalmente representativo de la realidad, ya que no todos los pacientes asignados a las pautas susceptibles de ser modificadas cambiarían su tratamiento habitual por la combinación fija de EFV-FTC-TDF. Esta situación llevaría a unos resultados intermedios entre los del escenario base y los del escenario concreto que se quisiera aplicar.
Asimismo, el modelo analiza únicamente el impacto presupuestario por coste farmacológico del tratamiento de la infección por el VIH, pero no hay que olvidar que otros aspectos específicos de las diferentes alternativas terapéuticas, como el perfil de reacciones adversas y aspectos relacionados con el seguimiento clínico, pueden requerir un consumo de recursos diferente y, por tanto, influir en el impacto presupuestario global.
Por otra parte, la utilización de una combinación a dosis fijas supone una simplificación del TARV, entendiendo como tal el cambio de un tratamiento con la que se llega a la supresión virológica absoluta por otra más sencilla que mantenga esta supresión. Se ha demostrado que las simplificaciones de los tratamientos mejoran tanto la calidad de vida del paciente, como su adherencia al tratamiento, al reducir el número de comprimidos, la frecuencia de administración, eliminar las restricciones alimentarias, mejorar la toxicidad actual y/o reducir el riesgo de interacciones5,31. En el presente caso, la combinación fija de EFV-FTC-TDF supone una reducción del número de comprimidos o de la frecuencia de administración respecto a las pautas originales, lo que, a igualdad de eficacia, se ha demostrado como opción preferida por los pacientes infectados por el VIH32.
En conclusión, la utilización de la combinación fija de EFV-FTC-TDF en el tratamiento de pacientes adultos infectados por el VIH-1 podría conllevar ligeros aumentos, o incluso ahorros, en el presupuesto total. Además, esta nueva formulación estaría asociada con una disminución del número de tomas por parte del paciente, lo que se traduciría en una mejoría de la calidad de vida, del cumplimiento y la adherencia al tratamiento.
AgradecimientosEste trabajo ha sido realizado con una ayuda no condicionada de Gilead Sciences y Bristol Myers Squibb.