La lenalidomida (LDM) es un agente inmunomodulador y antiangiogénico que ha demostrado su eficacia en varios trastornos hematológicos (mieloma múltiple [MM], metaplasma mieloide con mielofibrosis [MF] y síndrome mielodisplásico [SMD]). El objetivo de este estudio fue evaluar la efectividad y la tolerabilidad de la LDM en nuestros pacientes.
MétodoEstudio retrospectivo observacional que incluyó a los pacientes de nuestro hospital en seguimiento por la consulta de Hematología que fueron diagnosticados de MM, MF y SMD, y que eran candidatos a recibir tratamiento con LDM. La evaluación de la eficacia se realizó transcurridos aproximadamente 4 ciclos desde el inicio del tratamiento.
ResultadosDesde febrero de 2007 hasta marzo de 2008 fueron 16 los pacientes candidatos a recibir tratamiento con LDM (50% mujeres, 50% varones, con una edad media de 69,6 años), aunque 3 de ellos no llegaron a iniciarlo. De los 6 pacientes con MM tratados en nuestro hospital, 5 de ellos obtuvieron algún tipo de respuesta (83,3%). De los 4 pacientes con MF, 2 (66,6%) experimentaron algún tipo de respuesta al tratamiento. De los 6 pacientes diagnosticados de SMD, únicamente se inició el tratamiento en 3, y en 2 de ellos se tuvo que suspender por distintas causas. Destacamos que únicamente hubo que suspender el tratamiento en dos de los 13 pacientes que lo iniciaron (15,4%) por los efectos adversos.
ConclusiónLa LDM consigue, con buena tolerancia, beneficio clínico mantenido sobre todo en el MM y la MF. Son necesarios más estudios que profundicen en la duración del tratamiento, en nuevas indicaciones y en el uso de tratamientos combinados con otros agentes.
Lenalidomide (LDM) is an immunomodulatory and anti-angiogenic drug which has been shown to be effective in several haematological disorders (multiple myeloma [MM], myeloid metaplasia with myelofibrosis [MF] and myelodysplastic syndrome [MDS]). The objective of this study is to evaluate the effectiveness and tolerability of LDM in our patients.
MethodRetrospective observational study which included patients at our hospital who were monitored by the haematology unit, diagnosed with MM, MF and MDS and candidates for LDM treatment. Treatment effectiveness was assessed after approximately 4 cycles of treatment.
ResultsBetween February 2007 and March 2008, 16 patients were listed as candidates for receiving treatment with LDM (50% female/50% male, with a mean age of 69.6 years); of these candidates, 3 never initiated treatment. Five of the six patients with MM treated at our hospital obtained some sort of response (83.3%). Of the 4 patients with MF, 2 (66.6%) experienced some sort of response to treatment. Of the 6 patients diagnosed with MDS, treatment was initiated in 3, and it had to be suspended in 2 cases due to different reasons. Treatment only had to be suspended in two of the 13 patients who began it (15.4%) due to adverse effects (AE).
ConclusionLDM is well-tolerated and produces sustained clinical benefits, especially in MM and MF. More studies are needed for in-depth examination of treatment duration, new indications and the use of treatments combined with other drugs.
La lenalidomida (LDM) es un agente inmunomodulador y antiangiogénico análogo de la talidomida, pero de mayor potencia y mejor tolerado. Los efectos adversos (EA) más frecuentes son la neutropenia y la trombopenia, que suelen aparecer en las primeras ocho semanas del tratamiento. Ha demostrado su eficacia en varios trastornos hematológicos (mieloma múltiple [MM], metaplasma mieloide con mielofibrosis [MF] y síndrome mielodisplásico [SMD]) y se está investigando su utilidad en distintos tumores sólidos, como el cáncer de próstata, el melanoma o los gliomas1.
En principio, el medicamento se conseguía por la vía del uso compasivo en todas sus indicaciones, pero recientemente se ha aprobado en España, en combinación con dexametasona, como especialidad de diagnóstico hospitalario para el tratamiento del MM en pacientes que hayan recibido al menos un tratamiento previo.
Cada vez son más los estudios que hablan sobre experiencias en el manejo de pacientes con MM tratados con nuevos fármacos2, así como sobre las estrategias para manejar los EA sin necesidad de disminuir o suspender el tratamiento3. Sin embargo, escasean las referencias en otras patologías como la MF y el SMD. Por este motivo, consideramos de interés comunicar nuestra experiencia en pacientes con distintas patologías, respuesta y tolerancia al tratamiento.
MétodoEstudio retrospectivo observacional que incluyó a los pacientes de nuestro hospital en seguimiento por la consulta de Hematología que fueron diagnosticados de MM, MF o SMD y candidatos a recibir tratamiento con LDM. Se descartó a los pacientes que aún siendo diagnosticados con alguna de estas patologías no fueron propuestos para recibirla por no cumplir los criterios de inclusión expuestos en los protocolos de tratamiento. El reclutamiento de los pacientes se llevó a cabo durante un periodo de 13 meses (febrero de 2007–marzo de 2008) y entraron a formar parte del estudio un total de 16 pacientes. El Servicio de Hematología elaboró los protocolos diagnosticoterapéuticos para el uso de la LDM, que fueron aprobados en la Comisión de Farmacia y Terapéutica.
Según estos protocolos, el tratamiento consistía en 8 ciclos (fase de inducción y consolidación) de 21 días tomando 25mg (MM) o 10mg (MFM y SMD) de LDM y una semana de descanso. Los criterios de inclusión que debían cumplir los pacientes para ser tratados con LDM fueron los siguientes: a) en el MM, 2.a línea de tratamiento en pacientes con neuropatía que pudiera agravarse con bortezomib o talidomida o 3.a línea en pacientes refractarios o con progresión precoz tras haber empleado bortezomib o talidomida; b) en la MF, tratamiento en pacientes con neuropatía que pudiera agravarse con talidomida o 2.a línea en pacientes refractarios a talidomida, y c) en el SMD, pacientes con deleción 5q y dependencia transfusional, pacientes refractarios al espaciamiento con eritropoyetina (EPO), cualquiera que fuera el cariotipo, o pacientes <80 años con buen performance status, dependencia transfusional y mal pronóstico.
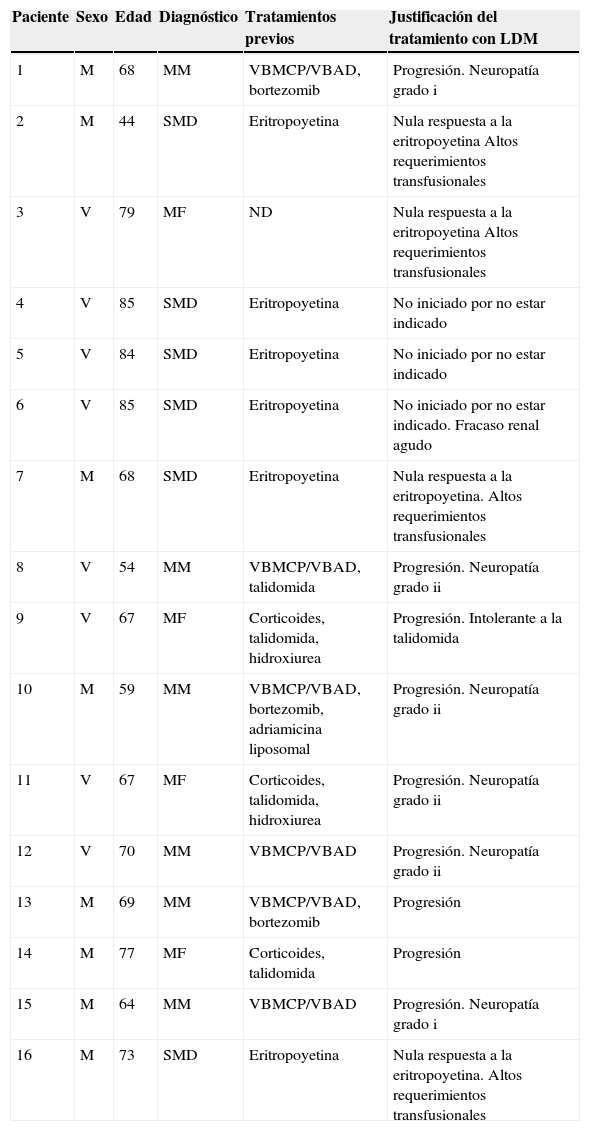
En la tabla 1 se recogen las características de los pacientes, así como los tratamientos anteriores recibidos y los motivos que obligaron al uso de LDM.
Características de los pacientes candidatos al tratamiento con lenalidomida
| Paciente | Sexo | Edad | Diagnóstico | Tratamientos previos | Justificación del tratamiento con LDM |
| 1 | M | 68 | MM | VBMCP/VBAD, bortezomib | Progresión. Neuropatía grado i |
| 2 | M | 44 | SMD | Eritropoyetina | Nula respuesta a la eritropoyetina Altos requerimientos transfusionales |
| 3 | V | 79 | MF | ND | Nula respuesta a la eritropoyetina Altos requerimientos transfusionales |
| 4 | V | 85 | SMD | Eritropoyetina | No iniciado por no estar indicado |
| 5 | V | 84 | SMD | Eritropoyetina | No iniciado por no estar indicado |
| 6 | V | 85 | SMD | Eritropoyetina | No iniciado por no estar indicado. Fracaso renal agudo |
| 7 | M | 68 | SMD | Eritropoyetina | Nula respuesta a la eritropoyetina. Altos requerimientos transfusionales |
| 8 | V | 54 | MM | VBMCP/VBAD, talidomida | Progresión. Neuropatía grado ii |
| 9 | V | 67 | MF | Corticoides, talidomida, hidroxiurea | Progresión. Intolerante a la talidomida |
| 10 | M | 59 | MM | VBMCP/VBAD, bortezomib, adriamicina liposomal | Progresión. Neuropatía grado ii |
| 11 | V | 67 | MF | Corticoides, talidomida, hidroxiurea | Progresión. Neuropatía grado ii |
| 12 | V | 70 | MM | VBMCP/VBAD | Progresión. Neuropatía grado ii |
| 13 | M | 69 | MM | VBMCP/VBAD, bortezomib | Progresión |
| 14 | M | 77 | MF | Corticoides, talidomida | Progresión |
| 15 | M | 64 | MM | VBMCP/VBAD | Progresión. Neuropatía grado i |
| 16 | M | 73 | SMD | Eritropoyetina | Nula respuesta a la eritropoyetina. Altos requerimientos transfusionales |
LDM: lenalidomida; M: mujer; MF: mielofibrosis; MM: mieloma múltiple; ND: información no disponible; SMD: síndrome mielodisplásico; V: varón; VBMCP/VBAD: vincristina, carmustina, melfalán, ciclofosfamida y prednisona/vincristina, carmustina, doxorrubicina y dexametasona.
En la primera dispensación de medicación por el Servicio de Farmacia el farmacéutico informó al paciente sobre las características del fármaco, la forma de administración, la conservación, los EA y las precauciones especiales para tomar dado su potencial teratógeno. En cada una de las visitas mensuales se realizó una entrevista al paciente sobre la tolerancia y los EA.
Se consideró que el paciente con MM respondió al tratamiento cuando se produjo una reducción en la cifra de paraproteína (PP) o una desaparición de esta por inmunofijación. Por el contrario, la ausencia de respuesta se estableció cuando no hubo reducción en esa cifra o la enfermedad progresó. En el caso de la MF y el SMD, la eficacia se midió en función de las cifras de hemoglobina, la independencia o disminución de las necesidades trasfusionales, la necesidad de soporte y/o espaciamiento con EPO, la tendencia a la normalidad en las cifras de leucocitos/plaquetas y la esplenomegalia.
Para valorar la tolerancia y la seguridad del tratamiento se utilizaron las cifras de leucocitos y plaquetas.
Los datos se obtuvieron del programa de dispensación a pacientes externos (Farmasyst®) y de la revisión de su historia clínica.
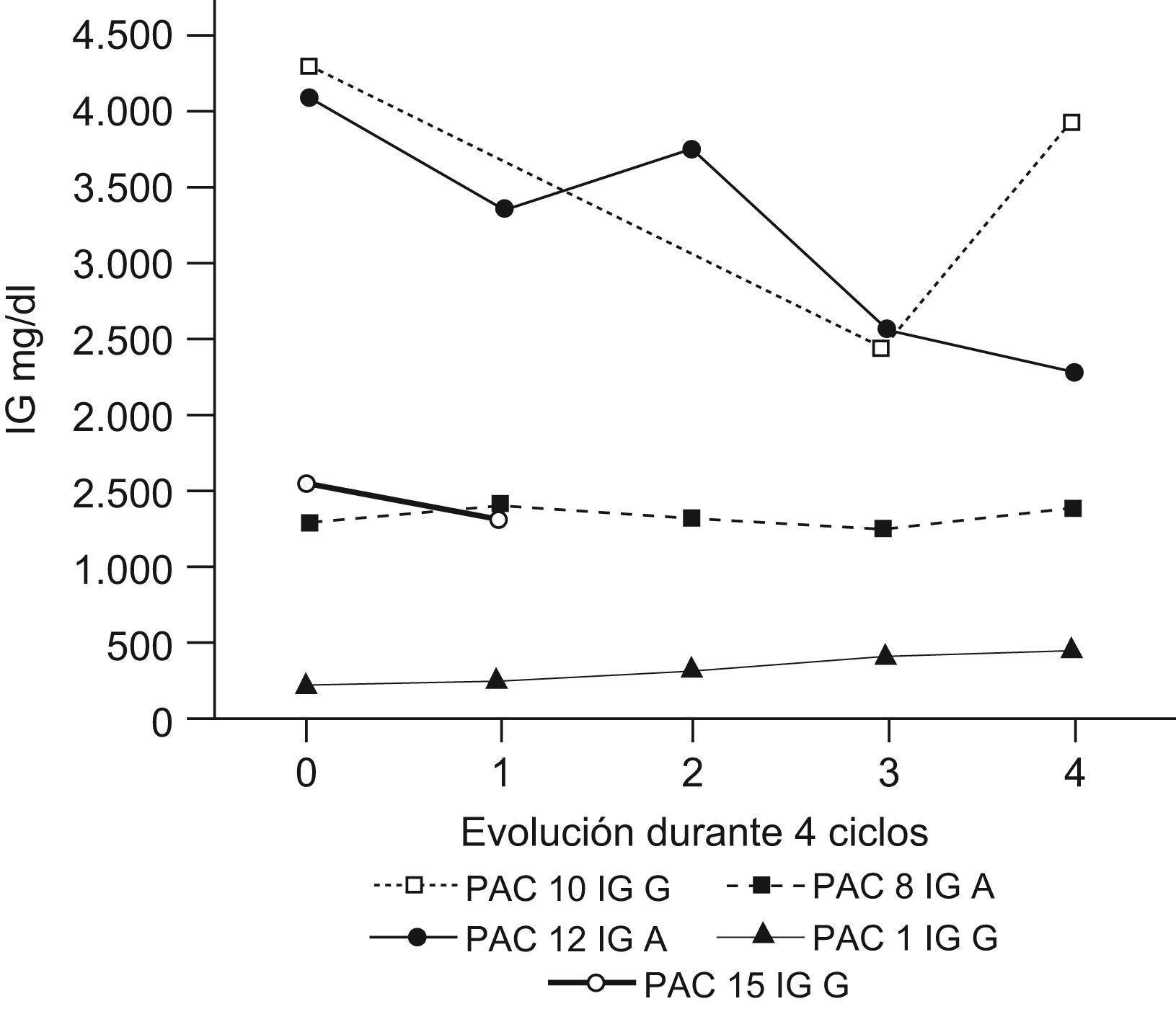
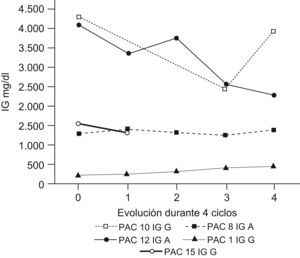
ResultadosDurante el periodo de estudio (febrero de 2007–marzo de 2008) se incluyó a 16 pacientes candidatos a recibir tratamiento con LDM. La proporción de varones y mujeres candidatos a iniciar el tratamiento fue del 50% con una media de edad de 69,6 años. La valoración del tratamiento con LDM se realizó tras haber recibido el 4.o ciclo, momento en el que, según el protocolo, debe valorarse la respuesta a este. En caso de ausencia de esta se abandona el tratamiento. En la tabla 2 describimos las causas por las que hubo pacientes que no iniciaron nunca el tratamiento (4, 5 y 6) y los motivos por los que hubo que suspender otros ya iniciados (7, 2, 3). Cinco pacientes completaron los 8 ciclos de tratamiento1,8–11. En la tabla 3 resumimos la evolución de los pacientes tratados con LDM.
Motivo de no inicio o discontinuidad del tratamiento con lenalidomida
| Paciente | Diagnóstico | Motivo no inclusión/retirada del tratamiento |
| 4 | SMD | Edad >80 años (no cumple el protocolo) |
| 5 | SMD | Edad >80 años (no cumple el protocolo) |
| 6 | SMD | Edad >80 años (no cumple el protocolo). Fracaso renal agudo |
| 7 | SMD 5q− | No llegó a terminar el 1.er ciclo ya que evolucionó a una leucemia linfoblástica aguda |
| 2 | SMD | En el 4.o ciclo y como resultado de la neutropenia se redujo la dosis a la mitad y se añadió filgastrim, lo que consiguió recuperar las cifras de leucocitos. Finalmente, se suspendió el tratamiento por falta de eficacia y mala tolerancia |
| 3 | MF | Se suspendió el tratamiento en el 2.o ciclo a pesar de haber reducido la dosis por exantema |
MF: mielofibrosis; SMD: síndrome mielodisplásico.
Resumen de la respuesta y la evolución de los pacientes tratados con lenalidomida
| Paciente | Diagnóstico | Respuesta/evolución |
| 1 | MM oligosecretor | Valoración clínica de la respuesta. A los 2 meses de completar el tratamiento con LDM desarrolló múltiples plasmocitomas cutáneos por lo que se valora el reinicio de tratamiento |
| 8 | MM deleción 13 q | No respondedor. Marcador de mal pronóstico |
| 10 | MM | Buena respuesta. Al mes de cesar el tratamiento sufrió un aumento en la PP por lo que se inició tratamiento con bortezomib |
| 12 | MM | Buena respuesta |
| 13 | MM | No se dispone de cifra de PP. Mejoró otros marcadores (reducción de LDH en un 36%). Mejoró clínica y radiológicamente. Desaparición de plasmocitoma costal masivo |
| 15 | MM | Reducción del 12% en la cifra de PP. En el momento de publicar el estudio estaba recibiendo el 5.o ciclo |
| 3 | MF | Se suspendió el tratamiento en el 2.o ciclo por exantema |
| 9 | MF | Reducción de la esplenomegalia (40%) y la cifra de leucocitos (26%). Al suspender el tratamiento por edemas se produjo un aumento de leucocitos y del tamaño del bazo, reiniciándose el tratamiento |
| 11 | MF | Reducción importante de la esplenomegalia, así como reducción progresiva de la terapia de soporte hematopoyético |
| 14 | MF | Recibiendo el 4.o ciclo sin manifestar mejoría en los parámetros sanguíneos |
| 7 | SMD 5q− | Desarrolló leucemia linfobástica durante el 1.er ciclo |
| 2 | SMD | Suspensión del tratamiento tras el 4.o ciclo por falta de respuesta y mala tolerancia (desarrollo de neutropenia) |
| 16 | SMD | Ha desarrollado eritema durante el 2.o ciclo que ha sido controlado con tratamiento de soporte. Ha iniciado el 3.er ciclo con reducción de la dosis |
LDM: lenalidomida; MF: mielofibrosis; MM: mieloma múltiple; PP: paraproteína; SMD: síndrome mielodisplásico.
De los 6 pacientes tratados en nuestro hospital, 5 de ellos respondieron al tratamiento (tasa de respuesta del 83,3%). De estos, 2 pacientes (10 y 12; el 40%) experimentaron una reducción de los niveles de PP en el plasma en al menos un 50% y otro paciente (13) tuvo una respuesta clínica muy significativa (con una desaparición del plasmocitoma costal y una reducción del 36% en la cifra de LDH). El paciente 1 fue diagnosticado de MM oligosecretor que se manifestaba más que cuantitativamente (cifra de PP) con la sintomatología general, por lo que no pudimos valorar la eficacia del tratamiento en función de los niveles de PP. En este caso, la mejoría fue, sobre todo, clínica y radiológica con disminución de la afectación ósea que se manifestó con reducción del dolor óseo, que era la principal limitación antes de iniciar el tratamiento en este paciente.
A los dos meses de finalizar la LDM desarrolló múltiples plasmocitomas cutáneos con adecuada respuesta tras reiniciar 2 ciclos más de LDM. Hubo un paciente (15) en el que se negativizó la inmunofijación tras recibir el 5.o ciclo de tratamiento. El único paciente diagnosticado de MM que no respondió, aunque tampoco se produjo progresión de la enfermedad, fue el paciente 8 que presentaba deleción del gen 13q, marcador de mal pronóstico. Aun así se está valorando la continuación del tratamiento hasta la aparición de toxicidad o la progresión de la enfermedad. En uno de los pacientes que respondió inicialmente, se tuvo que recurrir a otras terapias (bortezomib) al mes de finalizar la LDM, por signos de progresión de la enfermedad.
Pacientes con mielofibrosis tratados con lenalidomidaDe los 4 pacientes que empezaron el tratamiento con LDM, en uno tuvo que ser suspendido por eritema al inicio del 2.o ciclo (paciente 3). Dos pacientes (9 y 11) tuvieron algún tipo de respuesta al tratamiento (66,6%). En el paciente 9 la esplenomegalia se redujo en un 40% tras 5 ciclos y los leucocitos pasaron de 35.000 a 9.100/μl (26%) en el 4.o. Hubo que retrasar el 8.o ciclo por presentación de edemas tibiomaleolares y conjuntivales que no respondieron a diuréticos. Durante el tiempo que no tomó LDM (aproximadamente 2 meses) se produjo un aumento de leucocitos a 20.000/μl y del tamaño del bazo, lo que obligó a iniciar el 8.o ciclo. En el paciente 11 se produjo inicialmente una reducción importante de la esplenomegalia (demostrada en los exámenes físicos y ecográficos) y también una reducción progresiva de la terapia de soporte hematopoyética. Se decidió continuar el tratamiento y en la actualidad va a iniciar el 10.o ciclo. El paciente 14 está recibiendo en la actualidad el 4.o ciclo pero no hay respuesta evidente ya que los parámetros sanguíneos se mantienen como antes de iniciar el tratamiento con LDM y siguen siendo necesarias las transfusiones, el soporte con EPO y el tratamiento con lenogastrim.
Pacientes con síndrome mielodisplásico tratados con lenalidomidaÚnicamente 3 pacientes con SMD iniciaron tratamiento con LDM. El paciente 7 presentaba deleción 5q y no llegó a terminar el 1.er ciclo ya que desarrolló una leucemia linfoblástica. El paciente 2 experimentó desde el inicio disminución en la cifra de leucocitos (3.600 a 1.600/μl) que obligó a la reducción a la mitad de la dosis de LDM. A pesar de esto y de iniciar tratamiento con filgastrim (7 administraciones mensuales de 300μg), después del 4.o ciclo mantenía la neutropenia (500 de neutrófilos/μl), lo que supuso la suspensión del tratamiento por falta de eficacia y mala tolerancia.
El paciente 16 está recibiendo actualmente el 2.o ciclo. Ha desarrollado reacción cutánea que se ha controlado con medicación coadyuvante (corticoides y antihistamínicos). El 3.er ciclo se ha iniciado reduciendo la dosis a la mitad.
Tolerancia al tratamientoDe los 13 pacientes que iniciaron el tratamiento con LDM, únicamente hubo que suspender el tratamiento en dos de ellos (15,4%) por los EA. En el resto, los EA más frecuentes fueron molestias gástricas, astenia, neutropenias moderadas, infecciones urinarias y reacciones cutáneas autolimitadas.
DiscusiónEl MM es una enfermedad hematológica maligna caracterizada por la proliferación clonal de células plasmáticas en la médula ósea. La pasada década se ha caracterizado por un gran progreso en el entendimiento de su fisiopatología, así como en su tratamiento, lo que ha supuesto una mejora importante en la supervivencia de los pacientes. La enfermedad se aborda tratándola de forma específica y/o tratando sus manifestaciones clínicas (hipercalcemia, complicaciones musculoesqueléticas, anemia, infecciones y dolor). El tratamiento viene determinado, en gran medida, por la edad y el estado general del paciente. Desde 1998, tres nuevos agentes con actividad en el MM han sido identificados (talidomida, bortezomib y LDM), mientras que las tres décadas anteriores se caracterizaron por el empleo de agentes alquilantes (melfalán, carmustina y ciclofosfamida) y corticoides4. Sin embargo, la exposición al melfalán se asocia a un riesgo incrementado de mielodisplasia o leucemia aguda5. Con la terapia convencional, aproximadamente el 5% de los pacientes alcanza la remisión completa. La terapia de rescate utiliza vincristina, doxorrubicina y dexametasona llegando a tasas de respuesta que varían desde el 30–50%6. Con los nuevos agentes, bien solos o en combinación, se incrementan la tasa de respuesta y la duración de estas, consiguiendo mejoras en la supervivencia.
La efectividad de la LDM en el MM refractario ha sido demostrada en 2 ensayos clínicos paralelos fase iii en los que los pacientes se randomizaron a LDM más DXM o solo a DXM7. En ambos estudios la tasa de respuesta (el 58 vs. el 22%) y la duración de esta (11 frente a 5 meses) fue mayor en el grupo de LDM. Los EA obligaron a suspender el tratamiento en el 20% de los pacientes. Estos resultados derivaron en la realización de otros estudios en los que se utilizó la LDM junto con la DXM como terapia primaria, demostrando tasas de respuesta del 91% con mínima toxicidad8. Comparando nuestros datos obtenemos tasas de respuesta similares (el 83,3% de nuestros pacientes presentó algún tipo de respuesta). Queremos señalar que estos resultados no son del todo comparables, ya que la evaluación de la respuesta fue precoz (en torno al 4.o ciclo) con el fin de no asumir gastos innecesarios cuando el tratamiento no fuera eficaz.
La MF se caracteriza por esplenomegalia, granulocitos y eritrocitos inmaduros en la sangre periférica. Además de la proliferación clonal, la metaplasia mieloide se caracteriza por la colonización de sitios extramedulares, como el bazo o el hígado. La mayoría de los pacientes tienen más de 60 años en el momento del diagnóstico y el 33% de ellos están asintomáticos. La mediana de supervivencia es de 3,5–5,5 años, pero los pacientes menores de 55 años tienen una mediana de supervivencia de 11 años9. Las principales causas de muerte son el fracaso medular progresivo, la transformación a leucemia aguda, la infección, los episodios trombohemorrágicos, la insuficiencia cardiaca y la hipertensión portal10. En el caso de los pacientes asintomáticos, no se requiere ningún tratamiento. En el resto, además de las transfusiones necesarias para mejorar la anemia, está descrita la utilización de la eritropoyetina, la hidroxiurea, la cladribina, la talidomida, la LDM o el interferón. Se ha informado de una respuesta favorable a la talidomida y a la LDM en el 20–60% de los pacientes11. En nuestra experiencia, las tasas de respuesta fueron del orden del 66,6%. Creemos que estos datos justifican la necesidad de llevar a cabo más estudios para establecer el papel de la LDM en esta patología, sobre todo en cuanto a la obtención de datos relativos a mejoría en la supervivencia.
En cuanto al tratamiento del SMD con LDM, List et al consiguieron un 55% de respuesta citogenética y un 29% de respuesta hematológica completa, si bien es cierto que los pacientes incluidos en este estudio eran portadores de la deleción 5q−. Además, disminuyó la necesidad de transfusión en el 76% de los pacientes. La respuesta fue rápida (mediana de 4,6 semanas) y mantenida12. Estos estudios supusieron que la FDA aprobara el tratamiento con LDM en el SMD con deleción 5q− (síndrome 5q−)13 ya que, hasta el momento, la aportación de la LDM en el resto de los pacientes parece no estar clara. Sin embargo, nuestra experiencia en el SMD es escasa por el reducido número de pacientes que llegaron a iniciar el tratamiento y por los EA que obligaron a suspenderlo en 2 de ellos. El paciente 16 fue incluido recientemente y es pronto para hacer una valoración.
Globalmente, los EA fueron manejables y únicamente hubo que suspender el tratamiento en el 15,4% de nuestros pacientes, cifra comparable al 20% obtenido en algunos estudios7.
Como conclusión destacamos que la LDM consigue, según nuestra experiencia, beneficio clínico sobre todo en el MM y la MF, con buena tolerancia. Creemos que estas son razones suficientes que sustentan el optimismo con que se aborda en la actualidad el tratamiento de estas patologías. De hecho, la supervivencia ha mejorado desde los 3 años en las décadas de 1960–1990 hasta los 5 años en la actualidad. Hay autores que defienden que con la mejora de los regímenes actuales y la introducción y la combinación de los nuevos agentes, la supervivencia podría aumentar a más de 7 años en el futuro14,15. Queremos señalar que una limitación importante de nuestro estudio es que, además de tratarse de un estudio retrospectivo, hicimos la valoración de forma precoz (a mitad del tratamiento) con el fin de suspender aquellos tratamientos que no fueran eficaces lo antes posible y no hicimos seguimiento a largo plazo. En nuestra opinión, la mejoría de este grupo de enfermos justifica sobradamente el esfuerzo económico que conlleva la LDM, sin tener en cuenta que también se produce reducción de los costes asociados a la disminución de requerimientos transfusionales, periodos de hospitalización o desplazamientos. También es cierto que, al tratarse de un fármaco novedoso, se han realizado pocos estudios y los que hay son muy heterogéneos. Creemos que, aunque en nuestro hospital se establecieron como límite en un principio 8 ciclos, y dado que no hay estudios que clarifiquen la duración del tratamiento, la opción más correcta sería mantenerlo hasta la progresión o intolerancia. Por todo esto pensamos que son necesarios más estudios que profundicen en la duración del tratamiento y en nuevas indicaciones, pautas y tratamientos combinados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.