Estudiar la efectividad y la seguridad del pemetrexed en el cáncer de pulmón no microcítico.
MétodoEstudio retrospectivo (marzo 2006–mayo 2008) de utilización de pemetrexed. Se obtuvo la información de bases de datos Access de los Servicios de Farmacia y Oncología, del registro de visitas a consultas externas y de la historia clínica. Los datos se analizaron con SPSS v12.0. Las variables cuantitativas se expresaron con la mediana (mínimo-máximo).
ResultadosFueron 44 pacientes (61,7 años [39–77]) la mayoría hombres (86%), fumadores/exfumadores (80%), histología epidermoide/escamosa (46%) o adenocarcinoma (36%), con buen estado funcional (86%) y estadio iii o superior al inicio del tratamiento con pemetrexed (93%). El tratamiento previo con taxanos y este junto con la neutropenia previa fueron los criterios de cambio a pemetrexed en el 34,4 y el 22,7% de los pacientes, respectivamente. Ningún paciente presentó respuesta completa o parcial; el 18,2% mostró enfermedad estable y el 81,8% progresión de la enfermedad, siendo los principales motivos de retirada del pemetrexed la progresión de la enfermedad (54,5%) y el empeoramiento clínico (15,9%). La mediana de supervivencia desde el inicio de la quimioterapia fue de 22,2 meses (16–28,4) y desde el inicio con pemetrexed fue de 7,8 meses (4,4–11,2), siendo ésta significativamente mayor en las mujeres y de aquellos con valor 0-1 en la escala Eastern Cooperative Oncology Group. Los efectos adversos más frecuentes fueron astenia y neurotoxicidad.
ConclusiónPemetrexed se ha utilizado en todos los casos como segunda línea o superior con buen perfil de seguridad. En ningún caso se alcanzó respuesta completa o parcial, pero la supervivencia desde el inicio de pemetrexed iguala o supera a la de otros estudios.
To study the effectiveness and safety of pemetrexed in non-small cell lung cancer.
MethodRetrospective study (March 2006–May 2008) of pemetrexed use. Information was obtained from the Access database belonging to the Pharmacy and Oncology Departments, the registry of external consultations and clinical histories. Data were analysed using SPSS software version 12.0. Quantitative variables are expressed as the median (minimum-maximum).
ResultsThe study included 44 patients (61.7 [39–77] years old), mostly male (86%), smokers or former smokers (80%) with predominantly epidermoid/squamous disease (46%) or adenocarcinoma, in a good functional state (86%) and in stage ≥III upon beginning pemetrexed treatment (93%). Prior treatment with taxanes and taxane treatment along with a prior history of neutropoenia were the criteria for changing to pemetrexed in 34.4% and 22.7% of the patients, respectively. None of the patients presented a complete or partial response: 18.2% showed disease stability and 81.8% showed disease progression. The main reasons for discontinuing pemetrexed were progression of the disease (54.5%) and worsening of symptoms (15.9%). Median survival after beginning chemotherapy was 22.2 months (ranging from 16–28.4) and 7.8 months (4.4–11.2) after beginning pemetrexed treatment. These last figures were significantly higher in women and those with an ECOG of 0 to 1. The most common adverse effects were weakness and neurotoxicity.
ConclusionIn each of the cases, pemetrexed was used as a second-line treatment or higher with a good safety profile. A complete or partial response was not reached in any of the cases, but survival after beginning pemetrexed was equal to or longer than that achieved in other studies.
Pemetrexed es un antimetabolito que ejerce su actividad antineoplásica por interrupción de procesos metabólicos esenciales dependientes de folato, necesarios para la replicación celular1. Las indicaciones aprobadas por la Agencia Europea del Medicamento son el mesotelioma pleural maligno no resecable, como primera línea de tratamiento en combinación con cisplatino, y el carcinoma de pulmón no microcítico (CPNM) avanzado o metastásico, salvo histología predominantemente escamosa, como segunda línea de tratamiento en monoterapia o como primera línea de tratamiento combinado con cisplatino2.
El CPNM constituye el 87% de todos los casos de cáncer de pulmón3. Es un agregado heterogéneo de histologías, siendo las más comunes la epidermoide/escamosa, el adenocarcinoma y el carcinoma de células grandes o indiferenciado. Su pronóstico es bastante desfavorable y la supervivencia a largo plazo es corta4.
Los tres fármacos aprobados por la Food and Drug Administration y por la Agencia Europea del Medicamento como segunda línea de tratamiento del CPNM avanzado o metastásico refractario al tratamiento de primera línea o con progresión de la enfermedad (PE) son docetaxel, pemetrexed y erlotinib. Estos agentes fueron aprobados de acuerdo con cuatro ensayos clínicos fase iii, en los que se comparaban con otros antineoplásicos o tratamientos médicos de apoyo5–8 y en los que mostraron sus beneficios en términos de supervivencia y seguridad. El pemetrexed no presentó ventajas respecto al docetaxel en cuanto a respuesta y supervivencia, pero sí respecto a toxicidad, con una reducción significativa de la neutropenia y sus complicaciones8.
Más recientemente, el pemetrexed también ha sido aprobado como tratamiento de primera línea en combinación con cisplatino en el CPNM localmente avanzado o metastásico en pacientes no tratados previamente9.
El objetivo principal de este estudio es analizar la efectividad y la seguridad de la utilización del pemetrexed en el CPNM, así como analizar qué factores pueden influir en la supervivencia de los pacientes. Como objetivos secundarios se analizarán la efectividad y la seguridad estratificando por grupo de edad.
Material y métodosEstudio retrospectivo de utilización de pemetrexed en CPNM de marzo 2006 a mayo 2008 en un hospital general de 592 camas.
Como fuentes de datos se utilizaron una base de datos Access, 2003 de Microsoft® del Servicio de Farmacia donde se registran las dispensaciones de medicamentos antineoplásicos; una base de datos Access, 2003 de Microsoft® (Pigeo®) del Servicio de Oncología donde se registran los tratamientos administrados y el régimen de visitas de los pacientes a las Consultas Externas de Oncología y la revisión de las historias clínicas.
Se analizaron variables para caracterizar a los pacientes, la enfermedad y el tratamiento recibido, variables para medir la efectividad y variables para medir la seguridad.
Para la estadificación del tumor se ha utilizado el Sistema Internacional de Estadificación para el Cáncer de Pulmón del American Joint Committee on Cancer10.
El estado funcional previo al tratamiento con pemetrexed se evaluó según la escala Eastern Cooperative Oncology Group (ECOG)11.
La efectividad se midió con la respuesta al tratamiento, las causas de retirada y la supervivencia desde el inicio del tratamiento quimioterapéutico y desde el inicio del tratamiento con pemetrexed. Para la evaluación de la respuesta se han seguido los criterios de «Response Evaluation Criteria In Solid Tumors»12 (medidas unidimensionales del tumor mediante pruebas radiológicas), expresándose como respuesta completa (RC), respuesta parcial (RP), enfermedad estable (EE) y PE.
La seguridad se evaluó identificando en tipo y número los efectos adversos (EA) producidos por el pemetrexed. Se han utilizado los criterios de la Organización Mundial de la Salud para la clasificación del tipo y el grado de estos13. Además, se evaluó cuántos pacientes habían presentado neutropenia antes del tratamiento con pemetrexed.
Los datos se recogieron en una hoja de cálculo Excel Office, 2003 de Microsoft® y se analizaron con el programa estadístico SPSS® versión 12.0 (2003® SPSS Inc). Las variables cuantitativas se resumieron con la mediana (mínimo–máximo) y las variables cualitativas con las frecuencias y proporciones. Para comparar medianas se aplicó la prueba no paramétrica de la U de Mann-Whitney y para la comparación de proporciones la prueba exacta de Fischer. La probabilidad de supervivencia se estimó con el método de Kaplan-Meier y para el cálculo de la significación estadística de los distintos grupos se utilizó la prueba de Mantel-Haenszel.
La realización de este estudio fue aprobada por el Comité Ético de Investigaciones Clínicas del hospital, que no consideró necesario el consentimiento informado de los pacientes al tratarse de un estudio retrospectivo de evaluación de uso de un medicamento en la práctica clínica.
ResultadosCaracterísticas de los pacientes, la enfermedad y el tratamientoCuarenta y cinco pacientes fueron tratados con pemetrexed de marzo de 2006 a mayo de 2008. Un paciente recibió un ciclo y después fue trasladado a su hospital de referencia por lo que se perdió el seguimiento y fue excluido del estudio.
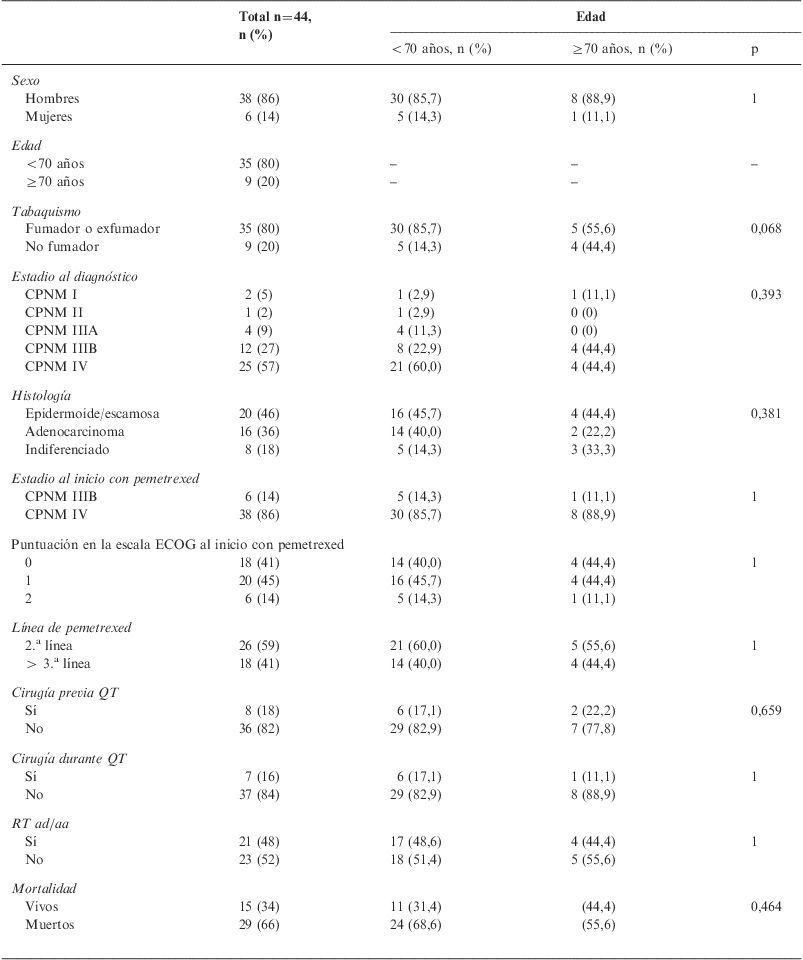
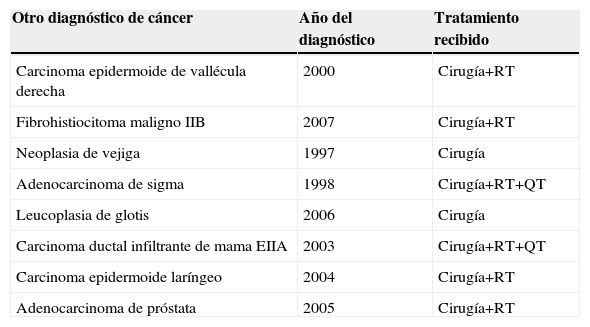
Las variables cuantitativas y cualitativas globales y estratificadas por grupo de edad de los 44 pacientes incluidos en el estudio se muestran en las tablas 1 y 2. La mediana de edad fue alta: 61,7 años (39–77), aunque sólo 9 pacientes tenían una edad de 70 años o superior, la mayoría eran hombres (86%) y fumadores o exfumadores (80%). Ocho pacientes habían sido diagnosticados y tratados previamente de otras neoplasias (tabla 3). En el 93% de los casos se diagnosticó la enfermedad en estadios avanzados (iiiA, iiiB y iv) y la histología predominante fue la epidermoide/escamosa (46%) seguida del adenocarcinoma (36%).
Características de los pacientes incluidos en el estudio
| Total n=44, n (%) | Edad | |||
| <70 años, n (%) | ≥70 años, n (%) | p | ||
| Sexo | ||||
| Hombres | 38 (86) | 30 (85,7) | 8 (88,9) | 1 |
| Mujeres | 6 (14) | 5 (14,3) | 1 (11,1) | |
| Edad | ||||
| <70 años | 35 (80) | – | – | – |
| ≥70 años | 9 (20) | – | – | |
| Tabaquismo | ||||
| Fumador o exfumador | 35 (80) | 30 (85,7) | 5 (55,6) | 0,068 |
| No fumador | 9 (20) | 5 (14,3) | 4 (44,4) | |
| Estadio al diagnóstico | ||||
| CPNM I | 2 (5) | 1 (2,9) | 1 (11,1) | 0,393 |
| CPNM II | 1 (2) | 1 (2,9) | 0 (0) | |
| CPNM IIIA | 4 (9) | 4 (11,3) | 0 (0) | |
| CPNM IIIB | 12 (27) | 8 (22,9) | 4 (44,4) | |
| CPNM IV | 25 (57) | 21 (60,0) | 4 (44,4) | |
| Histología | ||||
| Epidermoide/escamosa | 20 (46) | 16 (45,7) | 4 (44,4) | 0,381 |
| Adenocarcinoma | 16 (36) | 14 (40,0) | 2 (22,2) | |
| Indiferenciado | 8 (18) | 5 (14,3) | 3 (33,3) | |
| Estadio al inicio con pemetrexed | ||||
| CPNM IIIB | 6 (14) | 5 (14,3) | 1 (11,1) | 1 |
| CPNM IV | 38 (86) | 30 (85,7) | 8 (88,9) | |
| Puntuación en la escala ECOG al inicio con pemetrexed | ||||
| 0 | 18 (41) | 14 (40,0) | 4 (44,4) | 1 |
| 1 | 20 (45) | 16 (45,7) | 4 (44,4) | |
| 2 | 6 (14) | 5 (14,3) | 1 (11,1) | |
| Línea de pemetrexed | ||||
| 2.a línea | 26 (59) | 21 (60,0) | 5 (55,6) | 1 |
| > 3.a línea | 18 (41) | 14 (40,0) | 4 (44,4) | |
| Cirugía previa QT | ||||
| Sí | 8 (18) | 6 (17,1) | 2 (22,2) | 0,659 |
| No | 36 (82) | 29 (82,9) | 7 (77,8) | |
| Cirugía durante QT | ||||
| Sí | 7 (16) | 6 (17,1) | 1 (11,1) | 1 |
| No | 37 (84) | 29 (82,9) | 8 (88,9) | |
| RT ad/aa | ||||
| Sí | 21 (48) | 17 (48,6) | 4 (44,4) | 1 |
| No | 23 (52) | 18 (51,4) | 5 (55,6) | |
| Mortalidad | ||||
| Vivos | 15 (34) | 11 (31,4) | (44,4) | 0,464 |
| Muertos | 29 (66) | 24 (68,6) | (55,6) | |
CPNM: carcinoma de pulmón no microcítico; ECOG: Eastern Cooperative Oncology Group; QT: quimioterapia; RT ad/aa: radioterapia adyuvante/antiálgica.
Variables descriptivas de los pacientes del estudio
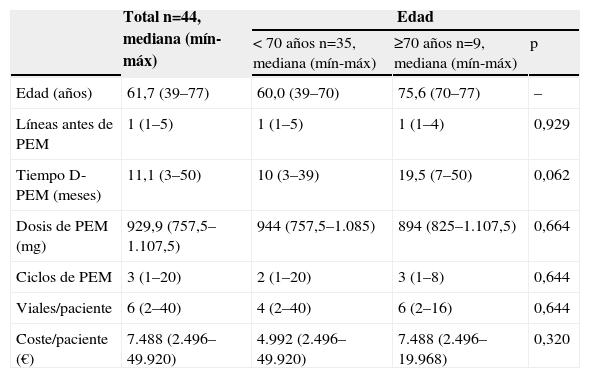
| Total n=44, mediana (mín-máx) | Edad | |||
| < 70 años n=35, mediana (mín-máx) | ≥70 años n=9, mediana (mín-máx) | p | ||
| Edad (años) | 61,7 (39–77) | 60,0 (39–70) | 75,6 (70–77) | – |
| Líneas antes de PEM | 1 (1–5) | 1 (1–5) | 1 (1–4) | 0,929 |
| Tiempo D-PEM (meses) | 11,1 (3–50) | 10 (3–39) | 19,5 (7–50) | 0,062 |
| Dosis de PEM (mg) | 929,9 (757,5–1.107,5) | 944 (757,5–1.085) | 894 (825–1.107,5) | 0,664 |
| Ciclos de PEM | 3 (1–20) | 2 (1–20) | 3 (1–8) | 0,644 |
| Viales/paciente | 6 (2–40) | 4 (2–40) | 6 (2–16) | 0,644 |
| Coste/paciente (€) | 7.488 (2.496–49.920) | 4.992 (2.496–49.920) | 7.488 (2.496–19.968) | 0,320 |
mín-máx: mínimo-máximo; PEM: pemetrexed; tiempo D-PEM: tiempo transcurrido desde el diagnóstico hasta el inicio con pemetrexed.
Otras neoplasias diagnosticadas en los pacientes del estudio anteriores a la enfermedad actual
| Otro diagnóstico de cáncer | Año del diagnóstico | Tratamiento recibido |
| Carcinoma epidermoide de vallécula derecha | 2000 | Cirugía+RT |
| Fibrohistiocitoma maligno IIB | 2007 | Cirugía+RT |
| Neoplasia de vejiga | 1997 | Cirugía |
| Adenocarcinoma de sigma | 1998 | Cirugía+RT+QT |
| Leucoplasia de glotis | 2006 | Cirugía |
| Carcinoma ductal infiltrante de mama EIIA | 2003 | Cirugía+RT+QT |
| Carcinoma epidermoide laríngeo | 2004 | Cirugía+RT |
| Adenocarcinoma de próstata | 2005 | Cirugía+RT |
QT: quimioterapia; RT: radioterapia.
Al inicio del tratamiento con pemetrexed, el 86% de los pacientes con CPNM se encontraba en estadio iv y el 86% presentaba 0–1 en la escala ECOG. Ningún paciente presentó más de 2 en la escala ECOG.
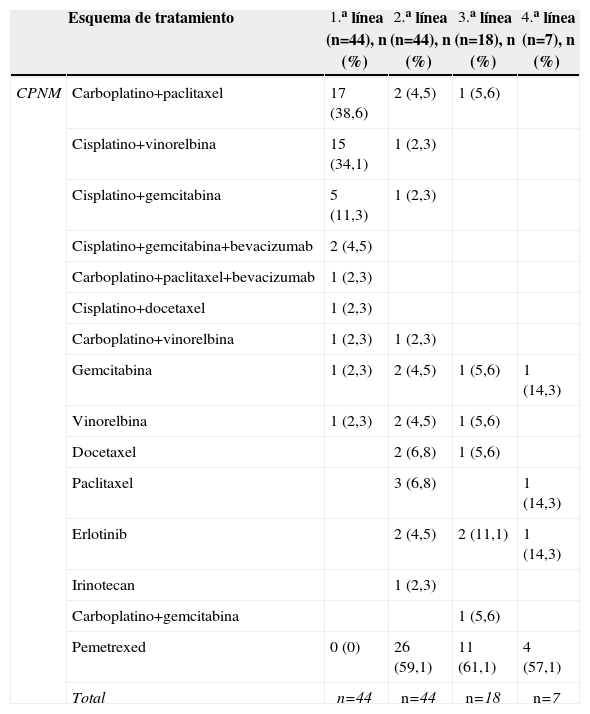
El 88,7% de los pacientes con CPNM fueron tratados en primera línea de tratamiento con doble terapia, incluyendo un compuesto tipo platino, principalmente platinos/taxanos (40,9%) y platinos/vinorelbina (36,4%) (tabla 4). La mediana de líneas de quimioterapia previa a pemetrexed fue de 1 (1–5), utilizándose como segunda línea en el 59% de los pacientes tras producirse con la primera línea de tratamiento un 34,6% de respuesta (RC y RP), un 53,8% de PE y un 11,5% de EE.
Tratamientos quimioterapéuticos de primera a cuarta línea recibidos por los pacientes del estudio
| Esquema de tratamiento | 1.a línea (n=44), n (%) | 2.a línea (n=44), n (%) | 3.a línea (n=18), n (%) | 4.a línea (n=7), n (%) | |
| CPNM | Carboplatino+paclitaxel | 17 (38,6) | 2 (4,5) | 1 (5,6) | |
| Cisplatino+vinorelbina | 15 (34,1) | 1 (2,3) | |||
| Cisplatino+gemcitabina | 5 (11,3) | 1 (2,3) | |||
| Cisplatino+gemcitabina+bevacizumab | 2 (4,5) | ||||
| Carboplatino+paclitaxel+bevacizumab | 1 (2,3) | ||||
| Cisplatino+docetaxel | 1 (2,3) | ||||
| Carboplatino+vinorelbina | 1 (2,3) | 1 (2,3) | |||
| Gemcitabina | 1 (2,3) | 2 (4,5) | 1 (5,6) | 1 (14,3) | |
| Vinorelbina | 1 (2,3) | 2 (4,5) | 1 (5,6) | ||
| Docetaxel | 2 (6,8) | 1 (5,6) | |||
| Paclitaxel | 3 (6,8) | 1 (14,3) | |||
| Erlotinib | 2 (4,5) | 2 (11,1) | 1 (14,3) | ||
| Irinotecan | 1 (2,3) | ||||
| Carboplatino+gemcitabina | 1 (5,6) | ||||
| Pemetrexed | 0 (0) | 26 (59,1) | 11 (61,1) | 4 (57,1) | |
| Total | n=44 | n=44 | n=18 | n=7 |
CPNM: carcinoma de pulmón no microcítico.
Al estratificar por grupos de edad no hay diferencias estadísticamente significativas, pero los porcentajes de fumadores/exfumadores (el 85,7 frente al 55,6%), de estadio iv al diagnóstico (el 44,4 frente al 31,4%) y de mortalidad (el 68,6 frente al 55,6%) eran algo mayores en los menores de 70 años. El tiempo desde el diagnóstico al inicio del tratamiento con pemetrexed fue mayor en los pacientes con 70 años o superior (19,5 frente a 10 meses; p=0,062).
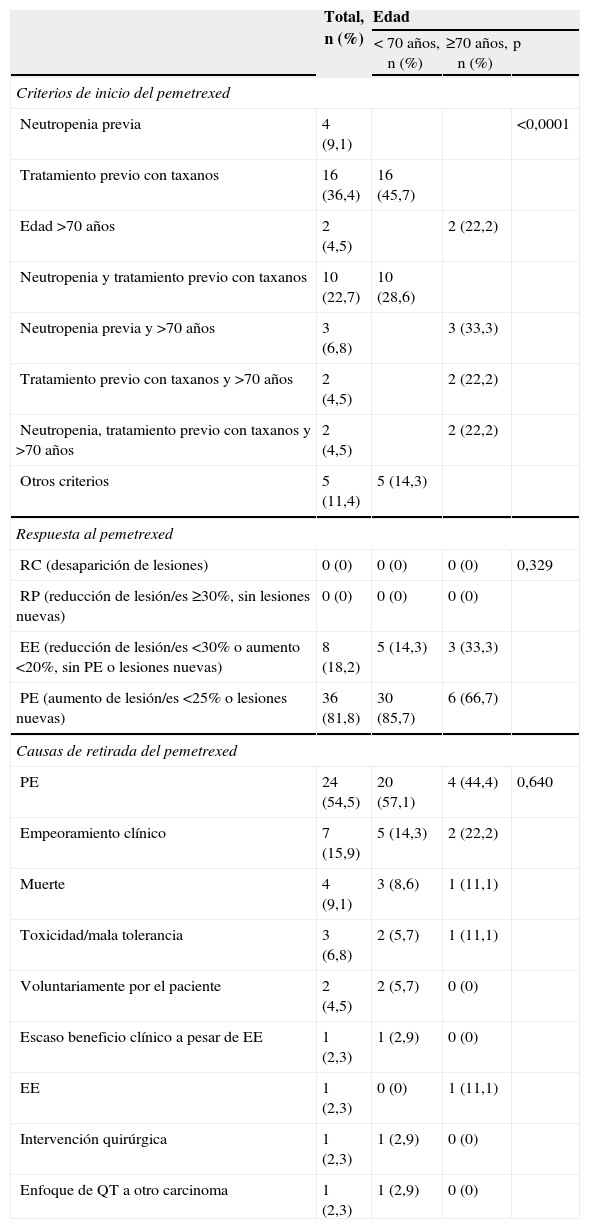
Según el protocolo de tratamiento del CPNM del hospital, los criterios por los que el oncólogo decidía iniciar tratamiento de segunda línea con pemetrexed podían ser la aparición de neutropenia con algún tratamiento previo, el tratamiento previo con taxanos o la edad de 70 años o superior. En los menores de 70 años, los principales motivos de inicio de pemetrexed fueron el tratamiento previo con taxanos (45,7%), la neutropenia previa (11,4%) o ambos (28,6%). En 5 pacientes no se recogían en la historia ninguno de estos dos criterios, pero todos habían sido tratados previamente con platinos, dos de ellos además habían presentado toxicidad gastrointestinal importante y uno de ellos parestesias en miembros inferiores y anemia que requirió tratamiento con epoetina. En los 9 pacientes que tenían una edad de 70 años o superior, este fue el único motivo de inicio de pemetrexed tan solo en 2 casos (22,2%). Tres casos (33,3%) además habían presentado neutropenia previa y otros dos pacientes habían sido tratados previamente con taxanos (22,2%) (tabla 5).
Criterios de inicio, respuesta y causas de retirada de pemetrexed
| Total, n (%) | Edad | |||
| < 70 años, n (%) | ≥70 años, n (%) | p | ||
| Criterios de inicio del pemetrexed | ||||
| Neutropenia previa | 4 (9,1) | <0,0001 | ||
| Tratamiento previo con taxanos | 16 (36,4) | 16 (45,7) | ||
| Edad >70 años | 2 (4,5) | 2 (22,2) | ||
| Neutropenia y tratamiento previo con taxanos | 10 (22,7) | 10 (28,6) | ||
| Neutropenia previa y >70 años | 3 (6,8) | 3 (33,3) | ||
| Tratamiento previo con taxanos y >70 años | 2 (4,5) | 2 (22,2) | ||
| Neutropenia, tratamiento previo con taxanos y >70 años | 2 (4,5) | 2 (22,2) | ||
| Otros criterios | 5 (11,4) | 5 (14,3) | ||
| Respuesta al pemetrexed | ||||
| RC (desaparición de lesiones) | 0 (0) | 0 (0) | 0 (0) | 0,329 |
| RP (reducción de lesión/es ≥30%, sin lesiones nuevas) | 0 (0) | 0 (0) | 0 (0) | |
| EE (reducción de lesión/es <30% o aumento <20%, sin PE o lesiones nuevas) | 8 (18,2) | 5 (14,3) | 3 (33,3) | |
| PE (aumento de lesión/es <25% o lesiones nuevas) | 36 (81,8) | 30 (85,7) | 6 (66,7) | |
| Causas de retirada del pemetrexed | ||||
| PE | 24 (54,5) | 20 (57,1) | 4 (44,4) | 0,640 |
| Empeoramiento clínico | 7 (15,9) | 5 (14,3) | 2 (22,2) | |
| Muerte | 4 (9,1) | 3 (8,6) | 1 (11,1) | |
| Toxicidad/mala tolerancia | 3 (6,8) | 2 (5,7) | 1 (11,1) | |
| Voluntariamente por el paciente | 2 (4,5) | 2 (5,7) | 0 (0) | |
| Escaso beneficio clínico a pesar de EE | 1 (2,3) | 1 (2,9) | 0 (0) | |
| EE | 1 (2,3) | 0 (0) | 1 (11,1) | |
| Intervención quirúrgica | 1 (2,3) | 1 (2,9) | 0 (0) | |
| Enfoque de QT a otro carcinoma | 1 (2,3) | 1 (2,9) | 0 (0) | |
EE: enfermedad estable; PE: progresión de la enfermedad; QT: quimioterapia; RC: respuesta completa; RP: respuesta parcial.
Al final del estudio, 29 pacientes habían fallecido y ninguno continuaba en tratamiento con pemetrexed.
EfectividadLa respuesta al tratamiento con pemetrexed y los motivos de retirada se muestran en la tabla 5.
La PE ha sido la principal respuesta al pemetrexed, superando el 80%. Ningún paciente presentó respuesta a pemetrexed (RC o RP) al finalizar el estudio o el tratamiento quimioterapéutico con este. Casi la mitad (45,5%) de los pacientes recibieron menos de 3 ciclos de pemetrexed, siendo la mediana de ciclos recibidos 3 (1–20).
En los 36 pacientes con PE como respuesta, este fue el principal motivo de su retirada (66,7%), seguido por el empeoramiento clínico (11,1%) y el fallecimiento (11,1%). En los 8 pacientes con EE, en tres casos se retiró por empeoramiento clínico, en dos por decisión voluntaria del paciente, en uno por toxicidad/intolerancia y en dos por escaso beneficio clínico.
El porcentaje con EE es algo mayor en los pacientes de 70 años o superior (el 33,3 frente al 14,3%), aunque no hay diferencias estadísticamente significativas entre ambos grupos, ni en la respuesta ni en las causas de retirada de pemetrexed. La principal causa de retirada en ambos es la PE.
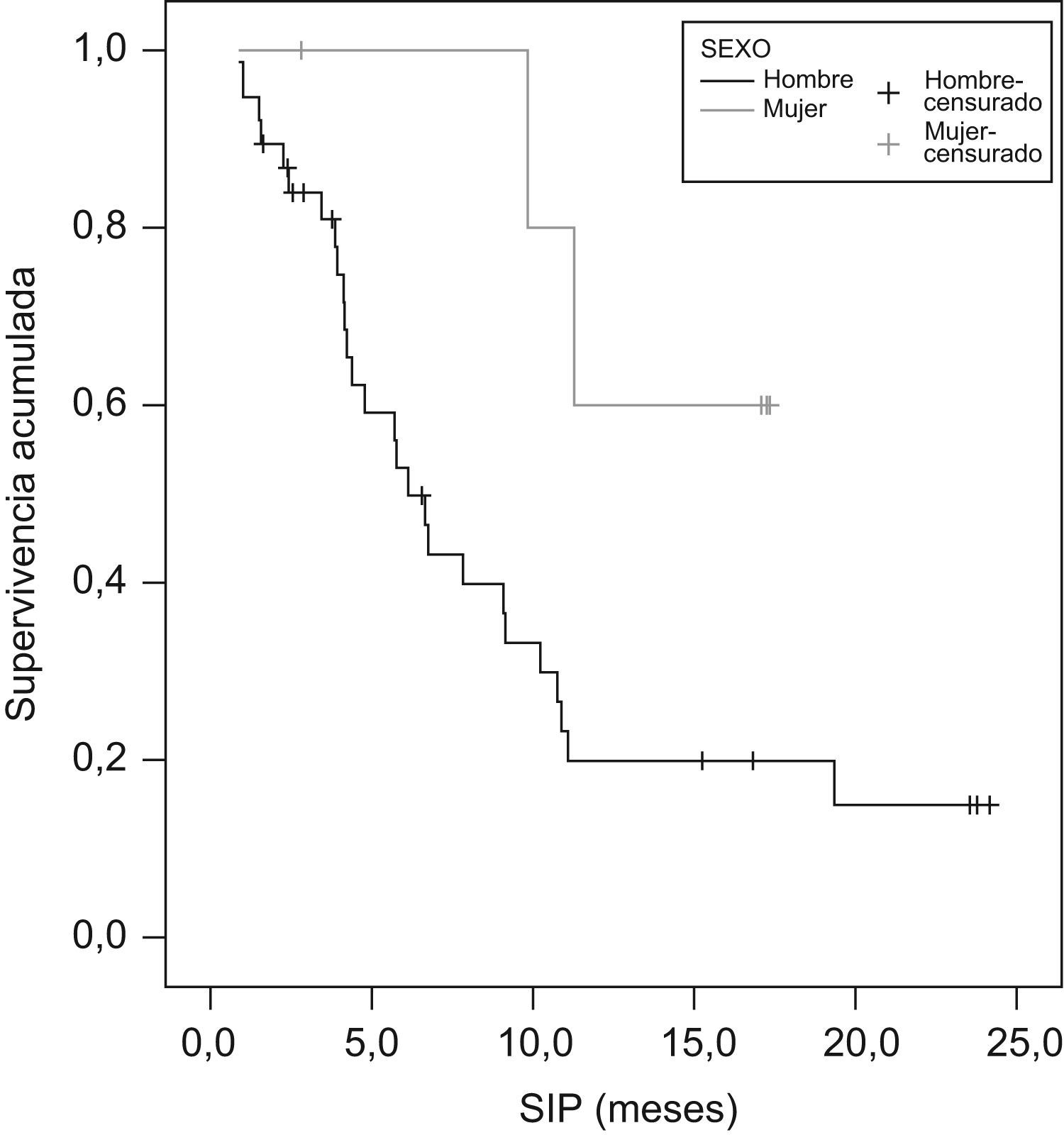
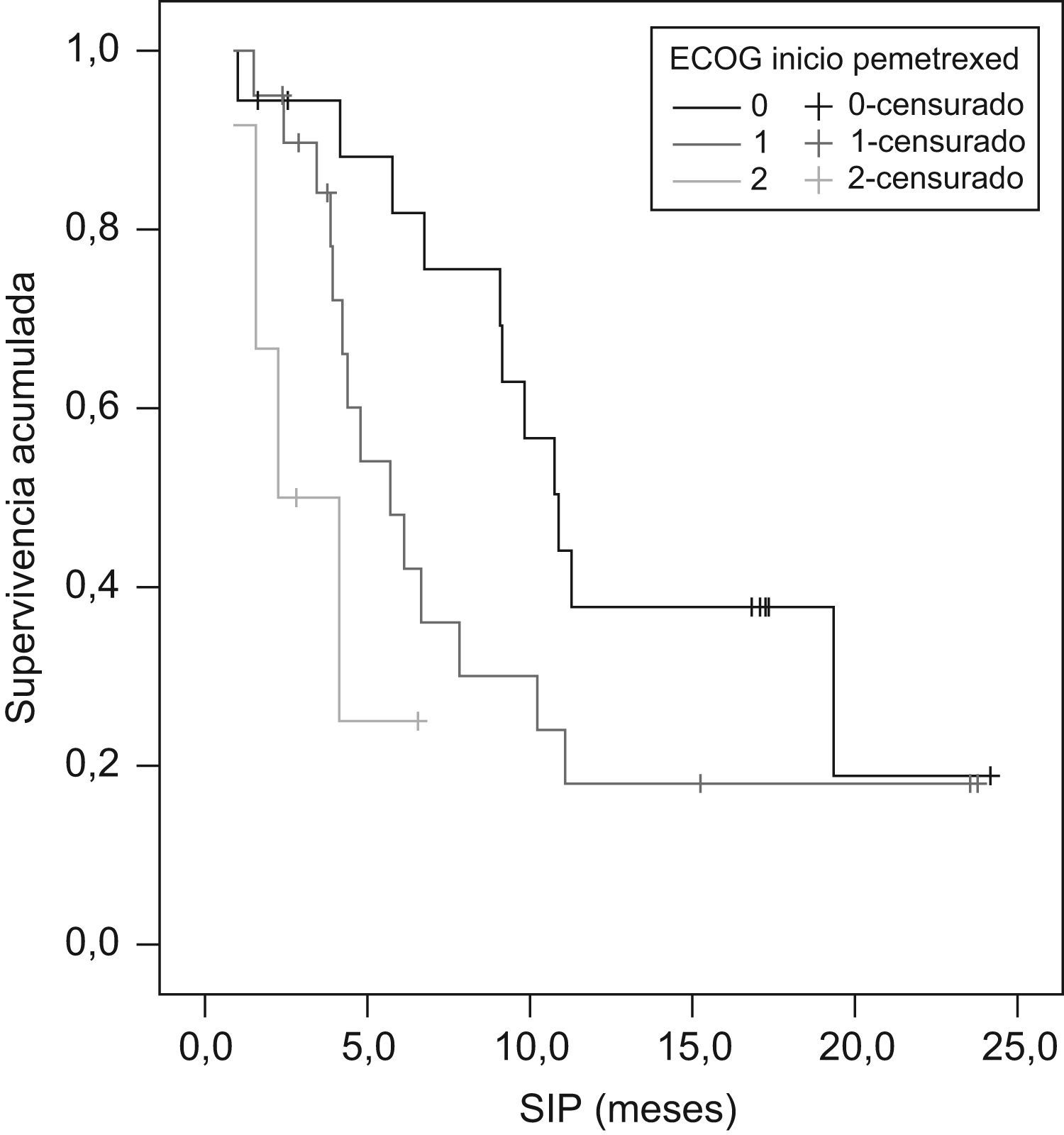
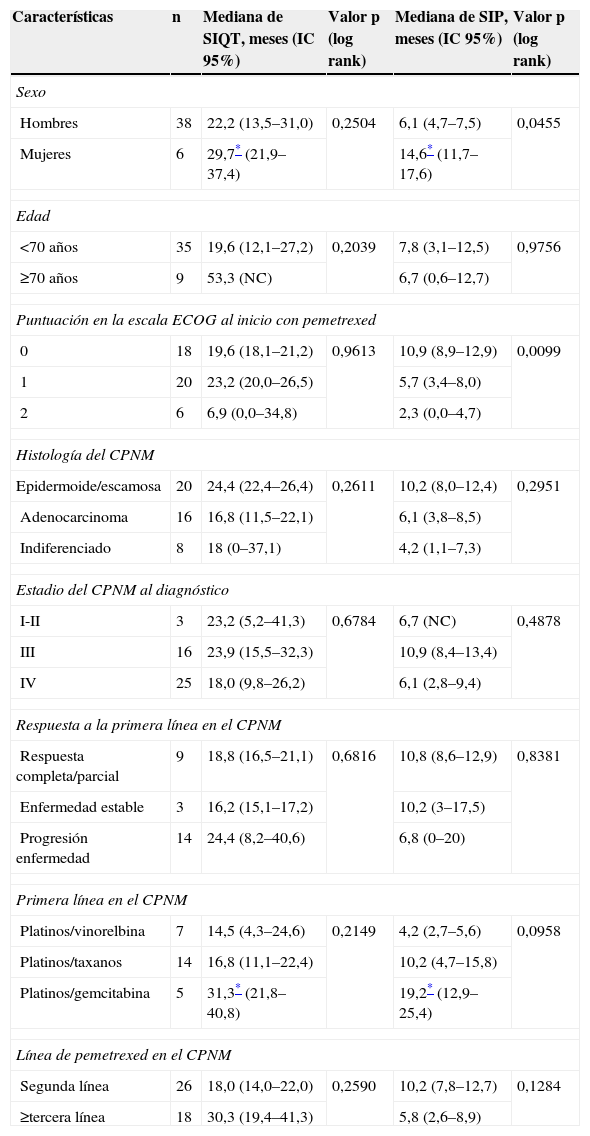
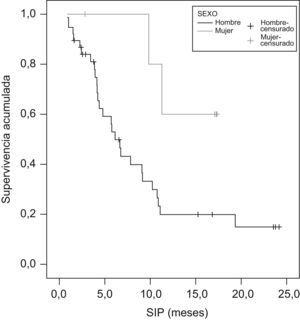
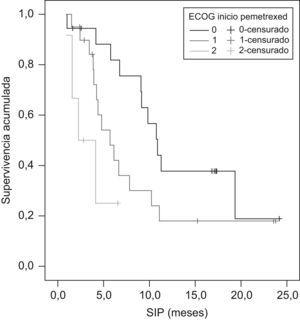
La mediana de supervivencia desde el inicio de la primera quimioterapia (SIQT) fue de 22,2 meses (IC 95%: 16–28,4) y la mediana de supervivencia desde el inicio con pemetrexed (SIP) fue de 7,8 meses (IC 95%: 4,4–11,2) (tabla 6). Parece que hay una tendencia aunque no significativa a mayor SIQT en mujeres, en pacientes con edad de 70 años o superior, en pacientes con mejor puntuación en la escala ECOG, en histología epidermoide/escamosa, cuando la enfermedad se diagnostica en estadio i–ii, cuando el tratamiento de primera línea ha sido con platinos/gemcitabina y cuando se utiliza pemetrexed como tercera línea o superior. La SIP es significativamente mayor en las mujeres (p=0,0455) (fig. 1) y en los pacientes con mejor estado funcional (p=0,0099) (fig. 2). Aunque no es significativo, también es mayor en la histología epidermoide/escamosa, cuando la enfermedad se diagnostica en estadio i-ii y cuando la primera línea de tratamiento ha sido con platinos/gemcitabina. A diferencia de la SIQT, la SIP es mayor cuando pemetrexed se utiliza como segunda línea de tratamiento. La SIQT superior en pacientes en los que el tratamiento con pemetrexed es como tercera línea o superior es lógica, puesto que los pacientes que llegan a esta circunstancia hace más tiempo que han sido diagnosticados y tratados.
Supervivencia global desde el inicio de la quimioterapia y desde el inicio con pemetrexed
| Características | n | Mediana de SIQT, meses (IC 95%) | Valor p (log rank) | Mediana de SIP, meses (IC 95%) | Valor p (log rank) |
| Sexo | |||||
| Hombres | 38 | 22,2 (13,5–31,0) | 0,2504 | 6,1 (4,7–7,5) | 0,0455 |
| Mujeres | 6 | 29,7* (21,9–37,4) | 14,6* (11,7–17,6) | ||
| Edad | |||||
| <70 años | 35 | 19,6 (12,1–27,2) | 0,2039 | 7,8 (3,1–12,5) | 0,9756 |
| ≥70 años | 9 | 53,3 (NC) | 6,7 (0,6–12,7) | ||
| Puntuación en la escala ECOG al inicio con pemetrexed | |||||
| 0 | 18 | 19,6 (18,1–21,2) | 0,9613 | 10,9 (8,9–12,9) | 0,0099 |
| 1 | 20 | 23,2 (20,0–26,5) | 5,7 (3,4–8,0) | ||
| 2 | 6 | 6,9 (0,0–34,8) | 2,3 (0,0–4,7) | ||
| Histología del CPNM | |||||
| Epidermoide/escamosa | 20 | 24,4 (22,4–26,4) | 0,2611 | 10,2 (8,0–12,4) | 0,2951 |
| Adenocarcinoma | 16 | 16,8 (11,5–22,1) | 6,1 (3,8–8,5) | ||
| Indiferenciado | 8 | 18 (0–37,1) | 4,2 (1,1–7,3) | ||
| Estadio del CPNM al diagnóstico | |||||
| I-II | 3 | 23,2 (5,2–41,3) | 0,6784 | 6,7 (NC) | 0,4878 |
| III | 16 | 23,9 (15,5–32,3) | 10,9 (8,4–13,4) | ||
| IV | 25 | 18,0 (9,8–26,2) | 6,1 (2,8–9,4) | ||
| Respuesta a la primera línea en el CPNM | |||||
| Respuesta completa/parcial | 9 | 18,8 (16,5–21,1) | 0,6816 | 10,8 (8,6–12,9) | 0,8381 |
| Enfermedad estable | 3 | 16,2 (15,1–17,2) | 10,2 (3–17,5) | ||
| Progresión enfermedad | 14 | 24,4 (8,2–40,6) | 6,8 (0–20) | ||
| Primera línea en el CPNM | |||||
| Platinos/vinorelbina | 7 | 14,5 (4,3–24,6) | 0,2149 | 4,2 (2,7–5,6) | 0,0958 |
| Platinos/taxanos | 14 | 16,8 (11,1–22,4) | 10,2 (4,7–15,8) | ||
| Platinos/gemcitabina | 5 | 31,3* (21,8–40,8) | 19,2* (12,9–25,4) | ||
| Línea de pemetrexed en el CPNM | |||||
| Segunda línea | 26 | 18,0 (14,0–22,0) | 0,2590 | 10,2 (7,8–12,7) | 0,1284 |
| ≥tercera línea | 18 | 30,3 (19,4–41,3) | 5,8 (2,6–8,9) | ||
CPNM: carcinoma de pulmón no microcítico; NC: no calculable; SIP: supervivencia desde el inicio con pemetrexed; SIQT: supervivencia desde el inicio de la primera quimioterapia.
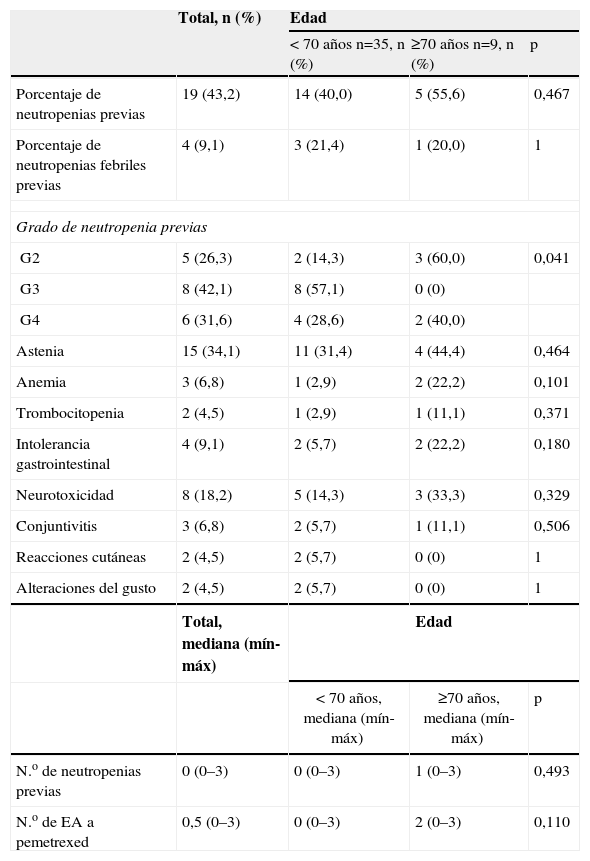
Todos los pacientes fueron suplementados correctamente con ácido fólico y vitamina B12. El 43,2% de los pacientes presentaron neutropenia con tratamientos quimioterapéuticos anteriores al pemetrexed, principalmente de grado (G) 3 (42,1%), con una mediana de 0 episodios (0–3) de neutropenia por paciente. El 21,1% de las neutropenias fueron febriles. El porcentaje de neutropenias previas fue algo mayor, aunque no significativo, en pacientes con edad de 70 años o superior (el 55,6 frente al 40%) y existieron diferencias significativas en el grado de la neutropenia, siendo principalmente de G3 en los pacientes con edad inferior a los 70 años y de G2 en los de 70 años o superior (p=0,041). Ninguno de los pacientes tratados previamente con docetaxel (n=5) presentó neutropenia. No hubo ningún caso de neutropenia asociada a pemetrexed.
La mediana de EA asociados a pemetrexed fue de 0,5 (0–3). Entre los EA destacan astenia (34,1%), neurotoxicidad (parestesias en extremidades y dolores musculares) (18,2%) e intolerancia gastrointestinal (9,1%) (tabla 7). Los tres pacientes que presentaron anemia con pemetrexed iniciaron tratamiento con epoetina.
Neutropenias previas al pemetrexed y efectos adversos asociados al pemetrexed
| Total, n (%) | Edad | |||
| < 70 años n=35, n (%) | ≥70 años n=9, n (%) | p | ||
| Porcentaje de neutropenias previas | 19 (43,2) | 14 (40,0) | 5 (55,6) | 0,467 |
| Porcentaje de neutropenias febriles previas | 4 (9,1) | 3 (21,4) | 1 (20,0) | 1 |
| Grado de neutropenia previas | ||||
| G2 | 5 (26,3) | 2 (14,3) | 3 (60,0) | 0,041 |
| G3 | 8 (42,1) | 8 (57,1) | 0 (0) | |
| G4 | 6 (31,6) | 4 (28,6) | 2 (40,0) | |
| Astenia | 15 (34,1) | 11 (31,4) | 4 (44,4) | 0,464 |
| Anemia | 3 (6,8) | 1 (2,9) | 2 (22,2) | 0,101 |
| Trombocitopenia | 2 (4,5) | 1 (2,9) | 1 (11,1) | 0,371 |
| Intolerancia gastrointestinal | 4 (9,1) | 2 (5,7) | 2 (22,2) | 0,180 |
| Neurotoxicidad | 8 (18,2) | 5 (14,3) | 3 (33,3) | 0,329 |
| Conjuntivitis | 3 (6,8) | 2 (5,7) | 1 (11,1) | 0,506 |
| Reacciones cutáneas | 2 (4,5) | 2 (5,7) | 0 (0) | 1 |
| Alteraciones del gusto | 2 (4,5) | 2 (5,7) | 0 (0) | 1 |
| Total, mediana (mín-máx) | Edad | |||
| < 70 años, mediana (mín-máx) | ≥70 años, mediana (mín-máx) | p | ||
| N.o de neutropenias previas | 0 (0–3) | 0 (0–3) | 1 (0–3) | 0,493 |
| N.o de EA a pemetrexed | 0,5 (0–3) | 0 (0–3) | 2 (0–3) | 0,110 |
EA=efectos adversos; G: grado; mín-máx: mínimo-máximo.
El número de EA fue mayor, aunque no significativo, en los pacientes con edad igual o superior a los 70 años. Los EA más frecuentes en ambos grupos de edad fueron astenia y neurotoxicidad.
Las repercusiones clínicas de los EA no fueron relevantes, se suspendió el tratamiento en 3 pacientes (en 2 por intolerancia gastrointestinal, neurotoxicidad y diplopía, y en uno por reacción cutánea en el primer ciclo de tratamiento) y en otros 2 pacientes se retrasó el ciclo de pemetrexed (en un caso por trombopenia de G3 y en otro por empeoramiento de su puntuación en la escala ECOG). No fue necesaria la reducción de dosis en ningún caso.
DiscusiónEl pemetrexed se ha utilizado sobre todo en hombres, al igual que en otros estudios5–8, lo que confirma el hecho de que actualmente estas neoplasias continúan siendo más prevalentes en este sexo. Además, el 80% de los pacientes diagnosticados de CPNM eran o habían sido fumadores, lo cual también confirma que el tabaco es uno de los factores de riesgo más importantes para el cáncer de pulmón3. El buen estado funcional junto con el ser mujer y la histología no escamosa se han descrito como factores favorables para llegar a recibir una segunda línea de quimioterapia en el CPNM14. Por todo ello, las guías clínicas15,16 recomiendan pemetrexed como segunda línea de tratamiento en el CPNM cuando el estado clínico de los pacientes es bueno.
En ningún paciente se ha utilizado pemetrexed como primera línea de tratamiento, lo que se debe a que la recogida de datos de nuestro estudio finalizó en mayo de 2008, antes de que se aprobara el uso del pemetrexed en esta indicación9.
Los regímenes quimioterapéuticos de primera línea, principalmente terapia doble que incluye un platino, se ajustan en la mayor parte de los casos a los recomendados por las guías de la American Society of Clinical Oncology15 y de la National Comprehensive Cancer Network16.
La mayoría de los pacientes (81,8%) presentaron PE, no habiendo ninguna RC o RP. Estos resultados difieren de lo observado en el ensayo clínico8 de aprobación de pemetrexed como tratamiento de segunda línea del CPNM, donde el 9,1% de los pacientes respondieron (RC/RP) al tratamiento y también del único estudio retrospectivo publicado en España17, en el que la respuesta aun fue mayor: el 29,2%. Estas diferencias pueden estar debidas al elevado porcentaje de pacientes en nuestro estudio con estadio iv al inicio del tratamiento con pemetrexed, el 86 frente al 37,5% del estudio de Picaza17 o el 74,9% del estudio de Hanna8.
En el estudio de Hanna8, la supervivencia desde la inclusión en el estudio en los pacientes tratados con pemetrexed como segunda línea fue de 8,3 meses, valor similar a la SIP de nuestro estudio: 7,8 meses. Picaza et al17, sin embargo, obtienen un valor inferior, entre 4,5 y 5 meses, según el estadio y los meses transcurridos desde el último tratamiento, a pesar de que su porcentaje de respuesta al pemetrexed era alto (29,2%). Estos resultados ponen de manifiesto que la respuesta al pemetrexed no se relaciona con la supervivencia.
Un análisis retrospectivo18 concluyó que el ser mujer, el estadio iii al diagnóstico de la enfermedad, el mejor estado funcional al inicio del tratamiento de segunda línea (0–1 en la escala ECOG) y la mejor respuesta al tratamiento de primera línea aumentan significativamente la supervivencia desde la inclusión en el ensayo clínico8 en que se basa dicho análisis retrospectivo de los pacientes con CPNM tratados en segunda línea de tratamiento con pemetrexed. En nuestro estudio, la SIP sería el equivalente más cercano a la supervivencia de ese estudio y hemos encontrado diferencias significativas con mayor SIP en las mujeres y los pacientes con mejor estado funcional. En el estudio de Weiss18, la mediana de supervivencia en las mujeres fue menor que en nuestro estudio (9,4 frente a 14,6 meses), pero hemos de ser cautos con nuestros resultados ya que los grupos por sexo no son homogéneos, tan solo hay 6 mujeres frente a 38 hombres. El estado funcional previo al tratamiento con quimioterapéuticos de segunda línea en el CPNM es un factor pronóstico de mayor supervivencia para los tres agentes aprobados5–8,18. En nuestro estudio, las medianas de SIP para las tres puntuaciones de la escala ECOG son similares a las del estudio de Weiss18 (0 en la escala ECOG: 10,9 frente a 12,7 meses; 1 en la escala ECOG: 5,7 frente a 8,3 meses; 2 en la escala ECOG: 2,3 frente a 2,6 meses; p=0,0099 frente a p<0,0001).
En el CPNM con histología escamosa, el pemetrexed ha mostrado menores ventajas respecto a la supervivencia global que el docetaxel en segunda línea de tratamiento (6,2 frente a 7,4 meses)8 o que la gemcitabina/cisplatino en primera línea de tratamiento (9,4 frente a 10,8 meses)9. Sin embargo, en nuestro estudio, la mayoría de los pacientes (46%) presentaron histología epidermoide/escamosa. Esta situación también se produce en otro estudio retrospectivo, en el que la histología escamosa es la más frecuente entre los pacientes con CPNM tratados con pemetrexed (58,3%)17. No observamos diferencias significativas en términos de supervivencia entre los distintos tipos de histologías. A diferencia del estudio de Weiss18, en el nuestro el estadio del CPNM al diagnóstico y la respuesta al tratamiento quimioterapéutico de primera línea no han sido factores pronóstico de la supervivencia. Sin embargo, nuestros resultados son muy parecidos. Nuestras medianas de SIP para los estadios iii y iv han sido de 10,9 y 6,1 meses frente a los 9,5 y 7,8 meses, respectivamente, en el estudio de Weiss18. Del mismo modo, las medianas de SIP para los pacientes con EE o PE tras la primera línea de tratamiento son similares a las obtenidas en dicho estudio: 10,2 frente a 10,5 meses y 6,8 frente a 4,6 meses. Sin embargo, nuestra supervivencia tras RC o RP al tratamiento de primera línea ha sido algo inferior: 10,8 frente a 15,8 meses. Aunque el tipo de régimen quimioterapéutico de primera línea no es considerado factor pronóstico de la supervivencia, en nuestro estudio hemos observado mejores SIP en los pacientes tratados con platinos/gemcitabina (19,2 meses) y platinos/taxanos (10,2 meses), siendo estas supervivencias superiores a las observadas por Weiss18: 9,1 y 7,4 meses, respectivamente.
Por grupos de edad no se han detectado diferencias significativas en la supervivencia, aunque la SIQT es mayor en los pacientes de 70 años o superior y la SIP algo mayor en los menores de 70 años. En otro estudio de Weiss19, no se detectaron diferencias significativas ni en la respuesta ni en la supervivencia desde la inclusión de los pacientes en el estudio entre ambos grupos de edad, siendo de 7,8 meses para los menores de 70 años y de 9,5 meses para los pacientes con 70 años o superior. En nuestro estudio, sin embargo, la SIP de los que tenían 70 o más años ha sido algo inferior a la de los menores de 70 años (6,7 frente a 7,8 meses).
El pemetrexed ha demostrado ser significativamente más seguro que el docetaxel respecto a la producción de neutropenia de G3 o de G4 (el 5,3 frente al 40,2%) y de neutropenia febril (el 1,9 frente al 12,7%), a las hospitalizaciones por esta (el 1,5 frente al 13,4%) y a las infecciones asociadas con la neutropenia (el 0 frente al 3,3%)8. Por ello, el pemetrexed es el agente recomendado como tratamiento de segunda línea en el CPNM en pacientes previamente tratados con regímenes de primera línea que incluían platinos y que habían sufrido neutropenias u otras toxicidades, hematológicas o no20. Un 43,2% de nuestros pacientes había presentado al menos un episodio de neutropenia con tratamientos previos, siendo este el motivo o uno de los motivos del tratamiento con pemetrexed. Ningún paciente desarrolló neutropenia por pemetrexed. Los EA observados han sido principalmente no hematológicos.
La principal limitación de este estudio es que se trata de un estudio retrospectivo en el que no existe un grupo control para comparar con otros tratamientos y, por tanto, no se puede llegar a conclusiones definitivas respecto a los factores pronósticos de la supervivencia. Además, el número de pacientes es reducido y, al clasificar por sexo o grupos de edad, los grupos no son homogéneos, por lo que los resultados observados en esos grupos se deben analizar con cautela. Ahora bien, nos proporciona información útil acerca de la utilización del pemetrexed en la práctica clínica habitual. Son necesarios estudios prospectivos que confirmen el efecto de los factores pronósticos observados en este y otros estudios retrospectivos, así como estudios comparativos con docetaxel y erlotinib.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido comunicado previamente en el 52 Congreso de la SEFH celebrado en Tenerife en 2007 y el comité evaluador estimó que sería de interés su publicación. No se ha percibido ninguna beca ni ayuda económica para la realización de este trabajo.