Los objetivos del estudio fueron conocer y describir el tratamiento quimioterápico (QT) en pacientes con cáncer de mama (CM) en España y estimar su coste.
MétodosEstudio multicéntrico y transversal en el que se incluyó a todos los pacientes consecutivos con CM tratados con quimioterapia entre el 10 y el 15 de mayo de 2004 en 110 centros de España. Se recogió información de las características generales de los centros y datos de los pacientes y tratamientos administrados, la cual se realize de manera prospectiva a partir de los datos disponibles en el servicio de farmacia y/o en la propia historia clínica. Se solicitaron datos demográficos, clínicos, tratamientos QT administrados durante la semana de estudio y protocolos previos, así como la inclusión en ensayos clínicos y los costes directos de la medicación.
ResultadosSe incluyó a 2.134 pacientes (el 99,7% mujer; edad media, 51,5 años) de 16 comunidades autónomas. La mayoría de los tratamientos se administró en hospitales generales (89,7%), públicos o concertados (91,5%) y de nivel 3 (64,5%). De ellos, 120 pacientes (5,6%) recibieron tratamiento en un ensayo clínico. El 51% de los pacientes recibió tratamiento adyuvante o neoadyuvante, principalmente por enfermedad en estadio IIA (28,7%). En total, 1.011 pacientes presentaron enfermedad metastásica (EM). El coste medio estimado del tratamiento quimioterápico fue de 428,5 €/ciclo, y las pacientes con EM constituyeron el grupo con un mayor coste (640,4 €/ciclo).
ConclusionesLos resultados presentan una visión de la situación real del tratamiento QT del CM en España, y se observa una amplia variabilidad, tanto en la utilización de fármacos como en los costes asociados.
The study's objectives were to observe and describe chemotherapy treatment (CT) used in breast cancer (BC) patients in Spain and estimate its cost.
MethodsMulti-centre and transversal study, which included consecutive BC patients treated with chemotherapy between 10 and 15 May 2004 in 110 centres throughout Spain. Information was gathered on the general characteristics of the centres, the patient data and the treatments administered. This information was collected prospectively based on the data available in the pharmacy service and/or the patient's clinical history. The following information was requested: demographic, clinical, CT administered during the week of the study, established guidelines, inclusion in clinical trials and the direct costs of the medication.
ResultsA total of 2,134 patients were included (99.7% women) from 16 autonomous communities and the average age was 51.5. The majority of the treatments were administered in general hospitals (89.7%), public or public health partnership hospitals (91.5%) and level 3 specialist hospitals (64.5%). Among these patients, 120 (5.6%) received treatment as part of a clinical study. A total of 51% of patients received adjuvant or neoadjuvant treatment, mainly for stage IIA disease (28.7%). A total of 1011 patients presented metastatic disease (MD). The estimated average cost of chemotherapy treatment was €428.5 per cycle and the group of patients with MD incurred the greatest cost (€640.4 per cycle).
ConclusionsThe results show the current situation of CT for BC in Spain and a great deal of variability is observed both in the use of drugs as well as in the associated costs.
El cáncer de mama (CM) es uno de los mayores problemas de salud pública de los países desarrollados, tanto por su incidencia como por su mortalidad, ya que es el tumor maligno más frecuente y la primera causa de muerte por cáncer en la población femenina. La probabilidad actual de una mujer española de presentar un CM antes de los 75 años es del 8%1 y se estima que una de cada 9 mujeres desarrollará esta enfermedad a lo largo de su vida. Según el informe La situación del cáncer en España2, cada año se diagnostican 16.000 nuevos casos de CM y se registran alrededor de 6.000 fallecimientos3,4. La tasa de incidencia ajustada por edad en el año 1998 fue de 67/100.000 mujeres, la menor de la Unión Europea2,3, pero el número de nuevos diagnósticos entre los años 2000 y 2005 (67.600) sitúa a España en línea con el resto de países europeos. Diferentes factores, entre ellos el progresivo envejecimiento de la población, han contribuido al aumento de la incidencia en los últimos años. Paralelamente, la mayor conciencia de la sociedad sobre la importancia del diagnóstico precoz y los programas de cribado ha favorecido que cada día sean más las pacientes diagnosticadas con enfermedad en estadios tempranos que gozan de mayor probabilidad de curación. Todo ello, junto con la aparición de más y mejores tratamientos derivados de los más recientes avances en el conocimiento de la biología del cáncer y el aumento de la supervivencia (> 75% a los 5 años del diagnóstico)3, constituye una de las causas principales del aumento de la prevalencia del CM observado en los últimos años.
El tratamiento del cáncer de mama es complejo y variado. Conceptualmente incluye -excepto en el carcinoma lobular in situel tratamiento de la enfermedad local mediante cirugía y/o radioterapia y el tratamiento de la enfermedad sistémica con quimioterapia (QT) y/o tratamiento hormonal. La necesidad y la selección de los distintos tratamientos locales o sistémicos se basa en distintos factores pronóstico y de predicción que incluyen la histología, las características clínicas del tumor primario, la afectación ganglionar, los receptores hormonales, los niveles de expresión de HER2/neu, la presencia o ausencia de enfermedad metastásica detectable, la comorbilidad, la edad de las pacientes y la función ovárica5.
Se definen como variaciones de la práctica médica (VPM) las variaciones sistemáticas (no aleatorias) de las tasas estandarizadas de determinados tratamientos, o aspectos importantes de éstos, respecto a algún valor sensible de agregación de la población6. El estudio de las VPM en España es relativamente reciente, pero se ha confirmado que buena parte de lo descrito en otros países (principalmente en Estados Unidos, Reino Unido y países nórdicos) también sucede en nuestro entorno. En el ámbito de la oncología destacan los trabajos de la Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (AETSA)7,8, el National Institute of Clinical Excellence (NICE)9 y del Karolinska Intitute10 sobre la variabilidad de utilización de citostáticos. Las VPM son importantes porque son frecuentes y sistemáticas, y repercuten en el coste de los tratamientos y los resultados. Conocer sus causas es complejo, pero ni la introducción de nuevas tecnologías ni aspectos dependientes de la población, como la diferente composición demográfica, circunstancias epidemiológicas específicas de las poblaciones comparadas o diferencias en la accesibilidad por motivos económicos, son tan determinantes como la oferta de servicios y la actitud del proveedor de estos servicios11. En relación con este punto, tres son las posibles fuentes de variabilidad identificadas: a) incertidumbre clínica ante la amplia oferta de tratamientos y la falta de investigaciones con rigor suficiente; b) desconocimiento de las nuevas investigaciones y sus resultados, y c) las preferencias de los clínicos. Hay cierto consenso a la hora de señalar la primera de ellas como el factor más influyente, pero es preciso considerar también la débil relación existente entre la realidad de la ciencia médica y la realidad de la práctica clínica como otra causa de variabilidad. La ciencia médica busca la mejor respuesta clínica frente a situaciones específicas, mientras que la práctica clínica tiene que responder ante un paciente para el cual es posible que no haya opciones de tratamiento claramente definidas. Éste podría ser el caso de pacientes con enfermedad metastásica tras el fracaso de la primera y segunda líneas de tratamiento. En el caso de VPM por incertidumbre, la elaboración e implantación de guías de práctica clínica (GPC) basadas en las mejores pruebas científicas disponibles parece ser la mejor herramienta para garantizar que los grupos de pacientes con condiciones clínicas definidas reciban los tratamientos recomendados por la comunidad científica12,13. En diversos estudios se ha demostrado que cuando el tratamiento del cáncer se protocoliza se obtienen mejores resultados clínicos en términos de menor mortalidad y morbilidad14,15. No obstante, en estudios previos se ha descrito que el grado de adecuación de los tratamientos quimioterápicos a las GPC no es uniforme y que depende de varios factores: el tipo y el grado de especialización de los centros16,17, la carga de trabajo de los profesionales sanitarios18 y las características de la enfermedad19, entre otros.
Si centramos el tema en el análisis de la variabilidad en el tratamiento del CM, podemos indicar que en diversos estudios se ha descrito el tratamiento de esta enfermedad en el ámbito internacional20,21. En España se encuentran disponibles los datos el grupo GEICAM22, pero hasta ahora ningún estudio nacional ha abordado la variabilidad el tratamiento QT en mujeres con CM específicamente, ni se han analizado los costes asociados. Los objetivos de este estudio son describir el tratamiento QT intravenoso del CM en España en función de la comunidad autónoma, el tipo y el tamaño de los hospitales, analizar la influencia de la edad en la elección de los tratamientos, conocer el porcentaje de pacientes incluidos en protocolos en fase de investigación y estimar el coste de los tratamientos QT administrados.
MÉTODOSe diseñó un estudio transversal y multicéntrico en el que se incluyó a todos los pacientes consecutivos con diagnóstico de CM que recibieron tratamiento QT intravenoso entre el 10 y el 15 de mayo de 2004 en los 110 centros participantes. Todos los servicios de farmacia de los centros hospitalarios con representantes del Grupo GEDEFO fueron invitados a participar de manera voluntaria.
Se diseñó un formulario ad hoc para la recogida de datos de los centros. Los formularios fueron cumplimentados antes del inicio del estudio y enviados a la sede de GEDEFO para la asignación de un código de centro que asegurara el ciego durante el análisis. Se recogió información relativa a las características generales de los centros (tipo: general/oncológico, financiación: público-concertado/privado), estructura (nivel), área de influencia y actividad clínica. Se definió el nivel 1 como comarcal o de baja complejidad, el nivel 2 como general o de complejidad media y el nivel 3 como de referencia, de alta tecnología o de alta complejidad. Se diseñó también un formulario específico para la recogida de datos de los pacientes y los tratamientos administrados, cuya recogida se realizó de manera prospectiva la semana del estudio a partir de los datos disponibles en el servicio de farmacia y/o en la propia historia clínica. Se solicitaron datos demográficos (edad), clínicos (estadio de la enfermedad), tratamientos QT administrados durante la semana de estudio y protocolos previos (citostáticos, dosis, número de ciclos previstos), así como el servicio responsable de la prescripción. El formulario incluía también un apartado para indicar la inclusión de los pacientes en protocolos en fase de investigación cuando fuera necesario. Sólo se recogió información relativa a citostáticos de administración intravenosa (incluido el trastuzumab) y se excluyó cualquier medicación de soporte. Los tratamientos orales sólo fueron considerados si se administraban en combinación o de manera consecutiva con otros citostáticos intravenosos. Los tratamientos en ensayo clínico (EC) fueron analizados por separado. Cada paciente fue considerado una única vez, con independencia de la administración de tratamiento en días consecutivos o alternos. Se consideró que era tratamiento previo todo régimen QT distinto del aplicado en el estudio y administrado con anterioridad a éste.
El análisis de costes se realizó a partir de la información descrita en el formulario de recogida de datos facilitada por los centros. Es decir, a partir de los datos del fármaco y la dosis se calculó el coste de aquel período (del 10 al 15 de mayo). Sólo se consideró el coste directo de adquisición (en euros) de los citostáticos administrados durante el período de inclusión, y a partir de esta información se estimó el coste por ciclo. Se definió como ciclo de tratamiento a la secuencia de fármacos administrados en un tiempo determinado según el esquema de administración. Para ello se calculó el precio de venta de laboratorio (PVL)/mg (IVA no incluido) de cada citostático en fecha de 1 de enero de 200423. En los casos en los que había más de una presentación disponible se utilizó el PVL/mg de citostático de la presentación de mayor dosis. Los datos se presentan por comunidad autónoma. Las comunidades autónomas con muestras pequeñas fueron agregadas y tratadas conjuntamente.
El análisis estadístico se realizó en dos etapas con el paquete estadístico SPSS' versión 9.0 (SPSS Inc.). En la primera etapa se aplicaron métodos descriptivos para calcular la distribución de frecuencia de las variables cualitativas. En el caso de las variables cuantitativas, se procedió al cálculo de las medidas de tendencia central y de dispersión, como la desviación típica y el recorrido de la variable. En la segunda se aplicó la prueba de la χ2. El nivel de significación aplicado a las distintas pruebas de hipótesis fue de p ≤ 0,05, con una potencia del 80%. Todas las pruebas fueron bilaterales. (Si bien durante el estudio se incluyó a un reducido número de pacientes varones, de aquí en adelante se utilizará el sexo femenino para referirse al conjunto de pacientes incluidos.)
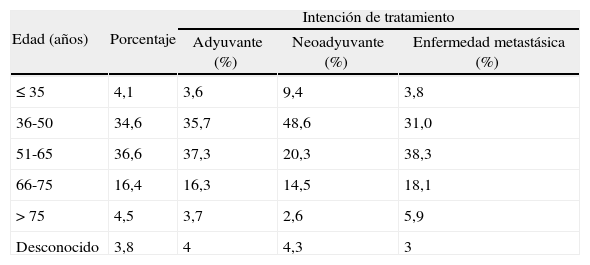
RESULTADOSUn total de 2.134 pacientes (el 99,7% mujeres) fueron incluidos en 110 centros de 43 provincias y 16 comunidades autónomas. Cataluña (n = 23), Andalucía (n = 15) y la Comunidad de Madrid (n = 14) fueron las comunidades con mayor número de centros participantes. Cataluña con 425 pacientes, la Comunidad Valenciana con 279 pacientes y Andalucía con 250 pacientes fueron las comunidades que incluyeron a un mayor número de pacientes. La edad media de las pacientes fue de 51,5 años (intervalo, 23-87). El 71,2% de la muestra tenía entre 36 y 65 años de edad (tabla 1).
Distribución de los pacientes según grupos de edad
| Edad (años) | Porcentaje | Intención de tratamiento | ||
| Adyuvante (%) | Neoadyuvante (%) | Enfermedad metastásica (%) | ||
| ≤ 35 | 4,1 | 3,6 | 9,4 | 3,8 |
| 36-50 | 34,6 | 35,7 | 48,6 | 31,0 |
| 51-65 | 36,6 | 37,3 | 20,3 | 38,3 |
| 66-75 | 16,4 | 16,3 | 14,5 | 18,1 |
| > 75 | 4,5 | 3,7 | 2,6 | 5,9 |
| Desconocido | 3,8 | 4 | 4,3 | 3 |
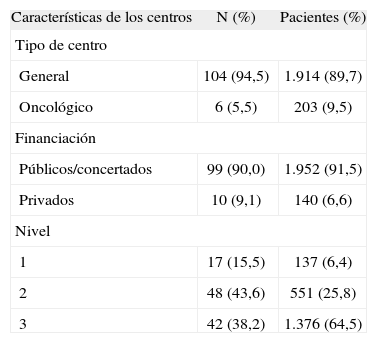
En la tabla 2 se describen las características principales de los centros. La mayoría fueron hospitales generales (94,5%), públicos o concertados (90,0%) y de nivel 2 (43,6%). En términos generales, éstos fueron también los centros que incluyeron el mayor número de pacientes. No obstante, el número de pacientes tratados en los centros de nivel 3 (64,5%) fue superior al de los centros de nivel 2 (25,8%). La práctica totalidad de los tratamientos (99,2%) fue administrada en el hospital de día. El servicio de oncología médica fue responsable del 93,2% de las prescripciones, seguido del servicio de ginecología (6,0%). No se indicaron otros servicios distintos de los mencionados como responsables de la prescripción de tratamientos QT.
Características de los centros participantes
| Características de los centros | N (%) | Pacientes (%) |
| Tipo de centro | ||
| General | 104 (94,5) | 1.914 (89,7) |
| Oncológico | 6 (5,5) | 203 (9,5) |
| Financiación | ||
| Públicos/concertados | 99 (90,0) | 1.952 (91,5) |
| Privados | 10 (9,1) | 140 (6,6) |
| Nivel | ||
| 1 | 17 (15,5) | 137 (6,4) |
| 2 | 48 (43,6) | 551 (25,8) |
| 3 | 42 (38,2) | 1.376 (64,5) |
El 49,0% de los tratamientos administrados durante el período de inclusión se administró a pacientes con enfermedad metastásica, el 46,2% en adyuvancia y el 7,9%, en neoadyuvancia. Si se consideran también los tratamientos QT previos se observa que en la mayoría de los casos el primer tratamiento QT se administra en adyuvancia (60,7%), por delante de los tratamientos por enfermedad metastásica (20,8%) y los tratamientos neoadyuvantes (18,5%). En relación con los tratamientos neoadyuvantes administrados durante la semana de selección, destaca el porcentaje que representan éstos respecto al total de tratamientos administrados en los centros de nivel 1 (9,5%) que, como se ha observado, es superior al de los centros de nivel 2 (2,5%) y nivel 3 (7,6%).
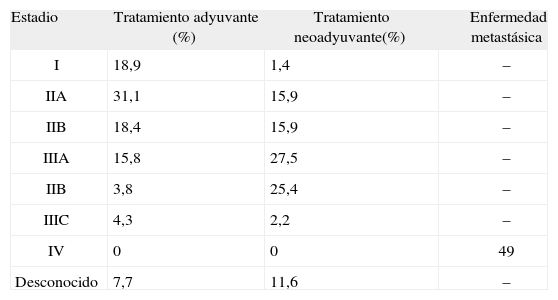
En la tabla 3 se muestra la distribución de pacientes según el estadio de la enfermedad y la intención de tratamiento. Cerca del 50% de los pacientes que recibieron tratamiento adyuvante presentaba enfermedad en estadio II. Alrededor del 55% de las pacientes con tratamiento neoadyuvante presentaba enfermedad en estadio III.
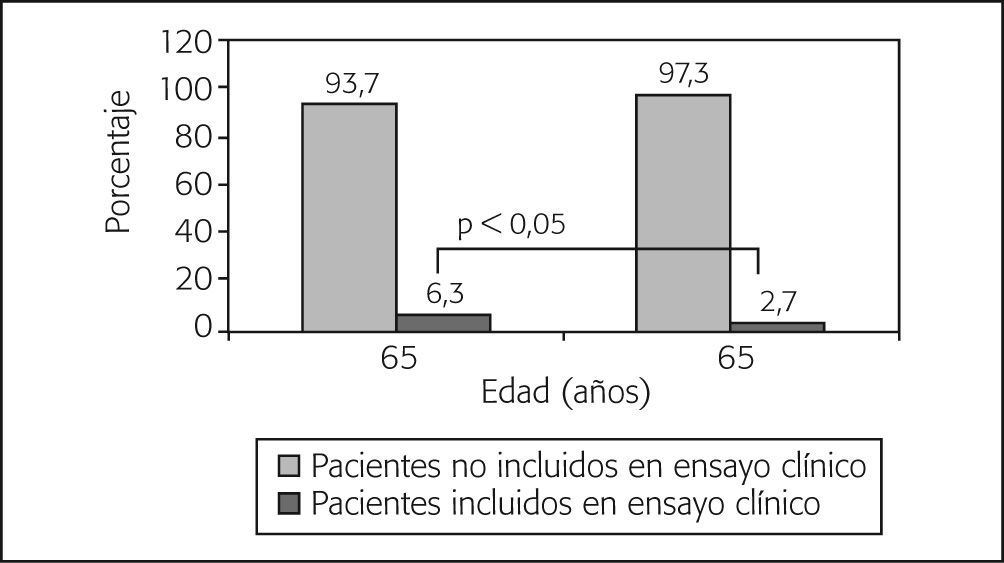
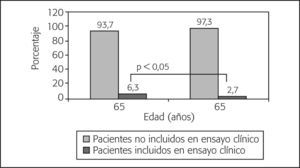
Ensayos clínicosUn total de 120 pacientes (principalmente en la Comunidad Valenciana [26,7%], Cataluña [19,2%], Andalucía [18,3%] y Madrid [13,4%]) repartidos en un total de 37 centros recibieron tratamiento QT en protocolos en fase de investigación, cifra que representa el 5,6% de la muestra. La edad media fue de 50,0 años (intervalo, 25-80). La mayoría de las pacientes recibió tratamiento en hospitales generales (79,2%), públicos/concertados (95%) y de nivel 3 (85,5%), en comparación con los hospitales monográficos (20,8%), privados (4,2%) y nivel 1 y 2 (el 3,3 y el 10%, respectivamente). No obstante, en relación con el número de pacientes tratados por tipo de hospital, los centros monográficos incluyeron a más pacientes en EC (12,3%) que los hospitales generales (5%). Del total de EC, 50 (41,7%) correspondieron a tratamientos adyuvantes, 36 (30%) a tratamientos neoadyuvantes y 34 (28,3%) a tratamientos metastásicos/paliativos (21 en primera línea, 9 en segunda línea, 2 en tercera línea y 2 en quinta línea o más). Con respecto al total de pacientes en cada grupo de tratamiento, los tratamientos en EC correspondieron al 5,5, el 20,7 y el 3,3% de los tratamientos adyuvantes, neoadyuvantes o por enfermedad metastásica, respectivamente. Se observaron diferencias con significación estadística en el porcentaje de pacientes incluidos en EC según grupos de edad (≤ 65 años y > 65 años) (fig. 1).
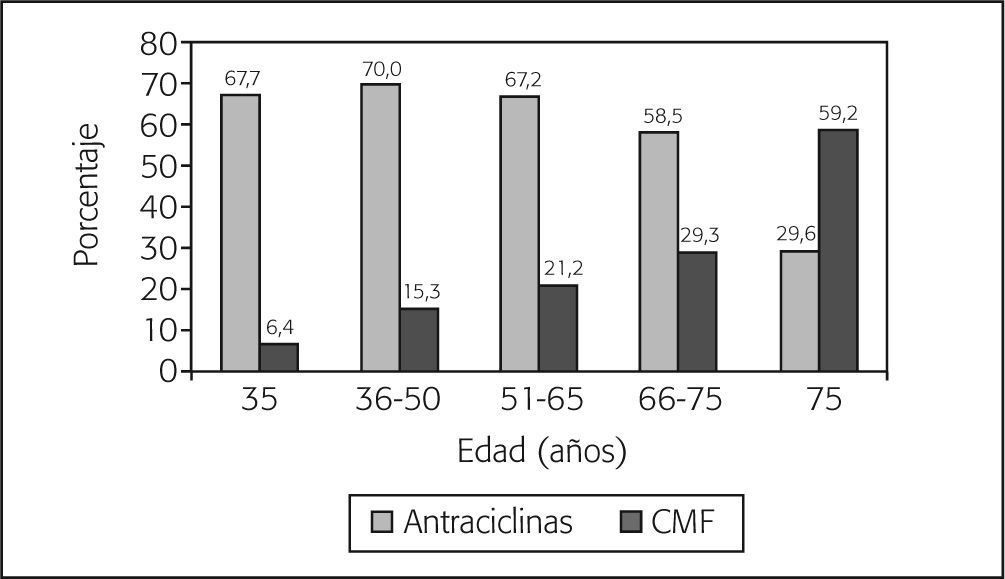
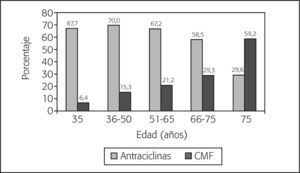
Tratamientos quimioterápicosUn total de 859 pacientes recibió tratamiento adyuvante fuera de protocolos en fase de investigación. De éstos, el 51,4% recibió al menos una antraciclina en esquemas del tipo AC (doxorrubicina, ciclofosfamida), FAC (5-fluorouracilo, doxorrubicina, ciclofosfamida), EC (epirrubicina, ciclofosfamida) o FEC (5-fluorouracilo, epirrubicina, ciclofosfamida), siendo éste último el más frecuente (n = 257). El 21,5% de las pacientes recibió algún taxano (un 49,4% en combinación con antraciclinas, un 44,9% en monoterapia y un 5,7% en combinación con otros citostáticos) y el 21,2%, tratamiento con CMF (ciclofosfamida, metotrexato, 5-fluorouracilo). El análisis por grupos de edad revela que el uso de CMF se incrementó con la edad, llegando a representar hasta el 59% de los tratamientos en pacientes > 75 años. El uso de antraciclinas fue relativamente constante en el grupo de pacientes de edad ≤ 65 años, si bien se observa una disminución importante a partir de esta edad (fig. 2). El paclitaxel fue el taxano más administrado (53,0%) y la epirubicina fue la antraciclina de elección en el 59,0% de los casos.
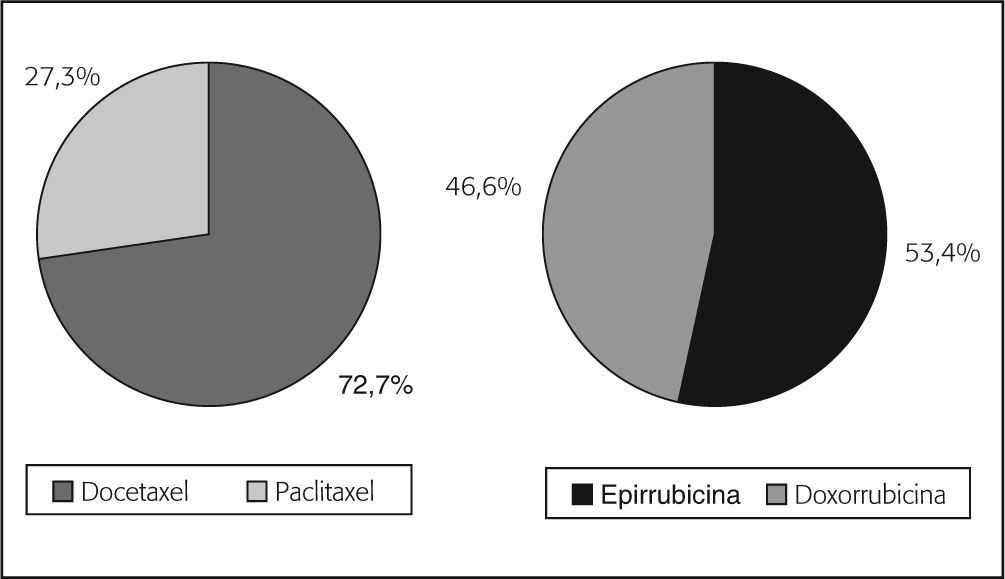
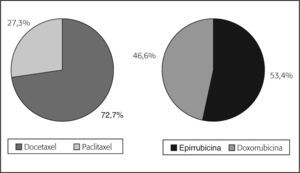
En el grupo de pacientes con tratamiento neoadyuvante fuera de un EC (138), el 42% recibió tratamiento basado en antraciclinas del tipo AC, FAC, EC o FEC, el 26,8% tratamiento combinado con taxanos y antraciclinas, y el 18,1% taxanos solos. Se observó una mayor utilización de docetaxel (72,7%) y epirrubicina (53,4%) (fig. 3).
El número de pacientes en tratamiento por enfermedad metastásica no incluido en EC fue de 1.011. De éstos, el 41,9% recibió tratamiento en primera línea, el 27,8% en segunda línea, el 14,5% en tercera línea, el 9,8% en cuarta línea y el 4,9% en quinta línea o posteriores. El 30,7% de las pacientes con tratamiento en primera línea recibió trastuzumab (el 43,1% en combinación con paclitaxel, el 24,6% en monoterapia, el 23,1% en combinación con vinorelbina y el 9,2% en combinación con docetaxel), el 22,0% taxanos en monoterapia, el 17,0% taxanos en tratamiento combinado (el 58,3% con antraciclinas, el 18,0% con capecitabina, el 13,8% con gemcitabina, el 5,5% con vinorelbina y el 4,2% con carboplatino) y el 7,8%, antraciclinas en protocolos tipo AC, FAC, EC y FEC. El 4,0% de las pacientes en tratamiento de primera línea con antraciclinas había recibido antraciclinas en tratamientos previos.
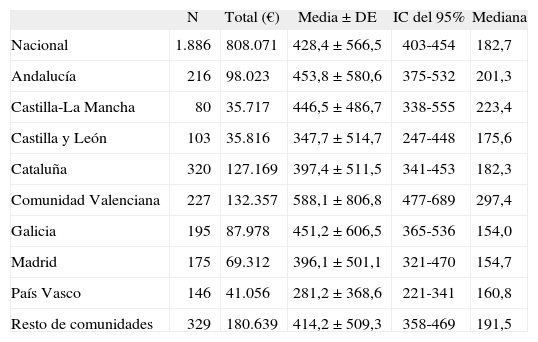
Análisis de costesEl coste global del tratamiento de las 1.886 pacientes evaluables ascendió a 808.071 €. La media nacional ± desviación estándar (DE) se situó en 428,4 ± 566,5 €/ciclo; la Comunidad Valenciana (581,8 ± 806,8 €/ciclo) y el País Vasco (281 ± 368,6 €/ciclo) fueron las comunidades autónomas con diferencias respecto a la media nacional (tabla 4).
Coste del tratamiento quimioterápico (€/ciclo) según comunidades autónomas
| N | Total (€) | Media ± DE | IC del 95% | Mediana | |
| Nacional | 1.886 | 808.071 | 428,4 ± 566,5 | 403-454 | 182,7 |
| Andalucía | 216 | 98.023 | 453,8 ± 580,6 | 375-532 | 201,3 |
| Castilla-La Mancha | 80 | 35.717 | 446,5 ± 486,7 | 338-555 | 223,4 |
| Castilla y León | 103 | 35.816 | 347,7 ± 514,7 | 247-448 | 175,6 |
| Cataluña | 320 | 127.169 | 397,4 ± 511,5 | 341-453 | 182,3 |
| Comunidad Valenciana | 227 | 132.357 | 588,1 ± 806,8 | 477-689 | 297,4 |
| Galicia | 195 | 87.978 | 451,2 ± 606,5 | 365-536 | 154,0 |
| Madrid | 175 | 69.312 | 396,1 ± 501,1 | 321-470 | 154,7 |
| País Vasco | 146 | 41.056 | 281,2 ± 368,6 | 221-341 | 160,8 |
| Resto de comunidades | 329 | 180.639 | 414,2 ± 509,3 | 358-469 | 191,5 |
DE: desviación estándar; IC: intervalo de confianza.
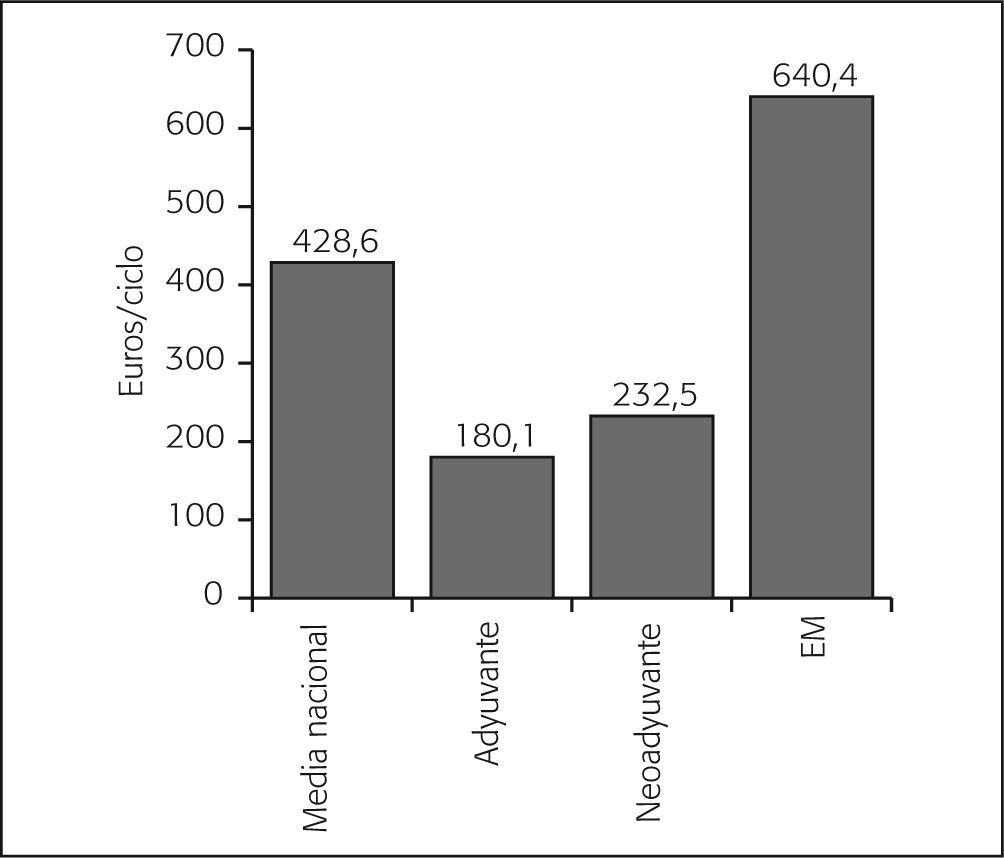
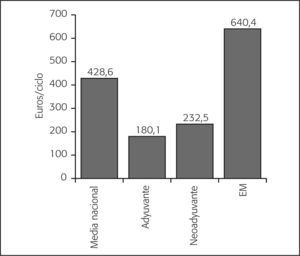
Por intención de tratamiento, el grupo de pacientes con enfermedad metastásica fue el grupo con un mayor coste asociado en citostáticos por paciente y ciclo (640,4 €/ciclo), seguido de los pacientes en tratamiento neoadyuvante (232,5 €/ciclo) y los pacientes con tratamiento adyuvante (180,1 €/ciclo). No obstante, fue en este último grupo en el que se observó una mayor variabilidad de los costes Por edad, se observa un mayor gasto en pacientes < 65 años, excepto en el contexto del tratamiento neoadyuvante. Asimismo, se observa que el gasto por paciente y ciclo es similar, con independencia de las características de estructura de los centros (fig. 4).
DISCUSIÓNÉste es el primer estudio realizado en España con el objetivo de conocer y describir el tratamiento QT intravenoso en pacientes con CM. Se estima que el conjunto de áreas de influencia de los centros participantes cubrió un porcentaje cercano al 70,0% de la población española (43.048.851, año 2004)24. Asimismo, considerando la población de mujeres en el año 2004 y una incidencia anual de CM de 45-75 nuevos casos por cada 100.000 mujeres2, y asumiendo que el 70% de las pacientes con enfermedad no metastásica recibe tratamiento QT y que el número medio de ciclos de quimioterapia en adyuvancia y neoadyuvancia es de 6, se estima que durante la semana de estudio se seleccionó cerca del 76% de las pacientes que recibieron tratamiento QT en ese mismo período. La naturaleza descriptiva del estudio exige interpretar los resultados de manera cautelosa; sin embargo, si atendemos a la amplia muestra de pacientes incluidas en centros de distintos niveles repartidos a lo largo de toda la geografía española, se considera que los datos aquí presentados son altamente representativos del tratamiento QT del CM de España.
Desde la publicación de los primeros estudios sobre la actividad del CMF en mujeres con enfermedad metastásica en la década de 1970, muchas han sido las opciones terapéuticas que han contribuido a la mejora del control de este grupo de pacientes. En el ámbito de la quimioterapia cabe destacar la aparición de las antraciclinas en la década de 1980 y de los taxanos en la de 1990. Más recientemente, los avances biomédicos han favorecido el desarrollo de nuevas moléculas que, hoy por hoy, forman parte del amplio arsenal terapéutico disponible para pacientes con enfermedad metastásica y que incluye, además de los citostáticos mencionados con anterioridad, la vinorelbina, el cisplatino, el carboplatino, la gemcitabina, la doxorrubicina liposomal y el trastuzumab. Los datos obtenidos indican que hay una gran variabilidad en la utilización de estos fármacos y en la combinación de éstos en nuestro país, hecho que se acentúa a medida que aumentan las líneas de tratamiento debido a la menor evidencia científica disponible en estos casos. El hecho de que sea en la enfermedad metastásica donde se introducen inicialmente los nuevos fármacos, por lo general de coste elevado, contribuye a que el coste del tratamiento de este grupo de pacientes sea mayor que el de pacientes con tratamiento adyuvante o neoadyuvante. En diferentes estudios se han realizado análisis de la eficiencia de estos tratamientos25,26.
Paralelamente, en los años setenta se realizaron también los primeros ensayos clínicos en pacientes con enfermedad en estadios tempranos y se demostró que la administración de quimioterapia con intención adyuvante aumentaba la supervivencia. En estudios posteriores se ha demostrado que la poliquimioterapia ofrece ventajas sobre la monoterapia en términos de beneficio, que la duración óptima del tratamiento debe de ser de 6 meses y que las antraciclinas son ligeramente más activas que el tratamiento clásico con CMF. No obstante, es preciso definir todavía el papel de los taxanos en adyuvancia, aunque en estudios recientes se apunta su papel en el tratamiento secuencial o combinado con antraciclinas en mujeres con afectación de los ganglios27-33. Los datos del estudio indican que ya en 2004 en nuestro país se utilizaban los taxanos fuera del entorno de un EC en el 22% de las pacientes.
En los últimos años se observa también una tendencia a anteponer la quimioterapia a la intervención quirúrgica. En estudios aleatorizados efectuados en pacientes con enfermedad en estadios II, IIIA y IIIB se ha demostrado, por ejemplo, que la quimioterapia neoadyuvante permite aumentar el porcentaje de pacientes con cirugía conservadora. En este grupo de pacientes, el tratamiento clásico se basa en antraciclinas y/o taxanos34. Pero, ciertamente, la utilización de esta modalidad de tratamiento requiere una amplia coordinación dentro del equipo asistencial, motivo por el que sorprende que el porcentaje de pacientes tratados en neoadyuvancia respecto el total de pacientes tratados sea mayor en los centros de nivel 1 que en los de nivel 2 y nivel 3.
El análisis de los datos obtenidos en pacientes incluidos en EC muestra una tendencia similar a la referida en estudios realizados en el ámbito de la oncología fuera de nuestro país, en los que se describe la edad como factor importante a la hora de determinar la inclusión de los pacientes en el EC35,36. En los datos presentados aquí, el 6,3% de pacientes ≤ 65 años fue incluido en EC, frente al 2,7% de pacientes > 65 años (p = 0,003).
El estudio de costes nos indica, por un lado, que los costes asociados con el tratamiento del cáncer de mama son amplios y que hay variabilidad, tanto según la intención de tratamiento, ligado a los esquemas utilizados, como según el área geográfica donde se administra el tratamiento. Como ya se ha discutido con anterioridad, en el momento de estudio, el grupo de pacientes que presentaba mayores costes asociados en citostáticos fue el recibió quimioterapia por enfermedad metastásica, pero se espera que, a medida que los nuevos fármacos se incorporen al tratamiento estándar de pacientes con enfermedad en estadios menos avanzados, estas diferencias disminuyan. Ejemplo de ello es el del trastuzumab en estadios tempranos (posterior a la recogida de datos).
El estudio presenta varias limitaciones. Si bien nos ofrece una imagen del tratamiento sistémico del CM en nuestro país, ésta es sólo parcial, ya que únicamente se recogieron datos de los centros con representantes del grupo GEDEFO y, a su vez, su participación fue voluntaria. La muestra de centros participantes es grande y, si bien participó la mayoría de centros que aglutinan el mayor número de pacientes en cada una de las comunidades autónomas representadas, no puede asegurarse lo mismo si nos referimos a centros más pequeños. Por ello se podría indicar una posible variable de confusión relacionada con esta clasificación, que impactaría tanto en la variable costes como en la de inclusión en ensayos clínicos. Asimismo, no se recogió información sobre tratamientos hormonales, tan importantes en algunos grupos de pacientes, especialmente los de edad avanzada, ni citostáticos orales (capecitabina y vinorelbina), excepto en los casos en los que se administraron en combinación con otros fármacos intravenosos. Además, debe tenerse en cuenta que el cálculo de costes se ha realizado utilizando el PVL. Éste no tiene por qué reflejar estrictamente la realidad, pues el coste final de los medicamentos depende de las políticas de compras de los centros. A pesar de ello, y aunque el diseño del estudio no permite asegurarlo, se cree que las diferencias observadas en relación con el gasto en citostáticos en el tratamiento del cáncer de mama en las distintas comunidades autónomas representadas estaría relacionada con la variabilidad en la utilización de fármacos, y no con diferencias en el coste.
Los datos del estudio nos ofrecen una visión de la situación real del tratamiento QT del cáncer de mama en España y de los costes asociados. Estudios futuros permitirán conocer la evolución de los tratamientos en el tiempo a medida que nuevas investigaciones aporten nuevas pruebas científicas.
AgradecimientosEl presente estudio es fruto de la iniciativa nacida de un grupo consolidado de farmacéuticos hospitalarios que trabaja para mejorar la calidad de la atención oncohematológica, el Grupo Español para el Desarrollo de la Farmacia Hospitalaria (GEDEFO).
Han participado en el estudio, por orden alfabético de centro, los siguientes farmacéuticos:
Centro Médico Teknon: Alonso P; Centro Oncológico de Galicia: Piñeiro MJ; Centro Oncológico MD Anderson: Bautista P, De Juan-García P; Centro Hospitalario La Mancha-Centro y Hospital de Alcázar de San Juan: Andrés N; Centro Hospitalario La Mancha-Centro y Hospital Virgen de Altagracia de Manzanares: Valenzuela JC, Luque MI; Centro Hospitalario XeralCalde de Lugo: Iglesias A; Clínica Arcángel San Miguel: Gainza C; Clínica Inmaculada: Nacle I; Clínica Virgen Blanca: Echeverria M; Clínica Vistahermosa: Lozano A; Complejo Asistencial de Zamora: Roldán JS; Complejo Hospitalario de Ciudad Real-Hospital de Alarcos: Fernández-Corada A; Complejo Hospitalario de Jaén: Marín JF; Complejo Hospitalario de Ourense: Landeiro E, Varela JJ; Complejo Hospitalario de Pontevedra: Olivera R; Complejo Hospitalario de Soria: Azcárate I, Fernández E; Consorci Sanitari de Terrassa: Barrera M, Busquets R; Consorcio Hospitalario Provincial de Castellón: Beltrán MT; Corporació Parc Taulí: Frías MC; Fundació Sanitaria d'Igualada: Serrais JJ; Fundación Hospital Alcorcón: González EM, Martín de Rosales AM; Fundación Instituto Valenciano de Oncología: Mas C, Ruiz A; Fundación Jiménez Díaz: Piedra F; Hospital Arnau de Vilanova de Valencia: Pérez-Serrano MD; Hospital Arquitecto Marcide: Rodríguez I; Hospital Clínico de Barcelona: Massó J, Vilaplana O.; Hospital Clínico de Valencia: Ferriols F; H Clínico Universitario de Valladolid: Cuervas-Mons M, Fernández M, Jiménez MP, Salvador A, Sánchez MT; Hospital Comarcal Alt Penedés: Cardells C; Hospital Comarcal de la Selva: Alemany P; Hospital de Alcañiz: Huarte R; Hospital de Basurto: Vilella ML; H de Conxo: Lamas MJ, Zarra I; H de Cruces: Gil MA; H de Galdakao: Ibarra MO, Lertxundi U.; Hospital de Gran Canaria Dr. Negrín: Salazar MC; Hospital de la Santa Creu i Sant Pau: Broto A, Moreno E; Hospital de la Zarzuela: Cruz S; Hospital de León: González P; Hospital de Mataró: Gurrera T, Hospital de Mérida: Carvajal E, González Y; Hospital de Navarra: Iruin A, Jiménez T; Hospital de Sagunto: Bellés MD; Hospital Donosita: López G; Hospital General Básico de Baza: Bordajandi ML, Marín MC, García AM, Reche P; Hospital General de Catalunya: Bara B; Hospital General de Segovia: López MC; Hospital General de Vic: Franquesa R, López C.; Hospital General San Jorge: Alcácera MA; Hospital General U de Elche: Jiménez I, Murcia AC, Navarro A, Romero I, Hospital General Universitario de Alicante: Burgos A, Ferrandis P; Hospital General Universitario de Guadalajara: Horta A, Lázaro A, Sáez C, Testillano ML; Hospital General Universitario Gregorio Marañón: González-Haba E, Sánchez MN; Hospital General Yagüe: Barrio A, De la Nogal B; Hospital Infanta Cristina de Badajoz: Medina R, Santos I.; Hospital Juan Canalejo: Busto F; Hospital Juan Ramón Jiménez de Huelva: Giménez J, Grutzmancher S, Martín N.; Hospital La Paz: Herrero A, Hospital Meixoeiro de Vigo: Castro I; Hospital Morales Meseguer: León J; Hospital Mútua de Terrassa: Parada MA, Redondo S; Hospital Ntra Sra de Valme: Arias JA; Hospital Ntra Sra del Prado: Berrocal MA; Hospital Ntra. Sra. de América: Areas VL, Castillo E; Hospital Príncipe de Asturias: García C, García J, Martínez A; Hospital Puerta de Hierro: Torralba A; Hospital Puerta del Mar de Cádiz: Martínez MJ, Martínez-Gil C, Sánchez I, Rodríguez ME, Hospital Punta Europa de Algeciras: Villanueva P; Hospital Reina Sofia: Bernal A., Larrea N; Hospital Río Carrión: Iribarren MM; Hospital Ruber Internacional: Méndez M, Puerta Y; Hospital San Juan de Alicante: Camacho MD, Hospital Sant Bernabé de Berga: Gorgas MQ, Odena E; Hospital Sant Jaume de Calella: Ruiz D; Hospital Sant Joan de Deu: Estelrich M, Pujol F; Hospital Santa Barbara de Puertollano: Arteta M; Hospital Santa Maria de Lleida: Navarro M, Torres F; Hospital SAS de Jerez de la Frontera: Estefanía L, Gómez P; Hospital SAS la Línea: Ávila JR, Sandoval S, Manzano A; Hospital Severo Ochoa: García B, Lara MA., Ramallal M; Hospital Son Dureta de Palma de Mallorca: Ginés J, Hospital Torrecárdenas de Almería: Fernández JJ, Pinto C, Tarín MJ; Hospital Txagorritxu: Beobide I, Buil P; Hospital Universitario de la Princesa: Gallego T, Hospital Universitario Arnau de Vilanova de Lleida: Mangues I, H Universidad Central de Oviedo: Gonzalez N, Hospital Universitario de Getafe: Díez R; Hospital Universitario de Puerto Real: Martínez C; Hospital Universitario Dr Peset: Albert A; Hospital Universitario Insular de Gran Canaria: García L, Mejías A; Hospital Universitario Marqués de Valdecilla: García AM; Hospital Universitario Miguel Server: Agustín MJ, Idoipe A; Hospital Universitario Ntra. Sra. de Candelaria: Merino J; Hospital Universitario Sagrat Cor: Martínez M; Hospital Universitario Vall d'Hebron: Carreras MJ, Tomás E; Hospital Universitari la Fe: Cercós AC, Escrivá JJ, Esteban MJ; Hospital Virgen de la Arrixaca: Díaz MS, Pareja A; Hospital Virgen de la Luz: González B, Martínez E; Hospital Virgen de la Salud: Rubio AR, Hospital Virgen de la Victoria: Muro B, Hospital Virgen de las Nieves: Fernández MA, Lara MM.; Hospital Virgen de los Lirios: Oltra A, Sánchez S; Hospital Xeral Cies de Vigo: González S, Lázaro M; Hospital Municipal de Badalona: Muro N; Institut Catalá d'Oncologia de Badalona Hospital Universitari Germans Trias i Pujol: Giner P, Institut Catalá d'Oncologia de Barcelona_ Hospital Duran i Reynals: Clopés A, Paladio N, Rey M; Institut Catalá d'Oncologia de Girona_ Hospital Dr. Josep Trueta: Quer N, Soler F; Instituto Oncológico de San Sebastián: Alcain I, Cajaraville G, USP Clínica Sagrado Corazón: Reyes T.
Parte de los resultados de este estudio fueron presentados en el congreso de la American Society of Clinical Oncology (ASCO 2005) y el 50 Congreso de la Sociedad Española de Farmacia Hospitalaria (2005).
Correspondencia: Núria Paladio Duran. Gran Vía, s/n, km. 2,7. 08907 L’Hospitalet. Barcelona. España. Correo electrónico: nuriapd76@yahoo.es / farmacia@iconcologia.net.