Estudio observacional que realiza un análisis coste-efectividad de la estrategia antifúngica empírica en pacientes oncohematológicos de alto riesgo, desde la perspectiva hospitalaria y con un horizonte temporal de 10,8 días de media de tratamiento.
MétodoSe ha recogido: efectividad, costes de adquisición y otros costes (pruebas de diagnóstico, hospitalización, terapia antifúngica de segunda línea). Se analizan 107 pacientes, 115 subepisodios de infección fúngica invasiva y 139 tratamientos empíricos.
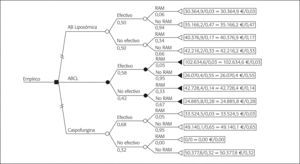
ResultadosLa efectividad y el coste medio/tratamiento fue: voriconazol, 88% y 20.108,8 €; caspofungina, 68% y 49.067,7 €; anfotericina B complejo lipídico (ABCL), 58% y 30.375,2 €, y anfotericina B liposómica (AB-L), 50% y 38.234,5 €. El primer árbol diseñado señala voriconazol como opción dominante, aunque su casuística resulta escasa. El segundo árbol selecciona ABCL frente a AB-L y caspofungina, con un CE medio de 52.371 €, el más próximo a la disponibilidad a pagar establecida (50.000 €). El análisis de sensibilidad evalúa los parámetros más influyentes: la variación del coste de adquisición no modifica el sentido del análisis; y la modificación de un 25% de otros costes para caspofungina invierte la relación, convirtiéndose ésta en la opción más coste/efectiva. El CEI indica que voriconazol en lugar de caspofungina ahorra 144.794 €. Respecto a caspofungina, ABCL incrementa el gasto en 186.925 €, cifra engañosa influenciada por una efectividad no muy distinta, y AB-L lo incrementa en 60.184 €.
ConclusionesEl estudio aporta información relevante desde la perspectiva de la práctica clínica pese a las limitaciones de costes no considerados (nefrotoxicidad). Este tipo de estudios contribuye a racionalizar el uso de antifúngicos en el entorno hospitalario y en los pacientes de alto riesgo como los oncohematológicos.
Observational study performing a cost-effectiveness analysis of the empirical antifungal strategy in high-risk oncohaematological patients, from the hospital perspective and with an average time horizon of 10.8 days of treatment.
MethodData gathered: effectiveness, purchase costs and other costs (diagnostic tests, hospitalisation, and second-line antifungal therapy). A total of 107 patients were analysed, 115 invasive fungal infection sub-episodes and 138 empirical treatments.
ResultsThe effectiveness and average cost/treatment were: voriconazole 88% and €20,108.8, caspofungin 68% and €49,067.7, Amphotericin B Lipid Complex (ABLC) 58% and €30,375.2, and Amphotericin B Liposome (AB-L) 50% and €38,234.5. The first tree designed shows voriconazole as the dominant option, although there are few case studies. The second tree selects ABLC in comparison to AB-L and caspofungin, with an average CE of €52,371, the nearest figure to the established availability to pay (50,000€). The sensitivity analysis evaluates the most influential parameters. The variation in the cost of purchasing do not modify the sense of the analysis, and the modification of 25% in other costs for caspofungin reverses the ratio, making this the most cost-effective option. The ICE indicates that using voriconazole instead of caspofungin saves €144,794. With regard to caspofungin, ABLC increases the cost by €186,925, a deceptive figure influenced by a level of effectiveness that is not very different; and AB-L increases the cost by €60,184.
ConclusionsThe analysis provides relevant information from the perspective of clinical practice in spite of the limitations of the unconsidered costs (nephrotoxicity). This type of analysis contributes to rationalizing the use of antifungal agents in the hospital setting and in high-risk patients such as oncohaematological ones.
Las infecciones fúngicas invasoras (IFI) se han incrementado en el medio hospitalario de forma significativa en los últimos años, tanto en frecuencia como en complejidad. Muchos enfermos se han convertido en huéspedes especialmente predispuestos, como son los inmunodeprimidos1-3. En el paciente oncohematológico el riesgo está relacionado con variables como: duración e intensidad de la neutropenia, enfermedad de base, uso de nuevas pautas de inmunoquimioterapia y/o antecedente de trasplante de progenitores hematopoyéticos4 (TPH). Las IFI se observan en el 10-50% de los pacientes con neutropenia o receptores de TPH, y encabezan la lista de causas infecciosas de fallecimiento. La mortalidad se ha mantenido muy elevada en las últimas décadas: no inferior al 30% en candidemia y superior al 50% en aspergilosis invasora, alcanzando cifras cercanas al 70-80%1,5. A todo ello se une la dificultad de un diagnóstico precoz y seguro, habiéndose descrito hasta un 75% de IFI no diagnosticadas en vida1,5-7.
Por otra parte, la aparición en los últimos 5 años de nuevos antifúngicos pertenecientes a familias clásicas (azoles) o dirigidos hacia nuevas dianas (equinocandinas) ha supuesto una innovación importante en el tratamiento de las IFI. Estas alternativas han demostrado en ensayos clínicos su eficacia y seguridad, al menos similar o incluso superior a los antifúngicos convencionales y que en algún caso permiten terapia secuencial o de combinación. Algunos estudios farmacoeconómicos publicados asocian una mayor eficiencia con estas nuevas moléculas, fundamentalmente en profilaxis o tratamiento de IFI8-13, pero también ventajas coste-efectivas en la terapia empírica de la neutropenia febril persistente14-16. La mayor parte de los estudios realizan comparaciones con el gold standard utilizado hasta el momento: anfotericina B desoxicolato (ABd).
Esta nueva situación, considerando además su impacto económico, requiere delimitar criterios de utilización como soporte a las decisiones terapéuticas diarias. Ello asegura la selección de la opción terapéutica más eficiente en cada caso, dado el elevado porcentaje del presupuesto hospitalario de medicamentos que representan los antifúngicos sistémicos y teniendo en cuenta que una IFI evitada implica un notable ahorro económico. El objetivo de este estudio es realizar un análisis costeefectividad de la estrategia antifúngica empírica utilizada en el hospital en pacientes oncohematológicos con elevado riesgo de IFI.
MÉTODOLa evaluación económica se ha realizado a partir de los resultados de efectividad y consumo de recursos obtenidos a partir de un estudio observacional retrospectivo y prospectivo que engloba 12 meses (2003-2004), y utilizando valores unitarios de costes del hospital.
Descripción del estudioPacientesPacientes oncohematológicos neutropénicos con elevado riesgo de IFI, en los que se inició un tratamiento antifúngico empírico en la unidad de hospitalización durante el periodo de recogida de datos. Se incluye la estancia en cuidados intensivos (UCI). En el análisis final se han excluido únicamente los pacientes con un seguimiento incompleto cuya información podía alterar los resultados, siendo su representación mínima (2 casos).
Pruebas de diagnósticoLas principales pruebas para el diagnóstico clínico y micológico, así como la identificación del hongo causal de la IFI, fueron:
- –
Cultivo: frotis (nasal, orofaríngeo), lavado broncoalveolar (LBA, obtenido mediante fibrobroncoscopia), hemocultivo, esputo, heces, orina, biopsias de piel y otros órganos…
- –
Serología: detección de antígeno galactomanano de Aspergillus.
- –
Estudio anatomopatológico de biopsias dirigidas de órganos determinados.
- –
Técnicas de imagen: tomografía computorizada (TC) de tórax y abdomen, senos paranasales, sistema nervioso central, y resonancia magnética (RM).
Se definió como criterio de IFI aquella situación clínica en la que se detecta un paciente neutropénico febril a pesar del tratamiento antiinfeccioso continuado, con signos o síntomas que hacen sospechar una IFI. Se ha recogido la información relativa a los episodios de IFI detectados durante el seguimiento, de modo que un mismo paciente puede presentar varios episodios en este período.
Terapia antifúngicaEn nuestro estudio la terapia antifúngica se refiere al tratamiento empírico17: administración temprana del antifúngico, al principio o durante el episodio de neutropenia febril, en pacientes neutropénicos con fiebre persistente o recurrente, de alto riesgo para IFI, pero sin disponer aún del diagnóstico de la micosis.
Tipo de análisis económicoModelo farmacoeconómico del tipo análisis coste-efectividad basado en el diseño de un árbol de decisión para la estrategia terapéutica empírica. Para su elaboración se empleó el programa TreeAge Pro Suite 2006 (TreeAge Software, Inc, Williamstown, MA).
Perspectiva del análisis y horizonte temporalLa perspectiva de la evaluación económica ha sido la del proveedor de servicios sanitarios, en este caso el Hospital Universitario La Fe (HULF). El horizonte temporal para la terapia empírica ha sido la media de días de tratamiento hasta resolución del episodio de IFI (10,8 ± 8,1; IC del 95% 9,5-12,1). El análisis se ha centrado en el perfil de los nuevos antifúngicos incorporados al hospital, voriconazol y caspofungina, respecto a la terapia utilizada preferentemente como estándar hasta el momento, anfotericina B en sus formulaciones alternativas: complejo lipídico (ABCL) y liposómica (AB-L). El período de estudio coincidió con una etapa de desabastecimiento de ABd, por lo que su uso se preveía escaso para el análisis.
Estimación de la efectividadLa efectividad se ha definido como la obtención de respuesta parcial o completa con y sin reacción adversa a medicamentos (efectivo con o sin RAM, no efectivo con o sin RAM) y la RAM como la detección de intolerancia al tratamiento inicial o algún efecto adverso que motivara, en cualquiera de los casos, el cambio a otro antifúngico de segunda línea. La efectividad se ha establecido en función de la respuesta de cada episodio individual de IFI al tratamiento antifúngico. No se han considerado las asociaciones dada la dificultad de atribuir la efectividad a uno de los antifúngicos. La clasificación de la respuesta se ha basado en criterios previamente asignados y reflejados en diversos estudios18,19, contándose para su evaluación con el consenso del clínico. Los tipos de respuesta han sido:
- –
Respuesta completa: resolución de todos los síntomas y signos clínicos atribuibles a la IFI y desaparición total o prácticamente total de los signos radiográficos.
- –
Respuesta parcial o estable: mejoría importante o resolución de los síntomas o signos clínicos, así como mejoría de al menos un 50% en las manifestaciones radiológicas, o ligera mejora (radiológica < 50%) o tratamientos cortos con escasa evaluación de la respuesta.
- –
Respuesta desfavorable o incompleta: enfermedad estable no progresiva.
- –
Fallo o fracaso del tratamiento: progresión de la enfermedad o fallecimiento del paciente, debido o no a la IFI. En estos pacientes con patologías complejas resulta difícil asociar directamente el fallecimiento a la IFI desarrollada, no siendo objeto de este estudio establecer dicha asociación.
Los episodios de IFI se han dividido en subepisodios en función del antifúngico utilizado (fecha inicio y fecha finalización), de modo que el tratamiento completo de un único episodio puede desdoblarse en etapas independientes (o subepisodios) según el antifúngico administrado. Así, un paciente puede tener varios episodios y un mismo episodio varios tratamientos. En cada subepisodio se evalúa la respuesta global del tratamiento administrado y la aparición de efectos adversos, aunque no se realizó seguimiento de los mismos.
Estimación de los costesLas consecuencias económicas de las opciones comparadas se han calculado a partir de los costes médicos directos relacionados con cada episodio, estimados para cada una de ellas. Estos costes computados son:
- –
Coste tratamiento farmacoterapéutico:
- •
Coste/tratamiento antifúngico completo.
- •
Coste de la terapia antifúngica de segunda línea en caso de fracaso inicial, de intolerancia o efecto adverso.
- •
- –
Otros costes asociados:
- •
Coste de las pruebas diagnósticas.
- •
Coste de las analíticas (bioquímica, hemograma, hemostasia).
- •
Coste de la estancia hospitalaria.
- •
Su cálculo se basa en la determinación del coste ponderado obtenido multiplicando la frecuencia de aparición por su coste unitario.
No se ha incluido el coste del abordaje y seguimiento de los acontecimientos adversos (prolongación de la estancia, mayor número de pruebas), ni los costes médicos directos e indirectos relativos a la terapia de la enfermedad de base. Tampoco se han considerado los costes de administración intravenosa (material necesario y tiempo empleado en la preparación y administración) por ser muy similares entre las opciones evaluadas. El coste de los medicamentos se calcula a PVL (tal y como son adquiridos por nuestro centro) y el resto se ha obtenido a partir del Sistema de Información Económica (SIE) del hospital.
El análisis estadístico básico lo realizó inicialmente Euroclin Institute y posteriormente hemos utilizado tanto el programa estadístico Statgraphics⊃ 5.0 como Microsoft⊃ Excel⊃.
Análisis de coste-efectividadLos resultados del análisis se presentan como coste medio por subepisodio, coste incremental, coste-efectividad medio y coste-efectividad incremental. La disponibilidad a pagar por un episodio tratado se ha cifrado en 50.000 € en todos los supuestos, teniendo en cuenta la complejidad de este tipo de pacientes.
Análisis de sensibilidadSe ha llevado a cabo un análisis de sensibilidad simple univariante de 2 vías con objeto de determinar la validez de las decisiones obtenidas modificando aquellas variables que se presentan con mayor grado de incertidumbre.
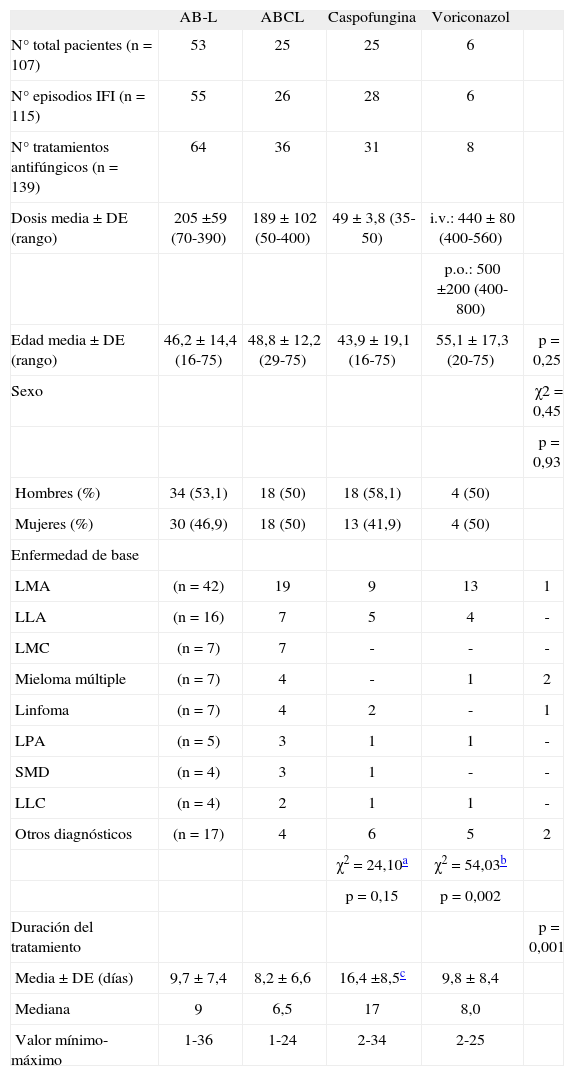
RESULTADOSSe han incluido 77 pacientes coincidentes en diferentes ramas por lo que para el análisis se consideran 107 pacientes en total. El número absoluto de sospechas de IFI ha sido de 94, desglosados en 115 subepisodios al evaluarse en cada rama (mismo episodio repetido con diferente tratamiento) y asociados a 139 tratamientos empíricos, correspondientes a los antifúngicos incluidos en el análisis coste-efectividad: AB-L (46,0%), ABCL (25,9%), caspofungina (22,3%) y voriconazol (5,8%). El promedio de días de tratamiento antifúngico por episodio ha sido de 10,8 (IC del 95% 9,5-12,1). El 89,6% de los pacientes eran neutropénicos, el 96,1% con situación febril y el 97,4% habían recibido tratamiento antibiótico previo, lo que confirmaba la presencia clara de factores de riesgo predisponentes de IFI. Un análisis multivariante (ANOVA) ha permitido determinar la ausencia de diferencias significativas entre las ramas en cuanto a sexo y edad, aunque sí se observan en la duración del tratamiento, siendo caspofungina el tratamiento de mayor duración. La tabla 1 recoge los datos referidos a las ramas. En cuanto a la enfermedad de base, la inclusión de la escasa muestra de voriconazol influye en el resultado, y muestra una diferencia entre los grupos (χ2 = 54,03; p = 0,002) que desaparece cuando se comparan sólo los tratamientos mayoritarios (χ2 = 24,10; p = 0,15).
Características de los pacientes, episodios de IFI y tratamientos antifúngicos de las ramas incluidas en el análisis coste-efectividad
| AB-L | ABCL | Caspofungina | Voriconazol | ||
| N° total pacientes (n = 107) | 53 | 25 | 25 | 6 | |
| N° episodios IFI (n = 115) | 55 | 26 | 28 | 6 | |
| N° tratamientos antifúngicos (n = 139) | 64 | 36 | 31 | 8 | |
| Dosis media ± DE (rango) | 205 ±59 (70-390) | 189 ± 102 (50-400) | 49 ± 3,8 (35-50) | i.v.: 440 ± 80 (400-560) | |
| p.o.: 500 ±200 (400-800) | |||||
| Edad media ± DE (rango) | 46,2 ± 14,4 (16-75) | 48,8 ± 12,2 (29-75) | 43,9 ± 19,1 (16-75) | 55,1 ± 17,3 (20-75) | p = 0,25 |
| Sexo | χ2 = 0,45 | ||||
| p = 0,93 | |||||
| Hombres (%) | 34 (53,1) | 18 (50) | 18 (58,1) | 4 (50) | |
| Mujeres (%) | 30 (46,9) | 18 (50) | 13 (41,9) | 4 (50) | |
| Enfermedad de base | |||||
| LMA | (n = 42) | 19 | 9 | 13 | 1 |
| LLA | (n = 16) | 7 | 5 | 4 | - |
| LMC | (n = 7) | 7 | - | - | - |
| Mieloma múltiple | (n = 7) | 4 | - | 1 | 2 |
| Linfoma | (n = 7) | 4 | 2 | - | 1 |
| LPA | (n = 5) | 3 | 1 | 1 | - |
| SMD | (n = 4) | 3 | 1 | - | - |
| LLC | (n = 4) | 2 | 1 | 1 | - |
| Otros diagnósticos | (n = 17) | 4 | 6 | 5 | 2 |
| χ2 = 24,10a | χ2 = 54,03b | ||||
| p = 0,15 | p = 0,002 | ||||
| Duración del tratamiento | p = 0,001 | ||||
| Media ± DE (días) | 9,7 ± 7,4 | 8,2 ± 6,6 | 16,4 ±8,5c | 9,8 ± 8,4 | |
| Mediana | 9 | 6,5 | 17 | 8,0 | |
| Valor mínimo-máximo | 1-36 | 1-24 | 2-34 | 2-25 |
ABCL: anfotericina B complejo lipídico; AB-L: anfotericina B liposómica; DE: desviación estándar; IFI: infecciones fúngicas invasoras; i.v.: intravenosa; LLA: leucemia linfoblástica aguda; LLC: leucemia linfoblástica;crónica; LMA: leucemia mieloide aguda; LMC: leucemia mieloide crónica; LPA: leucemia promielocítica aguda; p.o.: vía oral; SMD: síndrome mielodisplásico.
La respuesta favorable (parcial o completa) se alcanzó en un 58,3% de los 139 tratamientos considerados globalmente. Esto implica que en casi la mitad de los casos fue necesario intervenir en alguno de los tratamientos para resolver el episodio de IFI, modificando la posología, cambiando el antifúngico o combinando con otro antifúngico (70,7%).
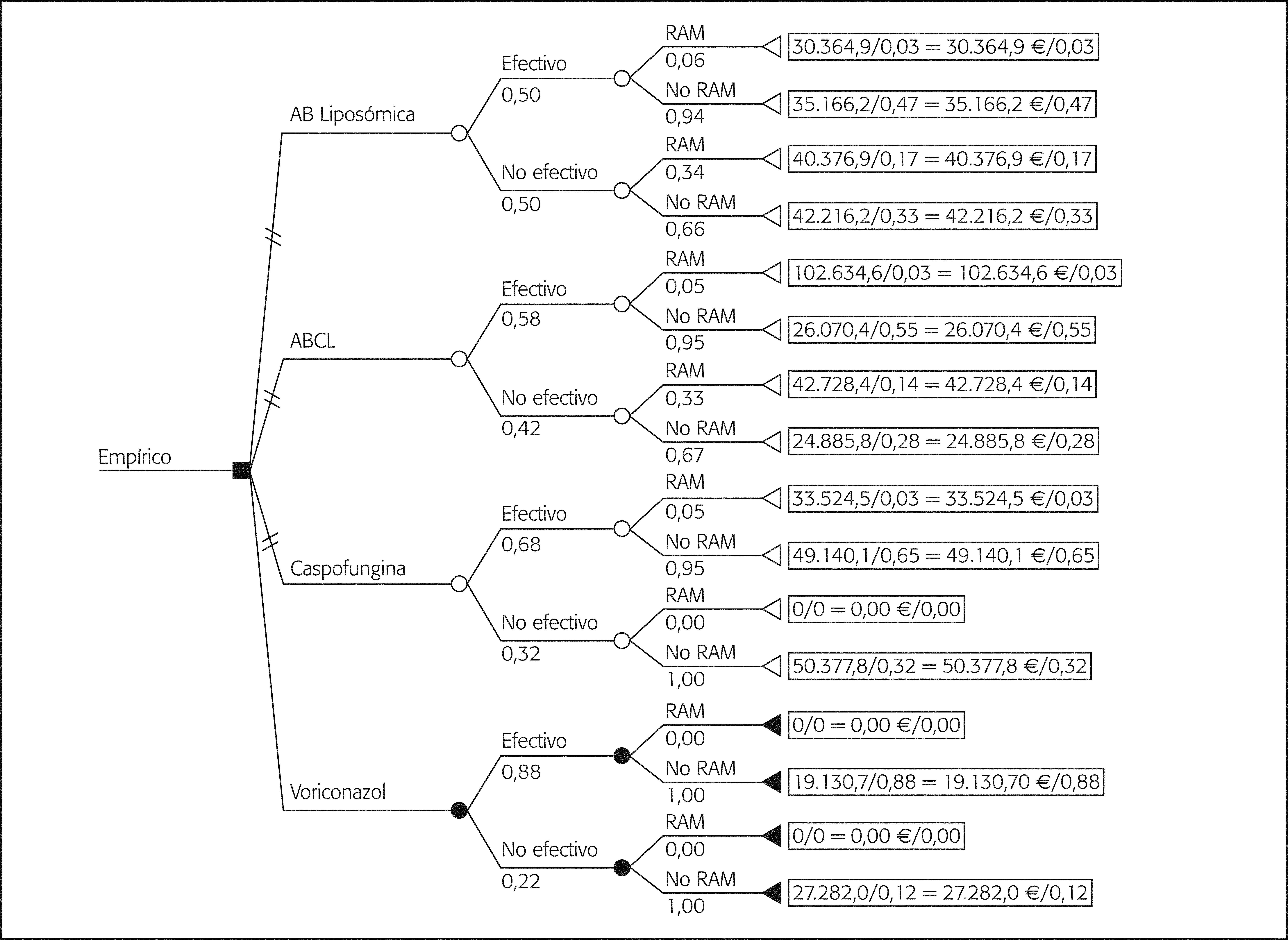
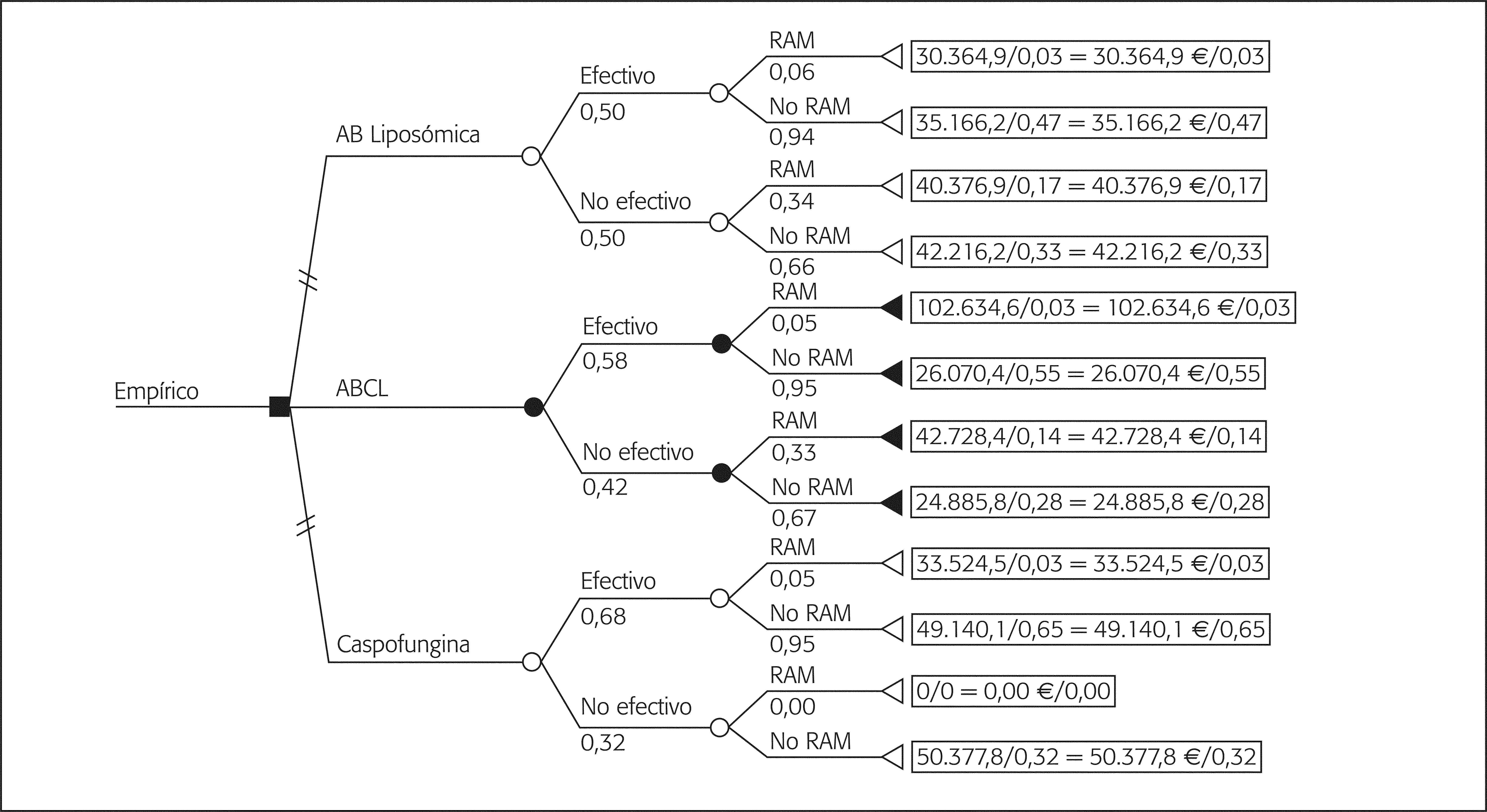
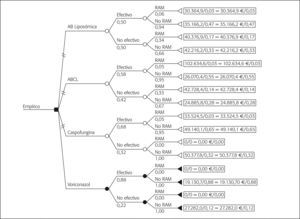
Análisis de los costesEn la tabla 2 se detallan los costes unitarios, costes de adquisición (€ año 2004) y las dosis de cada alternativa. El primer árbol de decisión contempla todas las opciones terapéuticas utilizadas en la terapia empírica (fig. 1). Las ramas se han distribuido contemplando las denominadas RAM que corresponden en su mayor parte a intolerancias y en algún caso a efecto adverso, incluyendo en el análisis el coste de la terapia de segunda línea que conlleva su aparición. Voriconazol es la rama más CE; sin embargo, el reducido número de casos recogidos dificulta la obtención de conclusiones claras. Por ello, se ha elaborado otro árbol eliminando voriconazol, que refleja la elección de ABCL como opción más CE (fig. 2).
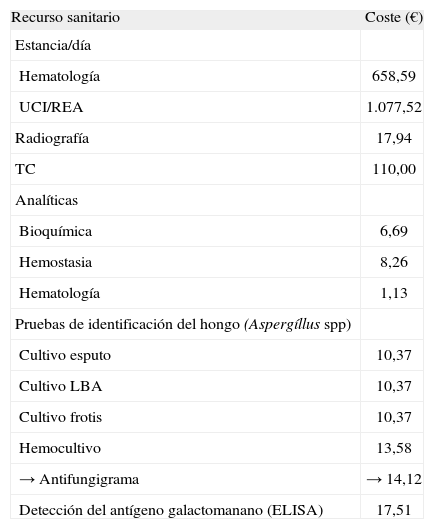
Descripción de los recursos sanitarios y sus costes unitarios considerados en el análisis coste-efectividad, así como de las dosis medias utilizadas
| Recurso sanitario | Coste (€) |
| Estancia/día | |
| Hematología | 658,59 |
| UCI/REA | 1.077,52 |
| Radiografía | 17,94 |
| TC | 110,00 |
| Analíticas | |
| Bioquímica | 6,69 |
| Hemostasia | 8,26 |
| Hematología | 1,13 |
| Pruebas de identificación del hongo (Aspergíllus spp) | |
| Cultivo esputo | 10,37 |
| Cultivo LBA | 10,37 |
| Cultivo frotis | 10,37 |
| Hemocultivo | 13,58 |
| → Antifungigrama | → 14,12 |
| Detección del antígeno galactomanano (ELISA) | 17,51 |
| Coste de antifúngicos (PVL) y dosis | ||||
| Unitario (€) | Dosis/día (€) | Dosis media ± DE (rango) | Dosis mg/kg/día (70 kg) | |
| Anfotericina B liposómica (Ambisome⊃) vial 50 mg | 138,53 | 554,12 | 205 ± 59 (70-390) | 2,9 |
| ABCL (Abelcet⊃) vial 100 mg | 97,52 | 195,04 | 189 ± 102 (50-400) | 2,7 |
| Caspofungina (Cancidas⊃) | ||||
| Vial 70 mg | 608,00 | Día 1: 608,00 | 49 ± 3,8 (35-50) | - |
| Vial 50 mg | 478,00 | Resto: 478,00 | ||
| Voriconazol (Vfend⊃) | ||||
| Vial 200 mg | 142,00 | 284,00 | i.v.: 440 ± 80 (400-560) | i.v.: 6,3 |
| Comprimidos 200 mg | 38,00 | 95,00 | p.o.: 500 ± 200 (400-800) | |
ABCL: anfotericina B complejo lipídico; DE: desviación estándar; i.v.: intravenosa; LBA: lavado broncoalveolar; p.o.: vía oral; TC: tomografía axial computorizada; UCI: Cuidados Intensivos. Costes obtenidos del Sistema de Información Económica (Dirección Económica) y de la base de datos de Gestión Farmasyst (Servicio de Farmacia) del Hospital Universitario La Fe.
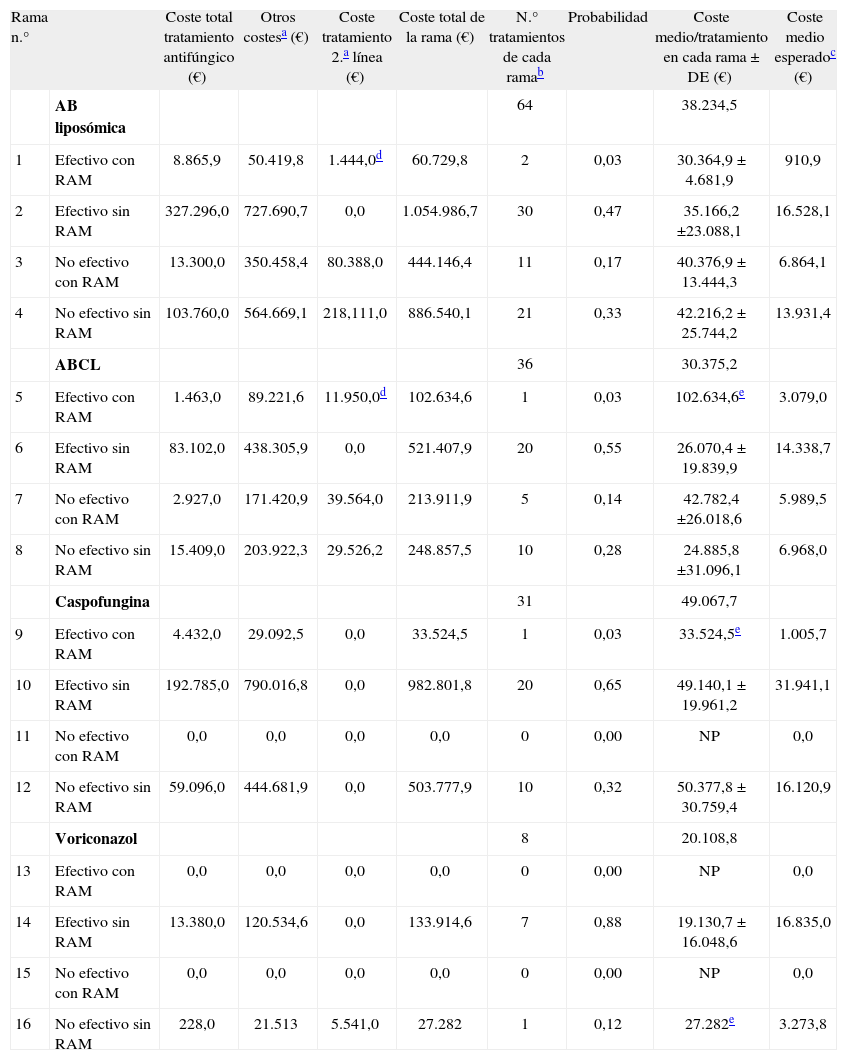
La tabla 3 muestra los costes desglosados de cada rama. Los componentes del coste que más influyen en el coste total son los no farmacológicos. El tratamiento antifúngico representa un 8,4% del coste total para voriconazol, un 9,5% para ABCL, un 16,9% para caspofungina y un 18,5% para AB-L. Según los resultados obtenidos la probabilidad media de respuesta favorable o efectiva fue del 88% para voriconazol (IC del 95%, 47,3-99,7), 68% para caspofungina (IC del 95%, 51,3-84,2), 58% para ABCL (IC del 95%, 42,2-74,4) y 50% AB liposómica (IC del 95%, 37,2-62,2).
Resultados de los costes de las distintas ramas para la terapia empírica
| Rama n.° | Coste total tratamiento antifúngico (€) | Otros costesa (€) | Coste tratamiento 2.a línea (€) | Coste total de la rama (€) | N.° tratamientos de cada ramab | Probabilidad | Coste medio/tratamiento en cada rama ± DE (€) | Coste medio esperadoc (€) | |
| AB liposómica | 64 | 38.234,5 | |||||||
| 1 | Efectivo con RAM | 8.865,9 | 50.419,8 | 1.444,0d | 60.729,8 | 2 | 0,03 | 30.364,9 ± 4.681,9 | 910,9 |
| 2 | Efectivo sin RAM | 327.296,0 | 727.690,7 | 0,0 | 1.054.986,7 | 30 | 0,47 | 35.166,2 ±23.088,1 | 16.528,1 |
| 3 | No efectivo con RAM | 13.300,0 | 350.458,4 | 80.388,0 | 444.146,4 | 11 | 0,17 | 40.376,9 ± 13.444,3 | 6.864,1 |
| 4 | No efectivo sin RAM | 103.760,0 | 564.669,1 | 218,111,0 | 886.540,1 | 21 | 0,33 | 42.216,2 ± 25.744,2 | 13.931,4 |
| ABCL | 36 | 30.375,2 | |||||||
| 5 | Efectivo con RAM | 1.463,0 | 89.221,6 | 11.950,0d | 102.634,6 | 1 | 0,03 | 102.634,6e | 3.079,0 |
| 6 | Efectivo sin RAM | 83.102,0 | 438.305,9 | 0,0 | 521.407,9 | 20 | 0,55 | 26.070,4 ± 19.839,9 | 14.338,7 |
| 7 | No efectivo con RAM | 2.927,0 | 171.420,9 | 39.564,0 | 213.911,9 | 5 | 0,14 | 42.782,4 ±26.018,6 | 5.989,5 |
| 8 | No efectivo sin RAM | 15.409,0 | 203.922,3 | 29.526,2 | 248.857,5 | 10 | 0,28 | 24.885,8 ±31.096,1 | 6.968,0 |
| Caspofungina | 31 | 49.067,7 | |||||||
| 9 | Efectivo con RAM | 4.432,0 | 29.092,5 | 0,0 | 33.524,5 | 1 | 0,03 | 33.524,5e | 1.005,7 |
| 10 | Efectivo sin RAM | 192.785,0 | 790.016,8 | 0,0 | 982.801,8 | 20 | 0,65 | 49.140,1 ± 19.961,2 | 31.941,1 |
| 11 | No efectivo con RAM | 0,0 | 0,0 | 0,0 | 0,0 | 0 | 0,00 | NP | 0,0 |
| 12 | No efectivo sin RAM | 59.096,0 | 444.681,9 | 0,0 | 503.777,9 | 10 | 0,32 | 50.377,8 ± 30.759,4 | 16.120,9 |
| Voriconazol | 8 | 20.108,8 | |||||||
| 13 | Efectivo con RAM | 0,0 | 0,0 | 0,0 | 0,0 | 0 | 0,00 | NP | 0,0 |
| 14 | Efectivo sin RAM | 13.380,0 | 120.534,6 | 0,0 | 133.914,6 | 7 | 0,88 | 19.130,7 ± 16.048,6 | 16.835,0 |
| 15 | No efectivo con RAM | 0,0 | 0,0 | 0,0 | 0,0 | 0 | 0,00 | NP | 0,0 |
| 16 | No efectivo sin RAM | 228,0 | 21.513 | 5.541,0 | 27.282 | 1 | 0,12 | 27.282e | 3.273,8 |
AB: anfotericina B; ABCL: anfotericina B complejo lipídico; DE: desviación estándar; NP: no procede; RAM: reacción adversa a medicamentos.
Incluye los costes totales de analíticas, pruebas radiológicas, estancia hospitalaria y pruebas de identificación de moho o levadura.
El coste medio esperado se calcula multiplicando el coste medio/tratamiento de cada rama por la probabilidad de ocurrencia de cada una y, mediante el sumatorio de las ramas de cada uno de los antifúngicos considerados, permite obtener el coste medio/tratamiento antifúngico empírico de un episodio de IFI.
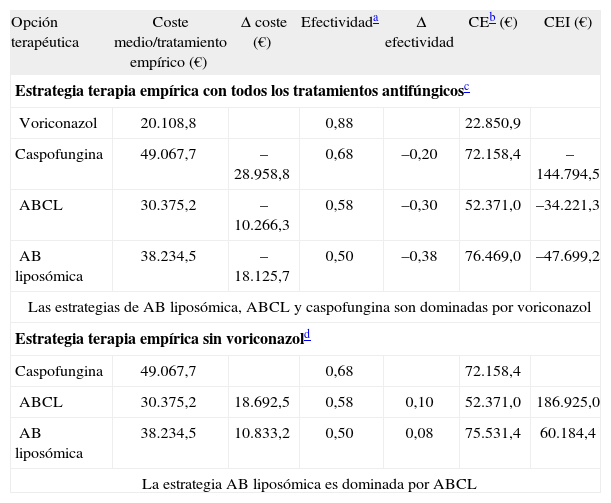
La tabla 4 muestra el cálculo de la relación CE media de las distintas ramas, con el análisis incremental (CEI). Ninguna de las opciones supera el límite de 50.000 € por paciente tratado en cuanto a coste medio, aunque el CE es algo superior excepto para voriconazol y ABCL.
CE y coste-efectividad incremental en terapia empírica
| Opción terapéutica | Coste medio/tratamiento empírico (€) | Δ coste (€) | Efectividada | Δ efectividad | CEb (€) | CEI (€) |
| Estrategia terapia empírica con todos los tratamientos antifúngicosc | ||||||
| Voriconazol | 20.108,8 | 0,88 | 22.850,9 | |||
| Caspofungina | 49.067,7 | –28.958,8 | 0,68 | –0,20 | 72.158,4 | –144.794,5 |
| ABCL | 30.375,2 | –10.266,3 | 0,58 | –0,30 | 52.371,0 | –34.221,3 |
| AB liposómica | 38.234,5 | –18.125,7 | 0,50 | –0,38 | 76.469,0 | –47.699,2 |
| Las estrategias de AB liposómica, ABCL y caspofungina son dominadas por voriconazol | ||||||
| Estrategia terapia empírica sin voriconazold | ||||||
| Caspofungina | 49.067,7 | 0,68 | 72.158,4 | |||
| ABCL | 30.375,2 | 18.692,5 | 0,58 | 0,10 | 52.371,0 | 186.925,0 |
| AB liposómica | 38.234,5 | 10.833,2 | 0,50 | 0,08 | 75.531,4 | 60.184,4 |
| La estrategia AB liposómica es dominada por ABCL | ||||||
AB: anfotericina B; ABCL: anfotericina B complejo lipídico; CE: coste-efectividad; CEI: coste-efectividad incremental.
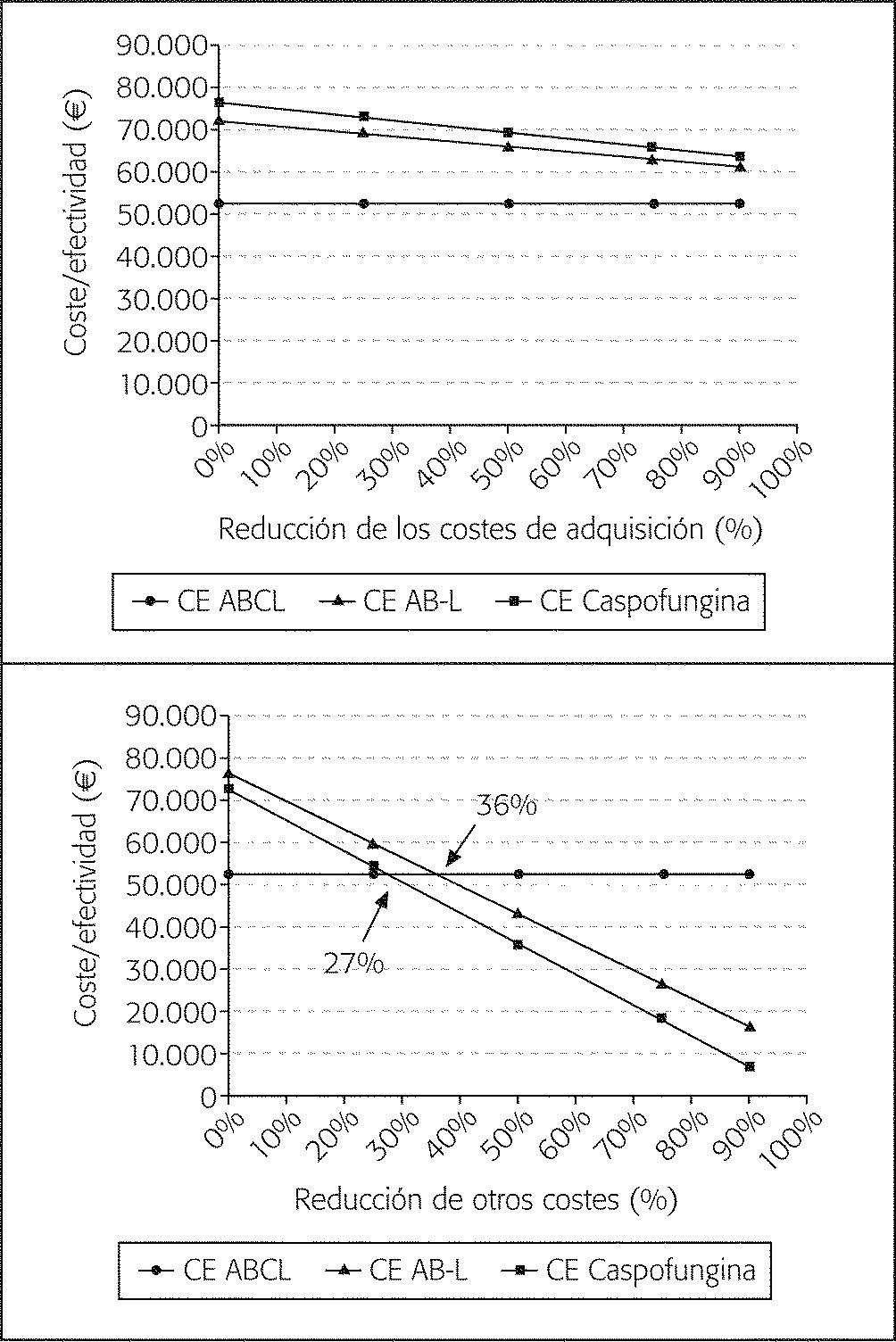
Los análisis de sensibilidad realizados han evaluado el impacto de los parámetros más influyentes o de mayor grado de incertidumbre sobre los resultados: coste de adquisición del tratamiento antifúngico (donde una reducción también hace referencia a una menor duración de la terapia) y otros costes del episodio. En todos los casos, se ha mantenido constante el valor medio de la alternativa más CE y se ha modificado el resto hasta los valores extremos del intervalo de confianza.
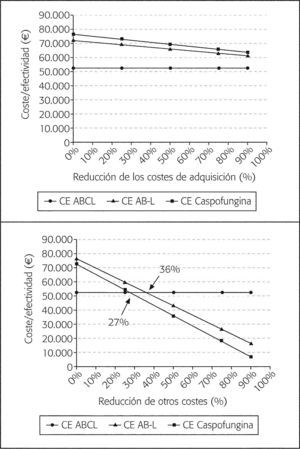
La variación de los costes de adquisición no modifica el resultado (fig. 3A), aunque en el caso de caspofungina y AB-L tienen mayor impacto en el gasto global que para voriconazol y ABCL. La variación de los otros costes en el análisis que excluye voriconazol modifica el sentido del análisis, no alterándose la relación de dominancia cuando se incluye voriconazol. La reducción del 27% de los otros costes asociados a la rama de caspofungina proporciona un coste medio de 38.057 €, valor plausible al encontrarse dentro del intervalo de confianza (IC 95% 36.802,761.332,6) (fig. 3B). El coste de la estancia (relacionado con la duración) y el coste de las pruebas son, por tanto, parámetros sensibles para caspofungina. En el caso de AB-L, el valor umbral (o punto donde se igualaría ambas alternativas) corresponde a un CE (28.713,8 €) que se sitúa fuera del intervalo de confianza (IC del 95%, 28.869,7-47.599,2).
Resultados del análisis de sensibilidad respecto a ABCL en el supuesto sin voriconazol. A: Reducción de los costes de adquisición de AB-L y caspofungina. B: Reducción del valor de otros costes de las ramas de AB-L y caspofungina. ABCL: anfotericina B complejo lipídico; AB-L: anfotericina B liposómica; CE: coste-efectividad.
La gran disponibilidad de antifúngicos y las expectativas generadas por los nuevos, solos o en combinación, hacen difícil la elección terapéutica. Además, el aumento creciente del uso de antifúngicos en el medio hospitalario, junto con el cambio y diversidad de criterios para su utilización y el importante consumo de recursos que generan, hacen necesaria la realización de estudios que permitan conocer los patrones de uso de los antifúngicos sistémicos.
La estrategia empírica constituye la de mayor interés por requerir la máxima efectividad con objeto de evitar que la IFI progrese y peligre la vida del paciente, y por otra parte la que puede implicar mayor coste. En el paciente oncohematológico, las IFI frecuentes y con una elevada mortalidad requieren la instauración de un tratamiento antifúngico precoz8. Sin embargo, son pocos los estudios que han analizado la eficiencia relativa de cada estrategia en el tratamiento empírico, únicamente dos utilizan datos de eficacia y consumo de recursos obtenidos de la práctica clínica real, y ninguno hasta la fecha en nuestro país. De ahí la importancia de analizar el perfil farmacoeconómico de las opciones disponibles, con la finalidad de determinar cuál es la más eficiente y así maximizar el beneficio social de los recursos invertidos.
LimitacionesUna de las limitaciones de nuestro estudio radica sin duda en la ausencia de ABd en el análisis, dado que su coste ostensiblemente inferior pudiera haber favorecido su elección o podría haber demostrado el mejor perfil de las otras formulaciones. Sin embargo, por una parte el estudio coincidió con un periodo de desabastecimiento generalizado de dicha especialidad, lo que llevó a promover como alternativa ABCL. Por otra parte, en los pacientes oncohematológicos, sobre todo trasplantados en situación clínica de máximo riesgo, el uso de ABd hubiera sido de por sí inferior al de otras formulaciones, ya que su situación de base no hace recomendable administrar un antifúngico con alto potencial nefrotóxico. Por ello, consideramos adecuada la selección de los antifúngicos analizados, y el uso de ABd en los pacientes incluidos no habría resultado significativo para analizar de forma comparativa desde el punto de vista farmacoeconómico.
Otra limitación es la utilización de datos retrospectivos, puesto que la obtención de información a partir de historias clínicas puede no reflejar todo lo necesario para una correcta evaluación. No obstante, la concreción con los clínicos de las partes dudosas ha permitido soslayar parcialmente este hecho, aunque lo importante es la ausencia de diferencias demográficas o clínicas entre los grupos, en cuanto a los aspectos valorados (tabla 1).
La posible limitación relativa al coste generado por los efectos adversos (tratamiento, consumo de recursos) queda en parte compensada por el hecho de que la mayor parte corresponde a intolerancias (exantema, prurito, fiebre, tiritonas…). Su manejo llevaría asociado un coste pequeño y en la mayoría de los casos la principal consecuencia es el cambio de antifúngico, habiéndose incluido el coste de éste. Los casos que podían atribuirse a nefrotoxicidad fueron escasos y se refieren a aquellos considerados clínicamente como tales, no a la duplicación de la creatinina basal como se define en muchos estudios20-22. No es infrecuente que estos pacientes presenten deterioro renal propio de otras terapias o de la propia situación clínica. La alteración de la creatinina observada ha sido escasa (3 con AB-L y 0 con ABCL) y se ha englobado con las intolerancias en las denominadas RAM que han obligado a un cambio de terapia o a la finalización de la misma. Por tanto, lo único que no hemos incluido son los costes asociados a una nefrotoxicidad tal como se asignan en la literatura20 (p. ej., incremento de la estancia). El 100% de las RAM con ABCL consistieron en intolerancias al tratamiento (6 de 6 entre ambas ramas, efectiva y no efectiva), lo que motivó una duración escasa del mismo, quizá insuficiente para poder desarrollar nefrotoxicidad, ya que su aparición está relacionada con la duración del tratamiento20. Parece lógico asumir que los periodos correspondientes a ABCL y AB-L fueron relativamente cortos para poder desarrollar dicho efecto (media 2,3 y 3,5 días, respectivamente, sólo para las ramas con RAM). De hecho, la duración media de la terapia señalada en algunos estudios se sitúa entre 7 y 14 días15,20,23,24. Así, en la mayoría de los pacientes se duplica el valor basal de la creatinina sérica a los 8-21 días de terapia25,26. Por otra parte, la prioridad en nuestro hospital se situó en ese momento en controlar un brote importante de aspergilosis que motivó cierta preocupación entre los clínicos, de modo que cualquier indicio inicial de inefectividad de la terapia empírica con AB conllevaba un cambio inmediato de antifúngico (fundamentalmente a caspofungina y voriconazol), lo que pudo contribuir a reducir los tratamientos con AB. Este mismo hecho puede justificar la duración significativamente mayor de la terapia con caspofungina, con un inicio temprano y prolongado en el tiempo (media 16,4 días). Es decir, lo que habitualmente podía corresponder a tratamientos con AB-L o ABCL, en nuestro estudio ha sido sustituido por caspofungina. También un inconveniente a la hora de atribuir el deterioro renal incluido en las RAM es que la profilaxis previa con AB podía condicionar dicha atribución al incrementar el riesgo, es decir, no se debería sólo a la AB-L o ABCL empíricas sino al efecto sumatorio de ambas estrategias.
La comorbilidad de los pacientes no reflejada en este estudio puede determinar sin duda la evolución de la IFI, sobre todo en cuanto a fallo de respuesta (mortalidad), por lo que en un futuro sería interesante delimitar la influencia de estos factores. También la influencia de la gravedad de la patología de base. Por último, no se ha considerado la contribución del efecto sumatorio de los distintos antifúngicos utilizados en un mismo episodio sobre la efectividad final.
DiscusiónVoriconazol ha sido la opción más CE en el primer supuesto. La AB, referente hasta el momento en terapia empírica, ha puesto de manifiesto resultados variables, observándose en este estudio que un 42-50% de los tratamientos empíricos con ambas formulaciones no han resultado efectivos. La respuesta con voriconazol ha sido elevada, aunque el reducido número de casos constituye una limitación importante. Sin embargo, proporciona un significativo punto de partida para futuros análisis. Algunos estudios han situado a voriconazol en un lugar preferente como tratamiento empírico debido a su buen perfil CE, y tanto documentos de consenso como guías desarrolladas en ámbitos hospitalarios, incluida la nuestra, lo consideran una alternativa adecuada a ABd, siendo de elección en pacientes seleccionados según el síndrome clínico, como los enfermos oncohematológicos de bajo riesgo de IFI27-29. Un estudio de cohortes retrospectivo incluye en su análisis los costes hospitalarios comparando voriconazol y AB-L en el tratamiento empírico de la neutropenia febril. A pesar de que, según ellos mismos afirman, también los casos incluidos son pocos, encuentran diferencias en la implicación económica de ambos antifúngicos. El coste hospitalario por episodio es de 56.621 $ (41.2476,71 €) y 56.495 $ (41.184,86 €) para voriconazol y AB-L, respectivamente, siendo similar al nuestro para AB-L (38.234,50 €) y superior para voriconazol, quizá por nuestra reducida muestra (20.108,80 €). En cualquier caso, este estudio apoya el uso de voriconazol como terapía empírica CE29. Un reciente análisis farmacoeconómico evalúa de forma similar a la nuestra los resultados propios de la práctica clínica que posteriormente combina con datos de la bibliografía y opinión de expertos, comparando AB-L con voriconazol26. Como en nuestro caso, los autores asumen la limitación de la naturaleza retrospectiva de los datos y tampoco incluyen los costes del tratamiento de las intolerancias típicas de la AB. Las respuestas efectivas para AB-L son similares en ambos casos (el 48 frente al 47% en nuestro caso), aunque la diferencia de casos analizados de voriconazol (32 frente a 8) proporciona resultados dispares (el 56 frente al 88% en nuestro estudio). Con voriconazol se observó una reducción global del coste del 27%: 14.950 $ EE.UU. (10.901,42 €) y 20.591 $ EE.UU. (15.014,68 €) con AB-L, cifras inferiores a las nuestras (20.108,80 € y 38.234,50 €), teniendo en cuenta que incluyen el coste de la nefrotoxicidad pero no el derivado de pruebas o de la estancia que incrementa nuestras cifras. En ambos análisis la diferencia favorece a voriconazol y coinciden en otra limitación al no evaluar el impacto de las posibles IFI de brecha que tienen un notable impacto económico, aunque su incidencia es escasa y por tanto resulta todavía limitada para obtener suficiente poder estadístico.
Los resultados del segundo árbol pueden interpretarse con mayor consistencia. Aunque puede considerarse la misma limitación referida a la nefrotoxicidad, lo cierto es que, como hemos mencionado, las detectadas en las ramas de AB han sido escasas y probablemente apenas generarían influencia en los costes.
La rama de ABCL resulta más CE por proporcionar resultados favorables y suponer un menor coste asociado. Esta etapa coincidió con un intento de promover ABCL como alternativa a la ABd y más económica que AB-L, cuando los nuevos antifúngicos, voriconazol y caspofungina, acababan de incorporarse al mercado y al hospital. Por eso, se utilizó en mayor proporción ABCL en este tipo de pacientes en comparación con etapas previas en las que AB-L hubiera sido preferente.
Una comparación farmacoeconómica no encontró diferencias significativas en los costes hospitalarios asociados al tratamiento empírico de pacientes neutropénicos febriles, siendo los valores de 55.603 $ (40.545,71 €) para AB-L 3 mg/kg/día y 46.442 $ (33.865,51 €) 5 mg/kg/día frente a 49.684 $ (36.229,57 €) para ABCL 5 mg/kg/día. Un inconveniente es su publicación como resumen, lo que dificulta su completa y adecuada interpretación, y los costes no incluyeron los de adquisición de los fármacos, proporcionados de forma gratuita al tratarse de pacientes incluidos en un ensayo30. No obstante, los costes en nuestro estudio no son muy dispares a éstos. El coste medio por tratamiento también es mayor para AB-L a una dosis media similar (2,9 mg/kg/día): 38.320 €, en relación a ABCL con menor dosis (media 2,7 mg/kg/día) y por tanto menor coste: 30.375 €. AB-L implica mayor impacto económico y teniendo en cuenta la efectividad obtenida resulta CE utilizar ABCL como terapia empírica.
En otro estudio farmacoeconómico comparando ambas formulaciones desde la perspectiva hospitalaria se lleva a cabo un análisis de minimización de costes al obtener tasas de respuesta clínica equivalentes (53% ABCL vs. 60% AB-L), siendo también el diseño retrospectivo. En el nivel que incluye todos los costes hospitalarios los valores obtenidos son bastante aproximados a los nuestros en el caso de ABCL: 43.814 $ EE.UU. (31.957,9 €) vs. 30.375,2 €, aunque la cifra es menor para ABL: 31.433 $ EE.UU. (22.927,2 €) vs. 38.234,5 €16. Las medianas respectivas del coste total asociado a la prevención o tratamiento de efectos adversos no mostraban diferencias significativas (p = 0,984), lo que podría apoyar el hecho de que la inclusión en nuestro caso no habría modificado los resultados.
En cuanto a los CEI señalar que el valor más significativo corresponde a ABCL en relación con caspofungina, de mayor efectividad, situándose en un valor de 186.925 €. Esta cifra quizá pueda ser engañosa en cuanto a que la diferencia de efectividad es pequeña frente a unos costes bastante distantes. La influencia más relevante sobre el coste global corresponde a los otros costes (hospitalización, pruebas), que se asocian a cifras elevadas en el caso de AB-L y caspofungina, probablemente por utilizarse en pacientes graves con estancias más prolongadas. En el análisis de sensibilidad precisamente la reducción del 27% de otros costes asociados a caspofungina invierte el sentido del mismo, pasando a ser el antifúngico con mejor perfil CE respecto a AB-L y ABCL (segundo árbol). Puesto que esta disminución es factible, ya que se incluye en el intervalo de confianza calculado, bastaría con que fuera posible reducir en cierta medida la hospitalización o el número de pruebas para conseguir un perfil más CE con caspofungina respecto a ABCL y AB-L. Puede que en otros hospitales esto sea factible, en función del coste propio de la estancia hospitalaria. La disminución del 36% en el caso de AB-L, el otro punto de corte en la figura 3B, excede el IC, por lo que no es probable que se pudiera alcanzar.
Los costes de hospitalización totales no difirieron entre ambas formulaciones en el citado análisis de minimización; sin embargo, se observó una alta sensibilidad del resultado económico a los costes de adquisición y a la dosificación del antifúngico16. En nuestro caso, la influencia del coste de adquisición sobre el global es de un 9,5 y un 19,1% para ABCL y AB-L, respectivamente, de modo que aun incrementando un 50% el coste de ABCL o reduciendo un 50% el de AB-L los resultados permanecen invariables, manteniéndose ABCL como opción más CE.
Por último, un análisis farmacoeconómico considerando los costes de adquisición y los derivados del tratamiento de la insuficiencia renal pone de manifiesto que caspofungina resulta más CE que AB-L en terapia empírica para fiebre neutropénica, lo cual podría estimarse de una comparación directa de estos dos fármacos en nuestro estudio13. De igual forma, este hecho ha sido corroborado en un reciente estudio que analiza también las infecciones de brecha, la supervivencia y los años de vida ajustados por calidad (AVAC o QALY), siendo caspofungina más CE que AB-L para el tratamiento de sospecha de IFI31.
En definitiva, según los resultados observados en las ramas respectivas de caspofungina y voriconazol, no suele requerirse tratamiento de segunda línea, su grado de ineficacia es bajo y su coste resulta inferior al de las distintas formulaciones de AB. También puede influir el uso de voriconazol oral que indudablemente reduce costes asociados. El CEI nos indica que utilizar voriconazol en lugar de caspofungina en terapia empírica supondría un ahorro de 144.794 €. Por su parte, ABCL supone un gasto de 186.925 € respecto a caspofungina, pero esta cifra está influenciada por una efectividad no muy distinta; y el uso de AB-L en lugar de caspofungina incrementa el coste en 60.184 €. El estudio aporta información relevante en cuanto al uso de antifúngicos en la estrategia empírica en pacientes oncohematológicos desde la perspectiva de la práctica clínica, pese a las posibles limitaciones referentes a los costes no considerados (tratamiento efectos adversos, nefrotoxicidad). El análisis CE de la estrategia empírica centrada en pacientes oncohematológicos de alto riesgo (TPH) ha puesto de manifiesto que voriconazol podría constituir una opción favorable desde la perspectiva hospitalaria, aunque sería necesaria una mayor representatividad de casos para poder afirmarlo de forma concluyente. ABCL resulta la alternativa más CE respecto a AB-L y caspofungina, probablemente consecuencia de su coste inferior a ABL, con menor efectividad, y a caspofungina, más efectiva pero con mayor duración del tratamiento. No obstante, los resultados sólo pueden aplicarse a poblaciones similares a las reflejadas en este estudio, de modo que el tipo de pacientes y las terapias utilizadas en otros entornos pueden variar el resultado.
Este tipo de estudio pragmático puede contribuir a racionalizar el uso de antifúngicos en el entorno hospitalario, siendo aconsejable realizar más evaluaciones económicas que contemplen algunas de las limitaciones de nuestro estudio y contribuyan a situar a cada uno de los agentes antifúngicos en el lugar que proporcionen mayor eficiencia.