El presente estudio comparó las condiciones reales de uso de trastuzumab en la práctica clínica con las descritas oficialmente en ficha técnica. Además, se midió el gasto asociado a su uso.
MétodosEstudio observacional de prescripción-indicación de trastuzumab en un hospital de tercer nivel desde enero de 2006 hasta el 31 de diciembre de 2007. Se analizó si el uso de trastuzumab en la práctica clínica se adecuaba a ficha técnica en lo referente a: sobreexpresión del HER2, indicación (cáncer de mama), esquema de tratamiento, línea de tratamiento, dosis, frecuencia y número de ciclos. Para medir el gasto, se calculó el número total de miligramos utilizados y posteriormente se multiplicó por el precio por miligramo de venta del laboratorio más IVA.
ResultadosTodos los pacientes (n=77) usaron trastuzumab para cáncer de mama. El 62,6% de los pacientes presentó sobreexpresión del HER2+++. Se utilizaron 29 esquemas no autorizados en ficha técnica. El gasto total de trastuzumab durante el periodo de estudio fue de 1.537.622,73 euros. Conclusiones: Aunque el trastuzumab se utiliza siempre en cáncer de mama, se usa en condiciones distintas a las autorizadas en ficha técnica, tanto en lo referente a la sobreexpresión de HER2, como en los esquemas de tratamiento.
This study compares trastuzumab's actual conditions of use in clinical practice with those officially described on its summary of product characteristics. We also measure the cost associated with its use.
MethodsObservational study of the prescription/indication of trastuzumab in a tertiary hospital from January 2006 to 31 December 2007. We analysed whether trastuzumab use in clinical practice complied with its summary of product characteristics, concerning the following: HER2 over expression, indication (breast cancer), treatment plan, line of treatment, dosage, frequency and number of cycles. To measure cost, we calculated the total number of milligrams used and then multiplied it by the laboratory's sale price per milligram plus VAT.
ResultsAll patients (n=77) used trastuzumab for breast cancer. Sixty-two point two percent of patients presented with HER2+++ over expression. Twenty-nine treatment plans were used, that were not authorised on the summary of product characteristics. The total trastuzumab cost during the study period was €1537 622.73.
ConclusionsAlthough trastuzumab is always used for breast cancer, it is used in conditions other than those described on its summary of product characteristics, both for HER2 over expression and treatment plans.
El cáncer de mama es el de mayor incidencia en mujeres; el tercero en la población general. Así, según la Sociedad Española de Oncología Médica, se estima que el número de casos nuevos en España para el año 2015 alcance los 21.262. En la actualidad, existen cinco formas de tratar este tipo de cáncer: cirugía, radioterapia, quimioterapia, terapia hormonal y terapia dirigida. Dentro de esta última alternativa, los anticuerpos monoclonales, concretamente el trastuzumab, bloquea los efectos de la proteína del factor de crecimiento HER2, que envía señales a las células cancerosas de la mama. En este sentido, alrededor de una cuarta parte de las pacientes con cáncer de mama pueden tratarse con trastuzumab1.
Debido al elevado impacto que los pacientes oncológicos tienen en términos sociales y asistenciales se viene reflexionando en la manera de introducir un sistema que evalúe la atención a estos enfermos, teniendo en cuenta aspectos relacionados con resultados clínicos (efectividad de los tratamientos), evaluación económica y utilización según la evidencia disponible. En relación a este último aspecto, los estudios de utilización de medicamentos tienen como fin conseguir una práctica terapéutica óptima2. Algunos autores demandan la necesidad de realizar estudios de este tipo al considerarlos útiles como sistema de control de calidad de la prescripción3. Dentro de este tipo de estudios, tanto los de prescripción-indicación como los de indicación-prescripción aportan información de gran relevancia sobre la posible sobreutilización o infrautilización de determinados fármacos, como por ejemplo las causas asociadas a estas prácticas. De esta forma, es posible diseñar/desarrollar protocolos para la mejora de la prescripción y seguridad de los medicamentos, así como para una gestión económica eficiente de los mismos.
Se ha acuñado un término para referirse a la utilización de medicamentos en condiciones distintas a las autorizadas en la ficha técnica: «off label». En la actualidad, en España, existe una legislación que trata de regular esta práctica4. A grandes rasgos, los médicos que deseen prescribir «off label» podrán hacerlo simplemente justificando la inexistencia de alternativas autorizadas a las comisiones de farmacia de los hospitales y obteniendo el consentimiento del paciente tras informar sobre los riesgos. Antes de la entrada de esta normativa, esta práctica era más restrictiva, ya que se precisaba una evaluación y autorización por parte de la Agencia Española del Medicamento y Productos Sanitarios. A juicio de la Sociedad Española de Farmacia Hospitalaria5, el uso de medicamentos en condiciones distintas a las autorizadas en la ficha técnica debería sustentarse en bibliografía de máxima calidad, permitiendo así elaborar protocolos de uso de los medicamentos, basados en la evidencia científica, que ayuden a utilizarlos en las mejores condiciones posibles. No obstante, el uso «off label» de medicamentos puede estar influenciado por los intereses de los diferentes actores que participan en la atención sanitaria: pagadores de la atención sanitaria, industria farmacéutica, médicos y consumidores6. Esto hace que el uso de medicamentos en condiciones distintas a las autorizadas deba ser examinado en detalle.
En este sentido, es conocido que muchos de los nuevos fármacos citostáticos que van apareciendo en el mercado empiezan a utilizarse en condiciones diferentes a las aprobadas en ficha técnica poco tiempo después de su comercialización, como ya se ha puesto de manifiesto en los casos de rituximab7 y cetuximab8. Esta práctica podría justificarse por el mal pronóstico del paciente, aunque apenas exista evidencia científica que respalde su uso9. Por su parte, Radley et al.10 mostraron que uno de cada cinco pacientes ambulatorios recibía un medicamento en condiciones distintas a las autorizadas en ficha técnica, y de estos, el 73% (IC95%: 61-84) lo hacía con poco o ningún apoyo científico.
En la misma dirección, el presente estudio pretendió analizar el uso de trastuzumab en las condiciones reales de la práctica clínica y comparar dichas condiciones con las descritas oficialmente en ficha técnica. Además, se midió el gasto asociado a su uso.
MétodoEstudio observacional de prescripción – indicación con diseño prospectivo, en el que se incluyeron todos los pacientes que usaron trastuzumab desde el 1 de enero de 2006 hasta el 31 de diciembre de 2007 en el Hospital Universitario Virgen de las Nieves de Granada. Se excluyeron los pacientes que se encontraban participando en algún ensayo clínico con trastuzumab.
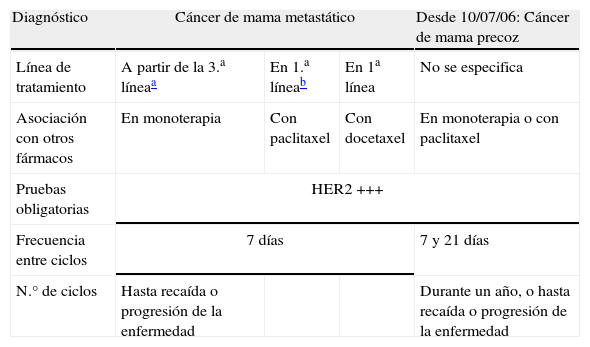
Para cada uno de los pacientes se analizó la concordancia entre las condiciones en que usaba el trastuzumab (condiciones reales) y las condiciones especificadas en la ficha técnica (condiciones teóricas) (tabla 1). Concretamente, se analizó si existía adecuación en lo referente a: sobreexpresión del HER2, diagnóstico (localización tumoral), esquema de tratamiento, línea de tratamiento, dosis, frecuencia y número de ciclos. Para conocer las condiciones reales de uso del trastuzumab, se consultaron las hojas de prescripción del medicamento, la base de datos generada a partir de dichas hojas (que además de la información inicial del paciente contenía datos de los ciclos posteriores) y la historia clínica del paciente. En aquellos casos en los que existió discordancia entre el uso real del medicamento y lo establecido en la ficha técnica, se trató de encontrar algún documento que permitiera apoyar y/o justificar la práctica clínica realizada. En este sentido, se procedió de dos formas: 1) revisando 5 guías de práctica clínica (National Comprehensive Cancer Network11, European Society for Medical Oncology12, British Columbia Cancer Agency13, Cancer Care Ontario14 y National Institute of Health and Clinical Excelence15), y 2) realizando una consulta al Centro Andaluz de Información del Medicamento (CADIME) con el fin de obtener alguna bibliografía relacionada (artículos en revistas). En caso de obtenerse tal bibliografía, esta fue calificada según su calidad (nivel de evidencia) de acuerdo con la escala de Ferguson modificada9.
Condiciones de uso de trastuzumab aprobadas en ficha técnica durante el periodo de estudio
| Diagnóstico | Cáncer de mama metastático | Desde 10/07/06: Cáncer de mama precoz | ||
| Línea de tratamiento | A partir de la 3.a líneaa | En 1.a líneab | En 1a línea | No se especifica |
| Asociación con otros fármacos | En monoterapia | Con paclitaxel | Con docetaxel | En monoterapia o con paclitaxel |
| Pruebas obligatorias | HER2 +++ | |||
| Frecuencia entre ciclos | 7 días | 7 y 21 días | ||
| N.° de ciclos | Hasta recaída o progresión de la enfermedad | Durante un año, o hasta recaída o progresión de la enfermedad | ||
Para medir el gasto se contabilizaron las dosis de trastuzumab administradas en cada ciclo y el número total de ciclos administrados. Con esto se obtuvo el número total de miligramos utilizados, posteriormente se multiplicó por el precio por miligramo de venta del laboratorio más el IVA. Se obtuvo información sobre: 1) gasto total de trastuzumab durante el periodo de estudio; 2) gasto total en cada uno de los diagnósticos en los que fue empleado, gasto medio por paciente (gasto total del medicamento en un diagnóstico determinado divido por el número de pacientes que usaron ese medicamento en ese diagnóstico) y gasto medio por ciclo de tratamiento (gasto total del medicamento en un diagnóstico determinado divido por el número de ciclos medio de ese medicamento en ese diagnóstico), y 3) gasto medio por mes libre de enfermedad (se dividió el gasto medio por paciente por la media del tiempo libre de progresión de la enfermedad, entendiendo este como el intervalo de tiempo entre el inicio del tratamiento y la recaída, progresión o muerte causada por la enfermedad y expresado en meses).
Análisis estadísticoLos datos fueron analizados utilizando SPSS para Windows versión 15.0 (SPSS Inc, Chicago, Illinois, EE.UU.). Para resumir las variables (cualitativas) se utilizaron medidas de frecuencia (porcentajes).
ResultadosDurante el periodo de estudio se incluyeron 77 pacientes tratados con trastuzumab. En todos los casos, el diagnóstico del paciente fue cáncer de mama: 22 con cáncer de mama precoz (CMP) y 55 con cáncer de mama metastático (CMM). El 63,6% (IC95%: 52,2-75,0) de los pacientes (n=49) presentó sobreexpresión del HER2 +++, condición de uso indispensable para la utilización de trastuzumab. De los pacientes que no cumplieron con este criterio de uso (n=28), 9 presentaban HER2 ++, 6 HER2 + y 3 en los que la expresión fue negativa; además, en 10 casos no se encontró información sobre si existía o no sobreexpresión del gen.
En pacientes con CMP (n=22) se utilizaron un total de 27 esquemas de tratamiento durante el estudio, de los cuales 24 (88,9%, IC95%: 70,8-97,6) cumplían con las especificaciones dadas en la ficha técnica. Los esquemas no autorizados fueron: trastuzumab+cisplatino+paclitaxel, trastuzumab+docetaxel y trastuzumab+vinorelbina. La frecuencia entre ciclos alcanza una adecuación a ficha técnica del 96,3% (IC95%: 81,0-99,9), y en cuanto al número de ciclos, todos los pacientes recibieron trastuzumab durante un año o hasta recaída de la enfermedad, alcanzando por lo tanto una adecuación del 100% (IC95%: 87,2-100,0) a la ficha técnica.
En pacientes con CMM (n=55) se utilizaron un total de 83 esquemas de tratamiento durante el periodo de estudio, de los cuales solo 57 se encontraban autorizados en ficha técnica, lo que supone una adecuación del 68,7% (IC95%: 58,1-79,2). De los 26 esquemas de tratamiento no autorizados en ficha técnica, destacó el de trastuzumab+vinorelbina, que se utilizó en 12 ocasiones. Al analizar el esquema conjuntamente con la línea de tratamiento según lo indicado en ficha técnica, el porcentaje de adecuación desciende hasta el 37,3% (IC95%: 26,3-48,4), ya que el trastuzumab se utilizó en monoterapia antes de tercera línea de tratamiento en 24 ocasiones y en 23 ocasiones se asoció a un taxano (9 paclitaxel y 14 docetaxel) en líneas de tratamiento avanzadas. Solo en 4 ocasiones se respetó la frecuencia semanal recomendada en ficha técnica, lo que supuso una adecuación del 7,0% (IC95%: 1,9-17,0) de los casos. En todas las ocasiones se administró hasta progresión de la enfermedad, por lo que la adecuación a ficha técnica del número de ciclos fue del 100% (IC95%: 95,6-100,0).
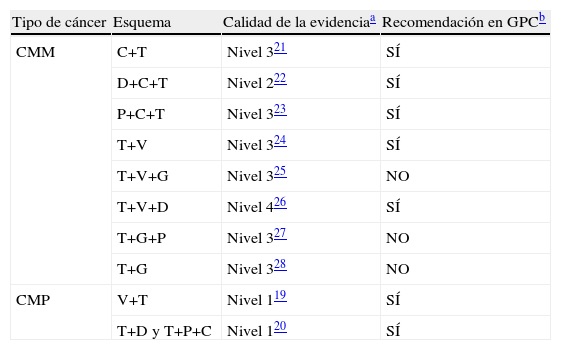
En la tabla 2 se muestra la calidad de la evidencia de la bibliografía que respaldaba el uso de los esquemas no autorizados asociados a trastuzumab (tanto en CMP como en CMM) y si existe recomendación expresa de los mismos por alguna de las guías de práctica clínica analizadas. Todos los esquemas utilizados en CMP se apoyaban en bibliografía de elevada calidad, mientras que no ocurría así en algunos de los esquemas empleados en CMM.
Nivel de calidad de la evidencia para los esquemas no autorizados (en CMP y CMM) y recomendación por alguna de las guías de practica clínica analizadas
| Tipo de cáncer | Esquema | Calidad de la evidenciaa | Recomendación en GPCb |
| CMM | C+T | Nivel 321 | SÍ |
| D+C+T | Nivel 222 | SÍ | |
| P+C+T | Nivel 323 | SÍ | |
| T+V | Nivel 324 | SÍ | |
| T+V+G | Nivel 325 | NO | |
| T+V+D | Nivel 426 | SÍ | |
| T+G+P | Nivel 327 | NO | |
| T+G | Nivel 328 | NO | |
| CMP | V+T | Nivel 119 | SÍ |
| T+D y T+P+C | Nivel 120 | SÍ |
C: carboplatino; D: docetaxel; G: gemcitabina; P: paclitaxel; T: trastuzumab; V: vinorelbina.
Finalmente, el gasto total de trastuzumab durante el periodo de estudio fue de 1.537.622,73 euros, repartiéndose 392.361,76 euros para el cáncer de mama precoz y 1.145.260,97 euros para el cáncer de mama metastático. En general, el gasto medio por paciente fue de 20.501,64 euros. Con respecto al gasto medio por paciente en cada diagnóstico, el cáncer de mama metastásico fue el que mayor carga supuso con 20.822,93 euros, frente a 17.834,62 euros del cáncer de mama precoz. El gasto por mes de supervivencia libre de enfermedad para el cáncer de mama metastásico fue de 1.667,12 euros.
DiscusiónEl presente estudio de prescripción – indicación pone de manifiesto el uso de trastuzumab en la práctica clínica habitual en un hospital de tercer nivel. Si bien es cierto que se utiliza siempre en cáncer de mama, se confirma que se usa en condiciones distintas a las autorizadas en ficha técnica, tanto en lo referente a la sobreexpresión de HER2, como en los esquemas de tratamiento utilizados.
En este estudio se ha observado un importante porcentaje (36,4%, IC95%: 25,0-47,8) de tratamientos en los que se utilizó trastuzumab sin que existiese sobreexpresión del HER2 +++, condición de uso indispensable para su utilización según ficha técnica. En los casos en los que el gen sobreexpresó con menor intensidad a la recomendada, la utilización del fármaco quedaba a juicio del clínico, ya que se trata de una prueba que depende en gran medida del juicio del observador (analista), lo que puede hacer que exista una variabilidad en los resultados16. Por tanto, es posible que el clínico haya optado por utilizar el medicamento en estos casos, más aun cuando el beneficio del trastuzumab en pacientes sin sobreexpresión es controvertido17,18. Por otra parte, en diez pacientes no se pudo constatar la realización de la prueba por no estar documentada en la historia clínica, por lo que el porcentaje de adecuación podría verse incrementado.
Independientemente de la sobreexpresion del HER2, se utilizaron gran cantidad de esquemas no autorizados en ficha técnica, fundamentalmente en CMM. La causa principal de estas prácticas es la falta de respuesta a los tratamientos estándares (pacientes refractarios a varias líneas de tratamiento). Además, en el caso del CMP, los tres esquemas no autorizados que se utilizaron estaban avalados por bibliografía con máximo nivel de calidad19,20 y recomendados por alguna de las guías de práctica clínica analizadas (tabla 2), por lo que su uso en las condiciones observadas puede ser razonable. Por su parte, algunos esquemas utilizados en CMM (trastuzumab+vinorelbina+gemcitabina, trastuzumab+gemcitabina+paclitaxel y trastuzumab+gemcitabina), solo se encontraban respaldados por ensayos clínicos en fase II no aleatorizados (nivel 3 y 4) y en ninguna de las guías analizadas se recomendaba su uso. Hay que destacar que los demás esquemas no autorizados utilizados en CMM (incluido trastuzumab+vinorelbina, utilizado en 12 ocasiones), aunque no avalados por bibliografía de calidad, todos están recomendados por alguna de las guías de practica clínica analizadas lo que contribuye a su uso.
Destacamos el elevado gasto de trastuzumab, que representaba casi la cuarta parte del total de citostáticos utilizados durante el periodo de estudio. Esto puede justificarse por el hecho de utilizarse en el tratamiento de un cáncer muy prevalente, así como en neoadyuvancia. El gasto total del trastuzumab en el cáncer de mama metastásico fue superior al de cáncer de mama precoz ya que se han tratado más pacientes, 55 frente a 22. El gasto por paciente para cáncer de mama metastásico correspondía a un periodo de tratamiento medio aproximadamente al valor del tiempo libre de progresión (9 meses), ya que se trataron hasta que progresó la enfermedad. El gasto por paciente para cáncer de mama precoz debería de referirse a un periodo de un año, pero en nuestro caso correspondía a un periodo de tiempo menor, ya que la mayoría de los pacientes comenzaron su tratamiento a los 6 meses de empezar el estudio, por lo que el periodo de seguimiento para muchos pacientes fue inferior al año. Esto justifica que el gasto por paciente en cáncer de mama precoz fuera más bajo que en cáncer de mama metastásico, cuando lo lógico seria lo contrario ya que el periodo de tratamiento teórico era de 1 año frente a los 9 meses de cáncer de mama metastásico.
El análisis de las condiciones de uso de los medicamentos puede presentar especial interés a nivel de investigación, ya que puede dar origen a nuevos trabajos que traten de generar evidencia sobre la efectividad de ciertos esquemas no contrastados empleados en la práctica habitual. Sería necesario poner en marcha estudios que, con un diseño adecuado, permitan evaluar la efectividad de estos esquemas no autorizados, así como la conveniencia de usar trastuzumab en pacientes que no sobreexpresión el HER2 +++. Igualmente sería de gran relevancia estudiar el impacto presupuestario y realizar análisis de coste-efectividad. Sin embargo, la detección y seguimiento del uso «off label» de medicamentos debería realizarse de forma permanente como parte de las actividades propias de los hospitales. Sería interesante que esta «vigilancia farmacológica» recayese sobre servicios especializados en la gestión del medicamento, como el servicio de farmacia. Adicionalmente, los farmacéuticos implicados deberían integrase en el equipo multidisciplinar que atiende al paciente e involucrarse en la evaluación de la efectividad y seguridad de los medicamentos con lo que podría obtenerse un beneficio adicional sobre la salud de los pacientes.
Por último, es preciso señalar que el presente estudio se limita al análisis de un fármaco citostático en un único hospital. Esto hace que debamos ser cautos a la hora de extrapolar los resultados a la práctica hospitalaria general en España. En cada hospital, los protocolos de prescripción médica pueden variar y dar lugar a resultados distintos. Además, no debemos olvidar que el ámbito temporal también puede ser importante, debido a que las fichas técnicas de los medicamentos pueden sufrir modificaciones que incluyan nuevas indicaciones. En este sentido, un uso fuera de ficha técnica en nuestro periodo de estudio puede no serlo en un futuro y viceversa.
En conclusión, el presente estudio pone de manifiesto el uso de trastuzumab en la práctica clínica habitual en un hospital de tercer nivel, y aunque se ha utilizado siempre en cáncer de mama se constata que se usa en condiciones distintas a las autorizadas en la ficha técnica. En ocasiones se ha utilizado sin la sobreexpresión de HER2 +++ y en esquemas no autorizados sin que exista bibliografía de calidad científica o recomendación expresa que avale su uso. En este sentido, se considera conveniente generar nueva evidencia científica que respalde estas prácticas clínicas.
FinanciaciónFinanciado por Fundación para la Investigación Biosanitaria de Andalucía Oriental – Alejandro Otero (FIBAO).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.