ORIGINALES
ESTABILIDAD Y COMPATIBILIDAD DEL METAMIZOL EN JERINGA Y EN MEZCLAS INTRAVENOSAS
Noguera Rodríguez A.1,Licenciada en Farmacia;Sancho Chust V.1,Doctor en Farmacia. Especialista en Farmacia Hospitalaria;Medina Hernández C.1,Licenciada en Farmacia. Becaria de AFAHPE;Medina Hernández M.J.2, Doctora en Ciencias Químicas. Profesora Titular Universitaria;Jiménez Torres N. V.1,3.,Doctor en Farmacia. Catedrático Universitario. Jefe de Servicio
1 Servicio de Farmacia , Hospital Universitario Dr. Peset. Valencia
2 Departamento de Química Analítica. Universidad de Valencia.
3 Departamento de Farmacia y Tecnología Farmacéutica. Universidad de Valencia.
Correspondencia: Clara Medina Hernández. Servicio de Farmacia. Hospital Universitario Dr. Peset. Avda. Gaspar Aguilar, 90. 46017 Valencia. E-mail: nvictor@gva.san.es.
Fecha de recepción: 18-11-98
Palabras clave:
Pirazolonas. Metamizol. Dipirona. Metilaminoantipirina. Mezclas intravenosas. Estabilidad química. Compatibilidad física. Conservación. Período de validez. Preparación centralizada.
Resumen:
Se ha estudiado la compatibilidad física y estabilidad química de mezclas intravenosas de metamizol DCI (sal magnésica). Se han utilizado soluciones de metamizol al 40 % (ampollas cargadas directamente en jeringas de polipropileno) y mezclas intravenosas diluidas al 2 y 4 % con NaC1 0,9 % en bolsas Viaflex® de PVC. Cada una de las soluciones se conservó a 10 y 25 oC, sin exponerlas a la luz, durante siete días.
Los ensayos se realizaron por triplicado para cada temperatura de conservación. En los ensayos de estabilidad química se tomaron muestras, a tiempos prefijados, durante siete días. La valoración de las muestras se realizó mediante cromatografía líquida de alta eficacia (CLAE). Se calculó la constante de degradación de primer orden y el período de validez (t90). También se comprobó la compatibilidad física a través de inspección visual y medida de la variación de pH, así como la estanqueidad de los envases por medición de la pérdida de peso.
El metamizol resultó físicamente compatible en las mezclas intravenosas ensayadas, durante el período de estudio y además, se asegura una buena estanqueidad de los envases.
En base a su estabilidad química, las mezclas intravenosas de metamizol 2 % y 4 % (p/v), tienen un período de validez de cuatro días a temperatura ambiente y cinco días cuando son conservadas a 10 oC; en el caso del metamizol al 40 % en jeringa, este período se prolonga a más de diez días. Estos períodos permiten que las mezclas i.v. puedan ser preparadas de manera centralizada por el servicio de farmacia, en lotes o individualmente, al menos 24 h antes de su dispensación y garantizan que puedan ser reutilizadas, en caso de no ser administradas al paciente.
STABILITY AND COMPATIBILITY METAMIZOLE IN SYRINGES AND INTRAVENOUS MIXTURES
Key words:
Pyrazolones. Metamizole. Dipyrone. Methylami-noantipyrine. Intravenous mixtures, Chemical stability, Physical compatibility, Storage. Expiration period. Centralized preparation.
Summary:
We studied the physical compatibility and chemical stability of intravenous mixtures of metamizole DCI (magnesium salt). Tests were done with 40 % methimazole solutions (ampules loaded directly into polypropylene syringes) and intravenous mixtures diluted to 2 % or 4 % in 0.9 % NaC1 in Viaflex® PVC bags. Each solution was stored at 10 oC and 24 oC away from light during seven days.
All assays were done in triplicate at each storage temperature. For chemical stability tests samples were drawn at specific times during seven days, and were analyzed with high performance liquid
chromatography (HPLC). The first order degradation constant and expiration period (t90) were calculated. Physical compatibility was studied by visual inspection and pH measurement, and air-tightness of the bags was checked by measuring weight loss with time.
Metamizole remained physically compatible throughout the study period with the intravenous mixtures tested, and the bags remained air-tight.
Thanks to their chemical stability, intravenous mixtures of metamizole at 2 % or 4 % (wt/vol) have an expiration period of four days at room temperature and five days when stored at 10 oC. In syringes, 40 % ,methimazole can be stored for more than ten days. These periods make it possible to centralize the preparation of i.v. mixtures (batch or individual doses) in the pharmacy service. The mixtures can be prepared at least 24 h before dispensation, and can be reused if not administered.
INTRODUCCION
El metanizol magnésico (2,3-dimetil-1-fenil-5-pirazolona-4-metilamino metanosulfonato magnésico) es un derivado pirazolónico con actividad analgésica, antipirética, antiinflamatoria, antiagregante plaquetaria y espasmolítica (1). Las indicaciones actualmente aprobadas en España son: dolor agudo post-operatorio o post-traumático, dolor de tipo cólico, dolor de origen tumoral y fiebre alta que no responda a otros antitérmicos (2). Sin embargo, su uso más frecuente corresponde al tratamiento de dolores asociados a espasmos cólicos del músculo liso en el tracto gastrointestinal, biliar o urinario (3).
En el medio hospitalario, la pauta posológica habitual es 2 g cada 6-8 horas por vía intramuscular, por vía intravenosa excepcionalmente se administra sin diluir para evitar el riesgo de hipotensión, por lo que es práctica común su dilución en volúmenes de 50 y 100 ml de fluidos intravenosos, principalmente CINa al 0,9 %, y administración durante 15 a 120 min. La preparación de estas mezclas i.v. se realiza en las unidades de hospitalización, generalmente sin ninguna directriz que soslaye los potenciales problemas de contaminación, correcta dosificación, incompatibilidad físico-química y estabilidad del principio activo. En suma, sin la participación directa del farmacéutico de modo que se garanticen las mejores condiciones en la preparación i.v. que recibe el paciente. En este sentido, la optimización de los métodos de administración intravenosa de medicamentos, con vistas a mejorar la respuesta terapéutica en los pacientes, debe representar uno de sus objetivos primarios.
El objetivo del presente trabajo ha sido estudiar la compatibilidad y estabilidad de preparaciones intravenosas de metamizol al 2, 4 y 40 % porque representan las pautas de dosificación más habituales en la práctica asistencial.
MÉTODO
Mezclas intravenosas
Las mezclas intravenosas ensayadas se prepararon en condiciones análogas a las de las unidades de hospitalización. Como inyectable se utilizó el Nolotil® (2 g de dipirona magnésica en 5 ml), lote L-106, que se adiciona a una bolsa Viaflex® (PVC) con 100 o 50 ml de NaC1 al 0,9 %, resultando concentraciones de metamizol del 2 % y 4 %, respectivamente. Del mismo modo se ensayaron concentraciones del 40 % (presentación comercial), mantenidos en jeringas de polipropileno de 5 ml de capacidad (marca ICO). La variabilidad del peso de las ampollas utilizadas, tanto interlote como intralote fue inferior al 0,2 %. Las mezclas intravenosas fueron preparadas en ausencia de esterilidad y se conservaron sin exponerlas a la luz. Las condiciones de ensayo se describen en la tabla 1.
Tabla 1. Condiciones del ensayo de estabilidad físico-química del metamizol en mezclas intravenosas | ||||
| Concentración(p/v) | Vehículo | Tipo de envase | T(a)ambiente (24±1(o)C) | Frigorífico (10±1(o)C) |
| 2% | NaCl 0,9% | Viaflex(®)100 ml | Sí | Sí |
| 4% | NaCl0,9% | Viaflex(®)50ml | Sí | Sí |
| 40% | | Jeringa polipropileno 5ml | Sí | Sí |
Preparación de las muestras
Previamente al análisis, las muestras se diluyeron con fase móvil adicionada del patrón interno, hasta conseguir una concentración final de metamizol entre 5 y 50 µg/ml. En este sentido, las muestras de metamizol al 2 y 4 % se diluyeron a razón de 1/1.000 y las de metamizol al 40 % a 1/10.000.
Valoración cromatográfica
Ambas especies se han analizado por separado en cada muestra, para ello se han construido rectas de calibrado independientes. El intervalo de concentraciones estudiado fue de 5 a 50 µg/ml de dipirona magnésica, lab. Europharma, Pm 753,1 (hexahidratada) y lote no 502379; y de 0,5 a 4 µg/ml de 4-metilaminoantipirina, lab. Europharma, Pm, 217,3 y lote no 2228044. Cada una de las soluciones patrón se analizó cinco veces de manera independiente.
La valoración de las muestras se ha realizado mediante cromatografía líquida de alta eficacia (CLAE), de tipo micelar híbrido, basada en la técnica descrita por Carretero, Vadillo y Laserna (4). El sistema cromatográfico está constituido por una bomba Waters modelo 501, inyector Rheodyne con un loop de 100 µl de volumen detector espectrofotométrico Waters de longitud de onda variable modelo 484, registrador e integrador Waters modelo 745. Como fase estacionaria se ha utilizado una columna de acero inoxidable Novapak C-18, de 150 mm de longitud, 3,9 mm de diámetro interno, relleno de partículas de polimetiloctadecilsilano de 4 µm de diámetro. Como fase móvil se ha empleado una solución acuosa de dodecilsufato sódico 0,01 M y 2-propanol al 2 %. El flujo se ha fijado a 1 ml/min y la longitud de onda a 262 nm. Como patrón interno se empleó cafeína (3,7-dihidro1,3,7-trimetril-1H-purina-2,6-diona o 1,3,7-trimetilxantina) a la concentración de 20 µg/ml. Se utiliza la relación de áreas analito/patrón interno como señal analítica.
El método de valoración por CLAE permite una buena separación de las tres especies: dipirona, cafeína y 4-metilaminoantipirina, como se aprecia en el cromatograma adjunto (Fig. 1).
Figura 1.Cromatograma para la determinación de metamizol (tR = 1,01 min), cafeína (tR = 3,01 min) y 4-metilaminoantipirina (tR = 5,53 min).
Dado que la dipirona magnésica en medio acuoso se transforma rápidamente en 4-metilaminoantipirina, se ha fijado el tiempo transcurrido entre la dilución de las muestras y la inyección en el sistema cromatográfico en dos minutos.
Se ha asumido que no hay pérdidas apreciables de ambas especies en este período de tiempo, por lo que se considera que todo el ión dipironato que desaparece se transforma en 4-metilaminoantipirina. En consecuencia y puesto que dicha transformación es inherente a la dilución de las muestras, la concentración teórica de cada uno de los patrones de dipirona fue corregida restando de la cantidad teórica inicial, la cantidad que se había transformado en 4-metilaminoantipirina en el momento de la valoración.
Dado que no existe homogeneidad de las varianzas en la recta de calibrado de la dipirona, se ha caracterizado el modelo de error, utilizando para ello el criterio de Akaike (AIC), la suma de cuadrados de los residuales (SS) y la r2 ajustada y se ha ponderado por la varianza de la concentración de dipironato. En el caso de la 4-metilaminoantipirina no ha sido necesario utilizar ponderación.
La reproducibilidad del método analítico se ha establecido a partir del coeficiente de variación de diez muestras independientes con diferentes concentraciones dentro del ámbito de calibrado (inter e intraensayo) y la exactitud por el error relativo. El resultado se ha considerado aceptable cuando el coeficinte de variación es menor o igual al 15 % y el error relativo es menor del 10 %. El límite de detección y cuantificación se ha obtenido a partir de la desviación estándar de la ordenada en el origen de recta de calibrado.
Compatibilidad física
Se comprobó por inspección visual de las mezclas intravenosas sobre fondo blanco (a fin de observar posibles incompatibilidades de tipo físico: coloración, cristales, nebulización, partículas, etc.) y por la medida de la variación de pH de las mezclas intravenosas. También se comprobó la estanqueidad del envase a partir de la medición de la pérdida de peso de las mezclas envasadas en Viaflex® y en las jeringas precargadas. Estos ensayos se realizaron por triplicado durante 168 h.
Estabilidad química
Para evaluar la estabilidad química se han realizado ensayos de degradación por triplicado para cada una de las condiciones de estudio. Al ser dos especies farmacológicamente activas (dipirona y 4-metilaminoantipirina), (6) se ha determinado la cinética de degradación considerando la desaparición del conjunto de las dos sustancias, tomando muestras al inicio, a las ocho horas y a los 1, 2, 3, 4, 5, 6 y 7 días.
A partir de las concentraciones molares de ambas especies en las muestras se ha calculado la concentración equivalente de dipironato inicial (antes de la hidrólisis), sumando la concentración final de dipironato y la de 4-metilaminoantipirina equivalente a ión dipironato, teniendo en cuenta que cada molécula de dipirona magnésica se transforma en dos moléculas de 4-metilaminoantipirina.
Los datos se ajustaron a una cinética de orden uno mediante regresión no lineal por mínimos cuadrados, utilizando el programa informático Sigmaplot®. De este modo se calcula la constante de degradación del proceso (kd, h1) y el período de validez de las muestras (t90, días). En los casos en los que las varianzas no resultaron homogéneas, se ponderó por la varianza de la concentración. La calidad del ajustado se ha evaluado utilizando el cuadrado del coeficiente de correlación (r2).
La comparación estadística de las constantes de degradación para los factores de temperatura de conservación y concentración de metamizol se ha realizado mediante análisis de varianza de dos vías y, en su caso, la prueba de comparación múltiple de Scheffé. Se ha fijado un nivel de confianza del 95 % (* = 0,05) y previamente se ha comprobado la homogeneidad de varianzas mediante la Prueba de Barlett (5).
RESULTADOS
Las rectas de calibrado presentan una excelente linealidad (r > 0,99) y los límites de detección y cuantificación obtenidos (tabla 2) permiten una adecuada valoración de ambas sustancias en las muestras, dado que dichos límites quedan por debajo de las concentraciones halladas en las muestras tras su dilución.
Tabla 2. Caracterización del método cromatográfico | ||
| Metamizol | 4-Metilaminoantipirina | |
| Modelo de varianza | Lineal: C (µM)=0,455++0,0790·DE(µM) | Independiente de la concentración |
| Recta de calibrado | Ra=0,0182+0,0864·C (r>0,997) | Ra=0,0464+0,2752·C (r>0,991) |
| Límite de detección | 2,55 µM | 0,57 µM |
| Límite de cuantificación | 8,02 µM | 2,30 µM |
| Ra: relación del área cromatográfica con la del patrón interno. C: concentración del fármaco. DE: desviación estándar,. | ||
La precisión y exactitu de la técnica (tabla 3) presentan valores adecuados en todo el ámbito de concentraciones ensayadas, presentando siempre valores de coeficiente de variación y error relativo, en todo el ámbito de concentraciones ensayado, inferiores al 10 % intra-ensayo y menores del 15 % inter-ensayo.
Tabla 3. Validación del método cromatográfico | ||||
Intra-ensayo | Inter-ensayo | |||
| 31 µM | 155 µM | 31 µM | 155 µM | |
| Precisión (CV, %) | 3,80 | 8,52 | 9,34 | 13,65 |
| Exactitud (Er, %) | 4,02 | 0,85 | 5,19 | 4,48 |
| CV: coeficiente de variación. Er: error relativo. | ||||
En la inspección visual realizada, en todas las mezclas ensayadas durante 168 horas, no se observan indicios de incompatibilidad física (cristales, nebulización, partículas, etc.). Sin embargo, sí se evidencia la aparición de una ligera coloración amarillenta, que ya es patente a las 2-3 horas y va aumentando con el tiempo.
El pH inicial de las mezclas i.v. de metamizol (tabla 4), no se modifica significativamente, siendo su descenso, en cualquier preparación, igual o inferior a 0,5 unidades de pH, a las 168 horas (siete días).
Tabla 4. Variación del pH inicial de las mezclas i.v. de metamizol al 2 %, 4 % y 40 % (p/v) | ||
| Mezcla intravenosa | DpH (EE) a | las 168 h |
| 10±1(o)C | 24±1(o)C | |
| Metamizol al 2% en Viaflex(®)con NaCl 0,9% | 0,280(0,012) | 0,310(0,006) |
| Metamizol al 4% en Viaflex(®)con NaCl 0,9% | 0,260(0,006) | 0,500(0,006) |
| Metamizol al 40% en jeringa de polopropileno | 0,250(0,006) | 0,330(0,006) |
| EE: error estándar | ||
Esta tendencia también se observa en cuanto a la modificación del peso inicial de las mezclas i.v., derivada de la evaporación de agua, siendo la disminución del peso siempre inferior al 0,6 % a los siete días (tabla 5).
Tabla 5. Variación del peso inicial de las mezclas i.v. de metamizol al 2 %, 4 % y 40 % (p/v) | ||
| Mezcla intravenosa | Porcentaje de Dpeso | (EE) a las 168 h |
| 10±1(o)C | 24±1(o)C | |
| Metamizol al 2% en Viaflex(®)con NaCl 0,9% | 0,16(0,02) | 0,3576(0,0003) |
| Metamizol al 4% en Viaflex(®)con NaCl 0,9% | 0,2520(0,0014) | 0,591(0,005) |
| Metamizol al 40% en jeringa de polopropileno | 0,0097(0,0015) | 0,0061(0,0010) |
| EE: error estándar | ||
El contenido de metamizol (mM) expresado como la suma de las concentraciones de dipironato y 4-metilaminoantipirina y su desviación estándar, obtenido a los distintos tiempos de muestreo durante siete días se describe en la tabla 6. Los datos permiten caracterizar la velocidad de degradación de la dipirona y calcular su constante de degradación de orden uno (kd) y el período de validez (t90) en las distintas condiciones ensayadas (tabla 7 y fig. 2).
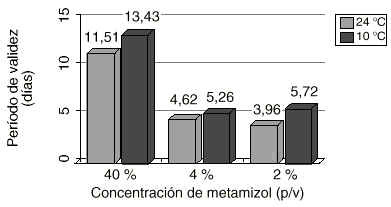
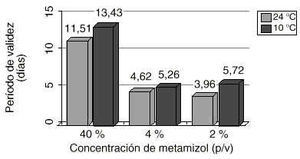
Figura 2.Comparación del período de validez (días) a las distintas concentraciones de metamizol y temperaturas de conservación.
Tabla 6. Estabilidad del metamizol al 2 % y 4 % en NaCl 0,9 % y 40 % (p/v) | |||||||
Concentración mM de metamizol promedio de los tres ensayos (desviación estándar) | |||||||
| Concentración: | 2% | 4% | 40% | ||||
| Tiempo | T(a): | 24±1(o)C | 10±1(o)C | 24±1(o)C | 10±1(o)C | 24±1(o)C | 10±1(o)C |
| Inicial | 64,1(2,4) | 64,4(1,8) | 119,8(2,6) | 119,3(1,1) | 1222,8(0,4) | 1187(23) | |
| Ocho horas | 59,0(0,5) | 63,2(1,0) | 118,4(0,8) | 119,0(3,2) | 1221(25) | 1199(37) | |
| Un día | 61,1(1,5) | 62,5(0,6) | 117,8(0,3) | 119,6(1,3) | 1213(28) | 1181(40) | |
| Dos días | 60,2(0,4) | 61,7(1,7) | 114,0(4,5) | 116,6(1,9) | 1226(22) | 1170(18) | |
| Tres días | 60,9(0,6) | 61,7(0,3) | 110,8(0,6) | 112,7(2,9) | 1228(42) | 1173(16) | |
| Cuatro días | 57,2(2,0) | 60,3(0,2) | 108,2(1,6) | 109,8(1,0) | 1164(19) | 1141(16) | |
| Cinco días | 55,7(2,9) | 59,1(0,9) | 104,9(3,2) | 107,8(3,1) | 1177(10) | 1143(24) | |
| Seis días | 52,6(2,1) | 56,3(0,9) | 101,7(2,2) | 106,8(1,1) | 1156(30) | 1155(27) | |
| Siete días | 52,8(0,7) | 56,2(1,0) | 105,4(1,3) | 104,3(1,4) | 1150(11) | 1132(4,0) | |
Tabla 7. Constante de degradación (h1) y período de validez (días) del metamizol al 2 %, 4 % y 40 % (p/v). | ||||||||
| Concentración | 2% | 4% | 40% | |||||
| Par | ámetro | T(a): | 24±1(o)C | 10±1(o)C | 24±1(o)C | 10±1(o)C | 24±1(o)C | 10±1(o)C |
| k() (1)·10(4) d (EE); h | 11,11(1,32) | 7,720,80) | 9,50(1,02) | 8,39(0,86) | 3,82(1,09) | 3,34(0,97) | ||
| (t)90 (EE); días | 3,96(0,47) | 5,72(0,60) | 4,62(0,49) | 5,26(0,54) | 11,51(3,28) | 13,43(3,90) | ||
| k() (: promedio de las constantes de degradación de los tres ensayos. EE: error estándar. t)90(: período de validez.) | ||||||||
DISCUSION
En la inspección visual de las mezclas intravenosas ensayadas no se observó la aparición de partículas, nebulización o cualquier otro indicio de incompatibilidad física. Este hecho, unido a la escasa variación del pH de las soluciones, siempre inferior a 0,5 unidades, asegura la compatibilidad física del metamizol en dichas mezclas, durante el período ensayado (siete días), sin que la concentración de metamizol ni la temperatura de conservación afecten, de manera apreciable, en este aspecto. Por otra parte, la aparición de color amarillento en la solución, no se traduce en una pérdida de actividad farmacológica, según la bibliografía facilitada por el laboratorio fabricante (6).
Como era previsible, a temperatura más elevada (24 oC) la pérdida de peso de los envases por evaporación de agua, es mayor que a baja (10 oC). Sin embargo, dado que la pérdida de peso es siempre inferior al 0,6 %, se puede considerar que, tanto los envases de Viaflex® como la jeringa de polipropileno, aseguran una buena estanqueidad.
Respecto a la estabilidad química, los resultados obtenidos indican que en las mezclas de metamizol al 2 y 4 % (p/v), diluido en NaCl 0,9 %, se pierde entre un 12 y un 18 % de la concentración inicial al cabo de una semana a temperatura ambiente, lo que corresponde a un período de validez alrededor de cuatro días. Cuando las mezclas i.v. se mantienen a 10 oC, este período se incrementa al menos un día.
El análisis estadístico de comparación dos a dos mediante la prueba de Scheffé revela que la estabilidad no se ve afectada por la concentración del aditivo, cuando se encuentra diluido al 2 o 4 %; es decir, que la dilución de las empollas de 2 g puede hacerse indistintamente en 100 o 50 ml de NaCl 0,9 %, respectivamente, sin que ello afecte significativamente a la estabilidad de la mezcla.
El período de validez se incrementa significativamente con la conservación refrigerada a 10 oC para las mezclas diluidas en NaCl al 2 % (p = 0,003) y 4 % (p = 0,049) pudiéndose, en este caso, preparar anticipadamente lotes que satisfagan la demanda hospitalaria de cinco días.
La estabilidad química es considerablemente mayor para el metamizol al 40 % en jeringa, produciéndose tan sólo pérdidas del 4-5 % de la concentración inicial, transcurrida una semana. Al contrario que en las soluciones diluidas con NaCl 0,9 %, en las ampollas sin diluir cargadas en jeringa, la conservación refrigerada no afecta apreciablemente la estabilidad del metamizol (p = 0,239), siendo siempre el período de validez superior a diez días.
En conclusión, las mezclas intravenosas de metamizol al 2 y 4 % en NaCl 0,9 %, si bien son físicamente compatibles durante siete días, debido a su estabilidad química tienen un período de validez de cuatro días a temperatura ambiente y cinco días a 10 oC. Con el metamizol al 40 % en jeringa, este período se prolonga, excediendo incluso el intervalo de tiempo recomendado según el criterio bacteriológico (7), por lo tanto, las jeringas precargadas pueden reutilizarse durante una semana. En cualquier caso, estos tiempos permiten, no sólo la preparación centralizada de estas mezclas por el servicio de farmacia, en lotes o individualmente para cada paciente, de manera anticipada a su dispensación; sino que garantizan su reutilización, al menos durante los dos días siguientes a su devolución, caso de no ser administradas al paciente.
BIBLIOGRAFIA
1. Weithman KU et al. Biochemical and Pharmacological effects of dypirone and its metabolites in model systems related to arachidonic acid cascade. Arzneim. Forsch Drug Res 1985;35:947-52.
2. Monografía de la especialidad Nolotil®. Europharma S.A., 1996.
3. Pérez Peiró C. Normalización de la terapia intravenosa en pacientes con cólicos renales atendidos en urgencias mediante el análisis de decisión. Ciencia Pharmaceutica 1993;3:184-90.
4. Carretero I, et al. Determination of antipyrine metabolites in human plasma by solid-phase extraction and micellar liquid chromatography. Analyst 1995;120:1729-32.
5. Doménech Massons JM. Métodos estadísticos en Ciencias de la Salud (Análisis de la varianza) 1.a ed. Barcelona: Signo; 1990.
6. Fernández-Velilla L. Comunicación personal. Laboratorios Inibsa. Barcelona; 1997.
7. ASHP. Technical assistance bulletin on quality assurance for Pharmacy-prepared sterile products. Am J Hosp Pharm 1993;50:2386-98.