Evaluar la efectividad de la palifermina en la prevención de la mucositis oral (MO) en pacientes oncohematológicos.
MétodoEstudio observacional retrospectivo de cohortes en pacientes con neoplasias hematológicas, sometidos a tratamiento mieloablativo de acondicionamiento y posterior transplante autólogo de progenitores hematopoyéticos, y que reciben como profilaxis de la mucositis palifermina u otro tratamiento convencional.
La variable principal evaluada fue la duración de la MO. Las variables secundarias fueron la incidencia de mucositis, neutropenia febril o sepsis y la administración de opiáceos o nutrición parenteral.
ResultadosSe incluyeron 36 pacientes en el estudio, 11 en el grupo de palifermina y 25 en el grupo control. La duración de la MO fue de 4,6±3,1 días (mediana: 5 días) en los pacientes tratados con palifermina respecto a 7,4±4,0 días (mediana: 6 días) en los tratados con profilaxis convencional (p<0,05). Sin embargo, no se observaron diferencias significativas en la incidencia de mucositis, sepsis o neutropenia febril, la administración de opiáceos o la utilización de nutrición parenteral.
ConclusionesEl tratamiento profiláctico con palifermina permite reducir la duración de la MO en pacientes oncohematológicos. Se necesitan más estudios y con un tamaño muestral mayor para poder evaluar el papel de la palifermina sobre otras variables, tales como la incidencia de la mucositis, sepsis, neutropenia febril, etc.
To assess the effectiveness of palifermin for the prevention of oral mucositis in patients with haematological cancers.
MethodsRetrospective observational study of cohorts of patients with haematological cancer undergoing cytotoxic therapy causing hematopoietic ablation.
The main variable assessed was the duration of the oral mucositis. Secondary variables assessed were incidence of mucositis, febrile or septic neutropenia and the administration of opioids and parenteral nutrition.
ResultsWe included 36 patients in this study, 11 in the group that received palifermin and 25 in the control group. The duration of oral mucositis was 4.6±3.1 days (median: 5 days) in the patients treated with palifermin in comparison with 7.4±4.0 days (median: 6 days) in patients treated with conventional prophylactic therapy (p<0.05). However, no significant differences were seen in the incidence of mucositis, febrile or septic neutropenia, opioid administration of the use of parenteral nutrition.
ConclusionsProphylactic treatment with palifermin reduces the duration of oral mucosities in patients with haematological cancer. Further studies are necessary with larger samples to be able to assess palifermin and its influence on other variables, such as incidence of mucositis, sepsis, febrile neutropenia, etc.
El tratamiento de los tumores malignos sólidos y de las leucemias con quimioterapia citotóxica o radioterapia, es cada vez más efectivo. No obstante, siguen asociándose con efectos secundarios importantes a corto y largo plazo1. Estos efectos, inducidos por los tratamientos administrados son, entre otros, trastornos en la funcionalidad e integridad de la mucosa oral que terminan provocando un proceso inflamatorio y ulcerativo denominado mucositis oral (MO)2.
La MO, además de producir molestias y dolor, puede provocar dificultad en la nutrición oral, retraso en la administración de los fármacos orales, estancias hospitalarias más prolongadas y, en algunos casos, infecciones potencialmente mortales1,3–6.
Igualmente, la MO grave puede provocar reducciones de dosis de la quimioterapia y de la radioterapia no programada, e incluso la suspensión del tratamiento, afectando a la eficacia del tratamiento y reduciendo la supervivencia de los pacientes, observándose un incremento del riesgo, tanto de la mortalidad a los 100 días, como de la mortalidad relacionada con el tratamiento postransplante autólogo de células madre3.
Además desde el punto de vista de los pacientes, la MO es a menudo considerada, como una de las complicaciones más debilitantes, que produce una disminución significativa de la calidad de vida de los pacientes1,7–10.
Existen diversas escalas comúnmente usadas para evaluar y cuantificar la gravedad de la mucositis, entre ellas la establecida por la OMS, que distingue cinco niveles de gravedad (de 0–4), siendo los grados 3 y 4 los más discapacitantes11 (tabla 1).
Gradación de la mucositis oral según la Organización Mundial de la Salud16
| Grado | Síntomas |
| 0 | Sin síntomas |
| 1 | Escozor con o sin eritema |
| 2 | Eritema y ulceraciones; capacidad de ingesta de sólidos |
| 3 | Eritema extenso con ulceraciones; incapacidad de ingesta de sólidos |
| 4 | Mucositis que impide la ingesta oral (sólidos y líquidos) |
Hasta la aparición de la palifermina, no se disponía de un tratamiento profiláctico específico para la mucositis12,13, empleándose una gran variedad de tratamientos, tales como, factor estimulante de granulocitos (G-CSF), factor estimulante de granulocitos y macrófagos (GM-CSF), sucralfato, glutamina, lidocaína, clorhexidina, nistatina, amifostina, el láser y la crioterapia entre otros, muchos de los cuales están destinados a paliar síntomas, siendo además los resultados de efectividad obtenidos poco concluyentes e incluso contradictorios14.
La palifermina, es un factor de crecimiento queratinocítico humano, obtenido por tecnología ADN recombinante, el cual se une a receptores específicos en la superficie de las células epiteliales estimulando la proliferación, diferenciación y regulación al alza de los mecanismos citoprotectores15,16. La aprobación de dicho fármaco por la EMEA y la AEMPS, para la disminución de la incidencia, duración y severidad de la MO, está basada en un estudio pivotal7, fase iii, aleatorio, doble ciego y controlado, que evalúa la eficacia de palifermina en la prevención de la MO, en pacientes con neoplasias hematológicas sometidos a tratamiento mieloablativo con irradiación corporal total y altas dosis de quimioterapia (QT) (esquemas basados con etopósido y ciclofosfamida), seguido de un trasplante de progenitores hematopoyéticos (TPH). Este régimen mielotóxico, tratamiento estándar en EEUU, se asocia a un alto grado de incidencia de MO grave (grado 3 y 4 según escala de la OMS)11, afectando al 70–80% de los pacientes6,10. Sin embargo, no es utilizado de manera rutinaria en España, donde se utilizan habitualmente regímenes de quimioterapia a dosis altas sin radioterapia, como son el esquema BEA (busulfán, etopósido y citarabina), BEAM (carmustina, etopósido, citarabina y melfalán), CBV (carmustina, etopósido y ciclofosfamida) y Melfalán a altas dosis, los cuales son menos mucotóxicos y afectan a un menor porcentaje de pacientes (30–50%)6,9,10. Estas diferencias en la utilización de los distintos esquemas de tratamiento y de los criterios de utilización hacen que los resultados de eficacia publicados en la bibliografía no sean extrapolables a nuestro entorno17.
En este contexto, el presente estudio tiene como objetivo evaluar la efectividad de la palifermina, en la prevención de la MO, en pacientes con neoplasias hematológicas sometidos a dosis altas de quimioterapia y transplante autólogo de células madre, respecto a pacientes que recibieron otros tratamientos preventivos convencionales.
MétodoAnálisis observacional retrospectivo de cohortes de pacientes con diagnóstico de neoplasias hematológicas, tratados con dosis altas de quimioterapia como tratamiento mieloablativo de acondicionamiento y posterior transplante autólogo de progenitores hematopoyéticos y que para la profilaxis o el tratamiento de la mucositis hayan recibido palifermina frente a otro tratamiento profiláctico convencional, entre enero de 2004 hasta febrero de 2009.
La identificación de los pacientes incluidos en el estudio, se realizó a través de los códigos CIE-9 del CMBD del hospital. Los datos demográficos y las variables relevantes se obtuvieron mediante la revisión de las historias clínicas, para lo que se diseñó una hoja de recogida de datos (fig. 1).
La variable principal de efectividad fue la mediana de duración de MO de cualquier grado. Como variables secundarias se midieron la incidencia global de mucositis, la incidencia de mucositis por grado de gravedad, la necesidad de uso de analgesia opioide, la necesidad de uso de nutrición parenteral y la incidencia de neutropenia febril y de sepsis. Solo se registro la utilización de nutrición parenteral cuando la indicación fue la incapacidad de nutrición por vía oral derivada de la mucositis. Igualmente, solo se considero la administración de analgesia opioide para el control del dolor secundario a la mucositis.
La clasificación de la mucositis por grado de gravedad fue realizada por el médico responsable del paciente, en base a la escala establecida por la OMS11.
El tamaño muestral se calculó a partir de los resultados de eficacia de la variable principal de eficacia del ensayo clínico pivotal fase iii, utilizado para la aprobación de la indicación7. Para conseguir una potencia del 80% y detectar diferencias en el contraste de la hipótesis nula, mediante la prueba t de Student bilateral para dos muestras independientes, teniendo en cuenta que el nivel de significación es del 5%, y asumiendo que la duración media de la mucositis severa (grado 3–4) en el grupo control en el ensayo clínico fue de 10,4 días, la media del grupo experimental es de 3,7 días y la desviación típica de ambos grupos es de 5,2 días, sería necesario incluir 23 pacientes, 14 pacientes en el grupo de control (pacientes tratados con tratamiento convencional) y 9 pacientes en el grupo experimental (pacientes tratados con palifermina).
El tratamiento y análisis estadístico se llevó a cabo con el paquete estadístico SPSS® para Windows versión 12.0. La estadística descriptiva de las variables cuantitativas continuas se realizó con medidas de tendencia central (media y mediana) y de dispersión (desviación estándar). Se evaluó la distribución normal de las variables principales mediante la prueba de Kolmogorov-Smirnov. La comparación de las variables cuantitativas se realizó mediante la prueba de la t de Student para muestras independientes y para las variables categóricas mediante la prueba de χ2.
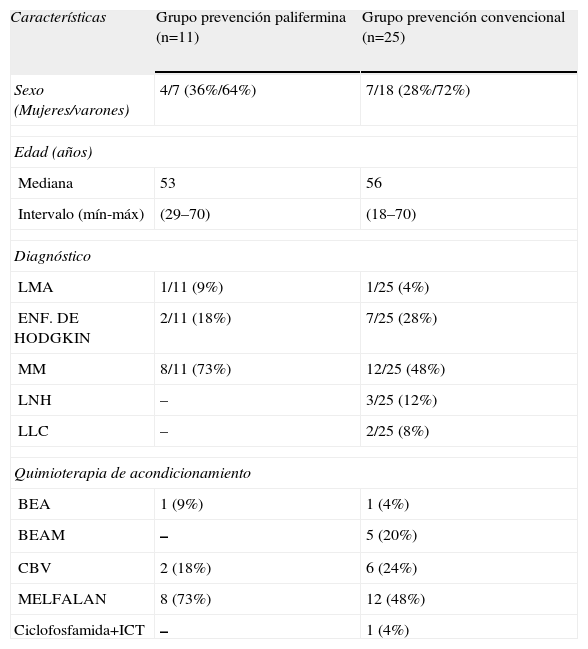
ResultadosSe incluyeron en el estudio 36 pacientes con diagnóstico de neoplasia hematológica, sometidos a altas dosis de QT como tratamiento de acondicionamiento mieloablativo y posterior TPH, incluyéndose en su totalidad en el estudio. El grupo experimental esta formado por 11 pacientes que recibieron tratamiento preventivo para la MO con palifermina, según la dosis y la pauta de administración especificada en su ficha técnica15. El grupo control esta constituido por 25 pacientes que recibieron tratamiento profiláctico convencional mediante la administración de un colutorio con mepivacaína 2%, dexametasona y clorhexidina 0,05%. Todos los pacientes recibieron cuidados generales para una correcta higiene bucal y enjuagues con solución antiséptica. La tabla 2 muestra las características de los pacientes incluidos en el estudio.
Características basales de la población incluida en el estudio en ambos grupos
| Características | Grupo prevención palifermina (n=11) | Grupo prevención convencional (n=25) |
| Sexo (Mujeres/varones) | 4/7 (36%/64%) | 7/18 (28%/72%) |
| Edad (años) | ||
| Mediana | 53 | 56 |
| Intervalo (mín-máx) | (29–70) | (18–70) |
| Diagnóstico | ||
| LMA | 1/11 (9%) | 1/25 (4%) |
| ENF. DE HODGKIN | 2/11 (18%) | 7/25 (28%) |
| MM | 8/11 (73%) | 12/25 (48%) |
| LNH | – | 3/25 (12%) |
| LLC | – | 2/25 (8%) |
| Quimioterapia de acondicionamiento | ||
| BEA | 1 (9%) | 1 (4%) |
| BEAM | – | 5 (20%) |
| CBV | 2 (18%) | 6 (24%) |
| MELFALAN | 8 (73%) | 12 (48%) |
| Ciclofosfamida+ICT | – | 1 (4%) |
BEA: busulfan, etopósido, citarabina; BEAM: carmustina, etopósido, citarabina, melfalán; CBV: carmustina, etopósido, ciclofosfamida; ICT: irradiación corporal total; LLC: leucemia linfoide crónica; LMA: leucemia mieloide aguda; LNH: linfoma no Hodgkin; MM: mieloma múltiple.
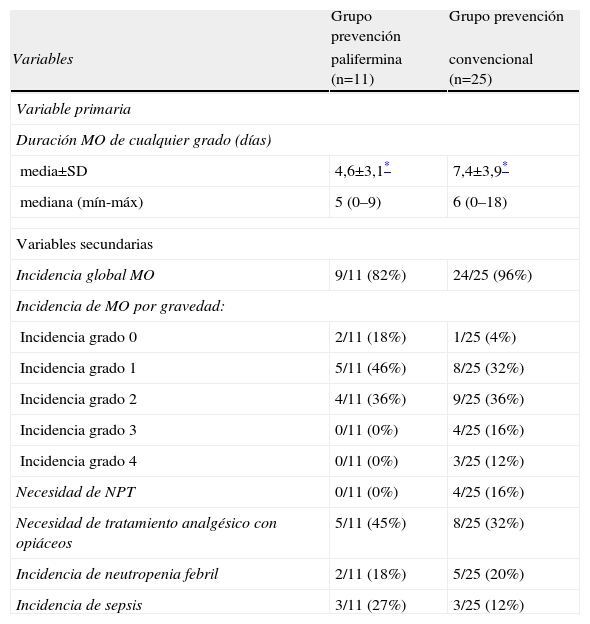
La mediana de duración de la MO fue de 5 días (intervalo: 0–9 días) en los pacientes tratados con palifermina respecto a 6 días (intervalo: 0–18 días) en los tratados con profilaxis convencional. La duración media de MO fue, significativamente mayor en el grupo control que en el grupo experimental (7,4±3,9 días vs. 4,6±3,1 días, p<0,05).
La incidencia global de MO fue del 82% en el grupo tratado con palifermina y del 96% en el grupo control, no detectándose diferencias significativas en la incidencia global de mucositis (p=0,16). No obstante, se observa una tendencia favorable al grupo tratado con palifermina (9/11 pacientes respecto a 24/25 pacientes en el grupo control). No se observó ningún caso de mucositis de grado 3–4 en el grupo tratado con palifermina. La incidencia en el grupo control fue de 4/25 pacientes para la mucositis grado 3, con una mediana de duración de 10,5 días y para la mucositis grado 4 de 3/25 pacientes con una mediana de duración de 15 días. La mediana de duración de la MO grado 3 y 4 en dicho grupo fue de 12 días.
La necesidad de nutrición parenteral se correlacionó con la incidencia y gravedad de la mucositis, ya que ningún paciente tratado con palifermina necesitó soporte nutricional por vía parenteral y, sin embargo, 4/25 pacientes tratados con profilaxis convencional si recibió soporte nutricional por vía parenteral.
Se administró analgesia con opiáceos a casi la mitad de los pacientes tratados con palifermina, (5/11pacientes) y, en menor medida en el grupo tratado con profilaxis convencional (8/25 pacientes).
En cuanto a la incidencia de neutropenia febril, ésta fue mayor en el grupo control, 5/25 pacientes frente a 2/11 pacientes, ocurriendo lo contrario con la incidencia de sepsis, 3/22 pacientes frente a 3/11 pacientes en el grupo tratado con palifermina.
La tabla 3 muestra los resultados de la variable principal y las variables secundarias.
Resultados de la variable principal de estudio y de las variables secundarias
| Grupo prevención | Grupo prevención | |
| Variables | palifermina (n=11) | convencional (n=25) |
| Variable primaria | ||
| Duración MO de cualquier grado (días) | ||
| media±SD | 4,6±3,1* | 7,4±3,9* |
| mediana (mín-máx) | 5 (0–9) | 6 (0–18) |
| Variables secundarias | ||
| Incidencia global MO | 9/11 (82%) | 24/25 (96%) |
| Incidencia de MO por gravedad: | ||
| Incidencia grado 0 | 2/11 (18%) | 1/25 (4%) |
| Incidencia grado 1 | 5/11 (46%) | 8/25 (32%) |
| Incidencia grado 2 | 4/11 (36%) | 9/25 (36%) |
| Incidencia grado 3 | 0/11 (0%) | 4/25 (16%) |
| Incidencia grado 4 | 0/11 (0%) | 3/25 (12%) |
| Necesidad de NPT | 0/11 (0%) | 4/25 (16%) |
| Necesidad de tratamiento analgésico con opiáceos | 5/11 (45%) | 8/25 (32%) |
| Incidencia de neutropenia febril | 2/11 (18%) | 5/25 (20%) |
| Incidencia de sepsis | 3/11 (27%) | 3/25 (12%) |
MO: mucositis oral; NPT: nutrición parenteral total.
Seis pacientes presentaron diez efectos adversos secundarios a la administración de palifermina. Tres pacientes experimentaron aumento del grosor lingual e hipertrofia de mucosa bucal, 2 presentaron edema o eritema en la cara y zona perioral, 2 refirieron alteraciones del gusto y 2, toxicidad cutánea y uno toxicidad cutánea grave con exantema severo en cara y zona perioral. No obstante, el tratamiento con palifermina se completo en todos los pacientes.
DiscusiónLos datos disponibles hasta el momento respecto a la efectividad de los diferentes tratamientos empleados para prevenir y tratar la mucositis son heterogéneos y poco concluyentes8. Actualmente, diversas guías clínicas, incluyen entre sus recomendaciones, la profilaxis con palifermina para disminuir la incidencia y duración de la mucositis en pacientes con neoplasias hematológicas sometidos a TPH y tratamiento mieloablativo previo18–20, solo cuando este último incluye dosis altas de QT e irradiación corporal total 17, y recomendando el uso de crioterapia como profilaxis de la MO cuando el tratamiento mieloablativo es con melfalan a altas dosis19, como ocurre en un 56% (20/36) de los pacientes del presente estudio. No obstante, no se dispone de ensayos clínicos comparativos entre la crioterapia y la palifermina.
Spielberger R et al asocian la utilización de palifermina con una reducción en la duración de la mucositis7. Palifermina disminuyó la duración de la mucositis en 6 y 3 días para la mucositis y la mucositis grave, respectivamente. Sin embargo, ningún paciente tratado con palifermina experimento mucositis grave (grado 3 y 4), que son los más discapacitantes para el paciente, no obstante esto puede ser debido a la menor mucotoxicidad de los esquemas de acondicionamiento que no incluyen radioterapia.
La mucositis grave se ha asociado a dificultad en la deglución e incapacidad para ingerir alimentos por vía oral9. Por ello, la necesidad de instaurar nutrición parenteral para evitar desnutrición en estos pacientes puede ser utilizado como variable secundaria de efectividad de la palifermina. Es evidente, que para la correcta evaluación de esta variable sería necesario tener en cuenta la necesidad de soporte nutricional debido a otras causas frecuentes, tales como toxicidad gastrointestinal y estados de malnutrición previa, asÍ como las diferencias de criterio médico en cuanto al inicio de ésta.
En cuanto a la necesidad de analgesia opioide, los resultados no son favorables al tratamiento con palifermina, sugiriendo que pese a que se descartó la necesidad de analgesia por otras causas, el hecho de coexistir en seis de los pacientes mucositis grados 1 y 2 con otros efectos adversos derivados del mecanismo de acción de la palifermina que afectan en parte a la piel y el epitelio oral15,16 puede ser una variable de confusión importante, tanto para la clasificación de la mucositis como para la indicación de tratamiento analgésico con opiáceos. No obstante, para evidenciar la relación entre la necesidad de tratamiento con opiáceos y la gravedad de la mucositis habría sido necesario considerar la dosis total acumulada y la duración del tratamiento5.
A diferencia del ensayo llevado a cabo por Spielberger y col7, no se ha tenido en cuenta la variable días de estancia hospitalaria post-transplante, ya que ésta, es una variable cuyos resultados pueden conducir a conclusiones erróneas, puesto que puede estar afectada por diversos factores, como complicaciones asociadas al estado de mielosupresión del paciente, toxicidad derivada de la intensificación del tratamiento quimioterápico para el acondicionamiento pre-transplante, tales como toxicidad hepática, toxicidad renal, etc.
Los resultados de este estudio contrastan con los presentados recientemente por Romero et al20, donde la utilización de palifermina no reduce la incidencia de mucositis grado 3–4, aunque si se aprecia una tendencia a disminuir la incidencia global de mucositis. Este estudio, al igual que el nuestro, presenta un tamaño muestral muy reducido que limita la precisión y potencia estadística de los resultados encontrados. Aunque el número de pacientes incluidos en el estudio fue superior a la estimación previa realizada del tamaño muestral, este cálculo se hizo utilizando como variable de efectividad la duración media de la mucositis severa, la cual no apareció en ningún paciente del grupo tratado con palifermina. Utilizando como variable de efectividad la duración de la mucositis, la potencia obtenida sería del 57%, inferior al 80% deseable en este tipo de estudios.
No obstante, entre las limitaciones importantes del estudio, está la diferente utilización de esquemas de acondicionamiento y su grado de influencia en la aparición mucositis, ya que esto podría ser una fuente de confusión a la hora de evaluar los resultados, y la recogida retrospectiva de los datos empleados en el análisis, que impiden o dificultan la comprobación de los mismos. Además la percepción de la mucositis puede diferir entre el paciente y el médico, ya que las herramientas (escalas) de evaluación se basan únicamente en la observación y evaluación de la gravedad de la situación clínica sin tener en cuenta la perspectiva del paciente, para los que la mucositis, incluso en sus manifestaciones más leves es una complicación grave, esto puede conducir a un tratamiento inadecuado de los síntomas y a conclusiones inexactas acerca de la efetividad del tratamiento utilizado. Por lo que el uso de instrumentos basados en la autoevaluación de paciente en relación con las escalas clínicas sería de gran ayuda para la determinación de la gravedad de la mucositis de una manera más precisa9.
En conclusión, el tratamiento profiláctico con palifermina permite reducir la duración de la MO en pacientes con neoplasias hematológicas sometidos a tratamiento mieloablativo con altas dosis de QT que precisen tratamiento con células madre autólogas hematopoyéticas. No obstante, el elevado coste de la palifermina y los resultados de efectividad publicados, hacen aconsejable la realización de estudios con un tamaño muestral mayor para poder establecer el impacto de la palifermina sobre otras variables, tales como la incidencia de la mucositis, sepsis, neutropenia febril, así como estudios farmacoeconómicos21,22 que faciliten el proceso de toma de decisión para la selección de una profilaxis eficiente de la mucositis derivada de los esquemas mielotóxicos utilizados en nuestra práctica clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.