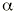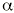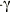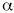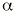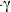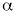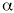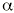REVISION
DIABETES MELLITUS NO INSULINODEPENDIENTE: FÁRMACOS ANTIDIABÉTICOS ACTUALES Y NUEVAS PERSPECTIVAS TERAPÉUTICAS
Martínez Bernabé, E. M.,Licenciada en Farmacia, Especialista en Farmacia Hospitalaria;Pellicer Jacomet, M. A.,Licenciada en Farmacia, Residente III;Pons Busom, M.,Licenciada en Farmacia, Especialista en Farmacia Hospitalaria, Farmacéutica Adjunta;Aguas Compaired, M., Licenciada en Farmacia, Especialista en Farmacia Hospitalaria, Jefe de Sección;Eguileor Partearroyo, B., Licenciada en Farmacia, Especialista en Farmacia Hospitalaria, Director del Servicio de Farmacia.
Servicio de Farmacia. Hospital Sagrat Cor. Barcelona.
Correspondencia: Eva M.a Martínez Bernabé. Servicio de Farmacia. Hospital Sagrat Cor. Viladomat, 288. 08029 Barcelona.
Fecha de recepción: 10-2-99
Palabras clave:
Antidiabéticos orales. Diabetes mellitus no insulinodependiente. Miglitol. Pramlintida. 4-hidroxileucina. Repaglinida. Troglitazona.
Resumen:
El tratamiento farmacológico actual de la diabetes mellitus no insulinodependiente consiste en estimular la secreción de insulina (sulfonilureas), disminuir la resistencia a la insulina (biguanidas), reducir la absorción de carbohidratos (acarbosa, miglitol y goma guar) y administrar insulina exógena. Este tratamiento no siempre es eficaz, por ello persiste el desarrollo de nuevos agentes y nuevas líneas terapéuticas.
Entre los nuevos agentes que estimulan la secreción de insulina destacan la repaglinida, la 4-hidroxileucina y el glucagon like peptide-1. Las tiazolidindionas, los compuestos de vanadio y el factor de necrosis tumoral disminuyen la resistencia a la insulina. La pramlintida actúa disminuyendo la absorción de carbohidratos.
Entre las nuevas líneas terapéuticas destacan los antagonistas del glucagón, los agentes hipolipemiantes, los inhibidores de la gluconeogénesis, los fármacos anorexígenos, los ß3-agonistas y los antagonistas del neuropéptido Y.
Algunos de estos fármacos se encuentran en fase de investigación, mientras otros ya han sido comercializados en algunos países.
NON-INSULIN-DEPENDENT DIABETES MELLITUS: CURRENT ANTIDIABETIC MEDICATIONS AND NEW THERAPEUTIC PERSPECTIVES
Key words:
Oral antidiabetics. Non-insulin-dependent diabetes mellitus. Miglitol. Pramlintide. 4-hydroxyleucine. Repaglinide. Troglitazone.
Summary:
The current drug treatment of non-insulin-dependent diabetes mellitus consistes of stimulating insulin secretion (sulfonylureas), reducing insulin resistance (biguanides), reducing carbohydrate absorption (acarbose, miglitol and guar gum), and administering exogenous insulin. This treatment is not always effective, so new agents and therapeutic lines are always under development.
Among the new agents that stimulate insulin secretion can be highlighted repaglinide, 4-hydroxyleucine, and glucagon-like peptide-1. The thiazolidinediones, vanadium compounds, and tumoral necrosis factor reduce resistance to insulin. Pramlintide acts by reducing carbohydrate absorption.
Among the new therapeutic lines can be emphasized glucagon antagonists, lipid-lowering agents, inhibitors of gluconeogenesis, anorexigenic drugs, ß3-agonists and Y neuropeptide antagonists.
Some of these medications are in the research phase, while others are already being marketed in some countries.
INTRODUCCIÓN
La diabetes mellitus tipo 2, conocida como diabetes mellitus no insulinodependiente (DMNID), consiste en una alteración en la regulación de la glucemia, en cuya aparición intervienen factores genéticos y ambientales. El inicio de la enfermedad suele ir precedido por un largo período de intolerancia a la glucosa, un estado metabólico reversible en el cual incrementa la aparición de complicaciones vasculares debido a laa situación de hiperosmolaridad que comporta la hiperglucemia. Por ello en el momento del diagnóstico una cuarta parte de los pacientes han desarrollado ya complicaciones a largo plazo que afectan a los ojos, riñones, sistema nervioso y vasos sanguíneos (1, 2).
En los pacientes con DMNID la hiperglucemia es el resultado de dos defectos fisiológicos: anomalías en la secreción de insulina y resistencia a la insulina en los tejidos efectores. El tratamiento debe ir encaminado a revertir la disfunción de las células beta pancreáticas y la resistencia a la insulina, a la vez que debe prevenir, retrasar o revertir las complicaciones a largo plazo (1). Los fármacos representan una parte del tratamiento de la DMNID; otras estrategias como la educación del paciente, la modificación de la dieta y la promoción del ejercicio físico son fundamentales en el control de esta enfermedad (3).
FARMACOS ANTIDIABÉTICOS ACTUALES
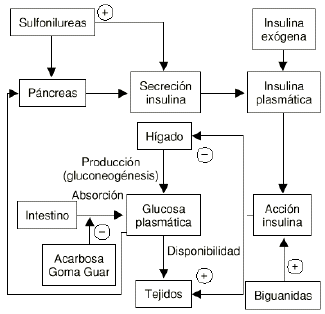
Los fármacos comercializados en la actualidad pueden ser agrupados según su modo de actuación: estímulo de la secreción de insulina, disminución de la resistencia a la insulina, disminución de la absorción de carbohidratos y administración de insulina exógena (Fig. 1).
Figura 1.--Tratamiento convencional de la diabetes mellitus no insulinodependiente.
Estos fármacos pueden ser utilizados individualmente o combinarse con el fin de conseguir un control más adecuado de la glucemia (4).
Agentes que estimulan la secreción de insulina: sulfonilureas
Fueron los primeros fármacos utilizados en el tratamiento de la DMNID. Su mecanismo de acción consiste en incrementar la secreción de insulina, actuando sobre receptores específicos de la superficie de las células beta, siendo las de segunda generación (glibenclamida, glipizida, gliclazida, gliquidona y glimepirida) más potentes que las de primera (tolbutamida y clorpropamida). Estudios recientes han sugerido también efectos extrapancreáticos de las sulfonilureas relacionados con su eficacia antidiabética (3, 5, 6).
En cuanto a la farmacocinética, las sulfonilureas se absorben muy bien por vía oral, se fijan fuertemente a proteínas y se metabolizan en porción variable dando lugar en algunos casos a metabolitos activos. La eliminación renal es muy variada, pero en general la insuficiencia renal prolonga e incrementa la acción hipoglucemiante. La gliquidona, sin embargo, se elimina de manera casi exclusiva por la bilis, por lo que es de utilidad en pacientes con insuficiencia renal (7).
La reacción adversa más frecuente es la hipoglucemia, por lo que es conveniente tomar el fármaco con alimento. También cabe destacar el aumento de peso debido a la hiperinsulinemia y al efecto anabolizante que la insulina produce (8).
Las sulfonilureas de semivida larga como la glibenclamida y la clorpropamida se asocian a un mayor riesgo de hipoglucemia, mientras que la tolbutamida, la gliquidona y la gliclalizida al tener una semivida más corta presentan un menor riesgo de hipoglucemia (9). La glimepirida es una nueva sulfonilurea que tiene una mayor potencia y presenta la ventaja de poder administrarse una vez al día debido a que se une a una subunidad distinta del receptor de la sulfonilureas, uniéndose y liberándose de esta subunidad a una velocidad superior a la del resto de las sulfonilureas. El menor tiempo de fijación de glimepirida al receptor se traduce en una menor cantidad de insulina liberada. Su mayor potencia también puede estar relacionada con una acción extrapancreática más prolongada (6).
Son, en general, una buena elección como terapia farmacológica de primera línea porque gran parte de los pacientes con DMNID son insulinodeficientes, exceptuando los pacientes obesos en los que el tratamiento con sulfonilureas agravaría la situación de sobrepeso (3). En los pacientes con insuficiencia renal o hepática, así como en el anciano, las sulfonilureas de semivida larga como la glibenclamida deben ser evitadas por el mayor riesgo de producir hipoglucemia (10).
Agentes que disminuyen la resistencia a la insulina: biguanidas
La acción hipoglucemiante de las biguanidas, como la metformina y la buformina, se atribuye a que actúan disminuyendo la gluconeogénesis hepática con la consecuente disminución de la liberación de glucosa y a que potencian la utilización de glucosa por los tejidos. Incrementan la glucólisis anaeróbica, potenciando la formación de ácido láctico (8). También incrementan la utilización intestinal de glucosa y disminuyen la degradación de los ácidos grasos. Se han descrito acciones a nivel celular para la metformina, especialmente un incremento en el número de los trasportadores para la glucosa del tipo GLUT4, que permiten el transporte de la glucosa al interior de las células del tejido muscular y adiposo. Pueden aumentar la sensibilidad a la insulina y con ello reducir la hiperinsulinemia (3).
Se absorben bien por vía oral, no se fijan a las proteínas plasmáticas y no sufren biotransformación, eliminándose casi por completo por la orina de forma activa, por lo que están contraindicadas en pacientes con insuficiencia renal (5).
Los efectos secundarios son principalmente de tipo gastrointestinal, raramente incluyen la hipoglucemia. La acidosis láctica es el efecto secundario potencial más grave de las biguanidas; sin embargo, en la metformina es poco frecuente, a diferencia de otras biguanidas como la fenformina, que fue retirada del mercado debido a esta complicación (1, 8). Las biguanidas no producen aumento de peso, por ello son el antidiabético de elección en pacientes obesos (7).
La biguanida usada clínicamente a escala internacional es la metformina (8). La buformina sólo está comercializada en España y en Suiza (11).
Agentes que disminuyen la absorción de carbohidratos
Acarbosa
Actúa inhibiendo de manera competitiva y dosis dependiente las
-glucosidasas intestinales, enzimas que en el intestino delgado tienen la función de hidrolizar carbohidratos complejos dando lugar a monosacáridos absorbibles. También actúa inhibiendo la amilasa pancreática (enzima que interviene en la digestión de polisacáridos) y disminuyendo la velocidad de vaciado gástrico. La presencia de polisacáridos no digeridos en el intestino delgado da lugar a una situación de hiperosmolaridad que estimula la motilidad intestinal. Como consecuencia se reduce el tiempo de contacto entre la mucosa y el alimento, lo que disminuye la absorción (12). En definitiva se obtiene una disminución de los niveles de glucosa postprandial y consecuentemente una disminución de los niveles de insulina en los pacientes capaces de segregarla.Puesto que no se absorbe en el tracto gastrointestinal, no tiene efectos adversos sistémicos. Localmente puede provocar intolerancia digestiva como flatulencias, diarreas y dolor abdominal, debido a su efecto osmótico y a la fermentación bacteriana en el intestino distal de los carbohidratos no digeridos. Por ello conviene iniciar el tratamiento a dosis bajas e incrementarlas paulatinamente. Se elimina con las heces (1, 5).
Se utiliza asociada a sulfonilureas o biguanidas, o bien como coadyuvante al tratamiento no farmacológico, como la dieta y el ejercicio (13).
Derivados de 1-desoxijirimicina: miglitol
Actúa de manera similar a la acarbosa sobre las
-glucosidasas intestinales, pero a diferencia de éstas se absorbe completamente. Sin embargo, no se han demostrado efectos sistémicos. Se administra vía oral. Se elimina por la orina sin metabolizar, por lo que no se recomienda su utilización en pacientes con insuficiencia renal. Los efectos secundarios son de tipo gastrointestinal: flatulencia, diarrea, dolor abdominal y náuseas. Parece ser que reduce los niveles de glucosa postprandial, independientemente del contenido de glucosa en el alimento. No se ha descubierto aún ninguna ventaja respecto a la acarbosa (3, 14, 15). Está contraindicado en pacientes con cetoacidosis diabética o con trastornos intestinales, tales como enteropatía inflamatoria, ulceración colónica u obstrucción intestinal (10).Goma Guar
Fibra soluble no absorbible que disminuye los niveles de glucosa postprandial y los niveles de insulina en personas sanas y en pacientes diabéticos capaces de segregarla. Posibles mecanismos de acción incluyen retraso en el vaciado gástrico, disminución de la motilidad intestinal y disminución de la absorción de los glúcidos, contenidos en la dieta debido a un incremento de la viscosidad del tracto gastrointestinal o bien a la inhibición de las hormonas gastrointestinales. Sin embargo, en los pacientes con DMNID no está claro que mejore el control de la glucemia y debe utilizarse asociada a otros fármacos o como adyuvante al tratamiento no farmacológico (8).
Las reacciones adversas son leves y de carácter transitorio al iniciar el tratamiento. Incluyen flatulencia, diarrea y náuseas (8, 11).
Insulina exógena
La utilización de insulina exógena en el tratamiento de la DMNID está en controversia. Puede ser utilizada como alternativa a los antidiabéticos orales cuando la dieta no ha resultado efectiva, como tratamiento de rescate tras el fracaso del tratamiento oral o bien cuando éste está contraindicado o es temporalmente ineficaz (1, 3). Sin embargo, durante el embarazo la insulina es el tratamiento de elección y las pacientes tratadas con antidiabéticos orales deberán pasar a tratarse con insulina (10).
NUEVAS PERSPECTIVAS EN EL TRATAMIENTO DE LA DMNID
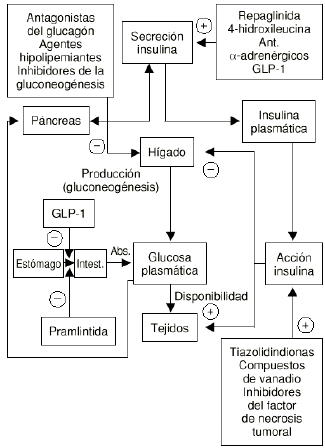
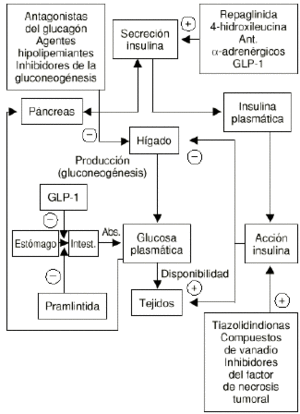
En ocasiones, y a pesar de la variedad de fármacos existentes para el tratamiento de la DMNID, la restauración de la normoglucemia no es efectiva o fracasa con el tiempo. Por ello persiste el desarrollo de nuevos agentes y de nuevas líneas terapéuticas con el fin de encontrar el tratamiento ideal de esta enfermedad (Fig. 2).
Figura 2.--Nuevas perspectivas terapéuticas de la diabetes mellitus no insulinodependiente.
Agentes que estimulan la secreción de insulina
Agentes insulinotropos no sulfonilureas
-- La repaglinida (NN-623) es un agente hipoglucemiante perteneciente a la familia de la meglitinida que regula la secreción de insulina actuando sobre el receptor de las sulfonilureas, pero en diferente lugar. Se absorbe bien por vía oral, se elimina por vía biliar y no se conocen metabolitos activos. Sería de utilidad en pacientes con deterioro de la función renal. Como efectos adversos cabe destacar la hipoglucemia y molestias gastrointestinales como náuseas, vómitos, diarrea, constipación y dispepsia. Puede utilizarse en monoterapia o bien asociada a la metformina (3, 4, 13, 16, 17). Está comercializada en algunos países como Estados Unidos y Gran Bretaña (18).
-- La 4-hidroxileucina es un aminoácido que se extrae y se purifica a partir de las semillas de plantas de la especie Trigonella. No se encuentra en mamíferos. En los estudios realizados in vitro sobre páncreas aislados de roedores, se ha visto que potencia la secreción de insulina únicamente si los niveles de glucosa están por encima de la normalidad, actuando de manera selectiva sobre las células ß-pancreáticas y sin interaccionar con otros agonistas de la secreción de insulina. Parece carecer de toxicidad. Por estos motivos 4-hidroxileucina debe ser considerado un agente potencialmente útil para el desarrollo de una nueva estrategia en el tratamiento de la DMNID.
Antagonistas *-adrenérgicos: idazoxan y MK-912
La secreción de insulina es inhibida por la adrenalina debido a un efecto mediado por los receptores *2-adrenérgicos de las células ß-pancreáticas, por tanto la administración de antagonistas
2-adrenérgicos en pacientes con DMIND aumentaría la secreción de insulina inducida por glucosa. Sin embargo, la capacidad que tienen estos compuestos de incrementar la presión arterial, además de competir con las sulfonilureas por su diana de actuación, ha disminuido el interés por los 2-antagonistas en el tratamiento de la DMNID (3, 4, 17).Glucagon like peptide-1 (GLP-1)
Es una hormona que proviene del gen proglucagón en mamíferos. La transcripción de este gen da lugar a una transcrito de RNA que se traduce y expresa de distinto modo en el intestino, páncreas y cerebro, dando lugar a tres polipéptidos: el glucagón, y dos glucagon like peptides (GLP-1 y GLP-2).
El GLP-1 se secreta en el intestino tras la ingesta e inhibe la velocidad de vaciado gástrico. En el páncreas actúa sobre las células ß potenciando la secreción de insulina inducida por glucosa e inhibe la secreción de glucagón, actuando directamente sobre las células A e indirectamente aumentando la secreción de somatostatina e insulina. En el cerebro actúa como inhibidor de la ingesta. También puede regular la síntesis de glucógeno en el tejido adiposo y en el músculo, aunque el mecanismo de estas acciones periféricas no está claro. Como consecuencia de todas estas acciones reduce la hiperglucemia postprandial en pacientes diabéticos (insulinodependientes o no) sin potenciar el riesgo de hipoglucemia como las sulfonilureas. Los inconvenientes son su corta duración de acción debido a la digestión enzimática y la administración parenteral. Posibles estrategias para mejorar su administración serían preparaciones de absorción retardada vía parenteral, la administración transdérmica o transepitelial y, finalmente, el desarrollo de agonistas para el receptor de GLP-1 por vía oral. Actualmente está en fase de ensayo clínico (3, 4, 17, 19).
El GLP-2 no tiene utilidad en el tratamiento de la diabetes. Parece tener actividad en la regeneración de la mucosa intestinal en roedores, por lo que sería de utilidad en el tratamiento de las afecciones de la mucosa intestinal (19).
Agentes que disminuyen la resistencia a la insulina
Tiazolidindionas
También conocidas como glitazonas (20). Son una nueva clase de compuestos que potencian la acción de la insulina, promueven la utilización de la glucosa por los tejidos periféricos y suprimen la gluconeogénesis hepática. Actúan como agonistas de uno de los subtipos del receptor nuclear del proliferador activado de los peroxisomas, (PPAR)-
. Este receptor es un factor de transcripción que potencia la expresión de enzimas que participan en el metabolismo de los ácidos grasos y la glucosa. En humanos abunda en el tejido adiposo, músculo e intestino grueso. Actúan también sobre los genes implicados en el metabolismo de los lípidos y pueden reducir ligeramente la presión arterial (21, 22).La troglitazona es el único agente comercializado actualmente de este grupo, concretamente en Estados Unidos y Japón, aunque existen otros análogos en fase de desarrollo (3).
Se absorbe rápidamente vía oral, preferentemente con las comidas. Se une a las proteínas en un 99%. Se metaboliza en el hígado, dando lugar a un metabolito activo. Se excreta mayoritariamente por las heces y en menor parte por la orina (3%).
Los efectos adversos suelen ser de tipo gastrointestinal (vómitos, náuseas y diarreas). La troglitazona parece tener cierta propensión a causar disfunción hepática que en alguna ocasión ha resultado fatal. Esta reacción ya se evidenció en algún ensayo clínico (22-24). En la fase postcomercialización del fármaco (en Estados Unidos y en Japón en marzo de 1997 y en Gran Bretaña en octubre de 1997) se han hallado varios casos de disfunción hepática reversible asociada a troglitazona, que ocasionalmente ha conducido a la necesidad de trasplante hepático e incluso a la muerte (25-28).
La reacción idiosincrática a la troglitazona tiene un mecanismo de acción desconocido. Puede ser debido a una reacción de hipersensibilidad a un metabolito o bien a su semejanza estructural con la vitamina E, que le confiere la capacidad de participar en reacciones de óxido-reducción, adquiriendo propiedades prooxidantes perjudiciales (28).
En Gran Bretaña, la Agencia de Control de Medicamentos junto con el laboratorio comercial decidieron retirarlo del mercado a finales de 1997 (29). En Estados Unidos, la FDA decidió no retirarla, ya que si se monitorizaba la función hepática del paciente los beneficios del tratamiento superaban a los riesgos (26, 27).
Compuestos de vanadio
Las propiedades insulinomiméticas de los compuestos de vanadio han sido bien documentadas in vitro e in vivo en animales de experimentación. El mecanismo de acción consiste en estimular la recaptación de glucosa, la síntesis de glucógeno a partir de la glucosa sanguínea y la oxidación de glucosa en las células de tejido adiposo y muscular. También disminuyen el apetito y la absorción de hidratos de carbono. Se administra por vía oral.
Los efectos secundarios son de tipo gastrointestinal generalmente al inicio del tratamiento, desapareciendo posteriormente.
Su utilización en el tratamiento de la diabetes en humanos se ha sugerido, pero no existen estudios por el momento. Es necesario un mayor conocimiento de los posibles efectos adversos en animales antes de considerar su potencial utilidad como agente terapéutico en la diabetes (3, 8, 30-32).
Inhibidores del factor de necrosis tumoral (TNF-
)Parece ser que la superproducción del factor de necrosis tumoral (TNF-
) por parte del tejido adiposo empeora el efecto de la insulina en el músculo esquelético en animales y humanos. Se ha comprobado en ratas que la neutralización del TNF-mediante un receptor de tipo inmunoglobulina G mejora la sensibilidad a la insulina y reduce los niveles plasmáticos de insulina, glucosa y ácidos grasos libres (1, 3).Agentes que actúan disminuyendo la absorción de carbohidratos
Análogos de amilina: pramlintida
La amilina es un polipéptido sintetizado y secretado por las células ß-pancreáticas junto con la insulina. Tiene numerosos efectos metabólicos. La pramlintida es un análogo sintético de la amilina que se encuentra en fase de estudio. Su efecto hipoglucemiante consiste en disminuir la velocidad de vaciado gástrico. Además reduce la liberación de glucagón inducida por la ingesta.
Los efectos secundarios son de tipo gastrointestinal. Se administra por vía parenteral en tres dosis al día, por lo que no es probable que exista una buena aceptación para el tratamiento de los pacientes con DMNID y son necesarios más ensayos clínicos (3, 33).
Otras perspectivas terapéuticas
Antagonistas del glucagón
En la diabetes existen niveles de glucagón elevados que contribuyen a la hiperglucemia estimulando la producción hepática de glucosa. El bloqueo de la síntesis y liberación de glucagón, así como el bloqueo del receptor en las células diana mediante un antagonista, podría ser una alternativa a añadir al tratamiento de la DMNID (3).
Agentes hipolipemiantes
La mayoría de pacientes con DMNID son obesos, tienen niveles elevados de ácidos grasos libres, lo cual contribuye a empeorar la hiperglucemia aumentando la disponibilidad de glucosa y potenciando la gluconeogénesis hepática. Interferir en el metabolismo de los lípidos, especialmente en la producción y/o oxidación de ácidos grasos, puede mejorar el control de los pacientes con DMNID (1, 3).
Disminución de la producción de ácidos grasos
La disminución de la concentración de los ácidos grasos libres con agentes hipolipemiantes como el ácido nicotínico y derivados, es eficaz a corto plazo, pero se ha descartado como terapia de mantenimiento debido a que se produce un aumento de los niveles de ácidos grasos libres por efecto rebote, lo cual conduce a empeorar la hiperglucemia.
El acipimox es un análogo del ácido nicotínico con una duración de acción más larga que inhibe la lipólisis y reduce los niveles de ácidos grasos libres, glicerol, triglicéridos y colesterol. La inhibición crónica de la lipólisis con acipimox se asocia a un incremento de la oxidación de la glucosa y una disminución de la gluconeogénesis sin tanto riesgo de producir efecto rebote. A pesar de que parece tener algún efecto en mejorar la sensibilidad a la insulina, su papel en el tratamiento de la DMNID consiste en mejorar la dislipidemia en personas con intolerancia a la glucosa (1, 3, 17).
Inhibidores de la oxidación de ácidos grasos
El desarrollo de inhibidores de la oxidación de ácidos grasos como el etomoxir ha sido descartado para el uso en humanos por los efectos secundarios observados en roedores, como, por ejemplo, hipertrofia cardíaca (1).
Inhibidores de la gluconeogénesis
La inhibición de la gluconeogénesis se puede realizar bien mediante inhibición de la piruvato carboxilasa o bien disminuyendo la disponibilidad de substratos gluconeogénicos.
Inhibición de la piruvato carboxilasa
La inhibición directa de esta enzima debe descartarse debido a que tiene actividad dual, participando también en el ciclo del ácido cítrico. Los inhibidores indirectos de la piruvato carboxilasa, como los secuestradores del acetil-CoA, han dado resultados prometedores en estudios con animales.
Limitación de substratos disponibles para la gluconeogénesis
Esta opción ha sido probada usando derivados del ácido acético y otros ácidos carboxílicos. Por ejemplo, el ácido dicloroacético (DCA) vía oral reduce los niveles plasmáticos de lactato y alanina (substratos para la gluconeogénesis) y los niveles de lípidos. Los efectos se mantienen tras unas semanas de suspender el tratamiento con DCA. Sin embargo, los estudios clínicos se suspendieron debido a la aparición de neuropatía, secundaria a una depleción de tiamina producida por el tratamiento con DCA. La administración concomitante de DCA y tiamina reduce la frecuencia y la toxicidad de la neuropatía en ratas. Se han sintetizado derivados de DCA, potencialmente menos tóxicos y serán objeto de ensayos clínicos en la terapia antidiabética (1).
Agentes que inducen la pérdida de peso
Fármacos anorexígenos
La reducción de peso debe ser una prioridad en la prevención y tratamiento de la DMNID. Cuando la dieta y el ejercicio fracasan se debe considerar el tratamiento farmacológico. Agentes como el benfluorex y la fluoxetina por sus efectos serotoninérgicos actúan estimulando el centro de saciedad en el cerebro e incrementan la utilización de glucosa a nivel periférico mejorando la sensibilidad a la insulina. Sin embargo, con el tiempo se desarrolla la tolerancia a la pérdida de peso y al efecto hipoglucemiante y cuando se suprimen estos fármacos suele producirse una recuperación de peso. La fenfluramina, la dexflenfluramina son dos agentes pertenecientes a este grupo que se retiraron del mercado por producir valvulopatías (34, 35).
Aunque algunos podrían utilizarse como tratamiento de soporte en pacientes que no responden a la dieta ni al tratamiento con hipoglucemiantes orales, se necesitan más estudios que evalúen el beneficio a largo plazo y la seguridad de estos agentes en pacientes obesos con DMNID (3, 17).
Agonistas del receptor adrenérgico ß3
El receptor adrenérgico ß3 actúa como mediador de la lipólisis. Mutaciones en este receptor se asocian a resistencia a la insulina y al debut de la diabetes tipo 2. Algunos ensayos clínicos con algunos agonistas ß3, como BRL 35135 y BRL 26830A, han dado resultados interesantes. Mejoran la tolerancia a la glucosa, disminuyen la hiperinsulinemia y aumentan la sensibilidad a la insulina. Producen pérdida de peso en pacientes obesos. En los ensayos clínicos se ha evaluado la tolerancia a corto plazo y aparte de unos temblores transitorios debido a la reactividad cruzada con receptores ß2, los ß3 agonistas parecen ser bien tolerados. No obstante, esta reactividad cruzada debe ser considerada con precaución debido al riesgo de arritmias e infarto que tienen los pacientes con DMNID y que podría ser potenciado con estos agentes. Se han intentado desarrollar agentes sin actividad ß2, pero no está claro que sean clínicamente eficaces. Además, la eficacia y seguridad de los ß3 agonistas a largo plazo aún tiene que ser probada en los ensayos clínicos (1, 17).
Antagonistas del neuropéptido Y
El neuropéptido Y se encuentra en concentraciones elevadas en regiones del cerebro que participan en la regulación del balance nutricional. Es un potente estimulador del apetido y parece ser que reduce el gasto energético. Antagonistas del neuropéptido Y han sido desarrollados como agentes antiobesidad, aunque no se conoce ninguno que haya sido objeto de ensayo clínico. Además es posible que el neuropéptido Y actúe en otras partes del cerebro y también a nivel periférico, con lo que los antagonistas del neuropéptido Y pueden ocasionar efectos adversos inesperados (17).
CONCLUSIONES
En la actualidad hay varias líneas de investigación en agentes antidiabéticos. Alguna de estas líneas podrían ampliar en un futuro el arsenal terapéutico de una patología que todavía hoy y a pesar de la variedad de fármacos de que disponemos no siempre está controlada. Es posible que próximamente se comercialicen en España nuevos fármacos para el tratamiento de la diabetes mellitus no insulinodependiente, como, por ejemplo, la repaglinida y la troglitazona.
La repaglinida presenta la ventaja frente a las sulfonilureas de eliminarse por vía biliar, lo cual permite su utilización en pacientes con insuficiencia renal, que solamente podrían ser controlados a este nivel con gliquidona.
La troglitazona representa una alternativa interesante en pacientes con resistencia a la insulina. Sin embargo, debido a la posibilidad de producir toxicidad hepática deberá ser utilizada con precaución.
Del resto de fármacos cabe destacar que la pramlintida, debido a su administración parenteral, será probablemente poco aceptada en el tratamiento crónico de estos pacientes en una fase futura de comercialización.
Los agentes hipolipemiantes resultan de interés como tratamiento coadyuvante de esta enfermedad.
El resto de alternativas están aún en fase temprana de desarrollo y serán necesarios más estudios antes de que alguno de estos fármacos pueda ser utilizado en el tratamiento de la DMNID.
BIBLIOGRAFIA
1. Dagogo-Jack S, Santiago JV. Pathophysiology of type 2 diabetes and modes of action of therapeutics interventions. Arch Intern Med 1997;157:1802-17.
2. Sauvaire Y, et al. 4-hydroxyleucine. A novel aminoacid potentiator of insulin secretion. Diabetes 1998; 47:206-10.
3. Scheen AJ. Drug treatment of non-insulin-dependent diabetes mellitus in the 1990s. Achievements and future developments. Drugs 1997;54:355-68.
4. Tauber JP. Médicaments antidiabétiques oraux. La Revue du Practicien (Paris) 1999;49:46-50.
5. Bressler R, Johnson DG. Pharmacological regulation of blood glucose levels in non-insulin dependent diabetes mellitus. Arch Intern Med 1997;157:836-48.
6. Pallarés M, Ravella R, Herreras A, Gómez J, Cabanillas JJ. Glimepirida. Una nueva sulfonilurea. Farm Clín 1998;15:21-30.
7. Scheen AJ, Lefebvre P. Oral antidiabetic agents. A guide to selection. Drugs 1998;55:225-36.
8. Jennings PE. Oral antidiabetic agents. Drugs and aging; 1997;10:323-32.
9. Oral hypoglicemics. Copyright Micromedex Inc. 1974-1999. Healthcare Series. Vol. 100. Expires 6/99.
10. Descripción de nuevas especialidades: miglitol. Panorama Actual del Medicamento 1999;23:40.
11. Martindale. The Extra Pharmacopoeia, 31.a ed. Londres: Pharmaceutical Press; 1996. p. 349-51.
12. Ranganth L, Norris L, Morgan L, Wright J, Marks V. Delayed gastric emptying occurs following acarbose administration and is a further mechanism for its antihiperglycaemic effect. Diabet Med 1998;15:120-4.
13. Melander A. Oral antidiabetic drugs: an overview. Diabet Med 1996; 13(suppl 6):S143-7.
14. Miglitol. Copyright Micromedex Inc. 1974-1998. Healthcare Series. Vol. 97. Expires 9/98. Drugdex®. Drug evaluations.
15. Miglitol para la diabetes mellitus tipo II. Medical Letter 1999;XXI:62-3.
16. Repaglinida. Copyrigth Micromedex Inc. 1974-1998. Healthcare Series. Vol. 97. Expires 9/98. Drugdex®. Drug evaluations.
17. Rachman J, Turner RC. Drugs on the horizon for treatment of type 2 diabetes. Diabet Med 1995;12:467-78.
18. Martindale. Complet drug reference, 32.a ed. Londres: Pharmaceutical Press, 1999. p. 331.
19. Drucker DJ. Perspectives in diabetes: glucagon-like peptides. Diabetes 1998;47:159-69.
20. Petrie J, Small M, Connell J. Glitazones, a prospect for non-insulin-dependent diabetes. Lancet 1997; 349:70-1.
21. Flórez J, Armijo JA, Mediavilla A. Farmacología humana, 31.a ed. Barcelona: Salvat-Masson; 1997.
22. Imura H. A novel antidiabetic drug. Troglitazone. Reason for hope and concern. N Engl J Med 1998; 338:908-8.
23. Spencer CM, Markham A. Troglitazone. Drugs 1997; 54:89-101.
24. Troglitazone. Copyright Micromedex Inc. 1974-1998. Healthcare Series. Vol. 97. Expires 9/98. Drugdex®. Drug evaluations.
25. Watkins P, Whitcomb R. Hepatic disfunction associated with troglitazone. N Engl J Med 1998; 338: 916-7.
26. Gitlin N, et al. Two cases of severe clinical and histologic hepatotoxicity associated with troglitazone. Ann Intern Med 1998;129:36-8.
27. Nithingale S. From the Food and Drug Administration. JAMA 1997;278:1728.
28. Neuschwander Tetri BA, et al. Troglitazone induced hepatic failure leading to liver transplantation. A case report. Ann Intern Med 1998;129:38-41.
29. Wise J. Diabetes drug withdrawn after reports of hepatic events. BMJ 1997;315:1564.
30. Vanadium. Availability and clinical use. Copyright Micromedex Inc. 1974-1998. Healthcare Series. Vol. 97. Expires 12/98. Drugdex®. Drug consults.
31. Shechter Y. Insulin-mimetics effects of vanadate. Diabetes 1990;39:1-4.
32. Brichard SM, Ledererer J, Henquin JC. The insulin-like properties of vanadium: a curiosity or a perspective for the treatment of diabetes? Diabete Metab 1991;17:435-40.
33. Pramlintide. Copyright Micromedex Inc. 1974-1998. Healthcare Series. Vol. 97. Expires 12/98. Drugdex®. Drug evaluations.
34. Institut Català de Farmacologia. Retirada de los anorexígenos fenfluramina y dexfenfluramina. Butlletí Groc 1997;10:17-9.
35. Institut Català de Farmacologia. Es confirmen els riscos dels anorexígens fenfluramina i dexfenfluramina. Butlletí Groc 1998;11:21-2.