ORIGINALES
CONTAMINACIÓN DE NUTRICIONES ENTERALES EN PACIENTES CRITICOS. VALIDACION DEL PROCESO DE MANIPULACION1
Lalueza Broto, M.P.*, Licenciada en Farmacia. Adjunto.Rodríguez Garrido, V.**,Licenciada en Biología. Adjunto.Robles González, A.***,Licenciado en Medicina y cirugía. Adjunto.Fontán Caudevilla, C.***,A.T.S. Supervisora
1Trabajo presentado como comunicación tipo póster con el título: «Validación del proceso de manipulación de nutriciones enterales en una UCI. Estudio comparativo de dos técnicas». XIV Congreso de la Sociedad Española de Nutrición Parenteral y Enteral. Zaragoza, 1997.
*Servicio de Farmacia. **Servicio de Microbiología y Parasitología. ***Unidad de Cuidados Intensivos. Hospital Universitario de Traumatología y Rehabilitación. Hospitals Vall d''Hebron. Barcelona.
Correspondencia: M. Pilar Lalueza Broto. Servicio de Farmacia. Hospital de Traumatología y Rehabilitación Vall d''Hebron. Pg. de la Vall d''Hebron, 119-129 08035 Barcelona.
Fecha de recepción: 22-11-98
Palabras clave:
Contaminación. Nutrición enteral. Manipulación. Administración. Implicaciones clínicas. Manejo humano. Paciente crítico.
Resumen:
Existe un creciente interés en el tema de la contaminación de nutriciones enterales (NE) y sus posibles implicaciones clínicas.
Se realizó un estudio de contaminación de las NE en pacientes críticos neurotraumáticos con objeto de validar un nuevo método de manipulación/administración de las mismas. Los preparados comerciales se infundían directamente y las líneas de administración se renovaban cada 24 horas. Se tomaron muestras asépticamente en recipientes herméticos estériles a las 0 y 24 horas. Se realizó estudio cuantitativo aplicando criterios de contaminación regulados en el RD 2685/1976 obteniendo los resultados de contaminación de 0 % (0/15) a las 0 horas y de 56 % (14/25) a las 24 h. Los gérmenes más frecuentemente aislados pertenecían al grupo de enterobacteriáceas. Los resultados obtenidos orientan hacia una contaminación fundamentalmente exógena («manejo humano»).
Se cree necesario realizar intervenciones periódicas docentes sobre técnicas de manipulación, programas de control microbiológico, así como protocolos detallados del proceso de manipulación/administración de las NE con objeto de conseguir que la administración de la nutrición artificial sea eficaz y segura.
CONTAMINATION OF ENTERALPREPARATIONS IN CRITICALLY ILL PATIENTS. VALIDATION OF HANDLING PROCESS
Key words:
Contamination. Enteral nutrition. Manipulation. Administration. Clinical implications. Human handling. Critically ill patient.
Summary:
There is growing interest in the contamination of enteral feeding (EF) preparations and its possible clinical effects. We studied contamination of EF in critically ill patients with neurological injury in order to validate a new method of manipulation and administration. Commercial preparations were infused via central venous catheter, and feeding lines were replaced every 24 h. Samples were collected aseptically in sterile, air-tight containers at 0 and 24 h. Quantitative studies were designed in accordance with the contamination criteria regulated by Real Decreto 2685/1976. Contamination rates were 0 % (0/15) at 0 h and 56 % (14/25) at 24 h. The mos frequently isolated germs were members of the family Enterobacteriaceae. Our findings suggest a mainly exogenous source of contamination (human handling).
Periodic training should be offered in manipulation techniques, and microbiological control programs and detailed procedures for the handling and administration of EF should be aimed at ensuring the safe and effective administration of artificial feeding.
INTRODUCCION
Una buena parte de los pacientes ingresados en el hospital reciben soporte nutricional artificial y de ellos la mayoría recibe nutrición enteral (NE).
Así como las complicaciones infecciosas derivadas de la administración de la nutrición parenteral han sido ampliamente descritas y estudiadas, no ha ocurrido lo mismo en el caso de la NE. Además, desde la aparición en el mercado farmacéutico de dietas líquidas estériles «listas para su uso», el problema de la contaminación de las mismas ha sido subestimado y, por tanto, ignorado por la literatura médica. Por otro lado, las consecuencias clínicas derivadas de la infusión de dietas enterales contaminadas a pacientes críticos no han sido claramente establecidas, debido, entre otros motivos, a que la nutrición enteral se ha utilizado poco en el pasado en estos grupos de pacientes (recibían nutrición parenteral mayoritariamente). Últimamente, la NE es de primera elección en algunos de estos pacientes por lo que se han puesto al descubierto los problemas asociados a esta vía de administración.
Diversos autores han demostrado que la administración de dietas enterales contaminadas con microorganismos potencialmente patógenos pueden producir infecciones nosocomiales en pacientes críticos (inmunodeprimidos, desnutridos, pacientes ingresados en unidades de cuidados intensivos, etc.). Además estos pacientes reciben tratamientos que pueden incrementar o potenciar los riesgos secundarios a la administración de nutriciones enterales contaminadas (fármacos que elevan el pH del estómago, antibióticos de amplio espectro, fármacos que disminuyen la motilidad gastrointestinal (1-3). Se ha documentado el riesgo de microaspiraciones de contenido gástrico en pacientes que reciben NE y ello podría correlacionarse con un mayor riesgo de desarrollar neumonías en estos grupos de pacientes.
Los hallazgos clínicos derivados de la administración de NE contaminadas van desde cuadros infecciosos digestivos hasta afectaciones sitémicas como neumonías o incluso septicemia.
Casewell et al (2) describen un paciente que desarrolló una septicemia por Enterobacter cloacae, bacteria que se encontraba previamente en la nutrición, concluyendo que las nutriciones enterales pueden ser una fuente de infección en pacientes hospitalizados. Freedland et al (4) describen un paciente que presentó una septicemia por Serratia marcescens cuya dieta enteral había estado contaminada por este microorganismo. Jacobs et al (5) han demostrado que el 54 % de los pacientes ingresados en unidades de cuidados intensivos y que recibieron NE durante más de tres días desarrollaron neumonías y que la mayoría de éstas eran causadas por bacterias Gram() previamente existentes en el estómago.
También Casewell (6) introduce el concepto de reservorio fecal de determinados patógenos (incluso algunos podrían ser cepas multiresistentes) que podrían producir la diseminación de los mismos en pacientes susceptibles.
Además la contaminación de la dieta produce una disminución en sus características nutricionales que también podría ser considerado cuando la contaminación fuera muy elevada.
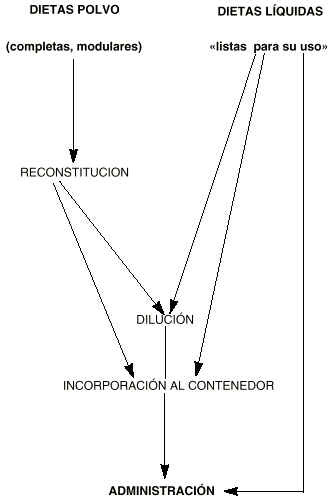
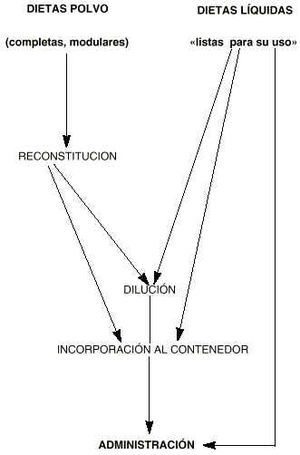
La contaminación de los preparados de NE puede tener un origen exógeno o incluso endógeno, como se ha postulado recientemente. La mayoría de veces los preparados comerciales deben ser manipulados por diversos motivos (reconstitución, dilución, incorporación al contenedor, etc.) por lo que se incrementan los riesgos de contaminación al aumentar el número de manipulaciones (fig. 1). También se utilizan diversos utensilios en la preparación de las mezclas nutrientes que pueden contribuir asimismo a aumentar el riesgo de contaminación (mezcladoras, abridores, tijeras, «manos»). Guenthner et al (7) encuentran bacilos Gram() en el 44 % de los cultivos de manos de personal de enfermería de UCI. Sanderson y Weissler comunican un nivel de contaminación similar en un Hospital de Traumatología, donde aproximadamente un 40 % de las manos de pacientes y enfermeras presentaban contaminación por coliformes (8).
Figura 1.--Proceso de posibles manipulaciones que pueden requerir los preparados de nutrición enteral según su presentación por la industria farmacéutica.
Asismismo se ha descrito la posibilidad de una contaminación endógena a partir de microorganismos presentes en el propio paciente, aunque este punto ha originado una gran discrepancia entre diversos autores.
Payne-James et al (9) han demostrado un movimiento retrógrado de los microorganismos desde el estómago al recipiente contendor de la nutrición enteral, especialmente si el equipo de administración carece de cámara de goteo.
Anderton (6) establece la posibilidad de contaminación del sistema de administración debido a las prácticas de aspiración a través de los equipos para comprobar la posición de las sondas y la existencia de residuo gástrico.
Sin embargo, Schereiner et al (10) llegan a la conclusión de que las bacterias no realizan un movimiento retrógrado desde el tracto gastrointestinal al recipiente contenedor.
El objetivo del presente trabajo es realizar un estudio de contaminación de las nutriciones enterales en pacientes críticos con objeto de validar un nuevo método de manipulación de las mismas, debido a la inexistencia de criterios estandarizados y aceptados universalmente sobre la preparación de NE. También se pretende establecer una comparación respecto a las técnicas anteriores de manipulación de nutriciones enterales establecidas en nuestra unidad.
MÉTODO
El estudio ha sido realizado en la Unidad de Cuidados Intensivos del Hospital de Traumatología y Rehabilitación del Hospital Vall d''Hebron. El hospital dispone de 10 camas de UCI donde ingresan pacientes traumáticos y neuroquirúrgicos.
Se les administró una nutrición enteral (NE) según el protocolo del servicio mediante perfusión continua con bomba volumétrica Abbott. Las nutriciones enterales correspondían a diferentes preparados comerciales y laboratorios pero todas ellas coincidían en el volumen (500 ml) y en el tamaño de la boca de la botella (cuello ancho), lo cual permite la adaptación directa de la línea de administración por sonda nasoentérica. La alimentación enteral se administró por vía nasogástrica mediante sonda de poliuretano (8F/12F). Los pacientes recibieron la NE en períodos de c/12 h, c/8 h o c/6 h según las características del mismo. Las líneas de administración se renovaron cada 24 horas.
Se tomaron muestras asépticamente en recipientes herméticos estériles a las 0 horas y a las 24 horas. Las muestras se transportaron al laboratorio de Microbiología inmediatamente, siendo procesadas a su recepción.
Metodología en trabajo anterior (11)
Se calculaba la cantidad de NE que debía recibir el paciente en ocho horas y se incorporaba el contenido de la misma a un recipiente contenedor (Flexitainer®). No se perfundía la alimentación durante períodos de tiempo superiores a ocho horas. Al cabo de 24 h se desechaba el recipiente contenedor y la línea de administración. El resto del proceso es similar al anteriormente descrito.
Respecto al estudio microbiológico se usaron técnicas y medios de cultivo habituales en microbiología alimentaria (siguiendo las recomendaciones del Centro Nacional de Alimentación y Nutrición CENAN).
La identificación de los microorganismos se realizó mediante los métodos habituales (sistema AMS-Vitek, API, etc.).
Se realizó el estudio cuantitativo aplicando criterios de contaminación regulados en el Real Decreo (RD) 2685/1976, de 16 de octubre (BOE 26/11/76), que aprueba la reglamentación técnico-sanitaria para la elaboración, circulación y comercio de preparados alimenticios para regímenes dietéticos y/o especiales, donde se regulan las normas microbiológicas para preparados alimenticios para regímenes dietéticos y/o especiales. Este RD establece una clasificación en cuatro grupos que son (tabla 1).
Tabla 1. Clasificación de las normas microbiológicas para preparados alimenticios para regímenes dietéticos y/o especiales por el RD | |||
| A | B | D | |
| Recuento colonias aerobias mesófilas (30(o)C) | máx 5´10(4)/g | máx 2´10(5)/g | máx 1´10(4)/g |
| Enterobacteriaceae Lact+ | ausencia/0,01 g | ausencia/0,1 g | ausencia/0,1 g |
| E. coli | ausencia/g | ausencia/0,1 g | ausencia/g |
| Salmonella | ausencia | ausencia | ausencia |
| Staphylococcus aureus | ausencia/0,1 g | ausencia/0,01 g | ausencia/0,1 |
| Mohos y levaduras | máx 300/g | más 1.000/g | máx 300/g |
| Grupo C:Productos sometidos a esterilización. | |||
| 1. Prueba de esterilidad: las muestras serán sometidas a pruebas de incubación. La mitad del lote de muestras a 30(o)C durante cuatro semanas y la otra mitad a 44(o)C durante 10 días. En este último caso, de no haber abombamiento, se someten las muestras de nuevo a 55(o)C durante 10 días. Las muestras, después de incubadas y enfriadas, no presentarán modificaciones en su labor y olor característicos. | |||
| 2. Estos productos habrán sufrido un tratamiento que garantice la inactivación de esporas de Clostridium botulinum. | |||
A. Productos que han de consumirse después de añadir un líquido.
B. Productos que deben cocerse antes del consumo.
C. Productos esterilizados y contenidos en envases herméticos.
D. Productos listos para su consumo, no comprendidos en A, B o C.
Las nutriciones enterales, tal como son proporcionadas por el laboratorio farmacéutico se incluirían en el apartado C pero una vez que éstas son abiertas y manipuladas e introducidas en los recipientes contenedores las incluimos en el apartado D.
No existe acuerdo internacional acerca de los límites aceptables de contaminación máxima que pueden presentar las nutriciones enterales. Diferentes sociedades de nutrición y autores han propuesto distintos niveles de contaminación máxima atendiendo a diversos criterios.
Pottecher (12) propone 104 unidades formadoras de colonias (ufc)/ml de nutrición enteral como cantidad suficiente para causar colonización del tracto gastrointestinal.
Kohn (13) propone como cantidad inaceptable de contaminación la de más de 105 ufc/ml de nutrición enteral.
La British Dietetic Association (B.D.A.) establece las recomendaciones de: NO patógenos y una contaminación inferior a 104 ufc/ml.
Fagerman (14) clasifica las NE en aceptables, calidad marginal, e inaceptables en función del nivel de contaminación al final de la administración del preparado. Si las muestras están en el nivel II y III deberían mejorarse las técnicas de manejo (tabla 2).
Tabla 2. Clasificación de NE en función del nivel de contaminación al final de la administración del preparado según Fagerman14 | |
| Contaminación | Calidad |
| <10(3)/ml | Aceptable |
| >=10(3)y <2 ´10(4)/ml | Calidad marginal |
| >2 ´10(4)/ml | Inaceptable |
RESULTADOS
Se cultivaron 15 muestras correspondientes a tiempo 0 horas y 25 muestras a las 24 horas que pertenecían a 13 pacientes diferentes.
De los 13 pacientes, cinco de ellos fallecieron, obteniéndose una mortalidad del 38 %.
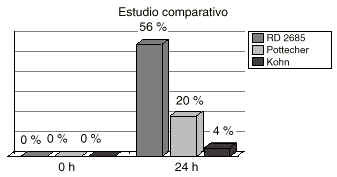
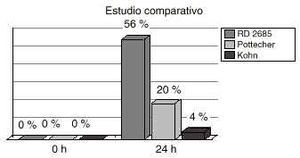
En la tabla 3 se recogen los resultados de contaminación correspondientes a esta fase del estudio aplicando los diversos criterios de contaminación descritos en el apartado de Método. Estos mismos resultados se presentan gráficamente en la figura 2. Los mismos indican que todas las muestras a tiempo 0 h presentan una ausencia total de contaminación. Sin embargo, a las 24 h encontramos un mayor o menor grado de contaminación según el criterio utilizado.
Figura 2.--Representación gráfica de la contaminación de las nutriciones enterales al cabo de 0 h y 24 h en función de los criterios de contaminación: RD 2685/1976, Pottecher y Kohn.
Tabla 3. Resultados de la contaminación de las nutriciones enterales al cabo de 0 h y 24 h aplicando el protocolo de manipulación y en función de los diferentes criterios de contaminación descritos en el apartado de Método (RD 2685/1976, Pottecher, British Dietetic Association (BDA), Fagerman y Kohn | |||||
Criterios de contaminación | |||||
| R. D. | Pottecher | B.D.A. | Fagerman | Kohn | |
| 0h | 0/15 (0%) | 0/15 (0%) | 0/15 (0%) | 100% aceptable | 0/15 (0%) |
| 24h | 14/25 (56%) | 5/25 (20%) | No aplicable | 13/25 (52%) aceptable | 1/25 (4%) |
| 9/25 (36%) cal. marginal | |||||
| 3/25 (12%) inaceptable | |||||
Aplicando la normativa española (más estricta) se obtiene el porcentaje de contaminación más elevado. Sin embargo, es importante recalcar que esta legislación no se adapta exactamente a las condiciones concretas de manipulación de nutriciones enterales para la cual no existe una normativa que la regule.
Según la clasificación de Fagerman, los resultados podrían considerarse bastante aceptables, con un nivel de inaceptables del 12 %. También hay que señalar que el porcentaje de muestras de calidad marginal es elevado (36 %).
De las 14 muestras contaminadas (según RD 2685/
1976), 11 de ellas presentaban contaminación por Enterobacterias (78 %).
Los microorganismos más frecuentemente aislados fueron: Enterobacter cloacae, Pseudomonas aeruginosa y Klebsiella pneumoniae.
En el estudio anterior el nivel de contaminación por enterobacterias fue del 83 % y los microorganismos aislados: Serratia marcescens, Klebsiella pneumoniae, Escherichia coli y Enterobacter spp.
DISCUSION
En personas sanas, la barrera física que constituye la mucosa intestinal previene la infección. El pH ácido del estómago y la motilidad intestinal permiten barrer las bacterias del tracto superior del intestino delgado. La renovación continua de la mucosa puede arrastrar toxinas y bacterias y así proteger la mucosa intacta del ataque enzimático y microbiano.
Sin embargo, el enfermo crítico que sufre una desnutrición presenta una producción de mucosa inferior a la normal. Estos pacientes pueden, además, estar recibiendo fármacos que inhiben la motilidad gástrica (anticolinérgicos, narcóticos, bloqueantes neuromusculares, etc.), con lo que se inhiben los mecanismos de defensa naturales y se puede producir una colonización por bacterias potencialmente patógenas.
Además, en estos grupos de pacientes pueden estar alterados los mecanismos de defensa inmunológicos, dando lugar a infecciones sistémicas cuyo origen sea el tracto gastrointestinal.
Por todo ello, los pacientes críticos presentan un mayor riesgo de sufrir complicaciones clínicas derivadas de la administración de nutriciones enterales contaminadas por microorganismos, especialmente aquellos potencialmente patógenos (Enterobacterias, Pseudomonas spp, Acinetobacter spp, etc.) (15).
Además, ciertos microoganismos y toxinas que ordinariamente no causan infecciones en personas sanas son capaces de producirlas en pacientes críticos (16).
Remington y Schimpff (17) postulan que la alimentación enteral puede ser una fuente de infección en pacientes hospitalizados y que el número de microorganismos que se requieren para infectar al paciente es inferior cuando el paciente está inmunodeprimido, granulopénico o toma antibióticos por vía oral.
Es importante conocer los diversos factores que inciden sobre el crecimiento microbiano con objeto de poder incidir sobre ellos. Los factores con mayor significación son: temperatura (los microorganismos con importancia clínica presentan un mayor crecimiento a 30-37 oC), composición y pH de la nutrición enteral, tiempo de administración, pH gástrico, concentración de glucosa, presencia de sorbatos/acetatos (inhiben el crecimiento de microorganismos), y sistema de administración de la NE (nutrición continua (pH elevado de manera persistente) versus nutrición intermitente (pH ácido en fase de ayuno) (18).
Entre los diversos métodos propuestos para reducir el crecimiento bacteriano se encuentra la acidificación de los preparados de NE.
Heyland et al (19) realizan un estudio en que acidifican la NE hasta un pH=3,5 consiguiendo una reducción en la colonización gástrica por bacterias Gram() patógenas.
En un estudio previo realizado por nuestro grupo (11) en que se valoraron diversas técnicas de administración que consistían en la administración de la NE mediante recipiente contenedor (ver Método), recomendábamos la no reutilización de los contenedores durante más de 24 horas al igual que otros autores (20).
Asimismo se demostró que el lavado con agua del grifo de los recipientes contenedores no eliminaba los microorganismos (11) incluso cuando se lavaba con jabón y se secaba (20). La microscopía electrónica ha detectado la existencia de irregularidades en la superficie interna del plástico dando lugar a la adherencia de determinados microorganismos como E. coli y Serratia marcescens (20, 21).
También se recomendaba que los tiempos de administración de las NE previamente manipuladas no superaran las ocho horas de perfusión en base tanto a los resultados hallados como a los acontecimientos sobre las curvas de crecimiento bacteriano.
El crecimiento bacteriano en un medio apropiado sigue una cinética exponencial. La fase de crecimiento exponencial va precedida de una fase Lag durante la cual se produce un incremento pequeño en el número total de bacterias. El período Lag obtenido en estudios experimentales oscila entre 3-6 horas a temperatura ambiente seguido por un incremento logarítmico en 2-10 horas. Teóricamente el número de microorganismos podría aumentar hasta la reutilización total del substrato pero en la práctica se produce una destrucción de la nutrición cuando la concentración supera 107 ufc/ml (22).
Teniendo en cuenta los datos de contaminación obtenidos (11) así como los factores que pueden producir la contaminación de las NE se elaboró un nuevo protocolo de manipulación y administración de NE que consistía básicamente en la administración directa del preparado de NE tal como viene presentado por la industria farmacéutica con objeto de reducir las manipulaciones y por tanto prevenir la contaminación (ver Método). Además, este nuevo sistema supone un ahorro económico considerable al eliminar el recipiente contenedor.
Los resultados obtenidos en el presente estudio son sorprendentes ya que los niveles de contaminación fueron similares a los hallados en el trabajo anterior (56 % versus 43 %, aplicando criterios de contaminación del RD 2685/1976) y por tanto superiores a los esperados.
Constatamos que con el método actual de administración se han reducido las muestras fuertemente contaminadas. Aplicando el criterio de Kohn (>105 ufc/ml), los resultados son claramente significativos a favor del protocolo de trabajo actual (4 % versus 21 %). Se obtiene la misma conclusión si interpretamos los resultados aplicando el criterio de Fagerman (tabla 4) detectando una menor proporción de muestras inaceptables en relación con el trabajo anterior.
Tabla 4. Resultados comparativos de contaminación entre el estudio actual y el estudio anterior descrito en Método (con diferente protocolo de manipulación/administración) aplicando el criterio de Fagerman | ||||
| 0 h | 24 h | |||
| Estudio anterior | Estudio actual | Estudio anterior | Estudio actual | |
| Aceptable | 93%(13/14) | 100% (15/15) | 57% (8/14) | 52% (13/25) |
| Calidad marginal | 7%(1/14) | | 21% (3/14) | 36% (9/25) |
| Inaceptable | | | 21% (3/14) | 12% (3/25) |
Teniendo en cuenta los resultados obtenidos, coincidimos con otros autores (6, 23) en considerar el manejo humano como máximo responsable de la contaminación de las NE. Además, el número de muestras contaminadas se encontraba relacionado con un mayor nivel de ocupación de la UCI y con la gravedad de los pacientes ingresados en la unidad. Por ello creemos necesario realizar intervenciones periódicas docentes sobre técnicas de manipulación/administración asépticas.
Se demuestra que aunque se disminuya la manipulación de los preparados de NE, ésta sigue siendo un factor fundamental en la contaminación y deben extremarse las condiciones de manipulación y las técnicas de asepsia, todo lo cual debería estar estrictamente detallado en los protocolos de administración de las NE.
En un estudio realizado por Anderton (24) con NE domiciliaria obtiene niveles de contaminación elevados (82 % (18/22) con valores de 101 106 ufc/ml) y gérmenes similares a los hallados en el hospital (E. cloacae, E. agglomerans, S. aureus, K. pneumoniae, E. faecalis) sugiriendo prácticas de manejo y preparación poco asépticas. Estos resultados enfatizan la necesidad de establecer protocolos de manipulación de las NE incluso en el ambiente domiciliario.
En cuanto a los gérmenes aislados, tanto en el estudio anterior como en el actual coincidimos con los hallados por Freedland (4) que postula una mayor contaminación por bacilos Gram() en unidades de cuidados intensivos.
Se revisaron los cultivos microbiológicos de diferentes muestras biológicas de los 13 pacientes, efectuados durante el período de administración de la NE, no pudiéndose establecer una correlación entre los microorganismos aislados en las NE y los agentes causales de las infecciones en el mismo paciente.
Sí se pudo constatar la coincidencia en la contaminación por el mismo microorganismo en el mismo día en diferentes perfusiones de NE, coincidiendo incluso en algún paciente.
Es necesario diseñar estudios prospectivos en que puedan incluirse los datos microbiológicos de los pacientes además de los de la NE realizando además un estudio epidemiológico (fagotipia, serotipado, etc.) de los microorganismos aislados repetidamente.
Es difícil establecer comparación de resultados con otros autores ya que las condiciones de preparación/administración de nutriciones enterales así como la toma de muestras del proceso difieren de unos estudios a otros. Además, algunos estudios no indican con detalle la metodología utilizada.
Si a todo esto añadimos la inexistencia de unos criterios internacionalmente reconocidos sobre límites aceptables de contaminación (no se conocen los niveles de contaminación que pueden ser seguros en los pacientes y probablemente varía de paciente a paciente), fácilmente se deduce la dificultad en la valoración comparativa de resultados entre diversos grupos de trabajo.
En un trabajo realizado por Fernández-Crehuet et al (25) en que aplican el mismo criterio de contaminación que nuestro grupo (RD 2685/76) los valores de contaminación obtenidos son del 27 % (56/208). Sin embargo, el estudio se refiere principalmente al momento de la preparación, obteniéndose las muestras en la cocina del hospital o tras realizar la incorporación de la dieta al recipiente contenedor por lo que los resultados obtenidos son difícilmente comparables a los nuestros.
Por ello, los datos obtenidos de los estudios de contaminación tienen un interés especialmente a nivel intrahospitalario con objeto de mejorar los protocolos de administración y manipulación de las nutriciones enterales así como permitir la validación de los mismos.
Es necesario protocolizar, detallando metodológicamente, el proceso de manejo y administración de la NE con objeto de conseguir que la administración de la nutrición artificial sea eficaz y segura. Las recomendaciones generales que debería incluir el protocolo de manipulación de las NE se presentan en la tabla 5. Los protocolos deben ser revisados y validados periódicamente, especialmente cuando se modifiquen algunas de las condiciones.
Tabla 5. Recomendaciones generales del protocolo de manipulación/administración de NE en el Hospital de Traumatología y Rehabilitación Vall d''Hebron. |
| Protocolo de manipulación de las nutriciones enterales. Recomendaciones generales. |
| * Extremar condiciones y técnicas asépticas tanto en preparación como manipulación (vía exógena: principal causa de contaminación). * Utilizar sistemas cerrados de administración. * No reutilizar los recipientes contenedores y los sistemas de administración más de 24 horas. * No se recomienda lavado del recipiente contenedor. * Preferentemente, utilizar métodos de administración que requieran las mínimas manipulaciones (similar a sueroterapia). * Los tiempos de administración de la nutrición enteral (NE) no deben superar las 8 horas de perfusión. * Realizar controles microbiológicos de la NE de manera similar a la NP. |
Además es importante destacar que la contaminación puede constituir un «reservorio» de microorganismos multiresistentes (26) por lo que se refuerza la necesidad de la puesta en marcha de un programa de control microbiológico de los preparados de NE especialmente en unidades de cuidados intensivos.
Por todo ello, podemos constatar que existe un creciente interés, entre el personal sanitario involucrado en la administración de NE, en el tema de la contaminación de las dietas y sus posibles implicaciones clínicas. Este interés ha sido detectado por la propia industria farmacéutica responsable del desarrollo de los preparados de NE y así se presentan en el mercado de las NE nuevos sistemas de administración (sistemas «ready-to-use») que intentan reducir o prevenir la contaminación de las dietas y sus riesgos y mejorar el coste/eficiencia de los mismos (27).
Concluimos indicando lo siguiente:
* No debe subestimarse el tema de la contaminación de las NE, especialmente en pacientes críticos.
* Las dietas se contaminan por gérmenes potencialmente patógenos que pueden incrementar el riesgo de infecciones nosocomiales.
* Deben establecerse protocolos de trabajo (manipulación/administración) detallados.
* Deben realizarse validaciones de los procesos tanto al inicio como cuando se modifiquen las variables de los procesos.
* Deben establecerse controles microbiológicos periódicos de manera análoga a las nutriciones parenterales.
BIBLIOGRAFIA
1. Schroeder P, Fisher D, Volz M, Paloucek J. Microbial contamination of enteral feeding solutions in a community hospital. JPEN 1983;7:364-8.
2. Casewell MW, Cooper JE, Webster H. Enteral feeds contaminated with Enterobacter cloacae as a cause of septicaemia. Br Med J 1981;282:973.
3. De Vries EG, Mulder NH, Houwen B, De Vries-Hospers HG. Enteral nutrition by nasogastric tube in adults patients treated with intensive chemotherapy for acute leukemia. Am J Clin Nutr 1982;35:1490-6.
4. Freedland CP, Roller RD, Wolfe BM, Flynn NM. Microbial contamination of continuous drip feendings. JPEN 1989;13:18-22.
5. Jacobs S, Chang RWS, Lee B, Bartlett FW. Continuous enteral feeding: A major cause of pneumonia amon ventilated intensive care unit patients. JPEN 1990;14:353-6.
6. Anderton A. Bacterial contamination of enteral feeds and feeding systems. Clin Nutr 1993;12 supl 1:S16-S32.
7. Guenthner SH, Owen-Hendley J, Wenzel RP. Gram-negative bacilli as nontransient flora on the hands of hospital personnel. J Clin Microbiol 1987;25:488-90.
8. Sanderson PJ, Weissler S. Recovery of coliforms from the hands of nurses and patients: activities leading to contamination. J Hosp Infect 1992;21:85-93.
9. Payne-James JJ, Rand SK, Bray MS, McSwiggan DA, Silk DBA. Retrograde (Ascending) bacterial contamination of enteral diet administration systems. JPEN 1992;16:369-73.
10. Schreiner RL, Lemons JA, Jansen RD. Microbial contamination of continuousdrip feedings in the newborn intensive care unit. En Proceedings of the Ross Laboratories Workshop on Contamination of Enteral feeding products during clinical usage. Columbus, Ohio: Ross Laboratories; 1983. p. 33-7.
11. Lalueza MP, Rodríguez V, Robles A, Fontán C, Clapés J. Contaminación de nutriciones enterales en pacientes críticos. Nutr Hosp 1994;9:18-26.
12. Pottecher B, Goetz ML, Jacquemaire MA, Reeb E, Lavillaureix J. Enterocolites infectieuses chez des malades de réanimation alimentes par sonde nasogastrique. Ann Anesth Franç 1979;20:595-7.
13. Kohn CL. The relationship between enteral formula contamination and length of enteral delivery set usage. JPEN 1991;15:567-71.
14. Fagerman KE. Limiting bacterial contamination of enteral nutrient solutions: 6-year history with of contamination at two institutions. Nutr Clin Prac 1992;7:31-6.
15. Baldwin BA, Zagoren AJ, Rose N. Bacterial contamination of continuously infused enteral alimentation with needle catheter jejunostomy-clinical implications. JPEN 1983;8:30-3.
16. Lannini PB, Mumford F, Buckalew F. Microbial contamination of enteral liquid nutritional systems. En Proceedings of the Ross Laboratories Workshop on Contamination of enteral feeding products during clinical usage. Columbus, Ohio: Ross Laboratories; 1983. p. 11-5.
17. Remington JS, Schimpff SC. Ocassional notes: please don''t eat the salads. N Engl J Med 1981;304-433-5.
18. Weenk G, van Unen E, Meeuwisse J, van Ess I, van der Hulst J. Assessment of the microbiological safety of enteral feeds when used with a prolonged feeding time. Burns 1995;21:98-101.
19. Heyland D, Bradley C, Mandell LA. Effect of acidified enteral feedings on gastric colonization in the critically ill patients. Crit Care Med 1992;
20:1388-94.
20. Oie S, Kamiya A, Hironaga K, Koshiro A. Microbial contamination of entral feeding solution and its prevention. Am J Infect Control 1993;21:34-8.
21. Grunow JE, Christenson JC, Moutos D. Contamination of enteral nutrition systems during prolonged intermittent use. JPEN 1989; 13:23-5.
22. Byrum B. Characteristics of bacterial growth in ready-to feed liquid nutritional products inoculated with rapid-growing bacteria. En Proceedings of the Ross Laboratories workshop on Contamination of enteral feeding products during clinical usage. Columbus, Ohio: Ross Laboratories; 1993. p. 6-10.
23. Donius MA. Contamination of a prefilled ready-to-use enteral feeding system compared with a refillable bag. JPEN 1993;17:461-4.
24. Anderton A, Nwoguh CE, Makune I, Morrison L, Greig M, Clark B. A comparative study of the numbers of bacteria present in enteral feeds prepared and administered in hospital and the home. J Hosp Infect 1993;23:43-9.
25. Fernandez-Crehuet M, Jurado D, Guillen JF, Galvez R. Bacterial contamination of enteral feeds as a possible risk of nosocomial infection. J Hosp Infect 1992;21:121-9.
26. Faintuch J. Contamination of enteral feeding systems in the nosocomial environment. JPEN 1993; 17:398-9.
27. Wagner DR, Elmore MF, Knoll DM. Evaluation of «closed» vs «open» systems for the delivery of peptide-based Enteral Diets. JPEN 1994, 18: 453-7.