Sr. Director:
Infliximab es un anticuerpo monoclonal quimérico humano derivado del ratón que inhibe la actividad funcional del factor de necrosis tumoral alfa (TNF-a) y forma complejos estables con el TNF-a humano, lo que lleva a la pérdida de actividad de éste. Está autorizado, entre otras indicaciones, para el tratamiento de la psoriasis en placas entre moderada y grave en adultos que no respondan o en los que está contraindicado otro tratamiento sistémico, incluidas la ciclosporina, el metotrexato o PUVA. Las reacciones adversas más frecuentes por infliximab fueron las relacionadas con la perfusión (disnea, urticaria y cefalea). Alrededor de un 10% de los pacientes experimentaron otro tipo de trastornos, como infecciones virales (gripe, virus del herpes), cefalea, vértigos y mareos, rubor, náuseas, dolor abdominal, fatiga, dolor torácico y elevación de las transaminasas hepáticas.
Su uso está contraindicado en pacientes con sepsis, tuberculosis, abscesos o infecciones oportunistas, e insuficiencia cardíaca moderada o grave1-3.
Describimos un caso de citolisis secundaria al uso de infliximab en un paciente con psoriasis en placas generalizada con afectación grave palmoplantar.
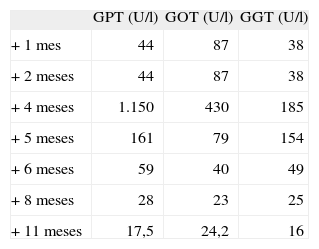
Descripción del casoVarón de 32 años y 73 kg de peso, diagnosticado de psoriasis desde hace 10 años. No refiere alergias medicamentosas; es fumador y bebedor de fines de semana. Ha sido tratado durante el año 2005 y la primera mitad del año 2006 con efalizumab, ciclosporina y acitretina, sin resultados satisfactorios. En septiembre de 2006 presenta un brote agudo de psoriasis generalizada casi eritrodérmica y, tras una revisión por el servicio de dermatología, se inicia tratamiento con infliximab en dosis de 5mg/kg, seguida de dosis adicionales de 5mg/kg en perfusión a las 2 y 6 semanas siguientes a la primera, y con posterioridad cada 8 semanas. Se realiza previamente radiografía de tórax y analítica con bioquímica y hemograma, sin datos relevantes, así como 2 determinaciones de Mantoux separadas por una semana que fueron negativas. En octubre recibe la segunda perfusión, sin presentar efectos secundarios. Tras la tercera perfusión, en noviembre, se plantea el cambio de tratamiento a etarnecept, pero el paciente prefiere continuar con infliximab por su buena tolerancia y la favorable evolución en su enfermedad. La analítica posterior a esta perfusión pone de manifiesto ligera elevación de las transaminasas, sin otros hallazgos de interés. En la analítica previa a la perfusión correspondiente al mes de enero de 2007, el paciente presentó una elevación considerable de transaminasa glutamicopirúvica (GPT), transaminasa glutamicoxalacética (GOT) y ligera elevación en la gammaglutamil transpeptidasa (GGT), con valores normales de bilirrubina y fosfatasa alcalina; la serología para virus de la hepatitis B (VHB) y C (VHC) fue negativa. Es remitido al servicio de digestivo para su evaluación, donde toda la batería hepática realizada fue normal, así como ecografía hepática y las concentraciones de a1-antitripsina, excepto los anticuerpos anti-ADN que se encontraban en bajas concentraciones en relación con infliximab, por lo que probablemente la elevación de las transaminasas (citólisis-colestasis) hasta el intervalo de hepatitis se debe a este fármaco, al no haber otras causas de hepatopatía. En las pruebas de imagen no se detecta lesión en el hígado. Tras la suspensión del tratamiento, el paciente normaliza sus valores a los 5 meses y el servicio de digestivo desaconseja el uso de infliximab. Los datos de transaminasas se presentan en la tabla 1.
Concentración de transaminasas respecto al inicio de tratamiento
| GPT (U/l) | GOT (U/l) | GGT (U/l) | |
| + 1 mes | 44 | 87 | 38 |
| + 2 meses | 44 | 87 | 38 |
| + 4 meses | 1.150 | 430 | 185 |
| + 5 meses | 161 | 79 | 154 |
| + 6 meses | 59 | 40 | 49 |
| + 8 meses | 28 | 23 | 25 |
| + 11 meses | 17,5 | 24,2 | 16 |
GGT: gammaglutamil transpeptidasa; GOT: transaminasa glutamicoxalacética; GPT: transaminasa glutamicopirúvica.
La aparición de anticuerpos anti-ADN en bajas concentraciones y la buena evolución de la citólisis en el paciente no parecen indicar la aparición de una reacción autoinmune.
Posteriormente, el paciente fue tratado con fototerapia PUVA y tratamiento tópico con calcipotriol y calcitriol, con buenos resultados en la actualidad.
Se notificó la sospecha de reacción adversa y el servicio de dermatología cumplimentó la tarjeta amarilla correspondiente, con su posterior envío al Centro Regional de Farmacovigilancia de nuestra comunidad autónoma. La imputabilidad fue realizada por el servicio de farmacia según el algoritmo de Karch-Lasagne modificado, obteniéndose una valoración causal de «probable».
DiscusiónEl uso cada vez más extendido de un número creciente de fármacos ha convertido en un acontecimiento frecuente la toxicidad hepática por medicamentos. Más de 1.100 fármacos se han catalogado potencialmente capaces de producir toxicidad hepática4. La incidencia estimada de reacciones de hepatotoxicidad por fármacos es muy variable, de 8,9 a 406 pacientes por millón de habitantes y año, debido a las grandes diferencias metodológicas de los estudios, pero si se tienen sólo en cuenta los casos graves, la mortalidad es superior al 10% en la mayoría de las series4. En el diagnóstico diferencial de una lesión hepática siempre deben considerarse los medicamentos como posibles agentes causales5.
En la ficha técnica de infliximab se describe que durante la experiencia poscomercialización se observaron casos muy raros de ictericia y hepatitis no infecciosa, algunos con características de hepatitis autoinmunitaria1. Se produjeron casos aislados de fallo hepático que resultaron en trasplante hepático o muerte1,3.
Al realizar una búsqueda bibliográfica encontramos casos de elevación de las transaminasas, hepatitis autoinmunitaria, colestasis hepática y trasplante hepático3,6-8.
En nuestro paciente, y debido al riesgo de utilizar como tratamiento otro fármaco anti-ADN con igual mecanismo de acción, se prefirió la fototerapia como alternativa terapéutica. No se descarta en un futuro, y si fuera necesario, usar ertanecept como tratamiento biológico. El paciente normalizó su perfil hepático sin secuelas, continuando así hasta la última revisión.
En noviembre de 2007 consultamos al Sistema Español de Farmacovigilancia las sospechas de hepatopatía por infliximab. De las 39 sospechas, 16 casos presentaron elevación en al menos una de las enzimas hepáticas y, de ellas, 7 se recuperaron y 5 no se recuperaron, desconociéndose el desenlace en 4 casos. En la base de datos de Farmacovigilancia de la Organización Mundial de la Salud, durante el período comprendido entre los años 2000 a 2006 se recogieron 649 sospechas de alteraciones hepatobiliares relacionadas con infliximab. De ellas, 302 casos presentaron elevación en al menos una de las enzimas hepáticas.
Los acontecimientos adversos por medicamentos constituyen un grave problema de salud pública cuya prevención precisa la participación y el esfuerzo de todos. Los ensayos clínicos encaminados a establecer el perfil de toxicidad de un fármaco, entre otras cosas, se realizan en unas condiciones de utilización radicalmente diferentes de las de la práctica diaria, por lo que es necesario realizar un seguimiento estrecho de las reacciones adversas de los fármacos introducidos recientemente en el mercado.