En pacientes con linfoma folicular refractario o en recaída que responden a terapia de inducción con CHOP o rituximab+CHOP, el tratamiento de mantenimiento con rituximab frente a la opción de “observar” mejora la supervivencia global y la supervivencia libre de progresión.
ObjetivoEstimar si el tratamiento de mantenimiento con rituximab es una intervención coste-efectiva en comparación con la práctica clínica de “observar” su evolución.
MétodoPoblación: la del ensayo clínico EORTC 20981. Perspectiva: Sistema Nacional de Salud Español (costes directos sanitarios). Diseño: Análisis coste-efectividad incremental, con un modelo de transición entre estados de salud. Variables principales: coste de ganar un año de vida ajustado por su calidad (AVAC), por año de vida Ganado (AVG) y por AVG libre de progresión. Premisas del caso básico: distribución de Weibull para extrapolación de supervivencia, 5 años de duración del beneficio del tratamiento, horizonte temporal de 10 años y tasa anual de descuento (costes y beneficios) del 3,5%. Estas premisas se modificaron en los análisis de sensibilidad.
ResultadosAnálisis determinístico: el coste por AVAC ganado fue de 9.358 €, por AVG de 8.493 € y por AVG libre de progresión de 5.485 €. Análisis probabilístico y de sensibilidad: confirmaron la estabilidad de los resultados del análisis determinístico.
ConclusionesSegún este modelo, el tratamiento de mantenimiento con rituximab es coste-efectivo (coste por AVG<30.000 €) en los pacientes con linfoma folicular resistente o en recaída que responden al tratamiento de inducción, en comparación con la práctica habitual de observar la evolución de los pacientes.
In patients with refractory or recurrent follicular lymphoma responding to induction therapy with CHOP or rituximab+CHOP, maintenance treatment with rituximab compared to the “observation” option improves both overall survival and progression-free survival.
ObjectiveEstimate whether maintenance treatment with rituximab is a cost-effective intervention compared to the clinical practice of “observing” its evolution.
MethodPopulation: the EORTC 20981 clinical trial population. Perspective: Spanish National Health System (direct healthcare costs). Design: Incremental cost-effectiveness analysis, with a transition model between states of health. Main variables: cost of gaining a quality-adjusted life year (QALY), per life year gained (LYG) and per progressionfree LYG. Premises of the basic case: Weibull distribution for survival extrapolation, 5 year duration of the benefits of the treatment, time horizon of 10 years and annual discount rate (costs and benefits) of 3.5%. These premises were modified in the sensitivity analyses.
ResultsDeterministic analysis: the cost per QALY gained was €9,358, €8,493 per LYG and €5,485 per progression-free LYG. Probabilistic and sensitivity analysis: they confirmed the stability of the deterministic analysis results.
ConclusionsAccording to this model, maintenance treatment with rituximab is cost-effective (cost per LYG<€30,000) in patients with resistant or recurrent follicular lymphoma responding to induction treatment, in comparison to the usual practice of observing patients’ evolution.
Los linfomas no hodgkinianos (LNH) son un grupo sumamente heterogéneo de neoplasias del sistema linfoide. De acuerdo con la clasificación de la Organización Mundial de la Salud (OMS), entre los LNH de células B se encuentran los linfomas foliculares (LF) que se caracterizan por su curso indolente, con tiempos de supervivencia prolongados (8-12 años), aunque son refractarios a los tratamientos quimiotérapicos, por lo que las tasas de respuesta son muy bajas. La incidencia del LF está aumentando rápidamente en los países industrializados, con una tasa de mortalidad en España de 5,5 casos y 3,6 casos por 100.000 en varones y mujeres, respectivamente1.
El tratamiento del LF es muy variable e incluye opciones como la radioterapia y la poliquimioterapia. Además de los tratamientos activos, la existencia de regresiones espontáneas, su curso clínico poco agresivo o indolente, y la frecuencia de amplios períodos asintomáticos, inducen en algunos casos a tomar una actitud conservadora de observación (o "espera vigilante") en pacientes sin sintomatología2,3.
Durante los últimos años, la introducción de una nueva opción terapéutica, la de la inmunoterapia con anticuerpos monoclonales, ha permitido aumentar la especificidad del tratamiento, reduciendo la toxicidad y presentando, además, sinergismo con la quimioterapia convencional debido a su distinto mecanismo de acción.
El rituximab (Mabthera®), primer anticuerpo monoclonal quimérico murino/humano contra el marcador CD20 para LNH, está indicado en el tratamiento de pacientes con LF en estadios III-IV, que son quimiorresistentes o están en su segunda o subsiguiente recaída tras la quimioterapia, en combinación o no con el esquema CHOP (ciclofosfamida + vincristina + doxorrubicina + prednisona), así como en combinación con el esquema CVP (ciclofosfamida + vincristina + prednisona) en pacientes que no hayan sido previamente tratados4. Recientemente, se ha aprobado su indicación como tratamiento de mantenimiento de pacientes con LF en recaída o refractario que respondan a la terapia de inducción con quimioterapia, en combinación o no con rituximab4.
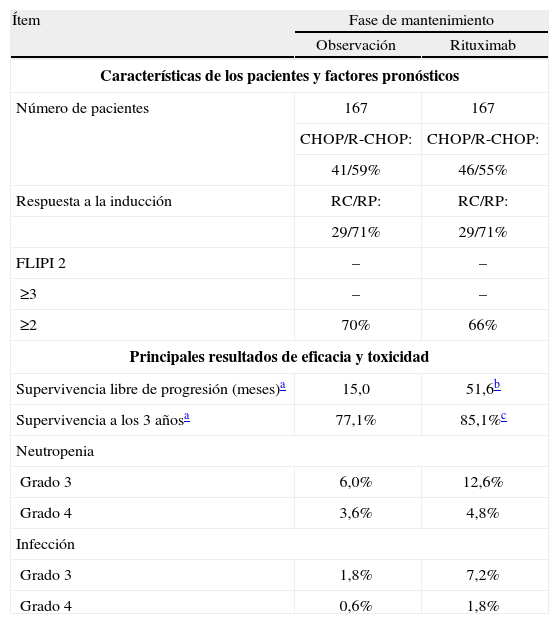
La aprobación de esta última indicación, se obtuvo debido fundamentalmente a los resultados del ensayo clínico realizado por el intergrupo de la EORTC (European Organization for Research and Treatment of Cancer), el EORTC 209815. Este estudio fue diseñado con dos objetivos: a) investigar el beneficio de añadir rituximab al esquema CHOP (R-CHOP) para el tratamiento del LF avanzado, resistente a la quimioterapia o en recaída (fase de inducción), y b) investigar si el mantenimiento del tratamiento con rituximab en monoterapia (375 mg/m en infusión i.v., una vez cada 3 meses, hasta un máximo de 2 años o hasta la recaída) en los pacientes con una respuesta parcial o completa tras el tratamiento de inducción previo, prolonga la duración de la respuesta5. El estudio concluyó que la mediana de la supervivencia libre de progresión fue mayor con R-CHOP (33,1 meses) que con CHOP (20,2 meses) (p = 0,0003) en la fase de inducción, así como que también lo fue con rituximab (51,6 meses) frente a observación (15,0 meses) (p < 0,0001) en la fase de mantenimiento. Además, y lo que es más importante, la supervivencia global fue superior en el grupo de mantenimiento con rituximab, con el 85,1% de los pacientes vivos a los 3 años frente al 77,1% en el grupo de observación (p = 0,011) (tabla 1)5.
Características de los pacientes y resultados de eficacia y toxicidad del ensayo clínico aleatorizado, en fase III, EORTC 20981. Tratamiento de mantenimiento en segunda línea del linfoma no Hodgkiniano folicular, en estadios III y IV, resistente o recidivante
| Ítem | Fase de mantenimiento | |
| Observación | Rituximab | |
| Características de los pacientes y factores pronósticos | ||
| Número de pacientes | 167 | 167 |
| CHOP/R-CHOP: | CHOP/R-CHOP: | |
| 41/59% | 46/55% | |
| Respuesta a la inducción | RC/RP: | RC/RP: |
| 29/71% | 29/71% | |
| FLIPI 2 | – | – |
| ≥3 | – | – |
| ≥2 | 70% | 66% |
| Principales resultados de eficacia y toxicidad | ||
| Supervivencia libre de progresión (meses)a | 15,0 | 51,6b |
| Supervivencia a los 3 añosa | 77,1% | 85,1%c |
| Neutropenia | ||
| Grado 3 | 6,0% | 12,6% |
| Grado 4 | 3,6% | 4,8% |
| Infección | ||
| Grado 3 | 1,8% | 7,2% |
| Grado 4 | 0,6% | 1,8% |
CHOP: cada 21 días, durante 5 días, se administra el ciclo siguiente (máximo de 6 ciclos): ciclofosfamida (750 mg/m2 i.v. día 1), doxorrubicina (50 mg/m2 i.v. día 1), vincristina (1,4 mg/m2 i.v. día 1) y prednisona (100 mg/día, días 1-5); FLIPI: Follicular Lymphoma International Prognostic Index; i.v.: intravenoso; RC: respuesta completa; R-CHOP: esquema CHOP más rituximab (375 mg/m2 i.v., el día 1 de cada ciclo); RP: respuesta parcial.
El coste del grupo relacionado por el diagnóstico (GRD) 401, que incluye el LF, es de 7.272 €, actualizados a 20066. La importancia de esta cifra y las repercusiones socioeconómicas del LF, justifican la realización de análisis farmacoeconómicos, mediante modelos, que ayuden a determinar la eficiencia de los diferentes tratamientos disponibles7.
El objetivo del presente trabajo fue determinar si el tratamiento de mantenimiento con rituximab es una intervención coste-efectiva en comparación con la práctica clínica de "observar" su evolución, en los pacientes con LF resistente o en recaída, que han respondido al tratamiento de inducción con CHOP o R-CHOP.
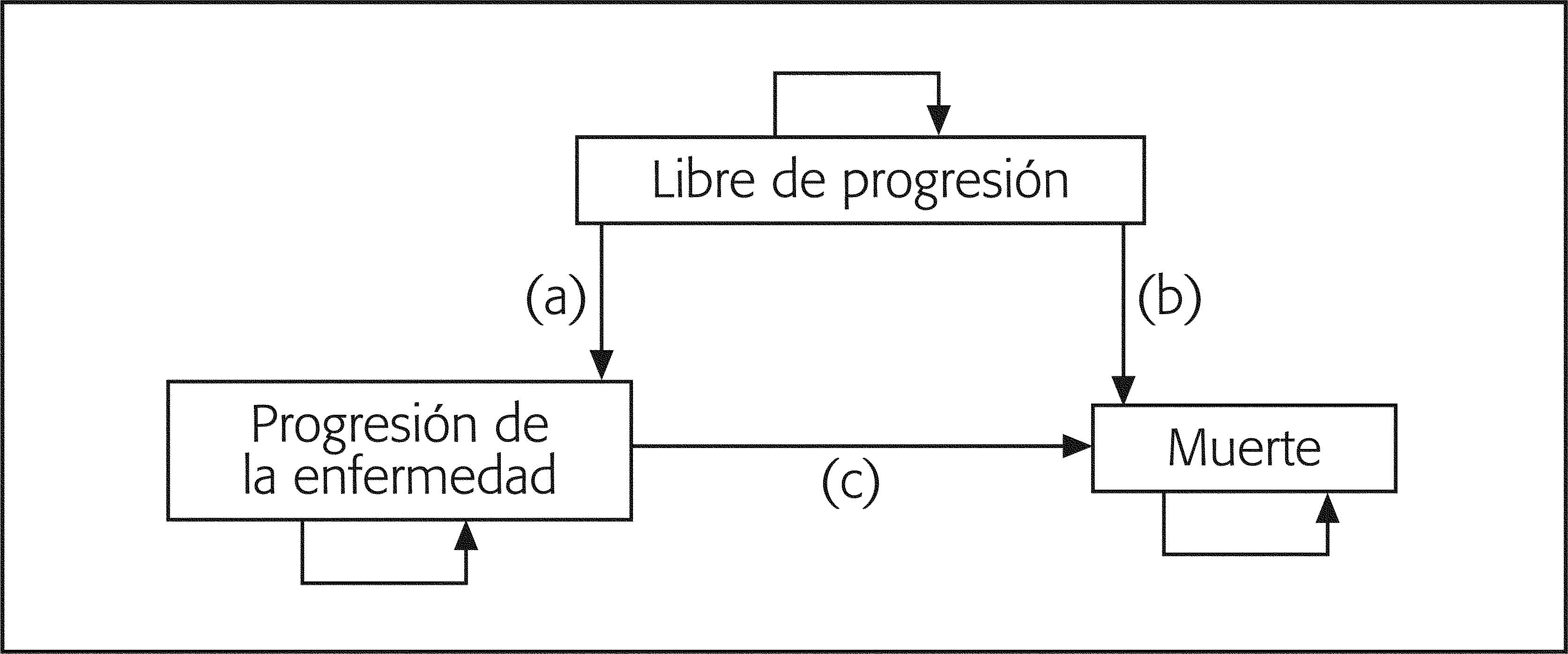
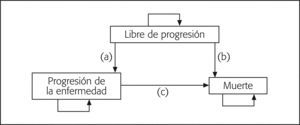
MÉTODOModelo farmacoeconómicoEl estudio consistió en un modelo farmacoeconómico, entendido como un esquema teórico que permite hacer simulaciones de procesos sanitarios complejos relacionados con medicamentos, y que es elaborado, siguiendo un protocolo previamente establecido, mediante estimaciones obtenidas a partir de los datos disponibles (publicados o no) de eficacia, toxicidad y costes de las alternativas comparadas7. Se llevó a cabo la adaptación al sistema sanitario español de un modelo internacional de transición entre estados de salud, con una estructura que se representa en la figura 1 y que se describe en detalle más adelante.
Población dianaRepresenta el conjunto hipotético de pacientes en los que se realiza el análisis teórico y, por tanto, la población a la que pueden aplicarse los resultados del estudio. La población diana fueron pacientes de ambos sexos, con diagnóstico de LF (estadios III o IV) resistente o en recaída, que han respondido al tratamiento de inducción con 6 ciclos de los esquemas CHOP o R-CHOP, conforme a las características de los pacientes del ensayo clínico EORTC 20981, cuyos resultados se utilizaron en el modelo farmacoeconómico (tabla 1)5.
Estados de saludEn el modelo se consideraron, de acuerdo con la historia natural del LF, los siguientes estados de salud (fig. 1): 2 estados "transitorios" (libre de progresión [LP] y progresión de la enfermedad [PE]) en los que los pacientes podrían permanecer varios ciclos de 1 mes de duración, y el denominado estado "absorbente" (la muerte [M] de los pacientes) (fig. 1). Todos los pacientes de la cohorte estarían inicialmente libres de progresión. Durante los ciclos mensuales, los pacientes pueden seguir en ese estado (LP) o bien transitar a los otros 2 estados (PE y M); una vez se produce la progresión, el paciente puede permanecer en ese estado (PE) o morir (M).
El objetivo del modelo fue estimar las diferencias entre las opciones terapéuticas (mantenimiento con rituximab u "observación") comparadas en los siguientes aspectos: a) los años de vida ajustados por calidad (AVAC); b) los años de vida sin ajustar por su calidad (AV); c) el tiempo en el que los pacientes sobreviven sin progresión de la enfermedad (años de supervivencia libre de progresión, ASLP), y d) los costes asociados a los estados LP y PE. No se consideraron los costes debidos a la muerte (M).
Debe destacarse que el modelo no sigue el procedimiento habitual de Markov, ya que no utiliza las probabilidades de transición entre los estados8, sino que emplea directamente los tiempos LP y de supervivencia, estimados mediante el método de Kaplan Meier. Por tanto, el modelo calcula el área bajo la curva del tiempo en el que los pacientes permanecen vivos en los estados LP y PE.
Datos de eficacia y tipos de análisisEl tipo de análisis farmacoeconómico que debe realizarse depende de que existan o no diferencias demostradas de eficacia o de toxicidad entre los tratamientos. Como se indicó anteriormente, el estudio EORTC 20981, cuyas características se resumen en la tabla 1, concluyó que en la fase de mantenimiento: a) la mediana de la supervivencia libre de progresión fue superior con rituximab (51,6 meses) frente al grupo de observación (15,0 meses) (p < 0,0001), y b) también hubo diferencias de supervivencia a los 3 años favorables a rituximab (el 85,1 frente al 77,1%; p = 0,011)5. Los pacientes en mantenimiento con rituximab tuvieron, asimismo, más acontecimientos adversos que los del grupo de observación (tabla 1).
Debido a que se han demostrado diferencias de supervivencia entre las opciones terapéuticas comparadas, se llevó a cabo un análisis de coste-efectividad (coste por año de vida ganado [AVG]; coste por ASLP ganado). Por otra parte, se hizo un análisis de coste-utilidad debido a que la diferente tasa de progresión de la enfermedad y las diferencias de toxicidad constatadas entre los pacientes en mantenimiento con rituximab y los sometidos a observación, podrían repercutir en la calidad de vida y, por tanto, en las utilidades (AVAC).
La comparación de los resultados incrementales de costeefectividad y coste-utilidad se efectuó aplicando la fórmula siguiente:
Los resultados se presentan como costes incrementales, coste por AVAC ganado (coste-utilidad) y como coste por AVG o coste por ASLP ganado (coste-efectividad) con el mantenimiento con rituximab, en comparación con la opción de la "espera vigilante".
Estimación de las utilidadesLas utilidades se midieron como AVAC, siendo un AVAC un año de vida multiplicado por un factor de ponderación que indica la calidad de vida de la persona durante ese año. El "peso" o factor de ponderación de la calidad de un año de vida, puede ir desde el valor 0 (la muerte o un estado equivalente) hasta el valor 1 (que indica la salud perfecta). Las utilidades empleadas en el modelo (tabla 2) se tomaron de un estudio realizado en el Reino Unido, en 152 pacientes con LF, a los que se administró la escala analógica visual del instrumento EQ-5D9. Los valores de las utilidades de los estados de salud LP y PE, estimadas mediante la tarifa de York, se indican en la tabla 2.
Utilidades empleadas en el modelo en linfoma folicular avanzadoa
| Estado de salud | Utilidad | N |
| Supervivencia libre de progresión | 0,805 | 132 |
| Progresión de la enfermedad | 0,618 | 33 |
| Muerte | 0,000 | – |
N: tamaño muestral.
Fuente: Estudio de Oxford Outcomes, en el que se calcularon las utilidades con el instrumento EQ-5D, utilizando la tarifa de York9.
Las transiciones entre estados se realizaron en unos periodos discretos de tiempo denominados "ciclos" que, como se dijo anteriormente, en el modelo tuvieron una duración de 1 mes. En el caso básico del análisis, la duración máxima del tratamiento de mantenimiento con rituximab fue de 2 años (aproximadamente la mediana del seguimiento del estudio EORTC 20981)5.
El horizonte temporal del caso básico del análisis fue de 10 años. Se eligió éste al considerar que reflejaba la supervivencia media de la población diana estudiada. No obstante, en el análisis de sensibilidad también se consideró un lapso de 30 años para simular la evolución de por vida de la cohorte teórica de pacientes.
Para estimar la duración del beneficio del tratamiento (5 años en el caso básico) y para desarrollar un modelo con un seguimiento de 10 años en el caso básico y de por vida en el análisis de sensibilidad, fue necesario extrapolar los datos de Kaplan Meier obtenidos del ensayo clínico, mediante extrapolaciones paramétricas utilizando las distribuciones Weibull (caso básico) y Log-logística (análisis de sensibilidad)10.
Se hizo un descuento anual del 3,5% para los costes y para los beneficios (AVAC, AV, ASLP) según las recomendaciones del National Institute for Clinical Excellence (NICE)11. Ambos se contabilizaron en la mitad de cada ciclo.
Perspectiva del estudio y directrices seguidasEl estudio se hizo desde la perspectiva del Sistema Nacional de Salud (SNS) español, por tanto considerando únicamente los costes directos sanitarios.
Se siguieron las directrices generales para la realización de análisis farmacoeconómicos en España7, así como las directrices publicadas por la Agencia Canadiense de Medicamentos y Tecnologías Sanitarias12 y los Principios de buenas prácticas de modelización de la International Society for Pharmacoeconomics and Outcomes Research (ISPOR)13.
Estimación de los costesLa estimación de los costes de una enfermedad tratada con un determinado fármaco se hace mediante la identificación y cuantificación de los recursos sanitarios que conlleva y asignando a los recursos unos determinados costes unitarios. De este modo, se estimaron los costes medios para un paciente tipo con LF avanzado. Los costes de los recursos sanitarios utilizados en el modelo se presentan en euros (€) de mayo de 2006.
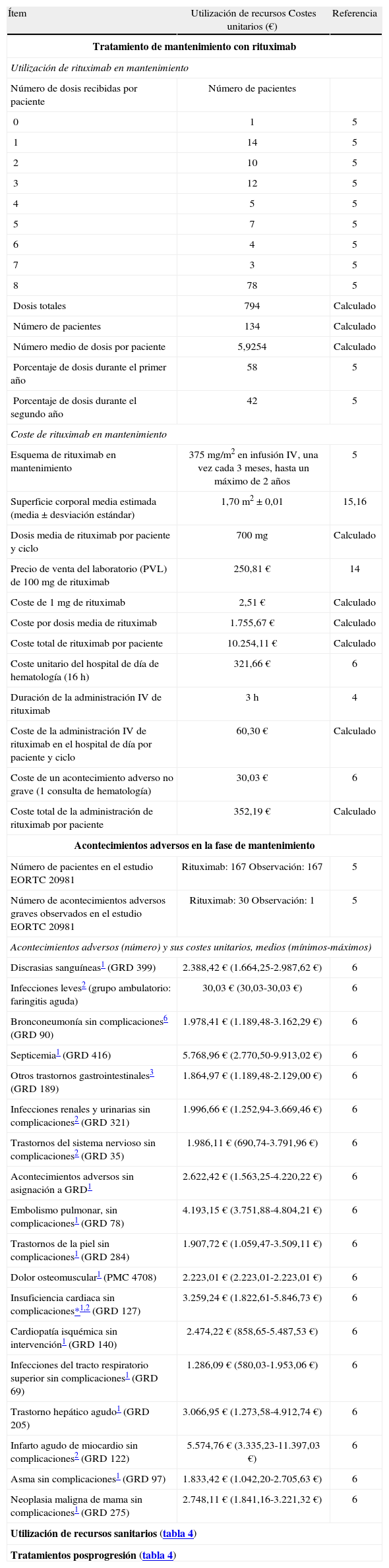
Solo se consideraron los costes anuales a partir de la aleatorización de los pacientes al grupo de mantenimiento con rituximab o al grupo de observación, en el ensayo clínico EORTC 20981. La utilización de recursos y sus costes unitarios se recogen en la tabla 3.
Utilización y costes unitarios de los recursos sanitarios (€ de mayo de 2006) empleados en el modelo farmacoeconómico
| Ítem | Utilización de recursos Costes unitarios (€) | Referencia |
| Tratamiento de mantenimiento con rituximab | ||
| Utilización de rituximab en mantenimiento | ||
| Número de dosis recibidas por paciente | Número de pacientes | |
| 0 | 1 | 5 |
| 1 | 14 | 5 |
| 2 | 10 | 5 |
| 3 | 12 | 5 |
| 4 | 5 | 5 |
| 5 | 7 | 5 |
| 6 | 4 | 5 |
| 7 | 3 | 5 |
| 8 | 78 | 5 |
| Dosis totales | 794 | Calculado |
| Número de pacientes | 134 | Calculado |
| Número medio de dosis por paciente | 5,9254 | Calculado |
| Porcentaje de dosis durante el primer año | 58 | 5 |
| Porcentaje de dosis durante el segundo año | 42 | 5 |
| Coste de rituximab en mantenimiento | ||
| Esquema de rituximab en mantenimiento | 375 mg/m2 en infusión IV, una vez cada 3 meses, hasta un máximo de 2 años | 5 |
| Superficie corporal media estimada (media ± desviación estándar) | 1,70 m2 ± 0,01 | 15,16 |
| Dosis media de rituximab por paciente y ciclo | 700 mg | Calculado |
| Precio de venta del laboratorio (PVL) de 100 mg de rituximab | 250,81 € | 14 |
| Coste de 1 mg de rituximab | 2,51 € | Calculado |
| Coste por dosis media de rituximab | 1.755,67 € | Calculado |
| Coste total de rituximab por paciente | 10.254,11 € | Calculado |
| Coste unitario del hospital de día de hematología (16 h) | 321,66 € | 6 |
| Duración de la administración IV de rituximab | 3 h | 4 |
| Coste de la administración IV de rituximab en el hospital de día por paciente y ciclo | 60,30 € | Calculado |
| Coste de un acontecimiento adverso no grave (1 consulta de hematología) | 30,03 € | 6 |
| Coste total de la administración de rituximab por paciente | 352,19 € | Calculado |
| Acontecimientos adversos en la fase de mantenimiento | ||
| Número de pacientes en el estudio EORTC 20981 | Rituximab: 167 Observación: 167 | 5 |
| Número de acontecimientos adversos graves observados en el estudio EORTC 20981 | Rituximab: 30 Observación: 1 | 5 |
| Acontecimientos adversos (número) y sus costes unitarios, medios (mínimos-máximos) | ||
| Discrasias sanguíneas1 (GRD 399) | 2.388,42 € (1.664,25-2.987,62 €) | 6 |
| Infecciones leves2 (grupo ambulatorio: faringitis aguda) | 30,03 € (30,03-30,03 €) | 6 |
| Bronconeumonía sin complicaciones6 (GRD 90) | 1.978,41 € (1.189,48-3.162,29 €) | 6 |
| Septicemia1 (GRD 416) | 5.768,96 € (2.770,50-9.913,02 €) | 6 |
| Otros trastornos gastrointestinales3 (GRD 189) | 1.864,97 € (1.189,48-2.129,00 €) | 6 |
| Infecciones renales y urinarias sin complicaciones2 (GRD 321) | 1.996,66 € (1.252,94-3.669,46 €) | 6 |
| Trastornos del sistema nervioso sin complicaciones2 (GRD 35) | 1.986,11 € (690,74-3.791,96 €) | 6 |
| Acontecimientos adversos sin asignación a GRD1 | 2.622,42 € (1.563,25-4.220,22 €) | 6 |
| Embolismo pulmonar, sin complicaciones1 (GRD 78) | 4.193,15 € (3.751,88-4.804,21 €) | 6 |
| Trastornos de la piel sin complicaciones1 (GRD 284) | 1.907,72 € (1.059,47-3.509,11 €) | 6 |
| Dolor osteomuscular1 (PMC 4708) | 2.223,01 € (2.223,01-2.223,01 €) | 6 |
| Insuficiencia cardiaca sin complicaciones*1,2 (GRD 127) | 3.259,24 € (1.822,61-5.846,73 €) | 6 |
| Cardiopatía isquémica sin intervención1 (GRD 140) | 2.474,22 € (858,65-5.487,53 €) | 6 |
| Infecciones del tracto respiratorio superior sin complicaciones1 (GRD 69) | 1.286,09 € (580,03-1.953,06 €) | 6 |
| Trastorno hepático agudo1 (GRD 205) | 3.066,95 € (1.273,58-4.912,74 €) | 6 |
| Infarto agudo de miocardio sin complicaciones2 (GRD 122) | 5.574,76 € (3.335,23-11.397,03 €) | 6 |
| Asma sin complicaciones1 (GRD 97) | 1.833,42 € (1.042,20-2.705,63 €) | 6 |
| Neoplasia maligna de mama sin complicaciones1 (GRD 275) | 2.748,11 € (1.841,16-3.221,32 €) | 6 |
| Utilización de recursos sanitarios (tabla 4) | ||
| Tratamientos posprogresión (tabla 4) | ||
Se analizaron cuatro tipos de costes: a) adquisición y administración de rituximab (estimado mediante las tasas de utilización: número de dosis recibidas por paciente); b) acontecimientos adversos (AA) (obtenido a partir de su frecuencia de aparición con rituximab u observación, mediante los costes unitarios de sus grupos relacionados por el diagnóstico o GRD: se calcularon individualmente los de los AA graves y el coste unitario de los demás AA se estimó como el coste de una consulta ambulatoria de hematología); c) tratamientos posprogresión (tratamientos de rescate administrados tras progresión de la enfermedad después de la terapia de mantenimiento con rituximab u observación y hasta la muerte), y d) costes del manejo rutinario y del seguimiento de los pacientes (tablas 3 y 4).
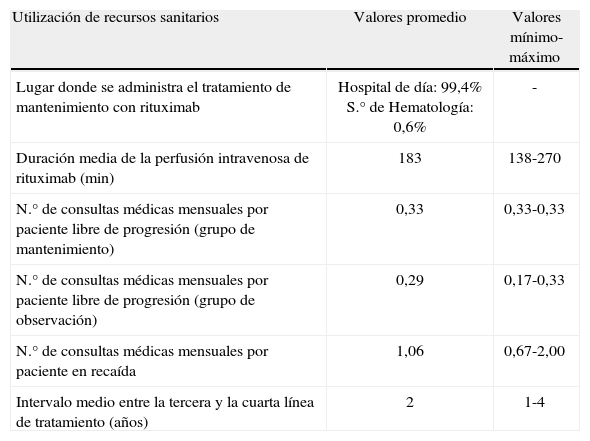
Resultados de las estimaciones de un panel de expertos españoles sobre la utilización de recursos sanitarios y tratamientos posprogresión en el entorno sanitario español
| Utilización de recursos sanitarios | Valores promedio | Valores mínimo-máximo | |
| Lugar donde se administra el tratamiento de mantenimiento con rituximab | Hospital de día: 99,4% S.° de Hematología: 0,6% | - | |
| Duración media de la perfusión intravenosa de rituximab (min) | 183 | 138-270 | |
| N.° de consultas médicas mensuales por paciente libre de progresión (grupo de mantenimiento) | 0,33 | 0,33-0,33 | |
| N.° de consultas médicas mensuales por paciente libre de progresión (grupo de observación) | 0,29 | 0,17-0,33 | |
| N.° de consultas médicas mensuales por paciente en recaída | 1,06 | 0,67-2,00 | |
| Intervalo medio entre la tercera y la cuarta línea de tratamiento (años) | 2 | 1-4 | |
| Tratamientos de postprogresión | Ítem | Mantenimiento con rituximab | Observación |
| Tratamientos de rescate más habituales, en los pacientes con respuesta previa a la terapia de inducción, que recaen después de… (%) | Quimioterapia | 40,57 | 18,86 |
| Rituximab en monoterapia | 3,71 | 13,43 | |
| Rituximab + quimioterapia | 31,14 | 47,71 | |
| TPH alogénico | 2,86 | 1,14 | |
| TPH autólogo | 10,00 | 4,71 | |
| TPH + rituximab | 1,79 | 2,64 | |
| Quimiorradioterapia | 3,00 | 6,43 | |
| Quimioterapia + interferón | 1,36 | 0,93 | |
| Radioterapia | 5,57 | 4,14 | |
| Esquemas de quimioterapia más habituales, en los pacientes con respuesta previa a la terapia de inducción, que recaen después de… (%) | ESHAP | 39,00 | 40,00 |
| FC | - | 14,00 | |
| FM | 22,00 | 8,00 | |
| CVP | 8,00 | 6,00 | |
| MVP | 6,00 | 5,00 | |
| HyperCVAD | 6,00 | 6,00 | |
| Clorambucilo | 4,00 | 2,00 | |
| FMD | 4,00 | - | |
| CHOP | 3,00 | - | |
| GEMOX | 2,00 | - | |
| FMC | 2,00 | 2,00 | |
| Fludarabina | 2,00 | 6,00 | |
| Ciclofosfamida oral | 2,00 | 2,00 | |
| Gemcitabina | - | 2,00 | |
| Otros | - | 5,00 | |
| Esquemas de quimioterapia (en combinación con rituximab) más habituales, en los pacientes con respuesta previa a la terapia de inducción, que recaen después de… (%) | R-FM | 35,00 | 17,50 |
| R-FC | 15,00 | 20,00 | |
| R-MVP | 15,00 | 7,50 | |
| R-HyperCVAD | 15,00 | 7,50 | |
| R-ESHAP | 10,00 | 23,75 | |
| R-CHOP | 5,00 | 16,25 | |
| R-FMC | 5,00 | 2,50 | |
| R-FMD | 5,00 | 2,50 |
CHOP: ciclofosfamida-doxorrubicina-vincristina-prednisona; CVP: ciclofosfamida-vincristina-prednisona; ESHAP: etopósido-metilprednisolona-cisplatino; FC: fludarabina-ciclofosfamida; FM: fludarabina-mitoxantrona; FMC: FM más ciclofosfamida; FMD: FM más dexametasona; GEMOX: gemcitabina-oxaliplatino; HyperCVAD: ciclofosfamida-mesna-doxorrubicina-vincristina-dexametasona-GCSF (ciclo 1) y metotrexato-citarabina-ácido folínico (ciclo 2); MVP: mitoxantrona-etopósido-prednisona; R: rituximab; TPH: trasplante de progenitores hematopoyéticos.
La utilización de recursos sanitarios y los tratamientos posprogresión fueron estimados (para el caso básico del análisis) por un panel de 8 oncohematólogos españoles (tabla 4). Se les plantearon las cuestiones siguientes: a) lugar de administración del tratamiento de mantenimiento con rituximab; b) duración media de la perfusión intravenosa de rituximab; c) frecuencia de las consultas médicas según el estado de salud del paciente; d) tratamientos de rescate en los pacientes que recaen después del periodo de mantenimiento con rituximab o de observación (tratamientos posprogresión), y e) frecuencia de administración de estos tratamientos.
Para calcular el coste de adquisición de rituximab, se utilizaron los precios de venta del laboratorio (PVL)14 y las pautas posológicas del estudio EORTC 209815 para una superficie corporal media de 1,7 m2, valor que se estimó de acuerdo con los datos estadísticos del Ministerio de Sanidad y Consumo sobre la talla y el peso de los españoles15 como promedio de los resultados obtenidos con varias fórmulas ad hoc16 (tabla 3). El coste de los tratamientos posprogresión, se estimó conforme a las dosis y número medio de ciclos recomendados en las fichas técnicas de los medicamentos.
Los demás costes unitarios (consultas médicas, hospital de día, GRD) se obtuvieron a partir de una base de costes sanitarios españoles6.
Análisis de sensibilidadPara comprobar la estabilidad de los resultados y la consistencia de las estimaciones efectuadas, se hicieron análisis de sensibilidad para las siguientes variables: a) el tipo de análisis (probabilístico en lugar de simple unifactorial)17; b) el tipo de distribución (Log-logística en lugar de Weibull); c) el número de años del modelo en los que la supervivencia se calcula mediante Kaplan Meier (el cálculo de la supervivencia en los años siguientes se obtuvo mediante curvas paramétricas); d) la duración del beneficio terapéutico (2, 3, 10, 20 y 30 años, en lugar de 5 años); e) el horizonte temporal de la simulación (4, 7, 15, 20 y 30 años, en lugar de 10); f) costes mínimos y máximos de los recursos sanitarios y de los acontecimientos adversos (en lugar de costes medios); g) variaciones en los valores de utilidad de los estados LP y PE; h) no aplicar una tasa de descuento anual a los costes y los beneficios (en lugar del 3,5% para ambos); i) considerar los tratamientos posprogresión utilizados en el ensayo clínico EORTC 20981 en lugar de las estimaciones del panel de expertos, y finalmente, j) variar el intervalo entre tratamientos posprogresión entre 1 y 5 años (en lugar de 2 años).
Se llevó a cabo un análisis de sensibilidad probabilístico y se calculó el intervalo de confianza (IC) del 95% de la razón de coste-utilidad, mediante 2.000 iteraciones por simulación que permitieron asegurar la estabilización de las desviaciones estándar.
Finalmente, se analizó la curva de aceptabilidad del costeefectividad incremental17 considerando que un nuevo tratamiento sería reembolsable por el SNS para un coste-efectividad incremental umbral igual o inferior a los 30.000 € por AVAC ganado o por AVG, de acuerdo con un estudio español que analizó 100 evaluaciones económicas realizadas en España entre los años 1999 y 200118.
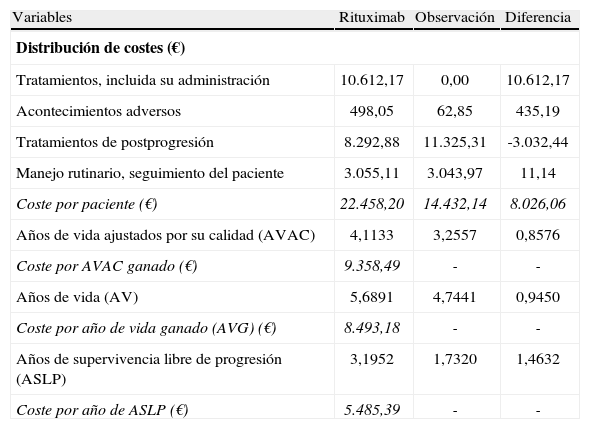
RESULTADOSAnálisis de costesEn el caso básico, el coste promedio por paciente en mantenimiento con rituximab fue de 22.458,20 € y de 14.432,14 € en el grupo de observación, con un coste incremental con rituximab de 8.026,60 € (tabla 5). Además de la adquisición del tratamiento, en el grupo de rituximab hubo mayores costes por acontecimientos adversos. Por el contrario, los costes fueron mayores en el grupo de observación en el capítulo de tratamientos posprogresión (3.032,44 € más) (tabla 5).
Resultados del caso básico del análisis determinístico del tratamiento de mantenimiento en segunda línea con rituximab, en comparación con observación, de los pacientes con linfoma no Hodgkiniano folicular (€ de mayo de 2006)
| Variables | Rituximab | Observación | Diferencia |
| Distribución de costes (€) | |||
| Tratamientos, incluida su administración | 10.612,17 | 0,00 | 10.612,17 |
| Acontecimientos adversos | 498,05 | 62,85 | 435,19 |
| Tratamientos de postprogresión | 8.292,88 | 11.325,31 | -3.032,44 |
| Manejo rutinario, seguimiento del paciente | 3.055,11 | 3.043,97 | 11,14 |
| Coste por paciente (€) | 22.458,20 | 14.432,14 | 8.026,06 |
| Años de vida ajustados por su calidad (AVAC) | 4,1133 | 3,2557 | 0,8576 |
| Coste por AVAC ganado (€) | 9.358,49 | - | - |
| Años de vida (AV) | 5,6891 | 4,7441 | 0,9450 |
| Coste por año de vida ganado (AVG) (€) | 8.493,18 | - | - |
| Años de supervivencia libre de progresión (ASLP) | 3,1952 | 1,7320 | 1,4632 |
| Coste por año de ASLP (€) | 5.485,39 | - | - |
AVAC: año de vida ajustado por calidad; AVG: año de vida ganado; ASLP: año de supervivencia libre de progresión.
En el caso básico, se obtuvieron más AVAC, más AV y más ASLP por paciente en mantenimiento con rituximab que con la simple observación (0,8576; 0,9450 y 1,4632, respectivamente) (tabla 5).
Coste-utilidad y coste-efectividad incrementalesEn el caso básico, el coste por AVAC ganado con el tratamiento más efectivo (mantenimiento con rituximab) fue de 9.358 €, el coste por AVG fue de 8.493 € y el coste por ASLP ganado fue de 5.485 € (tabla 5).
Análisis de sensibilidadLos resultados de los análisis de sensibilidad estuvieron, en todos los casos, por debajo de los 30.000 € por AVAC ganado, con valores que oscilaron entre 5.823 € (1 año de intervalo entre tratamientos posprogresión) o 7.263 € (extensión del beneficio del tratamiento hasta 30 años) y 22.160 € (reduciendo el beneficio del tratamiento a los dos años del ensayo clínico) por AVAC ganado (tabla 6).
Análisis de sensibilidad del modelo farmacoeconómico del tratamiento de mantenimiento en segunda línea del linfoma folicular avanzado con rituximab (coste por AVAC ganado; € de mayo de 2006)
| Escenarios | Coste por AVAC ganado (€) |
| Caso básico | 9.358 |
| Análisis probabilísticoa (caso básico: simple unifactorial) | 9.323 |
| IC del 95% | 9.282-9.364 |
| Extrapolación de los valores de supervivencia con una distribución Log-logística (caso básico: Weibull) | 8.685 |
| N.° de años del modelo en los que la supervivencia se calcula mediante Kaplan Meier (caso básico: 2 años) | |
| 1 año | 9.999 |
| 4 años | 9.541 |
| Duración del beneficio del tratamiento (caso básico: 5 años) | |
| 2 años | 22.160 |
| 3 años | 14.680 |
| 10 años | 7.263 |
| 20 años | 7.263 |
| 30 años | 7.263 |
| Horizonte temporal de la modelización (caso básico: 10 años) | |
| 4 años | 21.681 |
| 7 años | 10.210 |
| 15 años | 9.199 |
| 20 años | 9.192 |
| 30 años | 9.192 |
| Costes unitarios de los recursos sanitarios y de los acontecimientos adversos (caso básico: medios) | |
| Mínimos | 9.148 |
| Máximos | 9.715 |
| Utilidad del estado de supervivencia libre de progresión (caso básico: 0,805): 0,618 | 13.743 |
| Utilidad del estado de progresión de la enfermedad (caso básico: 0,618): 0,805 | 10.550 |
| Sin descuento anual de costes y beneficios (caso básico: 3,5%): 0,0% | 8.193 |
| Tratamientos posprogresión (caso básico: estimaciones del panel de expertos): los administrados en el ensayo clínico EORTC 20981 | 9.442 |
| N.° de años entre tratamientos posprogresión (tratamientos de rescate desde recaída al tratamiento de mantenimiento u observación) (caso básico: 2) | |
| 1 año | 5.823 |
| 5 años | 11.480 |
El análisis de sensibilidad probabilístico confirmó el resultado de coste-utilidad del caso básico. En este análisis, se dieron los siguientes resultados (medio ± desviación estándar; mínimomáximo): unos costes por paciente en mantenimiento con rituximab de 22.181,72 ± 1.885,58 € (15.296,55-28.981,40 €) y en observación 14.280,98 ± 1.781,79 € (8.282,25-21.912,79 €); y unos valores de AVAC con rituximab de 4,0694 ± 0,3818; 2,5045-5,1340) y con observación de 3,2336 ± 0,3159; 2,22084,2690). El coste promedio por AVAC ganado fue de 9.323€ (IC del 95% 9.282 €; 9.364 €). El rituximab fue más efectivo, con mayores costes que el grupo de observación, en el 100% de las simulaciones efectuadas, como puede apreciarse en la curva de aceptabilidad del coste-efectividad incremental, que estuvo en todas las simulaciones por debajo del umbral de 30.000 € por AVAC ganado18.
DISCUSIÓNDe acuerdo con los resultados del modelo, el tratamiento de mantenimiento con rituximab es coste-efectivo en los pacientes con linfoma folicular resistente o en recaída que responden al tratamiento de inducción, en comparación con la práctica habitual de observar la evolución de los pacientes.
En la valoración de estos resultados debemos considerar, en primer lugar, que se trata de un modelo teórico (que es, por definición, una simulación simplificada de la realidad) basado no obstante en los resultados de un ensayo clínico aleatorizado que comparó directamente las opciones estudiadas, con un diseño no pragmático. Por este motivo, cobra especial importancia la validación del modelo por un panel de expertos oncohematólogos españoles que estimaron la utilización de recursos en la práctica clínica en nuestro país, por lo que sus resultados deben considerarse como estimaciones válidas para los pacientes con las características de los incluidos en el ensayo clínico EORTC 20981, que pueden ser útiles como una herramienta para la toma de decisiones en la práctica clínica7.
Un aspecto que debe mencionarse es el hecho de que las utilidades de los estados de salud empleadas en el modelo se obtuvieron de un estudio del Reino Unido. Aunque las preferencias por los estados de salud pueden variar entre países, debido a factores culturales12 este riesgo es menor cuando se comparan países de similar nivel socioeconómico.
Por otra parte, también debe tenerse en cuenta que, gracias al modelo de transiciones, fue posible estimar de una manera más "realista" que con un modelo determinístico puro la evolución de la enfermedad a lo largo de 2-30 años19. Del mismo modo, deben señalarse como "fortalezas" del modelo que la estimación de los costes unitarios de los recursos sanitarios y de los acontecimientos adversos se hizo a partir de bases de datos españolas6,14 empleando GRD y que las utilidades se obtuvieron mediante una metodología adecuada, a partir de pacientes con linfoma folicular.
Para intentar minimizar las limitaciones del modelo, en el caso básico se tomaron premisas conservadoras y se hicieron análisis de sensibilidad simples unifactoriales y probabilísticos, que confirmaron la estabilidad de las premisas consideradas en el caso básico. En éste, los costes de los tratamientos posprogresión fueron mayores en el grupo de observación (3.032 € más). Esta diferencia se confirmó tanto con las estimaciones de los tratamientos posprogresión (tratamientos de rescate) del panel de expertos como cuando se utilizaron en el modelo los tratamientos administrados en el estudio EORTC 20981 (con costes adicionales en el grupo de observación de 2.910 €). A este respecto, debe mencionarse la gran variabilidad observada en los tratamientos posprogresión utilizados por los expertos consultados, lo que refleja la realidad de la práctica clínica habitual. Esta variabilidad no afectó a la estabilidad de los resultados del caso básico del análisis.
Además del estudio EORTC 20981, actualmente se dispone de resultados de otros tres ensayos clínicos en los que se evaluó la efectividad del tratamiento de mantenimiento con rituximab en pacientes con linfoma folicular: los estudios LYM-520
SAKK21 y GLSG-FCM22. En el modelo se utilizaron únicamente los datos del estudio EORTC 209815 porque proporciona una evidencia clínica de mayor calidad debido a su mayor tamaño muestral, lo que permitió encontrar diferencias estadísticamente significativas.
Únicamente se ha identificado un estudio de farmacoeconomía en el tratamiento de mantenimiento en segunda línea del linfoma folicular23, realizado con el mismo modelo utilizado en el presente estudio, obteniéndose un coste por AVAC ganado de 20.428 dólares canadienses (unos 13.000 €). La diferencia con el resultado del modelo español (9.358 € por AVAC ganado) debe achacarse tanto a las variaciones entre los sistemas sanitarios como a los distintos costes de los recursos de los dos países.
Es de interés poner en contexto el coste de unos 9.000 € por AVAC ganado, obtenido para el tratamiento de mantenimiento con rituximab de un paciente con linfoma folicular. Para ello, puede ser ilustrativo comparar este coste por AVAC ganado con los de fármacos de otros grupos terapéuticos. A este respecto, debe mencionarse en primer lugar que, según dos estudios españoles de los años 1995 y 1998, en nuestro país se utilizan por ejemplo fármacos hipolipemiantes financiados por el SNS, con un coste máximo por año de vida ganado que oscilaría entre los 66.000 y los 240.000 €24,25. Además, según una revisión del año 2.00218 otras intervenciones sanitarias estarían también por encima del coste por AVAC del mantenimiento con rituximab, como la vacunación neumocócica en el grupo de 5 a 44 años de edad (69.416 €)26, el tratamiento con alteplasa frente a estreptocinasa en el infarto de miocardio (10.870 72.471 €)27 o el tratamiento hormonal sustitutivo frente a no tratamiento en mujeres de 50 años de edad (19.562 €)28, en euros actualizados en el año 2006.
Los resultados de este análisis farmacoeconómico deberían confirmarse en ensayos clínicos pragmáticos y aleatorizados, en los que se comparasen directamente la eficacia, las utilidades, la tolerancia y el consumo de recursos sanitarios de las alternativas terapéuticas evaluadas. Mientras tanto, de acuerdo con los resultados del modelo, puede concluirse que, en comparación con la opción de "esperar y ver", el tratamiento de mantenimiento con rituximab (además de mejorar la supervivencia libre de progresión) proporcionaría más años de vida ajustados por su calidad (AVAC) a un coste medio por AVAC de 9.358 €, en los pacientes con linfoma folicular avanzado resistente o en recaída que han respondido anteriormente a CHOP o R-CHOP.
Grupo de Farmacoeconomía del Linfoma Folicular: Capote, Francisco J. (Hospital Universitario Puerta del Mar, Cádiz); Conde, Eulogio (Hospital Universitario Marqués de Valdecilla, Santander); Fernández Rañada, Jose M. (Hospital Universitario de La Princesa, Madrid); Giraldo, Pilar (Hospital Universitario Miguel Servet, Zaragoza); Gómez Codina, José (Hospital Universitario La Fe, Valencia); Provencio, Mariano (Hospital Universitario Puerta de Hierro, Madrid), Ríos, Eduardo (Hospital Virgen del Rocío, Sevilla); Rubio-Terrés, Carlos (HEALTH VALUE, Madrid); Rueda, Antonio (Hospital Virgen de la Victoria, Málaga); Varela, Cristina (Roche Farma, Madrid).
Correspondencia: Carlos Rubio Terrés. HEALTH VALUE. Health Economics and Research of Outcomes Consulting. C/ Virgen de Aránzazu, 21. 28034 Madrid. España. Correo electrónico: crubioterres@healthvalue.org.
Financiación: Estudio realizado con una ayuda a la investigación, sin restricciones, de Roche Farma, SA.