Analizar la estabilidad fisicoquímica y microbiológica de dos suspensiones orales de carbamazepina al 2,5 y al 5%.
MétodoLas suspensiones orales se elaboraron a partir de carbamazepina en polvo y los vehículos comerciales Ora-sweet SF® y Ora-plus®. Se realizaron controles de calidad físicos (pH, estado de la suspensión y características organolépticas), químicos (cromatografía líquida de alta resolución [HPLC]) y microbiológicos a los 2, 4 y 6 meses de la preparación.
ResultadosLa concentración a los 6 meses de las suspensiones de carbamazepina al 2,5% y al 5% resultó de 22,9mg/ml y de 45,9mg/ml, respectivamente, con valores de riqueza obtenidos mediante la cromatografía líquida de alta resolución se encontraron entre el 90 y el 110%, tal y como exige la Farmacopea Americana 23 NF18. Durante el período del estudio no se observó modificación de los parámetros físicos ni crecimiento en los cultivos microbiológicos realizados.
ConclusionesAmbas suspensiones orales son estables física, química y microbiológicamente durante al menos 6 meses a temperatura ambiente y en frasco de vidrio topacio.
To assess the physical, chemical and microbiological stability of two oral suspensions of carbamazepine at concentrations of 2.5% and 5%.
MethodsBoth oral suspensions were compounded from powdered carbamazepine and Ora-Sweet SF® and Ora-Plus® commercial compounding excipients. At the 2, 4 and a 6-month marks, different quality assays were performed, comprising physical (pH, state of the suspension, organoleptic properties), chemical (HPLC) and microbiological assays.
ResultsThe final concentration at 6 months for both the 2.5% and 5% carbamazapine suspensions was 22.9 and 45.9mg/ml respectively, with calculated richness values between 90 and 110% fulfilling USP23 NF18 requirements. No changes in physical properties and no culture growth were observed during the study period.
ConclusionBoth oral suspensions are physically, chemically and microbiologically stable for at least 6 months when preserved at room temperature in amber glass flasks.
La carbamazepina es el antiepiléptico de elección en las epilepsias parciales y las convulsiones tonicoclónicas generalizadas; además, está indicada en la neuralgia del trigémino y del glosofaríngeo, la enfermedad maniacodepresiva y los trastornos graves de conducta. Por su baja actividad depresora central está especialmente recomendada en los niños, con un mejor perfil de efectos adversos que la fenitoína y el fenobarbital. Presenta una buena biodisponibilidad por vía oral, favorecida por la presencia de alimentos y que resulta ser mayor para las formas farmacéuticas líquidas1. Su metabolismo es principalmente hepático (98%), siendo el principal metabolito el 10,11-epóxido de carbamazepina que es farmacológicamente activo. Presenta autoinducción enzimática dosis dependiente que resulta en una amplia variabilidad interindividual. En este sentido la individualización de la dosis mediante la monitorización de las concentraciones plasmáticas de carbamazepina contribuye a la optimización de la eficacia y la seguridad de los tratamientos.
En España únicamente hay comercializadas formas orales sólidas de carbamazepina (Tegretol®, Novartis Farmacéutica, Barcelona, España en comprimidos de 200 y de 400mg), a diferencia de lo que ocurre en países europeos en los que se encuentra disponible una suspensión oral de carbamazepina al 2%. La disponibilidad de una forma oral líquida de carbamazepina resulta de enorme utilidad para la dosificación más precisa del fármaco cuando se requiere individualizar la dosis en función de los niveles plasmáticos, facilitar la administración en los grupos de pacientes con problemas de deglución o para su administración en pacientes pediátricos. Así, ante esta laguna terapéutica obviada por la industria farmacéutica corresponde al farmacéutico la elaboración de una forma oral líquida que permita la administración de este fármaco en los grupos de población comentados. En la mayoría de los casos se parte de las presentaciones comercializadas de carbamazepina (Tegretol® en comprimidos) para la elaboración de estas formas orales líquidas, con los consiguientes problemas relacionados con la normativa actual para la elaboración de los medicamentos2, así como por la incorporación de excipientes no deseados al producto final. Ante esta situación se planteó realizar un estudio de estabilidad (física, química y microbiológica) de dos suspensiones orales de carbamazepina (el 2,5–5%), partiendo del principio activo puro.
MétodosSe prepararon dos suspensiones orales de carbamazepina a unas concentraciones del 2,5% (25mg/ml) y del 5% (50mg/ml). La elaboración de las suspensiones se realizó atendiendo a lo establecido en las normas de correcta elaboración de las fórmulas magistrales2. La materia prima empleada fue carbamazepina en polvo (Carbamazepina Ph Eur®, Laboratorio Fagrón Ibérica, Barcelona, España) y como excipientes se emplearon una mezcla al 50% de Ora-sweet SF® y de Ora-plus® (Paddock Laboratories, Minnesota, EE.UU.). El primero es un vehículo para jarabes sin azúcar y sin alcohol que contiene sorbitol, glicerina y sacarina sódica; mientras que Ora-plus® es un vehículo para suspensiones orales que contiene distintos agentes suspensores como carboximetilcelulosa sódica, celulosa microcristalina, goma xantan y carragenanos, entre otros. El proceso de elaboración de las suspensiones fue el siguiente: se pesó la cantidad necesaria de carbamazepina en polvo y se pulverizó en un mortero durante tres minutos hasta obtener un polvo fino. A continuación se incorporó el polvo obtenido a una mezcla al 50% de Ora-sweet® y de Ora-plus®, se envasó la suspensión resultante en un frasco de vidrio topacio y se etiquetó adecuadamente. La suspensión de carbamazepina se conservó a temperatura ambiente (24–27°C) durante todo el período de estudio.
Para determinar la estabilidad de las fórmulas preparadas se realizaron los siguientes controles de calidad a las 24h de la elaboración y a los 2, a los 4 y a los 6 meses:
- a)
Controles físicos: determinación del pH (pH meter 2000™ (Crison, Barcelona, España), calibrado: 4 y 7,01), el estado de la suspensión, el desprendimiento de gases y las características organolépticas (olor, coloración, etc.).
- b)
Control químico: determinación de la riqueza mediante la cromatografía líquida de alta resolución (HPLC). El sistema utilizado para el análisis fue el HPLC Hitachi D-7000™ (Hitachi High-Tech, Tokyo, Japón) y las condiciones cromatográficas empleadas fueron las siguientes:
- •
Fase móvil: tampón fosfato(pH 5,3):acetonitrilo:metanol (55:17:28).
- •
Columna: LICHROCART; LiChrospher 100 RP-18™ (5ìm), (Merck KGaA, Darmstadt, Alemania).
- •
Detección ultravioleta a 210nm.
- •
Volumen de inyección: 20μl.
- •
Flujo: 20ml/min.
- •
Se elaboraron rectas de calibrado para cada una de las determinaciones realizadas durante el tiempo del estudio. Para la obtención de las rectas de calibrado se prepararon patrones líquidos de 10, 20, 50, 100 y 200ppm en metanol calidad HPLC (LabScan Laboratories, Gliwice Polonia), empleando el mismo lote de carbamazepina utilizado en las fórmulas magistrales (fig. 1).
Finalmente, el cálculo de las concentraciones de las muestras se realizó mediante extrapolación de las áreas de los picos en las rectas de calibrado elaboradas a partir de los cromatogramas de los patrones.
- c)
Controles microbiológicos: se estudió el crecimiento de microorganismos aerobios y anaerobios. Para esto se realizó una siembra directa en agar-sangre, agar-polivitex y medio SCS de una alícuota de 1ml de las suspensiones elaboradas. Cada ensayo se realizó por duplicado, incubándose a 37°C durante 48h antes de comprobar el crecimiento bacteriano en el medio.
Las suspensiones de carbamazepina al 2,5% y al 5% presentaron una concentración inicial de carbamazepina de 22,9 y de 49,5mg/ml, respectivamente, lo que supone una desviación respecto a la concentración inicial teórica del 0,08 y del 0,01%, respectivamente. En cuanto a las características físicas y organolépticas, ambas suspensiones presentaron un color rosa claro, un tenue olor afrutado, una ligera viscosidad, una fácil redispersión de la suspensión, una ausencia de burbujas y un pH de 4,5 (±0,2). Estas características resultaron ser además las características físicas de los excipientes empleados, de forma que la carbamazepina en sí no modificó las propiedades organolépticas del preparado para las concentraciones ensayadas. Mientras que Ora-plus® fue prácticamente inodoro y blanquecino, Ora-sweet SF® aportó el color rosáceo, el olor característico y el sabor dulce al preparado. Ambos excipientes presentaron un pH cercano a 4,5 en comparación al pH más básico de la carbamazepina (pH: 7,0). Durante el tiempo del estudio no se observó modificación de los parámetros físicos estudiados en ninguno de los ensayos realizados.
En cuanto a los ensayos microbiológicos no hubo crecimiento en ninguno de los cultivos microbiológicos realizados a lo largo del estudio, aun cuando la conservación de las suspensiones siempre se realizó a temperatura ambiente. Los excipientes utilizados contenían conservantes y cumplían los requerimientos de la farmacopea americana en cuanto a la contaminación microbiológica, por lo que no era de esperar problemas en este sentido.
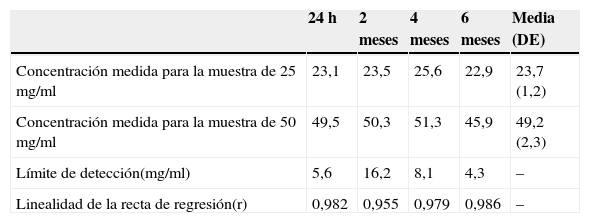
En la tabla 1 se muestran los resultados de los controles químicos mediante la HPLC en los que se determinaron las concentraciones de carbamazepina en ambas suspensiones. Sobre la base de las concentraciones medidas se calculó la riqueza en carbamazepina para cada suspensión en cada uno de los ensayos realizados. Para la suspensión al 2,5% los resultados fueron al inicio del 92,4%, a los 2 meses del 94%, a los 4 meses del 102,4% y a los 6 meses del 91,6%; mientras que para la suspensión al 5% los resultados fueron al inicio del 99%, a los 2 meses del 101,6%, a los 4 meses del 103,6% y a los 6 meses del 92,7%. Para ambas suspensiones los valores de riqueza obtenidos en todos los ensayos realizados se encontraron entre el 90 y el 110%, tal y como exige la farmacopea americana 23 NF183; por lo tanto, podemos garantizar estabilidad química hasta los 6 meses, si bien es cierto que a partir de entonces las concentraciones parecen disminuir y existe cierta tendencia al desdoblamiento de los picos en los controles mediante la HPLC.
Concentraciones de carbamacepina (mg/ml) durante el periodo de estudio
| 24h | 2 meses | 4 meses | 6 meses | Media (DE) | |
| Concentración medida para la muestra de 25mg/ml | 23,1 | 23,5 | 25,6 | 22,9 | 23,7 (1,2) |
| Concentración medida para la muestra de 50mg/ml | 49,5 | 50,3 | 51,3 | 45,9 | 49,2 (2,3) |
| Límite de detección(mg/ml) | 5,6 | 16,2 | 8,1 | 4,3 | – |
| Linealidad de la recta de regresión(r) | 0,982 | 0,955 | 0,979 | 0,986 | – |
DE: desviación estándar; r: coeficiente de correlación.
La disponibilidad de una formulación oral líquida de carbamazepina resulta de especial interés, dada la ausencia de un medicamento con estas características. La carbamazepina presenta una baja solubilidad en el agua, lo que obliga a realizar suspensiones para poder administrar el fármaco a través de formas orales líquidas. Así, en las diferentes guías para la administración de medicamentos por sonda nasogástrica se recomienda elaborar una suspensión extemporánea de carbamazepina al 4%4 y diluirla en un volumen similar de agua para minimizar la adherencia de carbamazepina a las sondas nasogástricas utilizadas5. Esta formulación extemporánea se suele elaborar a partir de los comprimidos y utilizando como excipiente el jarabe simple, debiéndose conservar el preparado en la nevera y con un período de validez de 3 meses6. Los estudios publicados sobre la elaboración y la estabilidad de una forma oral líquida de carbamazepina son escasos y muy antiguos. Uno de los principales estudios es el de Burckart et al (1981), en el que se estudió la estabilidad de una suspensión oral de carbamazepina al 4% en sorbitol7 al 70%, obteniendo una suspensión de fácil redispersión y con un período de validez de 90 días. El problema de este preparado es la elevada concentración de sorbitol que puede producir molestias intestinales y diarreas importantes en los pacientes. Aunque nuestra formulación contiene sorbitol debido al Ora-sweet®, este se encuentra con concentraciones inferiores al 10% con un riesgo menor de producir diarreas en los pacientes. Los resultados obtenidos en nuestro estudio permiten ampliar el período de validez de la suspensión de carbamazepina y proporciona una metodología clara para la elaboración de la suspensión oral. La utilización de un excipiente sin sacarosa permite su administración en pacientes diabéticos y el aporte de conservantes del excipiente utilizado reduce el riesgo de contaminación bacteriana del preparado, lo que nos permite aplicar a la fórmula un período de validez mayor. Sería necesario confirmar la idoneidad de esta formulación mediante estudios de biodisponibilidad y/o estudios de efectividad clínica.
En conclusión, ambas suspensiones de carbamazepina elaboradas (al 2,5% y al 5%) son estables física, química y microbiológicamente durante al menos 6 meses a temperatura ambiente y en frasco de vidrio topacio, lo que permite establecer con garantías un período de validez de 6 meses a la fórmula magistral. Esto nos permite disponer de una forma oral líquida de carbamazepina a unas concentraciones normalizadas para cubrir las necesidades de los pacientes que presentan problemas para la toma de formas orales sólidas de carbamazepina o que las dosis que requieren no se adaptan a las presentaciones comercializadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.



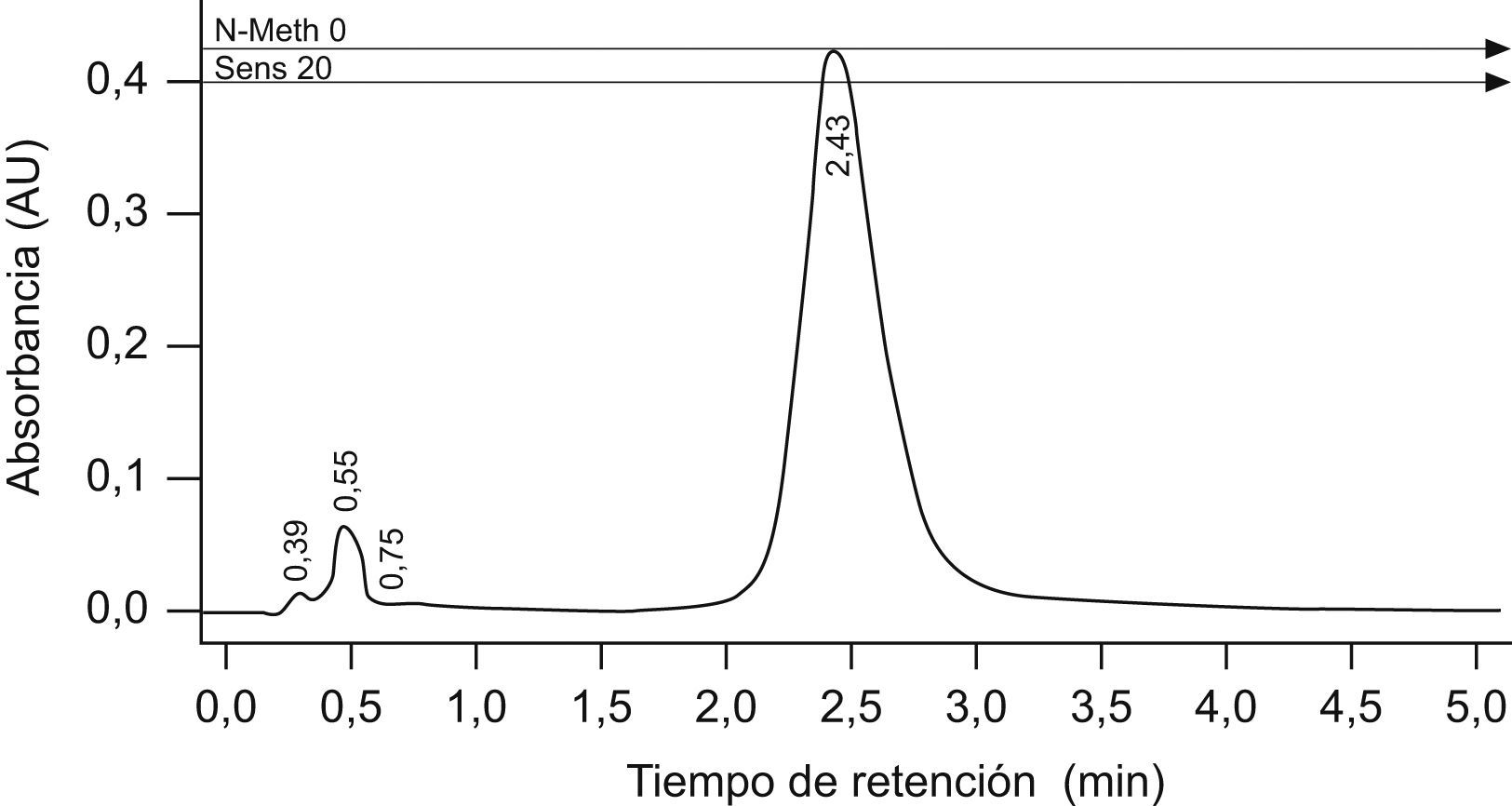
![Cromatograma de la cromatografía líquida de alta resolución para carbamazepina. Tiempos de retención (TR) de la fase móvil (TR=0,39; TR=0,55 y TR=0,75) y del patrón de carbamazepina (100ppm [TR=2,43]). Cromatograma de la cromatografía líquida de alta resolución para carbamazepina. Tiempos de retención (TR) de la fase móvil (TR=0,39; TR=0,55 y TR=0,75) y del patrón de carbamazepina (100ppm [TR=2,43]).](https://static.elsevier.es/multimedia/11306343/0000003500000001/v1_201305141053/S1130634310001558/v1_201305141053/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9+PsbGOJH+vufF49m/OrBrE=)



