ORIGINALES
ALGUNAS CONSIDERACIONES PRÁCTICAS RESPECTO A LA DETERMINACION DE CICLOSPORINAY SUS METABOLITOS EN SANGRE DE PACIENTESCON TRASPLANTE HEPATICO
Pérez Suárez L. F.,Doctor en Ciencias Biológicas. Especialista en Bioquímica Clínica.Rodríguez Nóvoa S.,Licenciada en Ciencias Biológicas. Residente de Bioquímica Clínica.Tutor Valcarce J. C.,Doctor en Farmacia. Licenciado en Ciencias Biológicas. Especialista en Bioquímica Clínica.
Laboratorio Central. Hospital General de Galicia-Clínico Universitario. Santiago de Compostela.
Correspondencia: J. Carlos Tutor. Laboratorio Central. Hospital General de Galicia-Clínico Universitario. c/ Galeras, s/n. 15705 Santiago de Compostela.
Fecha de recepción: 29-09-98
Palabras clave:
Ciclosporina. Acumulación de metabolitos. Colestasis. Inmunoanálisis no isotópicos.
Resumen:
Se determinaron las concentraciones de ciclosporina y metabolitos en 430 muestras de sangre de 39 pacientes con trasplante hepático, mediante los inmunoanálisis de polarización de fluorescencia (FPIA-Policlonal y FPIA-Monoclonal) y de multiplicación enzimática (EMIT). Se obtuvo una elevada correlación (r=0,970) entre los resultados de inmunoanálisis específicos FPIA-Monoclonal y EMIT, aunque la diferencia entre las medias y el error de la estima supera los valores clínicamente aceptables según los criterios del Colegio Norteamericano de Patólogos. No se encontró un aumento de la relación metabolitos/ciclosporina (índice de metabolitos) en los casos en que se suponía una eliminación alterada de ciclosporina. Se sugiere que esto se debería a que en la colestasis aumenta la concentración de metabolitos de segunda generación y el inmunoanálisis no específico utilizado reacciona con metabolitos de primera generación. El FPIA-Policlonal no parece un método adecuado para la identificación de pacientes con una alterada eliminación biliar de ciclosporina.
PRACTICAL CONSIDERATIONS IN RELATION TO THE DETERMINATION OF CICLOSPORINE AND ITS METABOLITES IN THE BLOOD OF LIVER TRANSPLANT PATIENTS
Key words:
Ciclosporine. Metabolite accumulation. Cholestasis. Non-isotopic immunoassays.
Summary:
Concentrations of ciclosporine and its metabolites were determined in 430 blood samples from 39 liver transplantation patients by fluorescent polarization immunoanalysis (FPIA-polyclonal and FPIA-monoclonal) and enzymatic multiplication (EMIT). The correlation between the results of specific FPIA-monoclonal and EMIT immunoanalysis was close (r=0.970), but the difference between means and the standar error of the estimate exceed the values considered clinically acceptable by the North American College of Pathologists. No increase was found in the metabolite/ciclosporine ratio (metabolite index) in patients who were assumed to have disturbances in ciclosporine elimination. It is suggested that this is because the concentration of second-generation metabolites increases in cholestasis, whereas the non-specific immunoanalysis used reacts with first-generation metabolites. FPIA-polyclonal does not seem to be a suitable method for identifying patients with disturbances in the bile elimination of ciclosporine.
INTRODUCCION
La ciclosporina es ampliamente metabolizada a nivel hepático, así como en riñón e intestino delgado, por el sistema enzimático microsomal del citocromo P450, con formación de más de 30 metabolitos como resultado de distintos procesos de oxidación, hidroxilación, demetilación, carboxilación y ciclación (1). La contribución de estos metabolitos a la acción inmunosupresora y tóxica de la ciclosporina es un tema debatido (2-7), y distintos comités de expertos han consensuado la recomendación de utilizar métodos analíticos específicos para la monitorización de la ciclosporina (4, 8-11). En cualquier caso, los resultados de diferentes autores sugieren el interés clínico de la determinación adicional de los metabolitos de la ciclosporina, sobre todo en pacientes con una función hepática deteriorada (3, 6, 12-14).
Aunque la cromatografía líquida de alta resolución (HPLC) se señala frecuentemente en la literatura como el método de referencia para la determinación de ciclosporina en sangre, en realidad aún no se ha establecido para esta variable un método definitivo o un método de referencia de acuerdo con los criterios de la Federación Internacional de Química Clínica (11). Distintos programas internacionales de control de calidad han puesto en evidencia para este tipo de técnicas analíticas la mayor variabilidad (15), probablemente debida a la utilización de distintos procedimientos metodológicos y a su mayor complejidad. Este hecho, unido a razones de coste de instrumentación y simplicidad operativa, hace que los distintos tipos de inmunoanálisis, a pesar de sus limitaciones, sean cada vez más utilizados rutinariamente para la monitorización de la ciclosporina (9). La significativa reacción cruzada de los anticuerpos policlonales no específicos con distintos metabolitos de la ciclosporina permite hacer una evaluación de estos, al realizar esta determinación en paralelo con la de ciclosporina mediante un inmunoanálisis específico utilizando anticuerpos monoclonales. Evidentemente los resultados obtenidos mediante distintos inmunoanálisis no específicos no serían necesariamente concordantes, ya que los anticuerpos utilizados presentan diferentes patrones de reactividad cruzada con los metabolitos de la ciclosporina (6).
En la presente comunicación se hace un estudio de la aplicabilidad del método Abbott de polarización de fluorescencia no específico (FPIA-Policlonal), para la evaluación de la acumulación de metabolitos de ciclosporina en pacientes con trasplante hepático, utilizado en paralelo con otros inmunoanálisis no isotópicos específicos como el método Abbott de polarización de fluorescencia (FPIA-Monoclonal) y el método Behring-Syva mediante conjugados enzima-anticuerpo (EMIT). Asimismo, se hacen algunas consideraciones prácticas en relación a la utilización de estos dos inmunoanálisis específicos.
MÉTODO
Se determinaron las concentraciones de ciclosporina y metabolitos en 430 muestras de sangre recogidas en tubos Vacutainer® conteniendo EDTA-K3, inmediatamente antes de la administración de la dosis matinal, de 39 pacientes a los que se había realizado un trasplante hepático en nuestro hospital.
La técnica FPIA-Policlonal se desarrolló siguiendo las instrucciones del fabricante y la técnica FPIA-Monoclonal ligeramente modificada (16) en un analizador Abbott TDx. La técnica EMIT se desarrolló siguiendo las instrucciones del fabricante (Behring-Syva) en un analizador centrífugo Cobas Fara II (Roche Diagnostica) con un programa facilitado por el fabricante de los reactivos. La concentración de metabolitos se estimó mediante la expresión: [Metabolitos] = [FPIA-Policlonal] [EMIT]. Se denominó «índice de metabolitos» al cociente [Metabolitos]/[EMIT]. La concentración de ciclosporina equivalente a la obtenida por HPLC se calculó mediante el procedimiento de Roberts et al (17): [HPLC-equivalente] = [FPIA-Monoclonal] 0,2 * ([FPIA-Policlonal] [FPIA-Monoclonal]).
Las concentraciones séricas de albúmina y bilirrubina, así como la actividad catalítica a 37 oC de la aspartato aminotransferasa (AST, EC 2.6.1.1), alanino aminotransferasa (ALT, EC 2.6.1.2), lactato deshidrogenasa (LDH, EC 1.1.1.27), glutamato deshidrogenasa (GLDH, EC 1.4.1.3), gammaglutamiltransferasa (GGT, EC 2.3.2.2) y colinesterasa (CHE, EC 3.1.1.8) se determinaron con métodos estandarizados utilizando reactivos de Boehringer Mannheim GmbH en un analizador Hitachi 717.
Como los datos no presentaron una distribución gaussiana, realizada la comprobación del ajuste mediante los coeficientes de sesgo y curtosis, se utilizaron pruebas estadísticas no paramétricas (prueba de Wilcoxon y coeficiente de correlación de Spearman). Los estudios de regresión lineal se realizaron mediante el método de Passing-Bablok. La significación clínica de la diferencia entre las medias y del error de la estima se estableció de acuerdo con las normas del Colegio Norteamericano de Patólogos (18, 19), en función del rango terapéutico de concentraciones de ciclosporina en nuestro laboratorio.
RESULTADOS
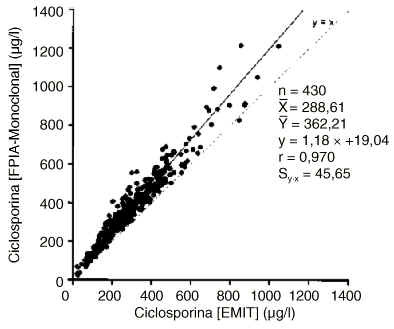
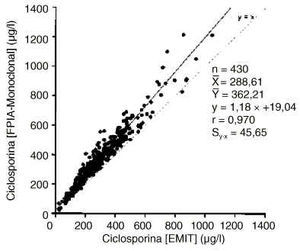
En la figura 1 se presenta el estudio de correlación y regresión entre los valores obtenidos para la concentración de ciclosporina mediante los métodos específicos EMIT y FPIA-Monoclonal. Los resultados de ambas técnicas no son transferibles ya que la diferencia entre las medias es mayor que el error clínicamente aceptable. Asimismo el error de la estima es superior al clínicamente aceptable, por lo que los valores no pueden ser interconvertidos mediante la correspondiente ecuación de regresión.
Figura 1.--Correlación y regresión entre las concentraciones de ciclosporina obtenidas mediante las técnicas FPIA-Monoclonal y EMIT.
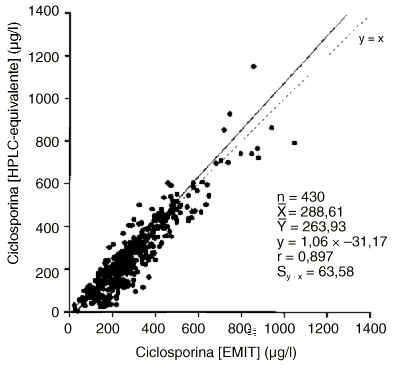
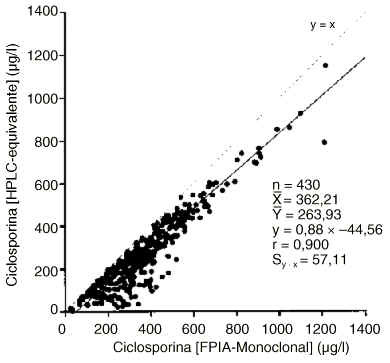
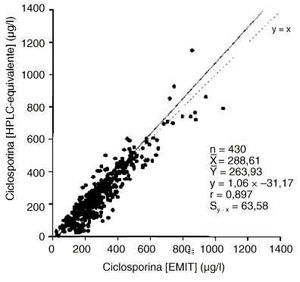
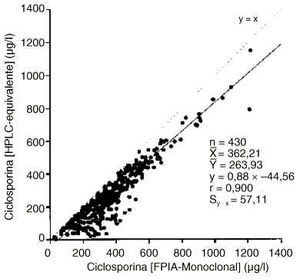
En las figuras 2 y 3 se muestran las correlaciones y regresiones encontradas entre los resultados proporcionados para la concentración de ciclosporina por los métodos EMIT y FPIA-Monoclonal con los valores calculados HPLC-equivalente. En ambos casos la diferencia entre las medias es mayor que el error clínicamente aceptable y el error de la estima es asimismo superior al clínicamente aceptable.
Figura 2.--Correlación y regresión entre las concentraciones de ciclosporina HPLC-equivalente y mediante la técnica EMIT.
Figura 3.--Correlación y regresión entre las concentraciones de ciclosporina HPLC-equivalente y mediante la técnica FPIA-Monoclonal.
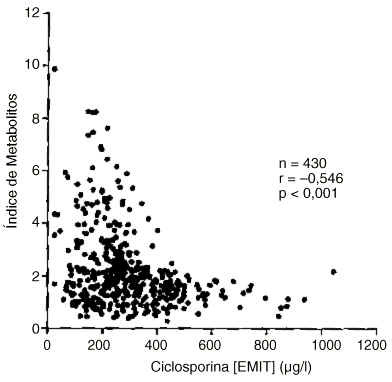
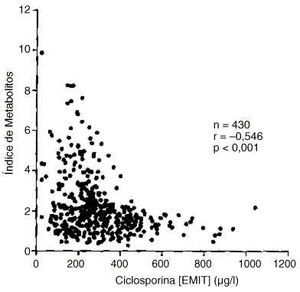
Se obtuvo una correlación positiva altamente significativa entre las concentraciones de ciclosporina y de metabolitos (r=0,485; p<0,001). Sin embargo, el índice de metabolitos presentó una correlación negativa altamente significativa con la concentración de ciclosporina (figura 4). Por otra parte, el índice de metabolitos estaba correlacionado positivamente con la concentración de metabolitos (r=0,608; p<0,001). Asimismo, el índice de metabolitos presentó una correlación altamente significativa con el cociente de concentraciones de ciclosporina FPIA-Monoclonal/EMIT (r=0,458; p<0,001).
Figura 4.--Correlación del índice de metabolitos con la concentración de ciclosporina (EMIT).
En la tabla 1 se indican los coeficientes de correlación obtenidos entre el índice de metabolitos y la concentración de ciclosporina y de metabolitos, con los distintos tests bioquímicos de funcionalismo hepático utilizados. Teniendo en cuenta los resultados de otros autores (5, 6, 12, 20), llama la atención la correlación negativa encontrada entre el índice de metabolitos y la concentración sérica de bilirrubina (r = 0,202; p<0,01).
Tabla 1. Coeficientes de correlación obtenidos entre el índice de metabolitos y la concentración de ciclosporina y de metabolitos, con las distintas pruebas bioquímicas de funcionalismo hepático utilizados (n=208). | ||||||||
| Bilirrubina | Albúmina | AST | ALT | GGT | LDH | GLDH | CHE | |
| Índice de metabolitos | 0,202(**) | 0,057 | 0,006 | 0,159(*) | 0,123 | 0,112 | 0,124 | 0,134 |
| Ciclosporina (µg/l) | 0,113 | 0,009 | 0,139(*) | 0,021 | 0,090 | 0,215(**) | 0,161(*) | 0,033 |
| Metabolitos (µg/l) | 0,089 | 0,129 | 0,142(*) | 0,190(**) | 0,056 | 0,088 | 0,251(**) | 0,036 |
| (**)p<0,01; (*)p<0,05. | ||||||||
En la tabla 2 se presentan los resultados obtenidos para las concentraciones de ciclosporina y de metabolitos, el índice de metabolitos y el cociente de concentraciones FPIA-Monoclonal/EMIT, haciendo una dicotomía de los datos en función de la concentración de bilirrubina (mayor o menor de 3,5 mg/dl), que es el valor de corte establecido por Christians et al (6) para identificar pacientes con alterada eliminación de ciclosporina. No se encontró una diferencia estadísticamente significativa entre los resultados de ambas subpoblaciones.
Tabla 2. Concentraciones de ciclosporina y de metabolitos, índice de metabolitos y cociente [FPIA-Monoclonal]/[EMIT], haciendo una dicotomía en función de la concentración de bilirrubina. | ||||
| Bilirrubina<3,5 mg/dl (n=161) | Bilirrubina³3,5 mg/dl (n=47) | |||
| Media±EEM | Mediana | Media±EEM | Mediana | |
| Índice de metabolitos | 2,05±0,10 | 1,66 | 1,82±0,17 | 1,71 |
| Ciclosporina (µg/l) | 333,02±12,59 | 298,00 | 333,00±27,56 | 287,00 |
| Metabolitos (µg/l) | 617,43±28,67 | 577,00 | 581,15±61,62 | 548,00 |
| [FPIA-Monoclonal]/[EMIT] | 1,27±0,01 | 1,25 | 1,25±0,02 | 1,22 |
| EEM: error estándar de la media. | ||||
DISCUSION
De acuerdo con los resultados de otros autores (8, 21, 22), los valores obtenidos para la concentración de ciclosporina mediante la técnica FPIA-Monoclonal fueron mayores que los de la técnica EMIT (figura 1), existiendo una diferencia estadística y clínicamente significativa, por lo que no son transferibles. Esto se debería a que el anticuerpo utilizado en el FPIA-Monoclonal presenta una mayor reactividad cruzada con distintos metabolitos de ciclosporina (9), aunque también ha de considerarse el posible efecto del material de calibración de ambas técnicas (23).
La consideración del error de la estima proporciona una información esencial en la interpretación de los análisis de regresión lineal para comparación de distintos métodos analíticos de ciclosporina (24). Aunque la ordenada en el origen (error constante) es inferior al límite de detección del FPIA-Monoclonal (25 µg/l) y la pendiente (error proporcional) ha de considerarse discreta, el error de la estima (Sy·x = 45,6 µg/l) es mayor que el clínicamente aceptable, por lo que los resultados FPIA-Monoclonal y EMIT, no pueden ser interconvertidos mediante la correspondiente ecuación de regresión.
Cuando se compararon los resultados de ciclosporina de las técnicas EMIT y FPIA-Monoclonal con los valores HPLC-equivalente (figuras 2 y 3), aumentaron significativamente los errores de la estima, lo cual dificulta la extracción de conclusiones. Sin embargo, es para concentraciones menores de 350 µg/l cuando más frecuentemente los inmunoanálisis específicos conducirían a una mayor sobreestimación proporcional de la concentración de ciclosporina. La variabilidad de la concentración de metabolitos es la principal fuente de errores positivos de los inmunoanálisis monoclonales (25), y según nuestros resultados para concentraciones de ciclosporina menores de 350-400 µg/l la proporción relativa de metabolitos tendería frecuentemente a aumentar de forma significativa (figura 4). Es, por tanto, para este intervalo de concentraciones en el que sobre todo el FPIA-Monoclonal, que es menos específico que el EMIT, podría proporcionar una mayor sobreestimación de los resultados. De hecho, se encontró una correlación altamente significativa (p < 0,001) del cociente [FPIA-Monoclonal]/[EMIT] con el índice de metabolitos.
Como ya se indicó anteriormente, en el grupo de pacientes estudiado se encontró una correlación estadísticamente significativa de signo negativo entre el índice de metabolitos y la concentración de ciclosporina (figura 4). Un hecho análogo ha sido observado en pacientes con trasplante renal, y podría ser explicado en función de la posible inhibición de la ciclosporina sobre su propio metabolismo (26, 27) por inactivación del sistema monooxigenásico citocromo P450 dependiente (28).
Es bien conocido que la colestasis se asocia con una acumulación de metabolitos de la ciclosporina en sangre (5, 6, 13, 29). Al considerar la correlación del índice de metabolitos con los test bioquímicos de colestasis (gamma GT y bilirrubina), capacidad de síntesis hepática (albúmina y CHE) y daño hepatocelular (AST, ALT, LDH y GLDH), llama la atención el modesto coeficiente de correlación negativo, aunque estadísticamente significativo, obtenido con la bilirrubina. Aunque algunos autores cuestionan el valor de esta variable bioquímica como marcador de la capacidad excretora del hígado en este tipo de pacientes (30), la evolución en paralelo de la acumulación de metabolitos de la ciclosporina y la concentración de bilirrubina es un dato bien documentado (6, 13, 20). En este sentido, Christians et al (6) utilizan un punto de corte para la concentración de bilirrubina de 3,5 mg/dl en la diferenciación de pacientes con alta o baja probabilidad de alterada eliminación de la ciclosporina y, por tanto, aumentada o no concentración de metabolitos en sangre. Sin embargo, como se desprende de los resultados señalados en la tabla 2, no se encontraron diferencias estadísticamente significativas para las concentraciones de ciclosporina y de metabolitos, índice de metabolitos y cociente [FPIA-Monoclonal]/[EMIT], al hacer una dicotomía de los datos en función de la concentración de bilirrubina.
Los metabolitos de primera generación de la ciclosporina proceden directamente de ésta, mientras los metabolitos de segunda generación derivan de los de primera generación. En pacientes con función hepática deteriorada, particularmente colestasis, se produce un incremento selectivo de las concentraciones en sangre y orina de metabolitos de segunda generación (AM1A, AM19, AM1c9), sin que se afecten significativamente las concentraciones de metabolitos de primera generación (AM1, AM9, AM4n) o de ciclosporina (5, 6). Probablemente, los metabolitos normalmente excretados por vía biliar se ven sometidos a una prolongada permanencia a nivel circulatorio, lo que facilitaría su ulterior metabolización a derivados de segunda generación (5). Este es un hecho de interés en el momento de explicar nuestros resultados, ya que el FPIA-Policlonal presenta la mayor reactividad con los metabolitos de primera generación, sobre todo AM1 y AM9 (17, 25, 31). Por lo tanto, con el inmunoanálisis no específico utilizado por nosotros, el índice de metabolitos calculado correspondería a la proporción relativa de derivados de la ciclosporina de primera generación, que parece lógico que tienda a disminuir al aumentar el grado de colestasis y favorecerse su paso a metabolitos de segunda generación.
A modo de conclusión puede señalarse que las técnicas FPIA-Monoclonal y EMIT proporcionan unos resultados para la concentración de ciclosporina que no son transferibles ni interconvertibles, lo cual no está de acuerdo con lo señalado por Witzke et al (32) sobre su posible equivalencia desde un punto de vista clínico. En cualquier caso, no se encontró una variación del cociente [FPIA-Monoclonal]/[EMIT] en función del grado de disfunción hepática, de modo análogo a lo reportado por estos autores (32). Aunque mediante HPLC se obtiene una información más detallada del perfil de los metabolitos de ciclosporina, para labores asistenciales se ha sugerido la posible utilización de inmunoanálisis no específicos (5, 6). No obstante, el FPIA-Policlonal no parece un método adecuado para la evaluación de una alterada eliminación de ciclosporina por efecto de la disfunción hepática en pacientes trasplantados.
AGRADECIMIENTOS
Se agradece a J. Pedreira su colaboración en la toma y procesamiento de las muestras.
BIBLIOGRAFIA
1. Wencer RM. Structures of cyclosporine and its metabolites. Transplant Proc 1990;22:1104-8.
2. Yatscoff RW, Rosano TG, Bowers LD. The clinical significance of cyclosporine metabolites. Clin Biochem 1991;24:23-35.
3. Humbert H. Metabolites of ciclosporine: blood and tissue levels. Biological activity. Nucl Med Biol 1990;17:723-7.
4. Kahan B, Shaw LM, Holt D, Grevel J, Johnston A. Consensus document: Hawk''s Meeting on Therapeutic Drug Monitoring of Cyclosporine. Clin Chem 1990;36:1510-6.
5. Bleck JS, Schlitt HJ, Christians U, et al. Cyclosporine metabolite pattern in blood and urine of kidney graft patients in relation to liver function. Eur J Clin Pharmacol 1991;40:565-9.
6. Christians U, Kohlhaw K, Sürig T, et al. Parallel blood concentrations of second-generation cyclosporine metabolites and bilirubin in liver graft recipients. Ther Drug Monit 1995;17:487-98.
7. Christians U, Sewing KF. Alternative cyclosporine metabolic pathways and toxicity. Clin Biochem 1995;28:547-59.
8. Shaw LM, Yatscoff RW, Bowers LD, et al. Canadian Consensus Meeting on Cyclosporine Monitoring: Report of the Consensus Panel. Clin Chem 1990; 36:1841-6.
9. Holt DW, Johnston A, Roberts NB, Tredger JM, Trull AK. Methodological and clinical aspects of cyclosporine monitoring: Report of the Association of Clinical Biochemists Task Force. Ann Clin Biochem 1994;31:420-46.
10. Felipe C, Villafruela JJ, Rengel M. Consenso para la monitorización de ciclosporina. Quim Clin 1993; 12:34-40.
11. Oellerich M, Armstrong VW, Kahan B, et al. Lake Louise Consensus Conference on Cyclosporine Monitoring in organ transplantation: Report of the consensus panel. Ther Drug Monit 1995;17:642-54.
12. Lucey MR, Kolars JC, Merion RM, Campbell DA, Aldrich M, Watkins PB. Cyclosporine toxicity at therapeutic blood levels and cytochrome P450 IIIA. Lancet 1990;335:11-5.
13. Wonigeit K, Kohlhaw K, Winkler M, Pichlmayr R. Cyclosporine monitoring in liver allograft recipients: two distincts patterns of blood level derangement associated with nephrotoxicity. Transplant Proc 1990; 22:1305-11.
14. Christians U, Kohlhaw K, Budniak J, et al. Cyclosporine metabolite pattern in blood and urine of liver graft recipients. I. Association of cyclosporine metabolites with nephrotoxicity. Eur J Clin Pharmacol 1991;41:285-90.
15. Morris RG, Tett SE, Ray JE, Cyclosporine A monitoring in Australia: Consensus Recommendations. Ther Drug Monit 1994;16:570-6.
16. Guinarte JC, Pérez LF, Tutor JC. Modification of the Abbott Cyclosporine Monoclonal Whole Blood Assay. Clin Chem 1998;44:1581-2.
17. Roberts NB, Dutton J, Tewari A, et al. A method of relating whole blood cyclosporine A results by HPLC to Abbott TDx monoclonal and polyclonal immunoassays. Ann Clin Biochem 1995;32:208-9.
18. Harris EK. Proposed goals for analytical precision and accuracy in single-point diagnostic testing. Theoretical basis and comparison with data from College of American Pathologists Proficiency Surveys. Arch Pathol Lab Med 1988;112:416-20.
19. Knoll E, Hafner F, Dettmer K, Wisser H. The determination of calcium, urea and uric acid using the Kodak Ektachem multilayer technology: An Evaluation. J Clin Chem Clin Biochem 1982;20:491-9.
20. Trull AK, Price CP. Cyclosporine monitoring and liver function test in heart, liver and kidney transplants recipients. Ann Clin Biochem 1988;25 Supl.:1125-35.
21. Armijo JA, de Cos MA. Parent cyclosporine in whole blood by FPIA and EMIT after kidney, heart and liver transplantation. Clin Biochem 1994;27:498-501.
22. Dusci LJ, Hackett LP, Chiswell GM, Ilett KF. Comparison of cyclosporine measurement in blood whole by high-performance liquid chromatography, monoclonal fluorescence polarization immunoassay and enzyme multiplied immunoassay. Ther Drug Monit 1992;14:327-32.
23. Pérez LF, Tutor JC. Influencia de la calibración en los estudios comparativos de la concentración de ciclosporina en sangre obtenida mediante FPIA y EMIT. Anal Clin 1997;22:71-4.
24. Kivistö KT. Misleading use of correlacion and regresion in method-comparison studies of cyclosporine. Clin Chem 1993;39:167-8.
25. Steimer W. Interindividual variance of CsA metabolite concentration is the major source for unpredictable biases of monoclonal CsA assays and consequent risk of underdosing in certain patients. Clin Chem 1998;44 Supl:A103-4.
26. Pedreira J, Tutor JC. Biodisponibilidad de la ciclosporina en pacientes hospitalizados y ambulatorios. Bioquímia 1995;20:260-5.
27. Pedreira J, Tutor JC. Concentración de ciclosporina en sangre y relación metabolitos/ciclosporina. PKS Info 1994;4:6-7.
28. Burke MD, Whiting PH. The role of drug metabolism in cyclosporine A nephrotoxicity. Clin Nephrol 1986;25 Supl.1:S111-6.
29. Christians U, Kohlhaw K, Budniak J, et al. Cyclosporine metabolite pattern in blood and urine of liver graft recipients. II. Influence of cholestasis and rejection. Eur J Clin Pharmacol 1991;41:291-6.
30. Sauer P, Stiehl A, Otto G, Theilmann L. In patients with orthotopic liver transplantation, serum markers of cholestasis are unreliable indicators of biliary secretion. J Hepatol 1995;22:561-4.
31. Roberts NB, Ward RG, Aikawa A, Brown G, Anderson M. Cyclosporine and M17+1 metabolite levels in renal allograft recipients. In: Martin SM, Halloran SP, eds. Procedings of the Association of Clinical Biochemists National Meeting. Cambridge: Piggott Printers Ltd.; 1991. p.36.
32. Witzke D, Heemann U, Thesing A, et al. A comparison of EMIT and FPIA methods for the detection of cyclosporine A blood levels: does impaired liver function make a difference? Eur Clin Pharmacol 1997;52:413-6.