Introducción
El medicamento constituye la tecnología terapéutica más utilizada, pero a menudo de forma ineficiente. Este problema, que afecta a todos los ámbitos sanitarios, disminuye la calidad de la asistencia, vulnera la seguridad de los pacientes y supone un despilfarro de recursos. Los clínicos se encuentran con una amplia y creciente oferta de medicamentos que sobrepasa la capacidad de conocimientos para su uso. Para una terapéutica racional, se hace imprescindible una adecuada selección de los medicamentos con pruebas de eficacia y seguridad y que aporten beneficios a los pacientes al menor coste posible.
La selección de medicamentos puede hacerse en los distintos niveles: sistema de salud, organizaciones, centros sanitarios y profesionales, pero los criterios deben ser siempre los mismos. Como el mercado y el conocimiento sobre el medicamento están siempre en evolución, la evaluación y selección de medicamentos deben constituir un proceso continuo y multidisciplinario.
Idealmente la selección de medicamentos debería derivar de las guías de práctica clínica, siempre y cuando sean de calidad. Son recomendaciones desarrolladas de forma sistemática para ayudar a los profesionales a seleccionar las opciones terapéuticas más adecuadas. Debemos tener presentes las guías adoptadas en nuestro medio para que haya coherencia en nuestro sistema de salud. Sin embargo, frecuentemente nos encontramos con dificultades para seleccionar los medicamentos directamente desde las guías de práctica clínica, como por ejemplo que sus recomendaciones se queden al nivel de grupo terapéutico sin descender al de principio activo o estén transpuestas desde otros ámbitos con diferentes datos de coste-efectividad.
¿Cómo es el proceso de selección de medicamentos en atención primaria?
Los sistemas de salud son clientes de la industria farmacéutica. Dentro de ellos, el farmacéutico de atención primaria actúa como un evaluador de proveedores, analizando qué ventajas aportan los productos ofrecidos. El resultado del proceso de selección de medicamentos puede ser una guía farmacoterapéutica o recomendaciones que ayuden al médico en la elaboración de su formulario personal.
Para ir respondiendo al lanzamiento de nuevos medicamentos y a la autorización de nuevas indicaciones, hay que evaluar la aportación terapéutica, lo que supone responder a estas cuestiones1:
— ¿Los pacientes necesitan realmente un medicamento para su problema?
— ¿Hay tratamientos disponibles para ese problema?
— ¿El nuevo medicamento es mejor que los disponibles?
El proceso de evaluación y selección de medicamentos debe estar guiado por unos principios claros2:
1. Toma de decisiones transparente e imparcial:
— Criterios y procedimiento explícitos.
— Documentación de las actividades.
— Ausencia de conflictos de interés.
— Desarrollo y aplicación de una estricta política ética.
2. Objetividad: método basado en la evidencia científica.
3. Consistencia: las decisiones deben ser coherentes y estar de acuerdo con las directrices del sistema de salud.
4. Expectativa de que las decisiones tengan un impacto con desarrollo de indicadores para medirlo.
Para que una evaluación de medicamento cumpla estos requisitos, se necesitan procedimientos normalizados de trabajo. Un ejemplo es el del Comité Mixto de Evaluación de Nuevos Medicamentos (CmENM)3.
¿Cuáles son las garantías que certifican las agencias reguladoras cuando autorizan un medicamento?
— Eficacia para prevenir o tratar las indicaciones clínicas a las que va destinado. Para ello, las agencias evalúan los estudios presentados cuando se solicita la autorización y establecen las condiciones específicas de uso en cada indicación.
— Seguridad. Cuando un medicamento se autoriza, es porque se considera que los beneficios potenciales superan a los riesgos conocidos hasta el momento.
— Calidad. Se comprueba que todos los componentes del medicamento tienen la calidad establecida por la normativa y que el proceso de fabricación es el adecuado.
— Que aporta la información necesaria para la correcta administración y uso del medicamento. Esta última exigencia es tan importante como las anteriores. Un medicamento no puede ser eficaz y seguro si se utiliza mal por culpa de una información deficiente.
Lo que no certifican las agencias reguladoras es el grado de aportación terapéutica respecto a las alternativas existentes, ni el equilibrio de la relación coste-beneficio.
¿Qué fuentes de información utilizamos para la evaluación de medicamentos?
La ficha técnica ofrece información sobre composición, indicaciones, posología, contraindicaciones, advertencias, reacciones adversas, propiedades farmacocinéticas y farmacodinámicas. Es el documento básico para la utilización del medicamento.
El European Public Assessment Report (EPAR) de la Agencia Europea de Medicamentos (EMA) sintetiza la información que se ha utilizado para la autorización de los medicamentos registrados por procedimiento centralizado. En ocasiones, contiene datos de ensayos clínicos no publicados. La Food and Drug Administration (FDA) estadounidense tiene informes equivalentes que suelen ser más exhaustivos, aunque de lectura más farragosa.
La principal fuente de información son los ensayos clínicos del medicamento en la indicación considerada. Los buscaremos en bases de datos como MEDLINE y la base de datos CENTRAL de la biblioteca Cochrane. Si las hubiera, utilizaremos las revisiones sistemáticas de ensayos clínicos.
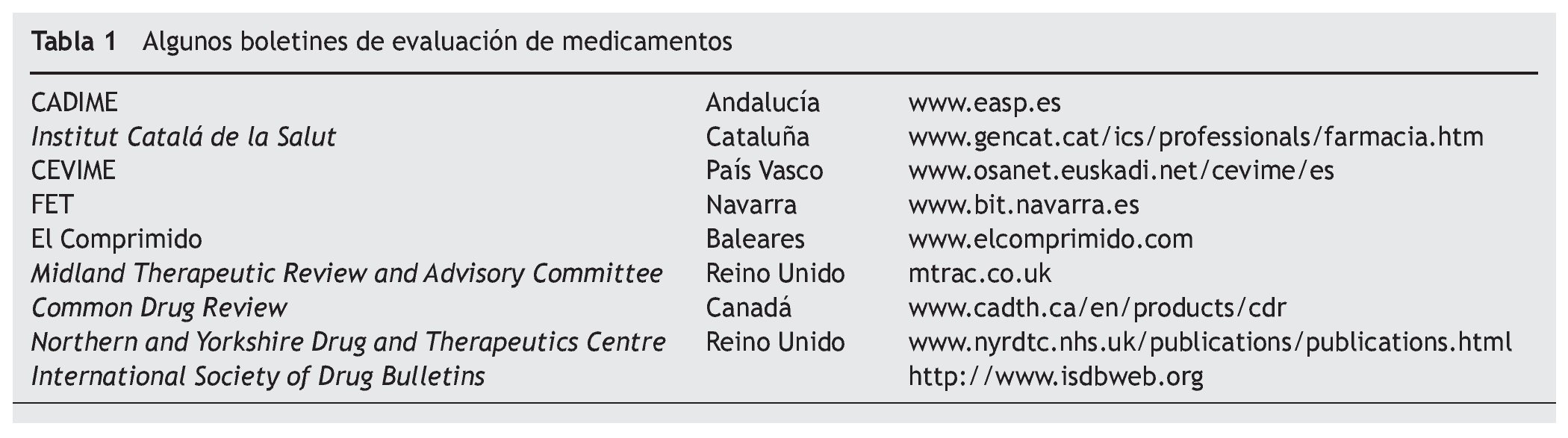
Existen diversos boletines dedicados a la evaluación de medicamentos (tabla 1). En ocasiones, las agencias de evaluación de tecnologías sanitarias también abordan el tema. El buscador Trip Database (www.tripdatabase.com) es una buena herramienta para encontrar este tipo de publicaciones en inglés.
¿Qué criterios se usan para seleccionar medicamentos?
Los criterios, reconocidos por la Organización Mundial de la Salud, que nos van a guiar para la selección de medicamentos son eficacia, seguridad, coste y conveniencia1,2.
1. Eficacia
Los estudios que mejor nos informan de la eficacia de una intervención son los ensayos clínicos controlados y aleatorizados, y las revisiones sistemáticas de estos. La evaluación de la eficacia de un medicamento supone responder a una pregunta clínica. Para formularla usamos el esquema PICO1.
— Población: viene dada por la indicación del medicamento.
— Intervención: el medicamento evaluado.
— Comparador: el/los medicamento/s de referencia para la indicación.
— Outcome: resultados que sean de importancia para los pacientes.
Entendiendo los resultados
La interpretación de los resultados de un ensayo clínico supone responder a dos cuestiones.
— ¿Las diferencias observadas entre los resultados de los distintos grupos son reales y debidas a los diferentes tratamientos o pueden ser producto del azar? (significación estadística).
— ¿La magnitud de las diferencias es suficiente como para ser de importancia para los pacientes? (relevancia clínica).
Limitaciones de los ensayos clínicos
Aunque la lectura crítica de ensayos clínicos sobrepasa los límites de este artículo, vamos a comentar algunos problemas con los que nos solemos encontrar.
a) Comparación con alternativas erróneas por no ser fármacos de elección para la indicación o a dosis no adecuadas. El comparador adecuado es la mejor alternativa terapéutica (farmacológica o no) disponible hasta el momento para la indicación clínica considerada.
b) Uso de criterios de valoración que no son de importancia clínica para el paciente. Uso de variables subrogadas en vez de variables de morbilidad, mortalidad o calidad de vida. Uso incorrecto de variables combinadas.
Se deben considerar las variables que son importantes para el paciente: en el caso de los procesos agudos, resolución del problema de salud, y en el caso de las enfermedades crónicas, reducción de la morbimortalidad, resolución de los síntomas o mejora de la calidad de vida.
Para tomar decisiones a partir de una variable combinada, sus componentes deben ser de similar importancia para el paciente, y los resultados de todos ellos apuntar en la misma dirección4.
Ejemplos
La ezetimiba se aprobó basándose únicamente en su eficacia para disminuir el colesterol unido a lipoproteínas de baja densidad (cLDL) sérico, cuando sabemos que hay fármacos, como los estrógenos, que a pesar de bajar el cLDL, aumentan el riesgo de episodios cardiovasculares5.
En el ensayo IDNT, que comparaba irbersartán con amlodipino en nefropatía diabética, se comunicó una reducción significativa en la variable compuesta de mortalidad, fallo renal y doblar la creatinina sérica; componentes de muy distinta importancia para el paciente. En realidad, sólo se disminuyó el riesgo de doblar la creatinina, sin que se encontrara ningún efecto en la mortalidad6.
Es interesante el abordaje utilizado por el método GRADE, que obliga a definir de antemano cuáles son las variables de resultado a considerar, clasificándolas en clave: importantes y no importantes. Las variables no importantes no se tienen en cuenta a la hora de emitir recomendaciones7.
La EMA elabora guías científicas para la investigación de productos para diversas enfermedades que pueden sernos de utilidad para conocer qué variables o escalas se deben utilizar.
Ejemplo
Guideline on the evaluation of drugs for the treatment of gastro-oesophageal reflux disease (Disponible en: http:// www.ema.europa.eu/docs/en_GB/document_library/ Scientific_guideline/2011/03/WC500103307.pdf)
c) ¿Significación estadística o significación clínica?
Frecuentemente se nos presentan como garantía de eficacia unas diferencias estadísticamente significativas, pero al analizarlas resultan ser de una magnitud sin importancia para el paciente.
Ejemplo
En los ensayos de solifenacina frente a placebo para la incontinencia urinaria, se informó de diferencias estadísticamente significativas. La magnitud del efecto era de 10 micciones frente a 11 cada 24 horas.
d) Comunicación selectiva de resultados
Puede consistir en no comunicar todos los resultados, tal como figuraban en el protocolo, y en no publicar los ensayos cuyos resultados no interesen al promotor.
Ejemplo
En el ensayo CLASS, que comparaba la seguridad gastrointestinal del celecoxib frente al diclofenaco y el ibuprofeno, se comunicaron resultados significativos en la variable complicaciones ulcerosas más úlceras sintomáticas, cuando con la variable definida en el protocolo (complicaciones ulcerosas) no había diferencias significativas. Además, se comunicaban los resultados de 6 meses de seguimiento cuando se disponía de datos de un año y estos no mostraban diferencias significativas8.
e) Realización en poblaciones o contextos no representativos de aquellos en los que el fármaco va a ser empleado.
Los ensayos clínicos se hacen en entornos muy controlados y en poblaciones seleccionadas que difícilmente reflejan la práctica clínica habitual. No hay que perder de vista que lo que en realidad nos interesa es la efectividad, o sea, el efecto del medicamento en condiciones normales. Deberemos valorar la aplicabilidad de los resultados a nuestro entorno.
2. Seguridad
La seguridad se debe valorar en relación con la gravedad de la enfermedad a tratar y comparar con la de las alternativas disponibles.
Ejemplo
En la ficha técnica de la pregabalina se advierte del riesgo de comportamiento suicida. El riesgo es bajo, pero hay que ponerlo en relación con la indicación, ya que no es lo mismo la epilepsia que la ansiedad generalizada.
A diferencia de la eficacia para la que el ensayo clínico es el método de referencia, la evaluación de la seguridad requiere que integremos información de múltiples procedencias. En el momento del registro de un nuevo medicamento, las fuentes de que disponemos son:
— Información de estudios preclínicos y clínicos incorporada a la ficha técnica.
— Los ensayos clínicos nos aportan información precisa sobre la seguridad comparada. Sin embargo, tienen poca potencia para detectar efectos adversos de baja frecuencia, como suelen ser los graves, y los que se manifiestan a largo plazo.
El EPAR puede incorporar un plan de gestión de riesgos en el que se especifican los datos sobre problemas de seguridad conocidos y se identifican áreas de riesgo que aún no se han estudiado, o no se estudiaron ampliamente (como poblaciones específicas, o de pacientes mayores, con otras enfermedades, interacciones con otros medicamentos, etc.). Esto sirve como base para un plan de farmacovigilancia y para las actividades de minimización de riesgos. Éstas pueden ser las sistemáticas o específicas (vigilancia activa, ensayos clínicos adicionales, estudios farmacoepidemiológicos, educación a pacientes o profesionales sanitarios, etc.).
Frecuentemente, la información sobre efectos adversos graves aparece después de la comercialización del fármaco proveniente de:
— Estudios en fase IV o realizados en poblaciones más grandes o menos seleccionadas.
— Sistemas de notificación espontánea de reacciones adversas, como la tarjeta amarilla.
— Estudios epidemiológicos realizados en bases de datos sanitarias.
— Revisiones sistemáticas de los ensayos clínicos y de estudios epidemiológicos observacionales.
Como vemos, en el momento de la autorización, se debe ser escéptico ante el aparentemente aceptable perfil de seguridad de un nuevo fármaco.
Un aspecto a tener en cuenta es la posibilidad de errores de medicación. Estos son más probables si el manejo del medicamento es complicado, muy diferente al de otros fármacos para la misma indicación o cuando el medicamento se acompaña de información que induce a error.
Ejemplo
El ketorolaco fue objeto de una alerta por el riesgo de hemorragias gastrointestinales. Entre los motivos estaban el extendido uso fuera de las indicaciones autorizadas y el uso conjunto con otros antiinflamatorios no esteroideos, contraindicado en la ficha técnica. Está claro que los médicos no utilizaban la información adecuada sobre el uso del fármaco.
3. Conveniencia
Se trata de disminuir las molestias para el paciente y facilitar el cumplimiento; aspectos como que la vía oral sea preferible a la parenteral o que una toma al día mejor que tres. Aunque reducir la complejidad puede aumentar la adherencia, el principal desafío para los pacientes es integrar la toma de medicamentos en sus vidas6. No necesariamente las combinaciones de medicamentos son mejores, ya que pueden traer otros problemas, como dificultad de titular las dosis o posibilidad de errores.
También debemos preguntarnos si hay algún subgrupo de pacientes que puedan beneficiarse de las características específicas de un medicamento.
Ejemplo
Aunque las formas bucodispersables de los antipsicóticos no suelen representar una ventaja, pueden ser útiles en el tratamiento observado, ya que el paciente puede guardarse una cápsula en la boca para escupirla después.
4. Coste
Cuando las alternativas son similares, se usan los precios y se comparan los costes totales del tratamiento para procesos agudos, o el coste por día para los procesos crónicos. Tenemos más dificultades cuando comparamos alternativas que implican diferentes gastos en analíticas, personal sanitario, etc., los cuales también tendremos en cuenta. El problema es que no siempre es fácil obtenerlos de forma precisa y son distintos en diferentes ámbitos geográficos.
Ejemplo
El dabigatrán es un anticoagulante oral con un coste de adquisición 50 veces superior al del acenocumarol, pero no requiere el seguimiento del tiempo de protombina, con lo que se ahorra el coste de ésta, que puede variar mucho si se realiza en el medio hospitalario o en atención primaria.
El análisis de disminución de costes asume los mismos efectos para dos fármacos y compara sus costes2. Su aplicación estricta exigiría disponer de estudios de equivalencia bien diseñados, lo que no ocurre casi nunca. En la práctica, es una forma de desenvolverse en la incertidumbre: al no tener pruebas de que alguno de los fármacos sea mejor, se opta por el más barato; sobre todo teniendo en cuenta que el fármaco más caro invariablemente es el más nuevo y, por tanto, el que más dudas ofrece.
¿Y si el fármaco más caro es más eficaz o seguro?
Este caso obligaría a decidir si las ventajas superan los costes. Hacerlo de forma rigurosa implica realizar una evaluación farmacoeconómica que normalmente tendrá la forma de un análisis de coste-efectividad, si comparamos costes con resultados en variables clínicas (recordar: variables de importancia para el paciente), o de coste-utilidad si usamos años ajustados por calidad de vida. No trataremos aquí estos estudios, pero señalaremos que el ser coste-efectivo no es una característica intrínseca del fármaco, sino que va a depender del contexto sanitario.
Conclusión
La selección de medicamentos exige un procedimiento de evaluación que sea riguroso, independiente, transparente y sistemático. El objetivo es que los pacientes reciban los medicamentos más adecuados, teniendo en cuenta los recursos disponibles.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
PREGUNTAS DE AUTOEVALUACIÓN
1. Los ensayos clínicos con estatinas en prevención primaria están realizados en poblaciones con riesgo cardiovascular considerablemente mayor que la española. Esto:
a) Es bueno, si funcionan en poblaciones de riesgo alto, mejor lo harán en las de bajo.
b) Nos da igual.
c) Nos causa problemas para evaluar su efectividad.
d) Obliga a que desechemos estos estudios, ya que no son aplicables a nuestra población.
e) Sólo importa si nos interesa el coste/efectividad de los tratamientos.
2. Para conocer la seguridad de un nuevo medicamento:
a) Usaremos los datos recogidos en el sistema de farmacovigilancia, que para eso está.
b) Usaremos la información de los ensayos clínicos que son los que aportan el mayor nivel de evidencia.
c) Esperaremos a que sea usado por un importante número de pacientes y se puedan hacer estudios epidemiológicos en las bases de datos sanitarias.
d) Usaremos la información disponible de diversas fuentes.
e) Usaremos lo recogido en la ficha técnica, que es la información oficial.
3. Se ha presentado una asociación de naproxeno y esomeprazol en el mismo comprimido. Sobre su posible inclusión en nuestra guía farmacoterapéutica:
a) No la incluiremos. Nunca hay que incluir asociaciones.
b) La incluiremos. Siempre será más cómodo que usarlos por separado.
c) Valoraremos si con ella mejora el cumplimiento.
d) Valoraremos si algún subgrupo de pacientes puede beneficiarse de ella.
e) C y d.
4. Se han comercializado unos parches de capsaicina para la neurálgica postherpética que deben aplicarse en un centro asistencial y por un profesional sanitario. Si quisiéramos comparar su coste con el de los comprimidos de amitriptilina:
a) Basta con dividir el precio de venta al público por el número de días que cubre cada medicamento.
b) No se puede comparar un fármaco que se administra por vía oral con otro por vía tópica.
c) Hay que tener en cuenta el sueldo del profesional que lo administra y las demás intervenciones que reciba el paciente.
d) No se pueden comparar, porque tienen mecanismos de acción distintos.
e) No se pueden comparar, porque uno es un medicamento muy novedoso y el otro, muy viejo.
5. El bacedoxifeno es un fármaco para la osteoporosis posmenopáusica. ¿Cuál de estas variables de resultado es más importante a la hora de evaluar su eficacia?
a) Densidad mineral ósea.
b) Fracturas vertebrales que dan síntomas.
c) Fracturas vertebrales detectadas por radiología.
d) Calcio en orina.
e) Una combinada de todas ellas.
6. ¿Qué elemento falta en el título de la revisión Cochrane "Aripiprazol para la esquizofrenia"?
a) El coste.
b) La seguridad.
c) El comparador.
d) La intervención.
e) Ninguno.
7. ¿Los miembros de un comité de evaluación de nuevos medicamentos deben hacer una declaración de conflicto de intereses?
a) Sí.
b) No, sólo es obligatorio para los comités éticos de investigación clínica.
c) Sólo si van a publicar en una revista.
d) No hace falta si trabajan en el sector público.
e) Sólo los médicos que prescriben, para los farmacéuticos no hace falta.
8. La silodosina ha demostrado una eficacia equivalente a la de los fármacos de elección en la hiperplasia benigna de próstata.
a) No la incluiríamos en la guía farmacoterapéutica.
b) Hay que incluirla en la guía farmacoterapéutica, siempre es bueno tener alternativas.
c) Deberíamos hacer lo que digan los expertos en la enfermedad.
d) Deberíamos preguntarnos por su seguridad.
e) La incluiríamos en la guía farmacoterapéutica si saliese más barata.
9. Un médico solicita la inclusión en nuestra guía farmacoterapéutica del antidepresivo duloxetina para el trastorno de ansiedad generalizada. Para responderle:
a) Nos basaremos en la información que nos suministre el laboratorio, que es quien mejor conoce su producto.
b) Buscaremos ensayos clínicos en MEDLINE.
c) Debemos tener presente la posibilidad de que haya ensayos no publicados.
d) Miraremos si está recomendado en las guías de práctica clínica.
e) B, c y d.
10. Nuestro servicio de salud ha publicado una guía de práctica clínica (GPC) de reagudización de la enfermedad pulmonar obstructiva crónica. En ella se recomienda el cefditoren, antibiótico que fue descartado de nuestra guía farmacoterapéutica (GFT). ¿Cual sería la actitud más adecuada?
a) Debemos incluirlo inmediatamente.
b) No tenemos por qué incluirlo, son documentos diferentes.
c) No nos tiene que preocupar si nuestra GFT está hecha con rigor.
d) Se debería hacer un esfuerzo por unificar criterios y que sean rigurosos.
e) No importa, la GPC quedaría para atención especializada y la GFT, para primaria.
Correo electrónico: jgarjonp@navarra.es (J. Garjón Parra).