Determinar los factores de riesgo presentes en los pacientes con disfagia en relación con una población de pacientes críticos.
MétodoSerie de casos de una cohorte de pacientes reclutados en la unidad de cuidados intensivos (UCI) hasta el alta hospitalaria. Se reclutaron a aquellos pacientes que dieron su consentimiento y cumplían los criterios de inclusión. El método de exploración clínica Volumen-Viscosidad fue utilizado para la detección de la disfagia. Se realizó un análisis estadístico uni- y bivariante, a través del odds ratio (OR) para detectar los factores de riesgo en la disfagia.
Resultados103 pacientes fueron reclutados de 401 posibles. La media de edad fue de 59,33±13,23; los hombres representaban el 76,7%. La gravedad media fue: APACHE II (12,74±6,17) y Charlson (2,98±3,31). Un 45,6% de los pacientes desarrollaron disfagia, obteniendo valores significativos de OR (p<0,050) para el desarrollo de disfagia: la mayor edad, los antecedentes neurológicos, COVID19, la alta estancia en UCI y hospitalización y la presencia de traqueotomía. Los pacientes COVID19 representaban el 46,6%, por lo que se realizó un análisis de este subgrupo observando resultados similares, con un riesgo de Charlson (OR:4,65; IC95%: 1,31-16,47; p=0,014) y una estancia hospitalaria (OR: 8,50; IC95%: 2,20-32,83; p<0,001). Al alta de UCI, el 37,9% de la población presentaba todavía disfagia, y mantenía este problema al alta hospitalaria el 12,6%.
ConclusionesCasi la mitad de nuestros pacientes presentaron disfagia. Fueron factores de riesgo la gravedad clínica y la presencia de traqueotomía. Se observó en estos pacientes una mayor estancia tanto en UCI como en hospitalización.
To identify risk factors present in patients with dysphagia in a population of critically ill patients.
MethodsCase series of a cohort of patients recruited in the intensive care unit (ICU) until hospital discharge. Patients who gave consent and met the inclusion criteria were recruited. The Volume-Viscosity clinical examination method was used for the screening of dysphagia. An uni- and bivariate statistical analysis was performed using odds ratio (OR) to detect risk factors for dysphagia.
Outcomes103 patients were recruited from 401 possible. The mean age was 59,33±13,23, men represented 76,7%. The severity of the sample was: APACHE II (12,74±6,17) and Charlson (2,98±3,31). 45,6% of patients showed dysphagia, obtaining significant OR values (p<0,050) for the development of dysphagia: older age, neurological antecedents, COVID19, long stay in ICU and hospitalization, and the presence of tracheotomy. COVID19 patients represented 46,6% of the sample, so an analysis of this subgroup was performed, showing similar results, with a Charlson risk (OR:4,65; 95% CI:1,31-16,47; p=0,014) and a hospital stay (OR: 8,50; 95%CI: 2,20-32,83; p<0,001). On discharge from the ICU, 37,9% of the population still had dysphagia; 12,6% maintained this problem at hospital discharge.
ConclusionsAlmost half of our patients developed dysphagia. Clinical severity and the presence of tracheotomy were risk factors. We observed in patients with dysphagia a longer stay in both ICU and hospitalization.
La disfagia se define como una alteración en el proceso de la deglución. En los pacientes críticos, su presencia ha sido estudiada como un elemento que dificulta la evolución clínica. Las enfermeras deben incorporar su detección en su práctica diaria.
¿Qué aporta?En el artículo, se presenta la incidencia de disfagia en una unidad de cuidados intensivos. La detección fue realizada mediante una prueba validada de nueva utilización en esta unidad. Además, describimos los factores de riesgo relacionados con este problema clínico.
Implicaciones del estudioLas enfermeras de la unidad han incorporado la detección de la disfagia como un elemento propio de su práctica diaria en el cuidado de los pacientes críticos. Concienciando a todo el equipo multidisciplinar en adoptar medidas para evitar la aspiración.
Durante los últimos años, cada vez son más las publicaciones que ponen de relieve a la disfagia como una alteración presente en muchos de los pacientes críticos ingresados en las Unidades de Cuidados Intensivos (UCI), aunque actualmente no se tiene una prevalencia clara de esta condición1,2. Algunos estudios han reportado la presencia de aspiración, consecuencia de la disfagia, hasta en 40-62% de los pacientes extubados2,3.
La disfagia es definida como la anormalidad del proceso de deglución. En el paciente crítico puede tener un origen multifactorial como el trauma directo sobre la laringe relacionado con el tubo endotraqueal o la traqueotomía, el volumen del neumotaponamiento, la debilidad de la musculatura oral y la alteración de los receptores aferentes o sensoriales faringo-laríngeos4–6.
Esta entidad se ha asociado, por distintos estudios, a mayor riesgo de aspiración, neumonía aspirativa, malnutrición, mayor estancia hospitalaria, peores resultados asistenciales y disminución de la calidad de vida1,7–9. Estas complicaciones en la evolución clínica de los pacientes anima a desarrollar un abordaje interdisciplinar en la detección precoz y la adopción de medidas para acortar el tiempo de duración de este problema3. Detectar la disfagia se convierte en fundamental ya que, como el estudio de Schefold et al. determina, es un predictor independiente de mortalidad a 28 y 90 días, con un Hazard ratio a 90 días de 3,74 (IC 95% [2,01-6,95]; p<0,001) y asociado a un exceso de mortalidad de 9,2%10. La sensibilización hacia esta situación debe ser desarrollada como una rutina de los equipos asistenciales11. Se recomienda el desarrollo de screening, ya que disminuye la neumonía postextubación y la estancia hospitalaria, mejorando la ingesta oral al alta de UCI12.
Uno de los elementos que mayor discusión genera es el efecto que pueden provocar los dispositivos presentes en la vía aérea de los pacientes críticos, tanto los tubos endotraqueales como las cánulas de traqueotomías, en el desarrollo de la disfagia. Aunque las cánulas anatómicamente no interfieren en la deglución, sí que lo hace la presión ejercida durante días por el neumotaponamiento sobre la pared traqueal. Otros de los factores que según Medeiros et al. en su revisión bibliográfica influyen en la biomecánica de la deglución, asociados a la traqueotomía, fueron: la reducción en la elevación de la laringe, el cierre insuficiente de las vías respiratorias, estasis en la región supraglótica, reducción del reflejo tusígeno, disminución de la protección de las vías respiratorias y reducción del reflejo de aducción de las cuerdas vocales13.
La disfagia se considera como un proceso multifactorial. Todos los factores deben ser investigados dentro del contexto de pacientes críticos, tal y como Skoretz et al. recomiendan al no poder determinar en su revisión sistemática la influencia de la traqueotomía en el desarrollo de la disfagia2. Estos autores por ejemplo encontraron que los valores del neumotaponamiento se incorporaron como variable en cuatro de los 10 estudios incluidos2. Aunque la traqueotomía podría favorecer la presencia de disfagia, no hay que olvidar que pueden coexistir otros factores favorecedores de la misma tales como la presencia de traumatismos faciales, quemaduras, bronconeumonía, aumento de secreciones, uso de ventilación mecánica por tiempo prolongado, aspiración silente de saliva, ausencia de deglución de saliva, alteración de la sensibilidad laríngea, tos ineficaz, necesidad de aspiración de traqueotomía, presencia de estenosis traqueal y tiempo prolongado de uso de la traqueotomía13. La posibilidad de que la deglución sea un proceso efectivo con un adecuado control de las secreciones anima a la retirada de la traqueotomía, mientras que el mal manejo de secreciones, así como la presencia de los factores citados anteriormente, retrasa la decanulación13.
Actualmente, la evidencia de las investigaciones relacionadas con las intervenciones del personal sanitario con relación a la disfagia de los pacientes críticos es limitada5. Aun así, es necesaria la formación del personal en el desarrollo de guías de práctica clínica y en la realización de investigaciones que fundamenten adecuadamente las decisiones clínicas5,14. Evitar las complicaciones y mejorar la ingesta oral son razones fundamentales para adoptar medidas que garanticen que los pacientes críticos con disfagia no tengan peores resultados asistenciales que otros pacientes15,16.
La continua evaluación permite la adaptación a los elementos dinámicos de la asistencia sanitaria, como la pandemia de COVID-19 que ha tensado los sistemas sanitarios en general y las unidades de críticos en particular. Todo ello ha dado lugar a documentos de consenso para continuar detectando, evaluando y tratando esta entidad nosológica, como la propuesta realizada por Miles et al.17. Estos autores recomiendan mantener la detección de la disfagia con los equipos de protección personal, adaptando los procedimientos de deglución a las fases de la enfermedad COVID-19 e implementar continuamente cuidados laríngeos y de la traqueotomía durante todo el ingreso, sin olvidar la rehabilitación de aquellos pacientes subsidiarios mediante el juicio interprofesional.
Los efectos de implementar estrategias de actuación determinan que es necesario seguir trabajando en el cuidado de los problemas de deglución, y es por ello que se debe continuar mejorando el conocimiento de la realidad de nuestros pacientes. Por tanto, nos planteamos como objetivo de esta investigación determinar los factores de riesgo presentes en los pacientes con disfagia de acuerdo con la población de pacientes críticos.
Material y métodoEstudio de series de casos de una cohorte de pacientes críticos ingresados en la unidad de cuidados intensivos adultos de un hospital de tercer nivel hasta el alta hospitalaria.
Se reclutó a los pacientes ingresados de manera consecutiva en la unidad y que aceptaron participar en el estudio. Los criterios de inclusión fueron tener el consentimiento informado, mayores de 18 años y con un periodo de ingreso superior a 48 horas, que habían requerido de intubación y/o traqueotomía.
Los criterios de exclusión fueron: no haber requerido de ventilación mecánica invasiva, ingresos con traqueotomía, no tener un nivel de consciencia adecuado o la contraindicación a la ingesta oral o haberla recibido antes del test, y haber sido diagnosticados previamente de disfagia.
Periodo de reclutamiento comprendido entre 1 de julio de 2020 y el 31 de mayo de 2021. Durante el proceso de recogida de datos estaba desarrollándose la pandemia por COVID-19, elemento que influyó en la asistencia sanitaria y por tanto en el presente estudio.
La aceptación de la participación en el estudio se desarrolló con el seguimiento de los pacientes reclutados hasta el alta hospitalaria.
Características de la unidadEl estudio fue realizado en una UCI de adultos en un hospital de tercer nivel con 32 camas, 1.200 ingresos al año (datos 2020), de carácter polivalente que dispone de dos fisioterapeutas, pero no de logopeda. Cuando se detecta un problema de disfagia se interconsulta con el foniatra. La unidad tiene un protocolo de desinflado del neumotaponamiento de la traqueotomía y del uso de la válvula fonatoria, que se aplica antes de realizar las pruebas de detección de la disfagia.
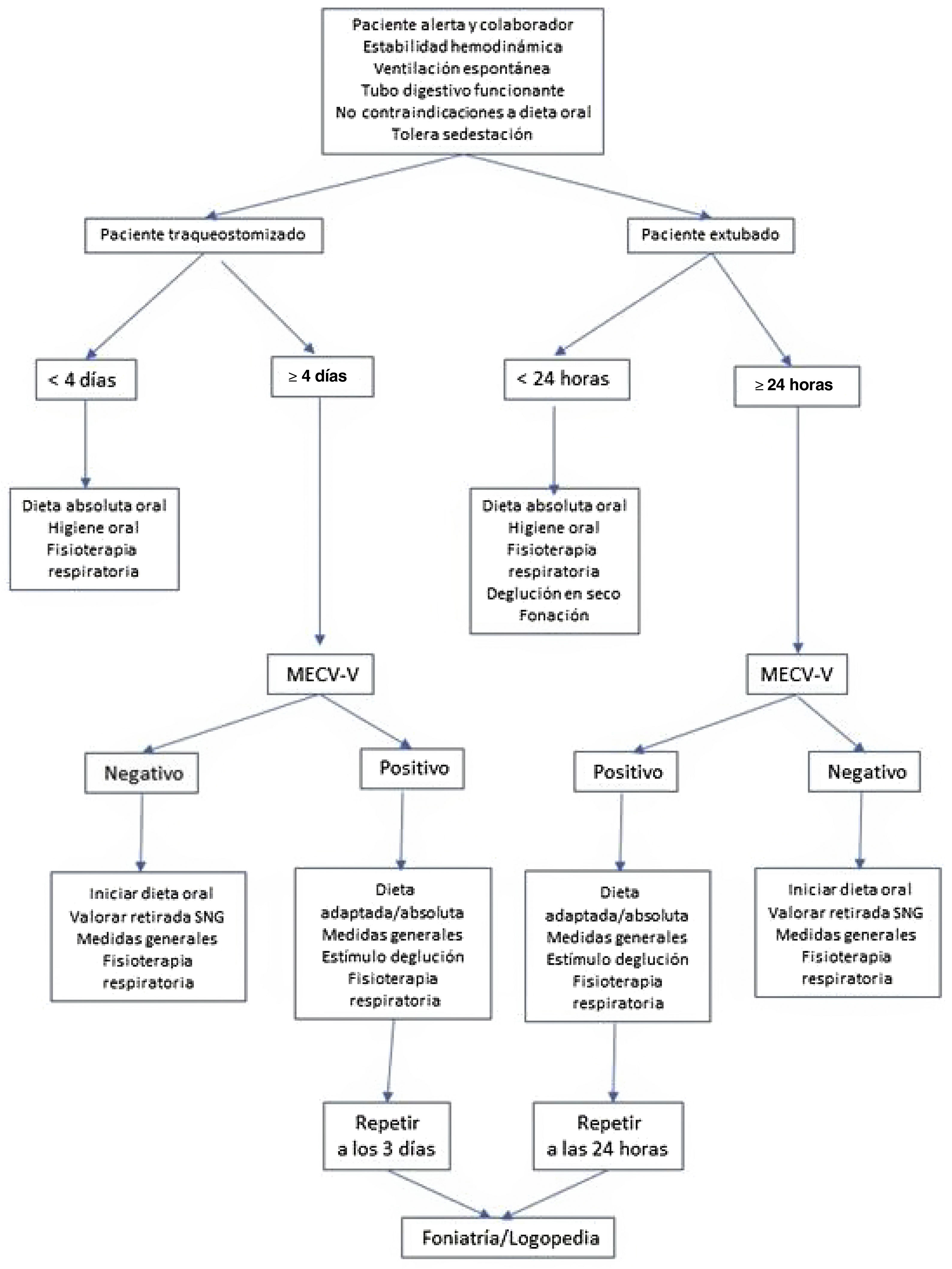
Procedimiento de detección de la disfagiaSe realiza mediante la prueba MECV-V (método de exploración clínica Volumen-Viscosidad) a todo paciente extubado (> 24 horas), traqueotomizado (> 4 días) o con empleo de oxigenoterapia de alto flujo, que sea capaz de tolerar la ventilación espontánea, aunque no presente síntomas de disfagia (fig. 1).
Durante el procedimiento el paciente se mantiene en sedestación en cama o en sillón y monitorizado en todo momento. En los pacientes portadores de traqueotomía, la prueba se realiza con el neumotaponamiento desinflado y, aquellos que pueden tolerarla, con válvula fonatoria. El método MECV-V fue desarrollado y validado por Clavé et al.18. La aplicación del MECV-V se lleva a cabo utilizando progresivamente bolos de volumen bajo (5 mL), medio (10 mL) y alto (20 mL) y viscosidad néctar (IDDSI 2), líquido (IDDSI 0) y pudin (IDDSI 4). Puede utilizarse agua y espesante comercial (tanto en base almidón como en base xantana), zumo de melocotón o yogurt líquido para néctar, agua gelificada o yogurt para pudin. El uso de colorante alimentario permite una mejor observación de los restos de alimento, así como su presencia en la cavidad oral o en la vía aérea inferior o su salida por el traqueostoma. En este estudio, se utilizó colorante azul para el agua, colorante rojo para el néctar y colorante amarillo para el pudin. El orden utilizado para desarrollar la prueba fue: néctar, líquido y pudin.
Los signos clínicos que detecta este método de evaluación son:
- •
Signos de alteración de la seguridad:
- -
Tos
- -
Cambio de voz
- -
Desaturación de oxígeno (descenso de 3% de la saturación de oxígeno)
- •
Signos de alteración de la eficacia:
- -
Falta de sello labial
- -
Residuo oral
- -
Deglución fraccionada
- -
Residuo faríngeo
Se considera que el test es negativo si no presenta ninguno de los signos descritos. Se considera que el test es positivo (eficacia/seguridad) cuando presenta alguno/s de los signos descritos, siendo relevantes los signos positivos de alteración de la seguridad y la eficacia para el tratamiento rehabilitador y para los abordajes compensatorios que se puedan llevar a cabo.
En los casos donde se detecta un resultado positivo para el test MECV-V, se utilizan las medidas que se muestran en la figura 1 y tras la valoración del foniatra, este adiestra a las enfermeras para realizar los ejercicios deglutorios adaptados a cada caso.
Se realiza el test también al alta de la UCI, durante el ingreso hospitalario y al alta hospitalaria para controlar la evolución de los pacientes reclutados, según las indicaciones del foniatra.
Recolección de datosEn el estudio fueron recogidos los siguientes datos demográficos: edad, sexo, peso y talla. Los antecedentes personales de patología neurológica, respiratoria y digestivos, así como el tratamiento domicilio con neurolépticos/sedantes e inhibidores de la bomba de protones como variables dicotómicas (Sí/No). Indicadores de severidad del paciente crítico como APACHE II y Charlson al ingreso. Días de ingreso previos a UCI y días de ingreso en UCI. Número de días intubado, o la necesidad de traqueotomía con tipo abordaje. Días desde el ingreso al primer test de disfagia, la presencia de disfagia mixta, líquidos, néctar y pudin; así como la seguridad y la eficacia. Disfagia al alta de UCI y tipo de dieta al alta de UCI y al alta del hospital. Diagnóstico de COVID-19 y número de días de ingreso hospitalario.
Análisis estadísticoLos datos fueron analizados con el paquete estadístico SPSS 25,0. Los datos cuantitativos fueron expresados en media y desviación típica (DT). Los datos cualitativos fueron descritos mediante frecuencia y porcentaje. Se incorporó en los datos el IC 95%. Para determinar la distribución de la normalidad se utilizó el test de Kolmogorov-Smirnov. El análisis bivariante se llevó a cabo mediante el test de t de Student para las variables continuas y el test de X2 para las variables cualitativas. Para detectar las variables de riesgo, se utilizó el Odds Ratio. Se consideraron estadísticamente significativos, valores de p<0,050.
Consideraciones éticasEl estudio fue aprobado por el Comité de ética con la referencia Código CEI/CEIm Las Palmas: 2019-510-1 y su participación fue voluntaria. Se siguió en todo momento la declaración de Helsinki de investigación biomédica. Los datos fueron anonimizados para su tratamiento estadístico.
ResultadosDatos demográficosDurante el periodo de estudio ingresaron 1.074 pacientes de los cuales 499 requirieron intubación y/o traqueotomía. Fueron reclutados 103 pacientes, 76,7% de la muestra eran hombres (n = 79), con una media de edad de 59,33 (DT:13,23). La mayoría ingresaron por causas médicas, representando 85,4% (n = 88); los pacientes de patología cardíaca, y traumatológica representaron 8,7% (n = 9) y 5,8% (n = 6), respectivamente.
Debemos destacar que 33% (n = 34) presentaba valores del índice de masa corporal (IMC) catalogados dentro del grupo de obesidad, teniendo 43,7% un perfil de sobrepeso (n = 45), y los restantes tenían valores de IMC normales. Los antecedentes personales de los pacientes se muestran en la tabla 1.
Antecedentes personales de la muestra
| Sí | No | |
|---|---|---|
| Diagnóstico neurológico al ingreso | 29 (28,2%) | 74 (71,8%) |
| Antecedentes neurológicos | 19 (18,4%) | 84 (81,6%) |
| Antecedentes respiratorios | 16 (15,5%) | 87 (84,5%) |
| Antecedentes digestivos | 14 (13,6%) | 89 (86,4%) |
| Prescripción previa de neurolépticos/sedantes | 33 (32,0%) | 70 (68,0%) |
| Prescripción previa de IBP | 33 (32,0%) | 70 (68,0%) |
IBP: Inhibidores de la Bomba de Protones.
Nota: Resultados expresados en frecuencia y porcentaje.
Los pacientes tenían una media de APACHE II al ingreso de 12,74 (DT:6,17) y un índice de comorbilidad de Charlson de 2,98 (DT: 3,31). Debido a la incidencia de la pandemia durante la recogida de datos, debemos afirmar que 46,6% (n = 48) de los incluidos en el estudio ingresaron por complicaciones derivadas de la COVID-19, centradas en la insuficiencia respiratoria aguda con necesidad de soporte ventilatorio invasivo.
Todos los pacientes de la muestra precisaron de intubación orotraqueal. Siendo la media de días intubados, 10,57 (DT:6,16). De estos pacientes precisaron traqueotomía el 50,5% (n = 52), siendo mediante técnica percutánea (n = 39) y por técnica quirúrgica (n = 13). La estancia media en UCI fue de 22,24 (DT:16,90). Al alta de UCI (n = 102), los pacientes presentaban como dieta prescrita: dieta oral (n = 43; 42,3%), dieta oral modificada (n = 36; 35,3%) y Nutrición enteral (n = 23; 22,5%).
Procedimiento de evaluación de la disfagiaTodos los pacientes incorporados en el estudio fueron evaluados mediante las pruebas de deglución. Siendo la media hasta el primer test de disfagia de 17,82 días (DT: 11,98). De los 103 pacientes incluidos en el estudio, presentaron disfagia el 45,6% (n = 47). Detectando disfagia a líquidos (n = 45), disfagia a néctar (n = 24) y disfagia a pudin (n = 16). La alteración más habitual fue disfagia sólo a líquidos (n = 20), seguida de disfagia mixta a los tres elementos (n = 13) y disfagia mixta a líquidos y néctar (n = 9).
Al alta de UCI (n = 102), 39 pacientes presentaban todavía disfagia y no eran capaces de conseguir los objetivos calóricos pautados con alimentación oral y/o oral modificada.
La media de hospitalización del total de la muestra fue de 43,05 (DT:31,73). Al alta hospitalaria (n = 100), el grupo era alimentado por dieta oral (86%), oral modificada (11%) y nutrición enteral (3%). A lo largo del seguimiento, fallecieron tres pacientes, uno en UCI y dos en hospitalización.
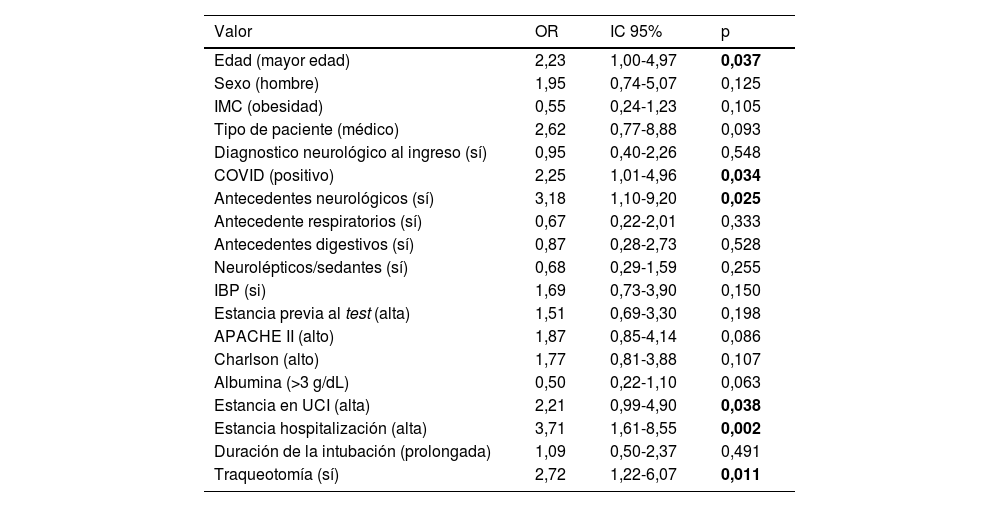
Factores de riesgo relacionados con el desarrollo de la disfagiaEntre los factores de riesgo encontramos que la mayor edad, los antecedentes neurológicos, la alta estancia en UCI y la presencia de traqueotomía eran factores estadísticamente significativos, tal y como se muestra en la tabla 2. Los pacientes que presentaron disfagia además tenían hasta tres veces más tiempo de ingreso hospitalario que los que no la presentaban. Los pacientes afectados por patología COVID-19 desarrollaron disfagia el doble que los pacientes no COVID-19.
Variables asociadas a disfagia en los pacientes críticos
| Valor | OR | IC 95% | p |
|---|---|---|---|
| Edad (mayor edad) | 2,23 | 1,00-4,97 | 0,037 |
| Sexo (hombre) | 1,95 | 0,74-5,07 | 0,125 |
| IMC (obesidad) | 0,55 | 0,24-1,23 | 0,105 |
| Tipo de paciente (médico) | 2,62 | 0,77-8,88 | 0,093 |
| Diagnostico neurológico al ingreso (sí) | 0,95 | 0,40-2,26 | 0,548 |
| COVID (positivo) | 2,25 | 1,01-4,96 | 0,034 |
| Antecedentes neurológicos (sí) | 3,18 | 1,10-9,20 | 0,025 |
| Antecedente respiratorios (sí) | 0,67 | 0,22-2,01 | 0,333 |
| Antecedentes digestivos (sí) | 0,87 | 0,28-2,73 | 0,528 |
| Neurolépticos/sedantes (sí) | 0,68 | 0,29-1,59 | 0,255 |
| IBP (si) | 1,69 | 0,73-3,90 | 0,150 |
| Estancia previa al test (alta) | 1,51 | 0,69-3,30 | 0,198 |
| APACHE II (alto) | 1,87 | 0,85-4,14 | 0,086 |
| Charlson (alto) | 1,77 | 0,81-3,88 | 0,107 |
| Albumina (>3 g/dL) | 0,50 | 0,22-1,10 | 0,063 |
| Estancia en UCI (alta) | 2,21 | 0,99-4,90 | 0,038 |
| Estancia hospitalización (alta) | 3,71 | 1,61-8,55 | 0,002 |
| Duración de la intubación (prolongada) | 1,09 | 0,50-2,37 | 0,491 |
| Traqueotomía (sí) | 2,72 | 1,22-6,07 | 0,011 |
APACHE II: Acute Physiologhy, Age, and CHronic Evaluation; IBP: inhibidores de la bomba de protones; IC: intervalo de confianza; IMC: índice de masa corporal; OR: Odds Ratio; UCI: unidad de cuidados intensivos.
Nota: valores en negrita estadísticamente significativos p<0,050.
El 57,7% (n = 30) de los pacientes que precisaron de traqueotomía desarrollaron disfagia, sin embargo, los pacientes que no tuvieron traqueotomía desarrollaron disfagia en 33,3% (n = 17) de los casos; esto implica un Odds Ratio de 2,72 entre estas poblaciones.
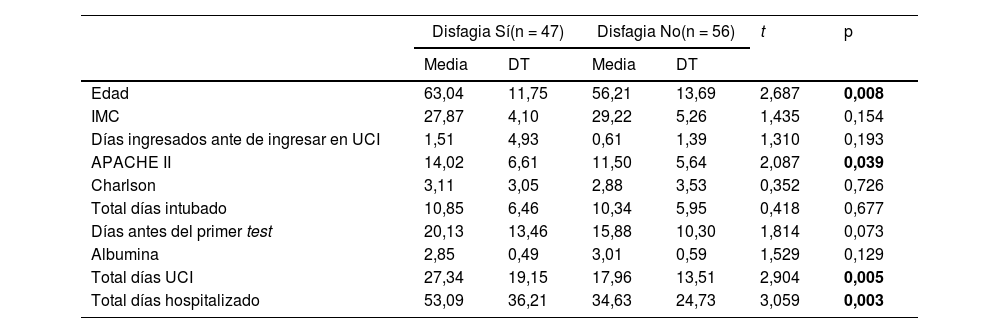
Las variables continuas analizadas, mediante la t de Student, demuestra que el grupo de pacientes que desarrolló disfagia era de mayor edad, con una mayor puntuación en el APACHE II, una mayor estancia en UCI y en hospitalización (tabla 3).
Análisis bivariante de las variables continuas entre los grupos de disfagia positiva y negativo
| Disfagia Sí(n = 47) | Disfagia No(n = 56) | t | p | |||
|---|---|---|---|---|---|---|
| Media | DT | Media | DT | |||
| Edad | 63,04 | 11,75 | 56,21 | 13,69 | 2,687 | 0,008 |
| IMC | 27,87 | 4,10 | 29,22 | 5,26 | 1,435 | 0,154 |
| Días ingresados ante de ingresar en UCI | 1,51 | 4,93 | 0,61 | 1,39 | 1,310 | 0,193 |
| APACHE II | 14,02 | 6,61 | 11,50 | 5,64 | 2,087 | 0,039 |
| Charlson | 3,11 | 3,05 | 2,88 | 3,53 | 0,352 | 0,726 |
| Total días intubado | 10,85 | 6,46 | 10,34 | 5,95 | 0,418 | 0,677 |
| Días antes del primer test | 20,13 | 13,46 | 15,88 | 10,30 | 1,814 | 0,073 |
| Albumina | 2,85 | 0,49 | 3,01 | 0,59 | 1,529 | 0,129 |
| Total días UCI | 27,34 | 19,15 | 17,96 | 13,51 | 2,904 | 0,005 |
| Total días hospitalizado | 53,09 | 36,21 | 34,63 | 24,73 | 3,059 | 0,003 |
APACHE II: Acute Physiologhy, Age, and CHronic Evaluation; DT: desviación típica; IMC: indice de masa corporal; UCI: unidad de cuidados intensivos; Prueba de t de Student.
Nota: valores en negrita estadísticamente significativos p<0,050.
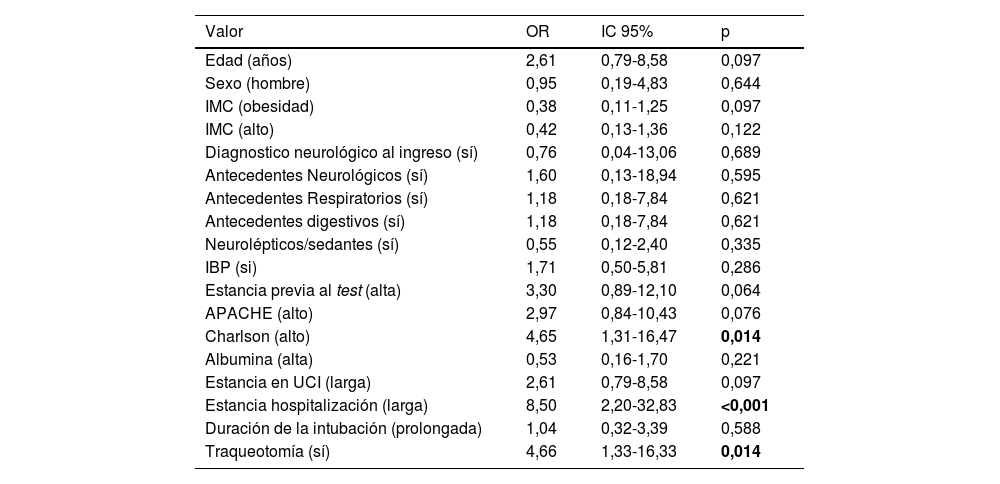
Debido al peso estadístico de los pacientes COVID-19 que representaban 46,6%, se realizó un análisis específico para esta población. Constituida por 48 pacientes, para poder evaluar si los factores de riesgo de estos pacientes de desarrollar disfagia eran simétricos. No se encontraron diferencias significativas en la composición entre la población no COVID y COVID-19, en cuanto a la variable de edad. Pero si existen diferencias entre estas poblaciones en el IMC, ya que los COVID-19 tenían un valor de IMC mayor y con una significancia estadística de p = 0,004. A la hora de evaluar estos grupos, con la variable sexo, nos encontramos un valor de X2 de 3.823 y p = 0,041, por lo que en esta muestra existe asociación entre tener COVID-19 y ser hombre. La presencia en este grupo de disfagia fue de 56,3%, superior al de la totalidad de la muestra.
En esta población COVID-19, existe un riesgo significativo, hasta cuatro veces mayor, de desarrollar disfagia ante una puntuación elevada del Charlson (mayor que el valor medio de 2,53) y ante la presencia de traqueotomía. Además, los pacientes que desarrollaron disfagia estuvieron hasta 8,5 veces más días de hospitalización que los pacientes sin esta entidad nosológica (tabla 4).
Variables de riesgo en la población COVID-19
| Valor | OR | IC 95% | p |
|---|---|---|---|
| Edad (años) | 2,61 | 0,79-8,58 | 0,097 |
| Sexo (hombre) | 0,95 | 0,19-4,83 | 0,644 |
| IMC (obesidad) | 0,38 | 0,11-1,25 | 0,097 |
| IMC (alto) | 0,42 | 0,13-1,36 | 0,122 |
| Diagnostico neurológico al ingreso (sí) | 0,76 | 0,04-13,06 | 0,689 |
| Antecedentes Neurológicos (sí) | 1,60 | 0,13-18,94 | 0,595 |
| Antecedentes Respiratorios (sí) | 1,18 | 0,18-7,84 | 0,621 |
| Antecedentes digestivos (sí) | 1,18 | 0,18-7,84 | 0,621 |
| Neurolépticos/sedantes (sí) | 0,55 | 0,12-2,40 | 0,335 |
| IBP (si) | 1,71 | 0,50-5,81 | 0,286 |
| Estancia previa al test (alta) | 3,30 | 0,89-12,10 | 0,064 |
| APACHE (alto) | 2,97 | 0,84-10,43 | 0,076 |
| Charlson (alto) | 4,65 | 1,31-16,47 | 0,014 |
| Albumina (alta) | 0,53 | 0,16-1,70 | 0,221 |
| Estancia en UCI (larga) | 2,61 | 0,79-8,58 | 0,097 |
| Estancia hospitalización (larga) | 8,50 | 2,20-32,83 | <0,001 |
| Duración de la intubación (prolongada) | 1,04 | 0,32-3,39 | 0,588 |
| Traqueotomía (sí) | 4,66 | 1,33-16,33 | 0,014 |
APACHE II: Acute Physiologhy, Age, and CHronic Evaluation; IBP: inhibidores de la bomba de protones; IC: intervalo de confianza; IMC: indice de masa corporal; OR: Odds Ratio; UCI: unidad de cuidados intensivos.
Nota: valores en negrita estadísticamente significativos p<0,050.
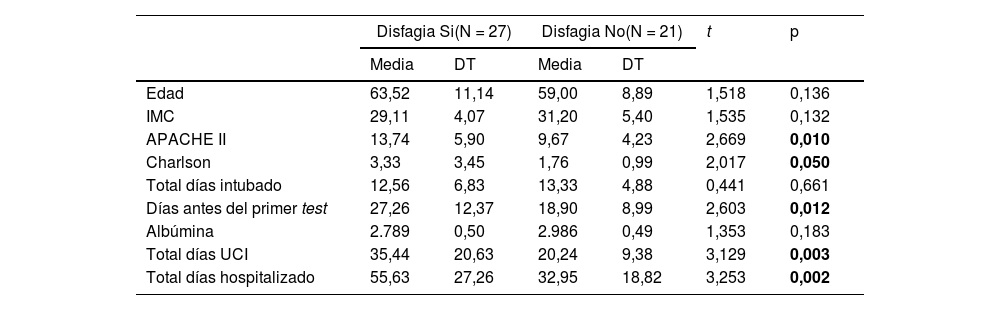
En el análisis de las variables continuas, nos encontramos valores que siguen la tendencia de la población general en los pacientes ingresados por COVID-19. En esta población las personas que desarrollaron disfagia eran de mayor edad, tuvieron mayor puntuación al ingreso del APACHE II y del Charlson. El retraso en la realización de la prueba diagnóstica también fue un valor significativo, por lo que, además, las personas con disfagia estuvieron más días de ingreso en UCI y en hospitalización (tabla 5).
Análisis bivariante de la población COVID-19 y el desarrollo de Disfagia
| Disfagia Si(N = 27) | Disfagia No(N = 21) | t | p | |||
|---|---|---|---|---|---|---|
| Media | DT | Media | DT | |||
| Edad | 63,52 | 11,14 | 59,00 | 8,89 | 1,518 | 0,136 |
| IMC | 29,11 | 4,07 | 31,20 | 5,40 | 1,535 | 0,132 |
| APACHE II | 13,74 | 5,90 | 9,67 | 4,23 | 2,669 | 0,010 |
| Charlson | 3,33 | 3,45 | 1,76 | 0,99 | 2,017 | 0,050 |
| Total días intubado | 12,56 | 6,83 | 13,33 | 4,88 | 0,441 | 0,661 |
| Días antes del primer test | 27,26 | 12,37 | 18,90 | 8,99 | 2,603 | 0,012 |
| Albúmina | 2.789 | 0,50 | 2.986 | 0,49 | 1,353 | 0,183 |
| Total días UCI | 35,44 | 20,63 | 20,24 | 9,38 | 3,129 | 0,003 |
| Total días hospitalizado | 55,63 | 27,26 | 32,95 | 18,82 | 3,253 | 0,002 |
APACHE II: Acute Physiologhy, Age, and CHronic Evaluation; DT: desviación típica; IMC: indice de masa corporal; UCI: unidad de cuidados intensivos; Prueba de t de Student.
Nota: valores en negrita estadísticamente significativos p<0,050.
Al alta de UCI de la población total, 39 (37,9%) pacientes todavía tenían un proceso de disfagia activo. Es de destacar que, al alta hospitalaria fueron dados de alta con el problema de disfagia todavía activo 13 pacientes (12,6%).
DiscusiónEn nuestro estudio, la disfagia representa 45,6% de los pacientes incluidos, similar al de otros consultados2,8,19. Sin embargo, autores como Bordejé et al., obtienen valores muchísimo menores, siendo de 11,6% en su población general y de 22,7% en su población intubada, utilizando una prueba distinta a la nuestra como es el test modificado de deglución volumen viscosidad (mV-VST)20. Nuestros datos recogen, en una población de pacientes intubados, una incidencia de disfagia que se acerca al 41% de la revisión sistemática realizada por McIntyre et al.21.
La disfagia en los pacientes críticos tiene una etiología multicausal, siendo la gravedad expresada por el índice APACHE II y la comorbilidad (Charlson), los que tanto en la población general como sólo en la COVID-19, han demostrado diferencias significativas, hecho ya mencionado por estudios previos10,19,22. Zuercher et al. determinó mediante regresión logística que los factores de riesgo independientes para desarrollar disfagia fueron: antecedentes de enfermedad neurológica, admisión de urgencias, días con ventilación mecánica, APACHE II y el número de días con terapias de depuración extracorpórea22.
Dentro de los factores de riesgo que nuestra población presentaba, fueron los antecedentes neurológicos previos los que juegan un papel fundamental, siendo estos hallazgos también mencionados por otros estudios22,23.
Entre los dispositivos para la ventilación mecánica que influyen en la aparición de este problema, la traqueotomía resultó un factor de riesgo, en la misma línea que otros estudios previos2,24–26. Esto se explica ya que la traqueotomía se tiene que llevar a cabo en los casos de intubación prolongada para avanzar en la retirada de la ventilación mecánica y, por tanto, se mantiene un dispositivo cuyos factores como volumen, tamaño de la cánula y presión, tal y como otros autores defienden como mecanismo de factor de riesgo2. Aunque la presencia de traqueotomía puede considerarse un factor desencadenante de disfagia, también se debe valorar la incidencia de otros posibles factores concurrentes que pueden causar su aparición, como pueden ser: la presencia de traumatismos faciales, quemaduras, bronconeumonía, aumento de secreciones, uso de ventilación mecánica por tiempo prolongado, aspiración silente de saliva, ausencia de deglución de saliva, alteración de la sensibilidad laríngea, tos ineficaz, necesidad de aspiración de traqueotomía, presencia de estenosis traqueal y tiempo prolongado de uso de la traqueotomía13. La posibilidad de que la deglución sea un proceso efectivo junto con un adecuado control de las secreciones anima a la retirada de la traqueotomía, mientras que la disminución o ausencia de degluciones espontáneas, el mal manejo de secreciones y la presencia de los factores relacionados anteriormente retrasan la decanulación de los pacientes13. El estado del paciente y la posibilidad de avanzar en la retirada de dispositivos, el desinflado del balón de la traqueostomía y la utilización de cánulas fonatorias pueden disminuir el tiempo de duración de la disfagia27. Sin embargo, en la revisión bibliográfica de 29 estudios llevada a cabo por Cabezas et al. solo se determinó relación directa entre traqueotomía y disfagia en cuatro, mientras 11 lo rechazaban y 15 asumían como una posibilidad en las conclusiones28. Otro aspecto a destacar es que se debe relacionar la debilidad muscular como un factor asociado a los pacientes portadores de traqueotomía que desarrollan disfagia1,9,28.
Un punto que se resalta en la literatura es la necesidad de evaluar a pie de cama la disfagia, mediante test validados por los profesionales de cuidados críticos3,22,29–31. Entrenar al personal sanitario en estas pruebas puede ayudar a implementar actividades correctivas que prevengan los episodios de aspiración9,12,32. La formación específica en disfagia por parte de los profesionales contribuye a introducir la ingesta oral de manera más precoz y mejora la supervivencia de los pacientes32. Sin embargo, y aunque los profesionales consideran la disfagia como un problema importante, 55,3% (n = 21) de las unidades en España todavía no cuentan con un protocolo establecido de cribado, y solo 7,9% (n = 3) lo aplican de manera sistemática a todos los pacientes11.
Nuestros datos demuestran un aumento de la estancia en UCI y hospitalaria de los pacientes con disfagia, igual que otros estudios previos1,20, y por tanto, las complicaciones derivadas del manejo de la alimentación pudieran ser factores relacionados15,32.
Un dato importante a tener en cuenta es el peso estadístico que los pacientes COVID-19 han tenido a la hora de desarrollar disfagia y es que el hecho de haber sido tratados en las primeras oleadas, según las recomendaciones, con intubación precoz para tratar el síndrome de distrés respiratorio agudo, esto conlleva indudablemente a un incremento de casos de disfagia26,33. La necesidad de testar a todos los pacientes por igual ha precisado de documentos de consenso y de investigaciones al respecto16,17,34. En nuestra investigación, observamos en la población COVID-19 la relación entre un retraso significativo en el momento de llevar a cabo el primer test y la presencia de disfagia, no siendo significativo en la población general. Este hecho puede estar relacionado con la mayor gravedad de estos pacientes que sufrieron más días de ventilación mecánica que los pacientes no COVID-19, lo cual retrasa el momento de poder realizar la prueba de deglución. Es por ello que, como mencionan Fritz et al., se debe implementar una estrategia a largo plazo para adecuar las necesidades de este tipo de pacientes35.
Por último, enfatizar que realizar un adecuado manejo de un problema como la disfagia precisa de un abordaje multidisciplinar de todos los profesionales sanitarios de los cuidados críticos tanto de los médicos como de las enfermeras y de otros campos relacionados, como foniatras, logopedas y otorrinolaringólogos3,17. Los sanitarios debemos seguir investigando en este campo, ya que actualmente no existen guías clínicas internacionales basadas en la evidencia que avalen las pautas a seguir en la detección, prevención y manejo de la disfagia post-extubación36.
Limitaciones del estudioLa principal limitación de este estudio es que, al ser una serie de casos, no sabemos de forma exacta cuál es la magnitud del problema respecto al total de la población ingresada, sin embargo, puede ser el primer paso para futuras investigaciones con la metodología apropiada. Además, nos ha permitido detectar la realidad de un problema que debe ser abordado, pues la incidencia afecta a un importante número de los pacientes críticos. También hay que resaltar que nuestro trabajo ha sido realizado durante la pandemia, lo cual ha incrementado la presión asistencial, elemento que no ha podido ser controlado por los autores, por lo que no estábamos en las condiciones habituales de un hospital de tercer nivel. Además, nuestros datos indican que los pacientes COVID-19 precisaron más tiempo de ventilación mecánica, lo cual puede ser un factor por explorar, aunque nuestros datos de días intubados no lo determinan así. En el futuro, será necesario investigar todos los aspectos involucrados de la traqueotomía (volumen, presión y tamaño de cánula) para poder evaluar adecuadamente cuál es la importancia de cada elemento dentro del conjunto de la técnica.
ConclusiónLa disfagia fue un síntoma presente en casi la mitad de la muestra estudiada, siendo mayor entre los pacientes ingresados por COVID-19. Hemos detectado como factores de riesgo para desarrollar disfagia, la gravedad (APACHE II) y la comorbilidad (Charlson), así como la presencia de traqueotomía. Los pacientes con disfagia tuvieron además una mayor estancia en UCI y hospitalaria, hecho que resulta muy importante ante los riesgos que se pueden derivar de una institucionalización prolongada.
Finalmente, este estudio determina que la disfagia es una alteración importante en la población de pacientes críticos que precisan de intubación orotraqueal y donde la severidad de la enfermedad y la presencia de dispositivos infraglóticos influyen en su desarrollo. Es por lo que, como profesionales sanitarios, debemos testar y tratar de una manera multidisciplinar a estos pacientes con el objetivo de evitar esta complicación.
FinanciaciónEl estudio ha sido financiado por los propios autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.