La diabetes tipo 2 (DM2) es una de las enfermedades que causa mayor mortalidad prematura y discapacidad a nivel mundial. Las alteraciones del sueño se han asociado a la aparición de trastornos metabólicos y a mayores niveles de hemoglobina glucosilada en personas diabéticas.
ObjetivoEvaluar la calidad del sueño de personas con DM2 y su asociación con características sociodemográficas, clínicas y metabólicas.
MétodosEstudio observacional, transversal, analítico en 223 personas con DM2 entre 20 y 64 años controladas en un centro de atención primaria de salud.
ResultadosLa mayoría eran mujeres (66,4%), edad promedio 54,7 años y solo el 33% duerme las horas necesarias (7 a 9 horas). Un 57,7% se encontraba metabólicamente descompensado (Hb1Ac>7%). Un 75,2% de los participantes presentó problemas de sueño de diversa gravedad, que se asoció a ser mujer, dolor nocturno, nicturia, tiempo de diagnóstico de la diabetes y síntomas depresivos. Las personas con mala calidad de sueño tuvieron 73% más probabilidad de estar descompensados metabólicamente, sin embargo, este resultado no fue estadísticamente significativo OR=1,73 (IC: 0,78-3,87).
ConclusionesDestaca la alta frecuencia de mala calidad de sueño y descompensación metabólica en la muestra, lo que podría complicar la DM2. No es concluyente la asociación entre mala calidad de sueño y descompensación de la DM2. Futuras investigaciones contribuirán a dilucidar el papel del sueño en la compensación metabólica y en la prevención de trastornos metabólicos.
Type 2 diabetes (DM2) is one of the diseases that cause the highest premature mortality and disability worldwide. Sleep disturbances have been associated with the onset of metabolic disorders and increased levels of glycated haemoglobin in diabetics.
ObjectiveTo evaluate the quality of sleep of people with type 2 diabetes and its association with sociodemographic, clinical, and metabolic characteristics.
MethodsObservational, cross-sectional, analytical study of 223 patients with DM2 between 20 and 64 years old, controlled in a primary health care centre in Chile.
ResultsMost were women (66.4%), average age 54.7 years. Only 33% slept the required number of hours (7 to 9hours) to maintain health. Fifty-seven point seven percent were metabolically unbalanced (Hb1Ac>7%). Seventy-five point two percent presented sleep problems of varying severity, which were associated with being a woman, night pain, nocturia, time of diagnosis of diabetes, and depressive symptoms. Persons with poor sleep quality were 73% more likely to be metabolically decompensated, however, this result was not statistically significant: OR=1.73 (CI:78-3.87).
ConclusionsThe high frequency of poor sleep quality and metabolic decompensation in the sample stands out, which could complicate DM2. The association between poor sleep quality and DM2 decompensation is inconclusive. Future research will contribute to elucidating the role of sleep in metabolic compensation and in the prevention of metabolic disorders.
La calidad del sueño se asocia a trastornos metabólicos. Existe asociación entre los problemas del sueño y escaso control glucémico en pacientes con diabetes mellitus tipo 2. La prevalencia de alteraciones del sueño es superior al 50% en la población chilena.
¿Qué aporta?Este estudio refleja que un alto porcentaje de personas con diabetes mellitus tipo 2 presentan multimorbilidad y alteraciones del sueño, sin embargo, no existe concordancia entre la percepción de mala calidad de sueño con los resultados objetivos obtenidos a través del Índice de Calidad del Sueño de Pittsburg (ICSP) en esta población. Lo anterior hace necesario considerar el sueño como un hábito que debe ser evaluado en los controles de personas con multimorbilidad, dado el impacto en la salud y compensación de sus patologías.
La diabetes tipo 2 (DM2) es una de las principales enfermedades que causa mortalidad prematura y discapacidad a nivel mundial. En Chile, la DM2 ha aumentado su prevalencia del 9,4 al 12,3% entre los años 2010 y 2017 y el 67,6% de los pacientes en control están metabólicamente descompensados1.
Estudios poblacionales y de investigación clínica relacionan la calidad y la cantidad de sueño, tanto al considerar la falta de este (menos de 7h) como su exceso (más de 9h), con efectos a nivel sistémico2, entre ellos: el aumento en el riesgo de padecer enfermedades como DM2, hipertensión arterial, obesidad y otras enfermedades cardiovasculares3–6. Los trastornos del sueño producen además alteraciones tales como la intolerancia a la glucosa, resistencia y alteración en la secreción de insulina, y finalmente la aparición de DM27. En esa línea, investigadores han señalado que existe asociación entre los problemas del sueño y el control glucémico en pacientes con DM28–11.
Además se ha observado una relación entre trastornos del sueño y síndrome metabólico en personas obesas, roncadores con o sin obesidad y con patrones respiratorios alterados del sueño (síndrome de hipoventilación), en particular en personas con apnea obstructiva del sueño (frecuente en pacientes con diabetes mellitus), patología que genera pequeños y grandes despertares que llevan a la activación repetida del sistema nervioso simpático y a la pérdida del control de la glucosa y la presión arterial12.
Un mecanismo que explica estas relaciones podría ser el hecho de que alteraciones en el patrón de sueño producen altos niveles de cortisol, de TNF-alfa, interleucina 6 y proteína C reactiva, los cuales a su vez impactan en el aumento de resistencia a la insulina. Cabe destacar que en fases profundas del sueño se regulan los niveles de insulina, momento en que existe menos utilización de glucosa y menos secreción de corticosteroides y los requerimientos metabólicos se encuentran en el mínimo, fase a la que cuesta más llegar con problemáticas del sueño13.
Por otro lado, existe una relación entre trastornos del sueño y DM2 que se manifiesta es la desregulación neuroendocrina del apetito mediante la interacción entre Leptina (hormona de la saciedad) y Grelina (antagonista), ambas producidas durante el sueño. Frente a un dormir pobre en calidad y cantidad, la Leptina disminuye aumentando la Grelina, lo que conlleva a un aumento del apetito (de preferencia en alimentos ricos en hidratos de carbono) y probablemente el aumento de la ingesta de alimentos. Esto es lo contrario de lo que sucede con el ejercicio, ya que este favorece un buen dormir, y por lo tanto una regulación neuroendocrina del apetito12.
Cabe destacar que la buena calidad de sueño ayuda al páncreas a regular los niveles insulínicos en sangre. En el caso de las personas con DM2, suelen presentar continuos despertares por condiciones subyacentes a esa patología, como la neuropatía diabética de las piernas, la polidipsia, poliuria y la fatiga, en desmedro de la regulación de la insulina por el páncreas13.
La prevalencia de los trastornos del sueño en la población chilena se encuentra entre 63,2% y el 67,2% medidas con diferentes instrumentos1,14.
No se encuentran publicaciones en Chile respecto a la calidad del sueño entre personas con condiciones crónicas como la DM2 y tampoco es evaluada dentro del Programa de Salud Cardiovascular (PSCV), ni mencionada en la guía clínica ministerial para el manejo de esta patología15,16.
El presente estudio busca evaluar la calidad del sueño de personas con DM2 y su asociación con características sociodemográficas, clínicas y metabólicas; y predecir el efecto de la calidad del sueño sobre la compensación metabólica, con el fin de contribuir a visibilizar este hábito como parte de un estilo de vida saludable de estos pacientes.
MétodoEstudio observacional, transversal y analítico realizado en personas con DM2 inscritas en el PSCV del Centro de Salud Familiar (CESFAM) Dr. Osvaldo Ruz de la comuna de Machalí, de la Región del Libertador Bernardo ÓHiggins en enero 2017, correspondiente a época de verano. Machalí es una comuna de la zona central de Chile, con aproximadamente 52.000 habitantes, un 95% de población urbana y un 5% población rural. De clima templado mediterráneo con estación seca en verano y lluviosa en invierno. En la actividad económica destaca el sector industrial y minero. Cuenta con 4 centros de atención de salud del nivel primario, siendo uno de ellos al cual se encuentran inscritos los participantes del presente estudio.
Se realizó un muestreo aleatorio simple, en una población de 631 personas con DM2 entre 20 y 65 años, inscritos en el PSCV del CESFAM, con un nivel de confianza del 95%, una precisión del 5% y una prevalencia de trastornos del sueño de un 67,2% en población adulta consultante de CESFAM, basado en el estudio de Castillo et al. 14, alcanzando un tamaño de muestra de 222 pacientes.
Del listado de pacientes inscritos en el PSCV entregado por el CESFAM se eligieron personas usando una lista de números aleatorios. Estas personas fueron contactadas telefónicamente o en el mismo CESFAM si asistían por otras razones por parte del equipo de investigación y personal capacitado de CESFAM, donde se corroboraron los criterios de inclusión y exclusión: diagnóstico confirmado de DM2; estar en tratamiento al menos un año y tener una medición de hemoglobina glucosilada (HbA1c) sérica en los 3 meses previos al inicio del estudio. Los criterios de exclusión fueron: la presencia de intervención quirúrgica que requirió anestesia general en los últimos 3 meses, expectativa de vida menor a 3 meses, adicción a drogas ilegales o alcohol, trabajar en sistema de turnos, condiciones de vida que impida dormir toda la noche y trastornos graves de salud mental. La mayoría de las mediciones se realizaron en las dependencias del CESFAM, y en algunos casos en el domicilio de la persona.
Mediante una entrevista, se aplicó un cuestionario que incluyó datos sociodemográficos, sexo, edad, escolaridad, estado civil y ocupación (especialmente diseñado para este estudio), Índice de Calidad del Sueño de Pittsburg (ICSP) y escala Patient Health Questionnaire (PHQ-9). Las variables primarias fueron calidad de sueño (variable resultado) y compensación metabólica evaluada mediante HbA1c (variable predictora). Las variables secundarias fueron datos sociodemográficos, antropométricos, comorbilidades, presencia de nicturia, tiempo de diagnóstico de diabetes, presencia de dolor nocturno y presencia de sintomatología depresiva. Para la variable edad se decidió como punto de corte mayor o menor de 45 años, dado que la mayor parte de la población con DM y con mala calidad de sueño se concentra en personas con 42,2 a 66 años según el metaanálisis de Azharuddin et al.17
Los datos antropométricos (índice de masa corporal), comorbilidades y valor de HbA1c actualizados se obtuvieron de la ficha clínica, y fueron medidos aquellos que se encontraban desactualizados. A partir del valor de HbA1c se creó la variable «control glucémico» definida como «descompensado» si el valor de HbA1c es igual o mayor al 7% y «compensado» si es menor que el 7%, basándose en las metas sanitarias de control de HbA1c de la Guía Clínica del Programa Cardiovascular del Ministerio de Salud chileno18. En cuanto a los años de diagnóstico de la DM2, se categorizó la variable en menos de 6 años y en 6 y más años, misma cifra utilizada en estudios similares19.
La calidad y cantidad de sueño fue evaluada con el ICSP, cuyo puntaje va de 0 a 21 y consta de 7 componentes: calidad subjetiva del sueño, latencia, duración, eficiencia habitual, alteraciones, uso de medicación y disfunción diurna. Este instrumento fue validado al castellano para uso en población latinoamericana con un coeficiente de confiabilidad promedio de 0,7820. En el presente estudio se consideró un ICSP≤5 puntos como buena calidad de sueño y sobre 5 puntos como mala calidad de sueño, de manera que puntuaciones superiores a 5 indican una mala calidad de sueño y graves dificultades en al menos 2 áreas de los 7 componentes, utilizando así valores similares de estudios encontrados en la literatura21.
La sintomatología depresiva fue evaluada mediante la escala PHQ-9, validada en Chile, con una sensibilidad del 92% y especificidad del 89%22.
El análisis se realizó mediante estadísticos descriptivos de estimación central y de dispersión para las variables continuas y distribuciones de frecuencias para las variables categóricas. Se realizaron modelos de regresión logística para estimar el efecto sobre la calidad y cantidad de sueño de las variables sociodemográficas y clínicas, ajustando por las covariables de interés, utilizando el método de stepwise. Se utilizó el programa Stata 14.0.
Este estudio contó con la aprobación del Comité Ético Científico de la Facultad de Medicina de la Pontificia Universidad Católica de Chile. Las personas manifestaron su voluntad de participar a través del proceso de consentimiento informado.
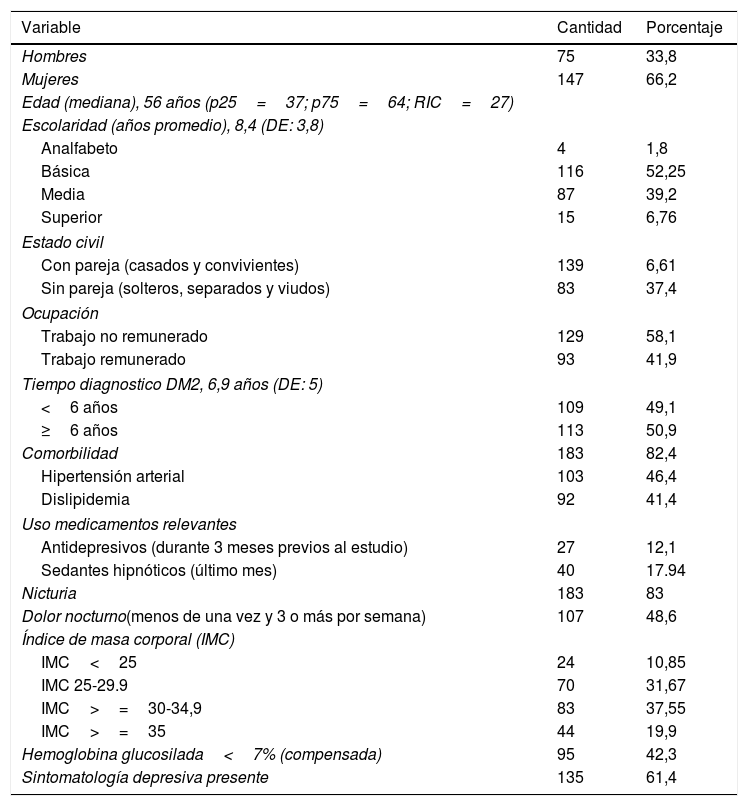
ResultadosPerfil sociodemográfico y de saludSe estudiaron 222 personas con DM2, los datos sociodemográficos y de salud son descritos en la tabla 1.
Perfil sociodemográfico y de salud
| Variable | Cantidad | Porcentaje |
|---|---|---|
| Hombres | 75 | 33,8 |
| Mujeres | 147 | 66,2 |
| Edad (mediana), 56 años (p25=37; p75=64; RIC=27) | ||
| Escolaridad (años promedio), 8,4 (DE: 3,8) | ||
| Analfabeto | 4 | 1,8 |
| Básica | 116 | 52,25 |
| Media | 87 | 39,2 |
| Superior | 15 | 6,76 |
| Estado civil | ||
| Con pareja (casados y convivientes) | 139 | 6,61 |
| Sin pareja (solteros, separados y viudos) | 83 | 37,4 |
| Ocupación | ||
| Trabajo no remunerado | 129 | 58,1 |
| Trabajo remunerado | 93 | 41,9 |
| Tiempo diagnostico DM2, 6,9 años (DE: 5) | ||
| <6 años | 109 | 49,1 |
| ≥6 años | 113 | 50,9 |
| Comorbilidad | 183 | 82,4 |
| Hipertensión arterial | 103 | 46,4 |
| Dislipidemia | 92 | 41,4 |
| Uso medicamentos relevantes | ||
| Antidepresivos (durante 3 meses previos al estudio) | 27 | 12,1 |
| Sedantes hipnóticos (último mes) | 40 | 17.94 |
| Nicturia | 183 | 83 |
| Dolor nocturno(menos de una vez y 3 o más por semana) | 107 | 48,6 |
| Índice de masa corporal (IMC) | ||
| IMC<25 | 24 | 10,85 |
| IMC 25-29.9 | 70 | 31,67 |
| IMC>=30-34,9 | 83 | 37,55 |
| IMC>=35 | 44 | 19,9 |
| Hemoglobina glucosilada<7% (compensada) | 95 | 42,3 |
| Sintomatología depresiva presente | 135 | 61,4 |
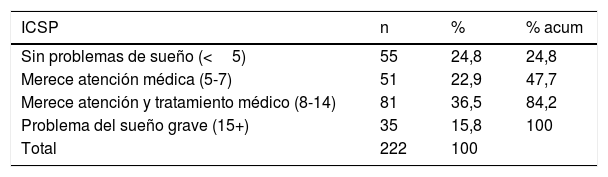
Con relación a la calidad del sueño, el puntaje promedio del ICSP fue 8,88 (DE: 4,99) rango 1-20. Un 75,2% de los participantes presentó problemas de sueño de diversa gravedad (tabla 2).
Las horas de sueño promedio reportada por los pacientes fue de 6,2h (DE: 1,9). Solo un 33% refirió dormir entre 7 y 9h. Respecto a la percepción subjetiva de la calidad del sueño, un 62,2% consideró que tenía un buen dormir y un 37,8% un mal dormir.
Respecto al periodo de latencia de conciliación un 54,7% tarda hasta 30min en quedarse dormido y un 45,3% más de este tiempo, destacando que el 33,2% tarda más de una hora.
En el último mes un 17,9% de los pacientes consumieron sedantes/hipnóticos, de estos un 12,5% entre una y más de 3 veces a la semana.
Compensación metabólicaLa HbA1c de la muestra alcanzó una mediana de 7,2% (RIC=3,2), sin diferencias significativas entre ambos sexos (suma de rangos de Wilcoxon=-0,459; p=0,646).
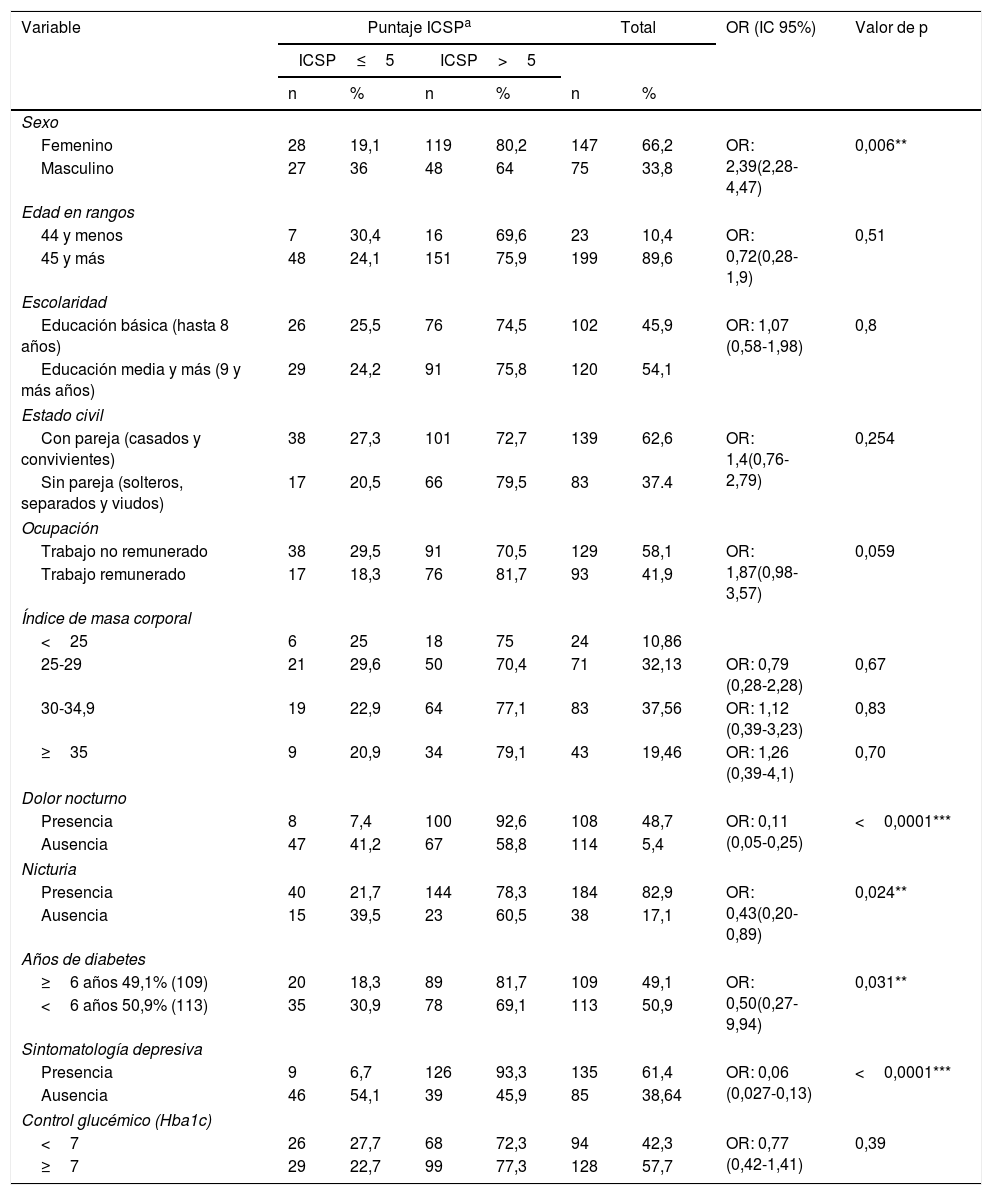
Calidad de sueño y asociación con características sociodemográficas y clínicasLa asociación entre la calidad de sueño y las características sociodemográficas y clínicas se muestran en la tabla 3. Las variables que tuvieron asociación estadísticamente significativa con el ICSP fueron: ser mujer, dolor nocturno, nicturia tiempo de diagnóstico de la diabetes y síntomas depresivos. No contar con trabajo remunerado marcó una tendencia con mal dormir.
Asociación entre calidad de sueño y características sociodemográficas y clínicas
| Variable | Puntaje ICSPa | Total | OR (IC 95%) | Valor de p | ||||
|---|---|---|---|---|---|---|---|---|
| ICSP≤5 | ICSP>5 | |||||||
| n | % | n | % | n | % | |||
| Sexo | ||||||||
| Femenino | 28 | 19,1 | 119 | 80,2 | 147 | 66,2 | OR: 2,39(2,28-4,47) | 0,006** |
| Masculino | 27 | 36 | 48 | 64 | 75 | 33,8 | ||
| Edad en rangos | ||||||||
| 44 y menos | 7 | 30,4 | 16 | 69,6 | 23 | 10,4 | OR: 0,72(0,28-1,9) | 0,51 |
| 45 y más | 48 | 24,1 | 151 | 75,9 | 199 | 89,6 | ||
| Escolaridad | ||||||||
| Educación básica (hasta 8 años) | 26 | 25,5 | 76 | 74,5 | 102 | 45,9 | OR: 1,07 (0,58-1,98) | 0,8 |
| Educación media y más (9 y más años) | 29 | 24,2 | 91 | 75,8 | 120 | 54,1 | ||
| Estado civil | ||||||||
| Con pareja (casados y convivientes) | 38 | 27,3 | 101 | 72,7 | 139 | 62,6 | OR: 1,4(0,76-2,79) | 0,254 |
| Sin pareja (solteros, separados y viudos) | 17 | 20,5 | 66 | 79,5 | 83 | 37.4 | ||
| Ocupación | ||||||||
| Trabajo no remunerado | 38 | 29,5 | 91 | 70,5 | 129 | 58,1 | OR: 1,87(0,98-3,57) | 0,059 |
| Trabajo remunerado | 17 | 18,3 | 76 | 81,7 | 93 | 41,9 | ||
| Índice de masa corporal | ||||||||
| <25 | 6 | 25 | 18 | 75 | 24 | 10,86 | ||
| 25-29 | 21 | 29,6 | 50 | 70,4 | 71 | 32,13 | OR: 0,79 (0,28-2,28) | 0,67 |
| 30-34,9 | 19 | 22,9 | 64 | 77,1 | 83 | 37,56 | OR: 1,12 (0,39-3,23) | 0,83 |
| ≥35 | 9 | 20,9 | 34 | 79,1 | 43 | 19,46 | OR: 1,26 (0,39-4,1) | 0,70 |
| Dolor nocturno | ||||||||
| Presencia | 8 | 7,4 | 100 | 92,6 | 108 | 48,7 | OR: 0,11 (0,05-0,25) | <0,0001*** |
| Ausencia | 47 | 41,2 | 67 | 58,8 | 114 | 5,4 | ||
| Nicturia | ||||||||
| Presencia | 40 | 21,7 | 144 | 78,3 | 184 | 82,9 | OR: 0,43(0,20-0,89) | 0,024** |
| Ausencia | 15 | 39,5 | 23 | 60,5 | 38 | 17,1 | ||
| Años de diabetes | ||||||||
| ≥6 años 49,1% (109) | 20 | 18,3 | 89 | 81,7 | 109 | 49,1 | OR: 0,50(0,27-9,94) | 0,031** |
| <6 años 50,9% (113) | 35 | 30,9 | 78 | 69,1 | 113 | 50,9 | ||
| Sintomatología depresiva | ||||||||
| Presencia | 9 | 6,7 | 126 | 93,3 | 135 | 61,4 | OR: 0,06 (0,027-0,13) | <0,0001*** |
| Ausencia | 46 | 54,1 | 39 | 45,9 | 85 | 38,64 | ||
| Control glucémico (Hba1c) | ||||||||
| <7 | 26 | 27,7 | 68 | 72,3 | 94 | 42,3 | OR: 0,77 (0,42-1,41) | 0,39 |
| ≥7 | 29 | 22,7 | 99 | 77,3 | 128 | 57,7 | ||
Se ajustó un modelo de regresión logística para predecir el efecto de la calidad del sueño sobre la compensación metabólica, cuyos valores se muestran en la tabla 4. Como variables de ajuste al modelo se incluyeron aquellas que alcanzaron asociaciones estadísticamente significativas con la calidad del sueño, utilizando método setpwise: presencia de síntomas depresivos, sexo, presencia de dolor nocturno, nicturia y tiempo de diabetes. El modelo arrojó un OR=1,73 (IC: 0,78-3,87), es decir, las personas con mala calidad de sueño tuvieron un 73% más de probabilidad de estar descompensados metabólicamente que las que tienen buena calidad de sueño, ajustado por las variables señaladas. A pesar de que este resultado no fue estadísticamente significativo, dado que el intervalo de confianza atraviesa el valor crítico 1, es un resultado clínicamente relevante.
Efecto de la calidad del sueño sobre el control glucémicoa
| Variable | OR | IC 95% |
|---|---|---|
| Modelo no ajustado | ||
| Calidad del sueño (ICSP) | ||
| Buena calidad de sueño (≤5 puntos) | Referencia | ---- |
| Mala calidad de sueño (>5 puntos) | 1,30 | 0,71-2,41 |
| p=0,39 | ||
| Modelo ajustadob | ||
| Calidad del sueño (ICSP) | ||
| Buena calidad de sueño (≤5 puntos) | Referencia | ---- |
| Mala calidad de sueño (>5 puntos) | 1,73 | 0,78-3,87 |
| p=0.18 | ||
Este es el primer estudio publicado que evalúa la calidad del sueño y su asociación con variables sociodemográficas y metabólicas en pacientes diabéticos controlados en la atención primaria de salud en Chile.
La mayoría eran mujeres, de escolaridad básica completa, con un promedio de 6 años con diagnóstico de DM2, presencia de hipertensión, dislipidemia y valores de HbA1c similares a lo reportado por otros investigadores19,23–25. El perfil de pacientes era similar al que habitualmente se encuentra en control en el nivel primario de atención de salud en Chile26. La presencia de síntomas depresivos en esta población fue del 61,4%, cifra muy superior a la reportada en la literatura internacional en pacientes diabéticos (40,1% y 43,6%)10,24,27, como también en usuarios de la atención primaria en Chile (25%)28. Llama la atención que, a pesar del alto porcentaje de personas con síntomas depresivos, solo el 12,1% manifestó estar recibiendo tratamiento (antidepresivo o ansiolítico) durante los 3 meses previos a la entrevista.
Las horas promedio de sueño reportada por las personas del presente estudio (6,2h) fueron similares a las reportadas por el estudio de Shamshirgaran et al.19 y mayores a los reportados por Knutson et al.29, cantidad que se encuentra bajo las consideradas como adecuadas30 y que podrían estar afectando la salud de estos usuarios, especialmente considerando su condición de cronicidad.
Con relación a la calidad del sueño evaluada a través del ICSP, los puntajes promedio en este estudio fueron similares a los reportados por Bing-Qian et al.31 y mayores a los publicados por Shamshirgaran et al.19 El 75,2% de las personas tenía algún problema de sueño según ICSP, similar a lo señalado por Navarro32, sin embargo esta cifra fue superior a la encontrada en otros estudios que no alcanzaba el 50%24,25,30. Llama la atención que más de la mitad de los pacientes del presente estudio tenían una buena percepción de su calidad de sueño, a pesar de los altos puntajes de ICSP descritos.
En nuestros resultados, el ser mujer tuvo una asociación significativa con mala calidad de sueño, al igual que en el estudio de Chao et al.33 y Song et al.34 Sin embargo Narisawa et al. no encontraron diferencias entre sexos23. Estas diferencias podrían estar asociadas a temas de género en relación con la multiplicidad de roles que asumen muchas mujeres, en especial en el ámbito doméstico.
La presencia de dolor nocturno y nicturia se asociaron significativamente con mala calidad de sueño, similar a lo encontrado por Narisawa et al.23 Ambas situaciones podrían ser factores independientes de la mala calidad del sueño, sin embargo también podrían ser complicaciones de la diabetes, las que aparecen en etapas avanzadas de la enfermedad (tiempo de diagnóstico de la enfermedad), condición que también en este estudio se asoció significativamente a una mala calidad del sueño, al igual que en los estudios de Zhu et al.10 y Chao et al.33.
Otra variable que mostró asociación estadísticamente significativa con la calidad del sueño fue la presencia de síntomas depresivos, tal como lo señala el estudio de Knutson et al.29. La depresión sería un factor de riesgo independiente para una mala calidad del sueño29, condición que es altamente frecuente en el presente estudio.
Respecto a la relación entre la calidad de sueño y la compensación metabólica, los resultados son controvertidos. El presente estudio, así como el de Shamshirgaran et al.18 y el de Narisawa et al.23, no encontró una asociación estadísticamente significativa entre estas variables, sin embargo las diferencias podrían tener relevancia desde el punto de vista clínico. En el metaanálisis realizado por Lee et al., que incluyó 15 estudios de pacientes con características muy heterogénea y con diferentes puntos de corte en el ICSP para identificar a las personas con buena y mala calidad de sueño, se evidenció que la disminución o el exceso en horas totales de sueño se asociaron a un aumento de la HbA1c. Sin embargo, la evidencia para la asociación entre calidad del sueño y compensación metabólica evaluada por HbA1c fue insuficiente11, similar a los hallazgos encontrados en el metaanálisis de Azharuddin et al.17
Cabe destacar que la mayoría de las personas presentaban multimorbilidad y mala calidad del sueño, que podría contribuir a deteriorar más su salud, dado las evidencias que muestran los efectos de la calidad del sueño en el metabolismo de la glucosa y de otras funciones fisiológicas básicas.
Este estudio presenta algunas fortalezas y limitaciones. Dentro de las fortalezas destaca que a la fecha existen escasos estudios publicados sobre la calidad del sueño en personas diabéticas en América Latina y ninguno en Chile, siendo este el primero. Este estudio podría dar valiosa información para los clínicos acerca de la calidad del sueño de las personas con DM2 del PSCV.
En cuanto a las limitaciones, este fue un estudio transversal sin evaluaciones de seguimiento a los participantes, lo que no permite aportar evidencia a las causas de la mala calidad del sueño en esta población. Además, el estudio no incluyó a pacientes que requieren insulina, ya que no se controlaban en estos centros de salud primarios, por tanto, los resultados no son generalizables a todos los pacientes con DM2. Se puede considerar una limitación la capacidad de los participantes para recordar algunos antecedentes (sesgo de recuerdo), como por ejemplo dolor nocturno y nicturia. El estudio se realizó en época de verano lo que podría haber influido en la calidad del sueño.
ConclusiónLos resultados evidencian que gran parte de las personas con DM2 tienen una mala calidad del sueño (según el ICSP), no obstante, la mitad de ellos tenían una buena percepción de su calidad de sueño. La calidad del sueño se asoció de manera estadísticamente significativa a ser mujer, tener un diagnóstico de diabetes mayor a 6 años, presentar dolor nocturno, nicturia y síntomas depresivos. Por otro lado, se encontró una asociación entre la calidad del sueño y la compensación metabólica sin significancia estadística, sin embargo, podría tener relevancia clínica.
Por otro lado, la mayoría de la población estudiada tiene comorbilidades (como hipertensión y dislipidemia) y cerca de 2 tercios presentan síntomas depresivos (muy superior que en estudios nacionales e internacionales), aun cuando solo el 12,1% manifestó estar recibiendo tratamiento (antidepresivo o ansiolítico) durante los 3 meses previos a la entrevista.
Dada las evidencias que muestran los efectos de la calidad del sueño en el metabolismo de la glucosa, se requieren futuras investigaciones que puedan aportar a relevar la calidad del sueño en personas con condiciones crónicas, como parte de los hábitos que conforman un estilo de vida saludable, para ser incluido en las guías clínicas de manejo de cuidado de estos pacientes.
FinanciaciónVicerrectoría de Investigación, Pontificia Universidad Católica de Chile. Santiago-Chile
Conflicto de interesesTodos los autores de este estudio reportan no tener conflictos de intereses.
A los participantes que generosamente entregaron sus datos. A los directivos y profesionales del Centro de Salud Familiar Dr. Osvaldo Ruz comuna Machalí, VI Región, Chile.