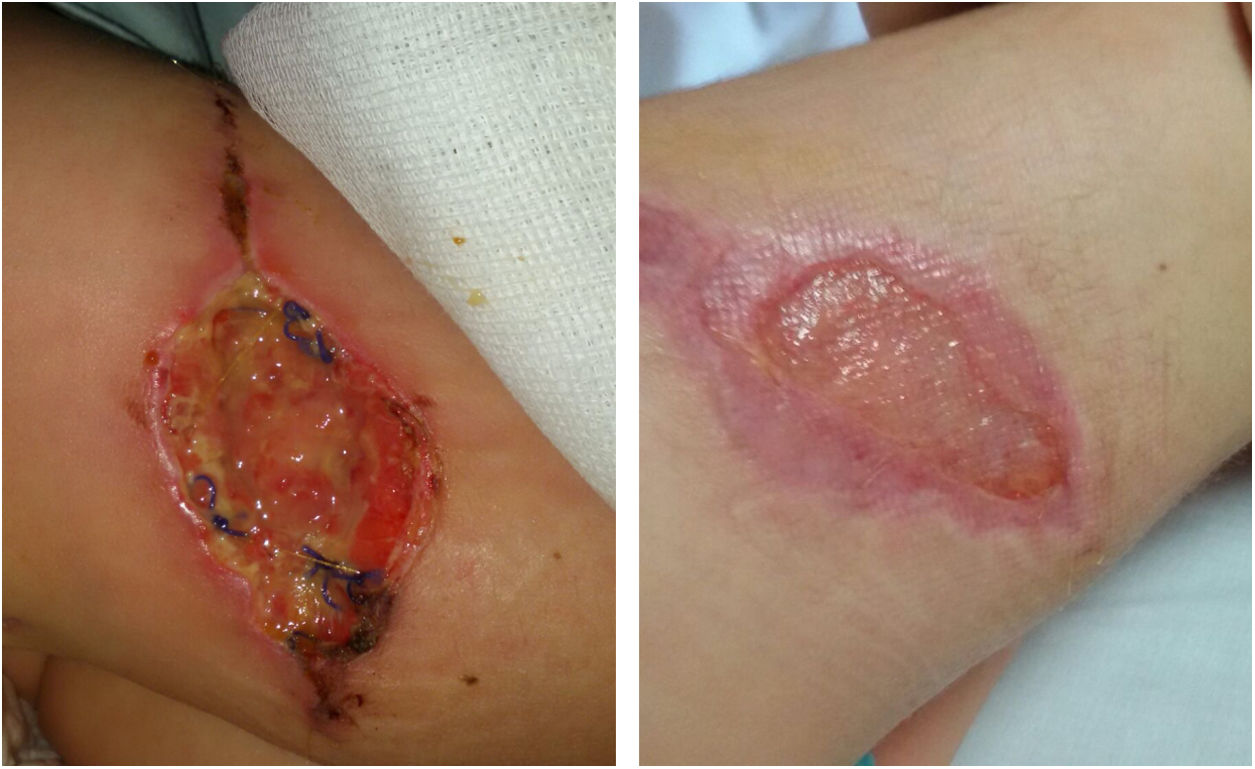
Las micobacterias no tuberculosas (MNT) pueden producir infección de piel y tejidos blandos. Aunque infrecuentes, se han descrito casos de infección de herida quirúrgica. Su diagnóstico es importante para un tratamiento adecuado.
Presentamos el caso de una niña de 4 años, intervenida de nevus melanocítico congénito de 6cm de diámetro en el muslo derecho. Al quinto día poscirugía presentó tumefacción en lecho quirúrgico, que fue tratada con amoxicilina-clavulánico, a pesar de lo cual la lesión aumentó en extensión y se produjo dehiscencia de la herida. Fue reintervenida a los 20 días y se realizó desbridamiento.
Las muestras de exudado se sembraron en medios habituales no selectivos, agar sangre y agar chocolate, así como en medios específicos para micobacterias: Löwenstein-Jensen y medio líquido Bactec MGIT 960 (BD Diagnostics, EE. UU.). A las 72 h crecieron colonias diminutas y translúcidas; se procedió a su identificación mediante espectrometría de masas, Maldi-Tof (Bruker Daltonics GmbH, Leipzig, Alemania). La cepa se identificó como Mycobacterium senagalense con una puntuación de 2,1. Dada la alta similitud genética entre M. senegalense y Mycobacterium conceptionense, recientemente descrita1,2, se procedió a diferenciar las especies mediante características bioquímicas y de crecimiento3. En concreto, M. senegalense fue positiva para inositol y negativa para manitol, y creció a 42°C, lo que confirmó el diagnóstico. En el estudio de sensibilidad antibiótica mediante Etest®, la cepa resultó sensible a amikacina, ciprofloxacino, claritromicina, doxiciclina, cotrimoxazol e imipenem y resistente a tobramicina y a linezolid.
Se inició tratamiento con ciprofloxacino y claritromicina. Posteriormente presentó nuevamente dehiscencia de la herida quirúrgica: se decidió cierre por segunda intención y se añadió cotrimoxazol, que se suspendió a los 20 días ante la presencia de leucopenia.
La ecografía no objetivó afectación muscular. La evolución fue favorable (fig. 1). La paciente permaneció afebril, sin elevación de reactantes de fase aguda. Los estudios inmunitarios fueron normales. El estudio genético de susceptibilidad mendeliana a micobacterias no mostró mutaciones.
M. senegalense es un patógeno relacionado con enfermedades del ganado bovino en el continente africano (muermo bovino). Pertenece al grupo de las MNT de crecimiento rápido, y se aísla en agua, suelo o animales. Tiene capacidad de formar biopelículas, lo que dificulta su erradicación. M. senegalense pertenece al grupo de M. fortuitum, que incluye además a otras especies como M. peregrinum, M. mageritense, M. septicum, M. houstonense, M. boenickei, M. neworleanense y M. brisbanense.
Los avances en biología molecular han conducido a un aumento en el diagnóstico de estas infecciones1. Es probable que M. senegalense, como patógeno humano, haya sido infradiagnosticado, debido a su similitud con otras micobacterias de este grupo. Wallace et al., mediante secuenciación del 16SARN, encontraron que 43 aislamientos previamente identificados como M. peregrinum correspondían a M. senegalense4.
Encontramos limitadas referencias en la literatura de M. senegalense como causante de enfermedad en humanos. El primer caso fue descrito en 2005 en Corea y se relacionó con bacteriemia asociada a infección de catéter central en un paciente con linfoma no Hodgkin5. Talavlikar et al. describieron el caso de una niña que, tras un accidente doméstico con rotura de un acuario, sufrió diversas heridas faciales en las que se aisló M. senegalense3. En 2019, Maupin et al. notificaron un caso de osteomielitis de tibia en el que se aisló este microorganismo6. Nuestro caso es, hasta donde conocemos, la primera infección de herida quirúrgica por M. senegalense descrita. Las MNT causan infecciones nosocomiales en instituciones sanitarias en países desarrollados, en las que se concentran habitualmente en las conducciones de agua. Kohsravi et al. encontraron que un 7,7% de las micobacterias aisladas en las conducciones de agua de un hospital correspondieron a M. senegalense7.
Las MNT de crecimiento rápido son resistentes a los antituberculosos convencionales, lo que justifica el uso combinado de antibióticos y la necesidad de estudiar la sensibilidad de la cepa aislada en cada caso8.
En nuestro caso utilizamos una combinación de claritromicina, ciprofloxacino y cotrimoxazol, de igual forma que Talavlikar et al.3. En los otros casos descritos, la micobacteria fue igualmente sensible a estos 3antibióticos. En la actualidad existen datos de eficacia y seguridad del uso de fluoroquinolonas en niños, por lo que su uso en infecciones complicadas, como el que describimos, estaría justificado9,10.
La duración del tratamiento no está definida, si bien se recomiendan pautas prolongadas; en nuestro caso fue de 6 meses. Además de la antibioterapia, dada la capacidad para formar biopelículas, en las infecciones de piel y partes blandas debe realizarse desbridamiento quirúrgico.
FinanciaciónLos autores declaran no tener financiación externa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.