Las enfermedades parasitarias tienen una distribución mundial y son causa de una significativa morbimortalidad, principalmente en las regiones tropicales. En los últimos años, el interés por estas infecciones ha crecido como consecuencia del incremento de la inmigración, los viajes al extranjero y las adopciones internacionales, que además han supuesto un incremento en la incidencia de parasitosis en nuestro país. El perfil típico del viajero también ha cambiado, ha aumentado el número de personas inmunodeprimidas, con enfermedades crónicas o de mayor edad. Los inmigrantes establecidos en los países de acogida a menudo regresan a sus regiones de origen para visitar a sus parientes o amigos, viajes que suelen ser de alto riesgo. Las donaciones de sangre y órganos pueden provenir de inmigrantes originarios de cualquier parte del mundo, con el consiguiente riesgo de transmisión de infecciones exóticas. El objetivo de esta revisión es sintetizar el tratamiento de las parasitosis más frecuentes en un momento en el que la parasitología clínica está de plena actualidad.
Parasitic infections occur worldwide and cause significant morbidity and mortality, especially in tropical areas. In recent years, the interest in these infections has grown because of the increase in immigration, international travel, and international adoptions. In Spain, these factors have led to a rise in the incidence of parasitic infections. The typical profile of travelers has also changed, with an increase in immunosuppressed persons, and those of advanced age or with pre-existing medical conditions. Immigrants who have settled in host countries often return to their countries of origin to visit friends and relatives, and these travelers are at a higher risk of acquiring certain infections. Immigrants may be blood or organ donors, and transmission of exotic infections may occur. This review summarizes the management of the most frequent parasitic infections at a time when clinical parasitology is of considerable interest.
Las enfermedades parasitarias tienen una distribución universal y son causa de una significativa morbimortalidad, principalmente en las regiones tropicales del mundo. Tradicionalmente son enfermedades asociadas a un bajo grado de desarrollo, malas condiciones higienicosanitarias y determinadas condiciones ecológicas. En los países desarrollados, las medidas de salud pública, el control vectorial y la educación sanitaria han permitido el control de la mayoría de las parasitosis, e incluso la erradicación de algunas de ellas.
En los últimos años, el interés por estas enfermedades ha crecido principalmente como consecuencia del incremento de la inmigración, los viajes fuera de nuestras fronteras y las adopciones internacionales. Estos movimientos demográficos hacen que las parasitosis sean un diagnóstico cada vez más frecuente en nuestro medio. Sin embargo, además del aspecto meramente cuantitativo hay que tener en cuenta otros aspectos que modulan la relación hospedador-parásito o la respuesta al tratamiento y que también se han modificado significativamente en los últimos años. El perfil típico del viajero ha cambiado, cada vez viajan más personas inmunodeprimidas, con enfermedades crónicas o de mayor edad. Los inmigrantes establecidos en los países de acogida a menudo viajan a sus regiones de origen para visitar a sus parientes o amigos. Estos viajes suelen ser de mayor riesgo; es común que viajen niños o mujeres embarazadas y que se adopten menos medidas preventivas. En relación con las donaciones de sangre y órganos, éstas pueden provenir de inmigrantes originarios de cualquier parte del mundo, con el consiguiente riesgo de transmisión de infecciones exóticas. Además, el desarrollo de resistencias a los antiparasitarios constituye una dificultad añadida, máxime en un área donde la investigación de nuevos fármacos es muy limitada.
El objetivo de esta revisión es sintetizar el tratamiento de las enfermedades producidas por parásitos, que en nuestro medio pueden englobarse en 2 grandes grupos:
- •
Parasitosis autóctonas, endémicas en nuestro país y generalmente de distribución universal, como las producidas por Leishmania infantum, Ascaris lumbricoides, Taenia saginata, Echinococcus granulosus, Fasciola hepatica, Giardia lamblia o Cryptosporidium sp., entre otras.
- •
Parasitosis importadas, adquiridas en el extranjero por viajeros, inmigrantes o expatriados; la mayoría de éstas no están presentes en nuestro país o su incidencia es muy baja, como las producidas por Plasmodium sp., Cyclospora cayetanensis, Schistosoma sp., Onchocerca volvulus, Strongyloides stercoralis o Trypanosoma cruzi.
La amebiosis es una infección producida por Entamoeba histolytica, protozoo parásito no flagelado que afecta al intestino grueso, desde donde puede diseminarse a otros órganos, principalmente el hígado. Los seres humanos pueden albergar distintas especies de amebas no patógenas (Entamoeba coli, Entamoeba gingivalis, Entamoeba hartmanii, Iodamoeba bütschlii, y Endolimax nana); la única con capacidad invasora es Entamoeba histolytica. Recientemente se han clasificado en 3 especies que son morfológicamente idénticas pero genéticamente distintas: E. histolytica, Entamoeba dispar y Entamoeba moshkovskii. Estas 2 últimas son comensales no patógenos del intestino grueso.
La forma más común de infección es la colonización asintomática. Las cuadros clínicos sintomáticos se dividen en 2 grandes grupos: amebiosis intestinal complicada o no, y amebiosis extraintestinal (principalmente en forma de absceso hepático y mucho más raramente como afectación pleuropulmonar, peritonitis o pericarditis).
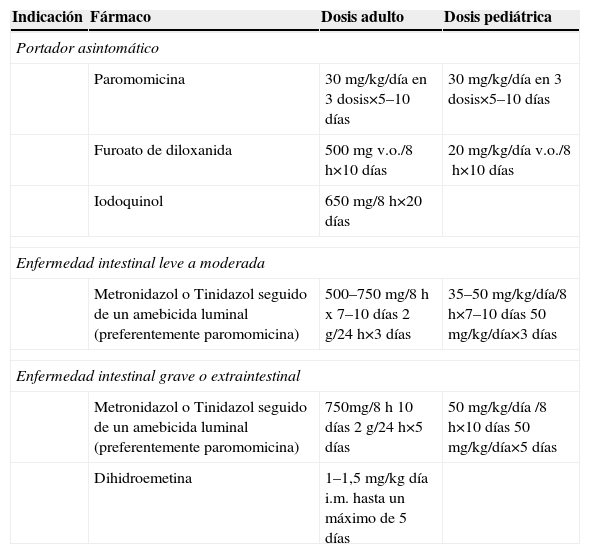
El tratamiento farmacológico se basa en el uso de amebicidas intraluminales, que alcanzan una elevada concentración en el intestino y son eficaces contra los quistes y los trofozoítos, y de amebicidas tisulares1–3, que son eficaces en los tejidos pero no logran eliminar hasta el 50% de los quistes intestinales (tabla 1). Para la enfermedad invasora los fármacos de elección son los nitroimidazoles (metronidazol, tinidazol y ornidazol), para los que no se han descrito resistencias. Otros amebicidas tisulares de segunda elección son la dihidroemetina y la cloroquina (que se concentra en la vía biliar y se usa como adyuvante de otros amebicidas). Los fármacos con actividad intraluminal son el tratamiento de elección para los portadores de quistes (riesgo anual de desarrollo de amebiosis en colonizados del 4–10%)4 así como un complemento imprescindible en el tratamiento de la amebiosis invasora. El más usado en nuestro país es la paromomicina, seguida del iodoquinol y el furoato de diloxanida.
Tratamiento farmacológico de la amebiosis producida por Entamoeba histolytica
| Indicación | Fármaco | Dosis adulto | Dosis pediátrica |
| Portador asintomático | |||
| Paromomicina | 30mg/kg/día en 3 dosis×5–10 días | 30mg/kg/día en 3 dosis×5–10 días | |
| Furoato de diloxanida | 500mg v.o./8h×10 días | 20mg/kg/día v.o./8h×10 días | |
| Iodoquinol | 650mg/8h×20 días | ||
| Enfermedad intestinal leve a moderada | |||
| Metronidazol o Tinidazol seguido de un amebicida luminal (preferentemente paromomicina) | 500–750mg/8h x 7–10 días 2g/24h×3 días | 35–50mg/kg/día/8h×7–10 días 50mg/kg/día×3 días | |
| Enfermedad intestinal grave o extraintestinal | |||
| Metronidazol o Tinidazol seguido de un amebicida luminal (preferentemente paromomicina) | 750mg/8h10 días 2g/24h×5 días | 50mg/kg/día /8h×10 días 50mg/kg/día×5 días | |
| Dihidroemetina | 1–1,5mg/kg día i.m. hasta un máximo de 5 días | ||
i.m.: intramuscular; v.o.: vía oral.
El tratamiento quirúrgico se reserva para los casos de abscesos de gran tamaño con peligro de rotura a pericardio, abscesos complicados, pericarditis o casos de megacolon. La perforación intestinal puede beneficiarse de tratamiento conservador con amebicidas y antimicrobianos. Una alternativa a la cirugía consiste en el drenaje percutáneo guiado por TAC o ecografía, con o sin aspiración, en aquellos casos de respuesta tórpida (fiebre y dolor abdominal durante más de 4 días), diagnóstico dudoso (sospecha de infección o sobreinfección bacteriana), gran tamaño (>10cm de diámetro o > de 300cm3) o en los empiemas5.
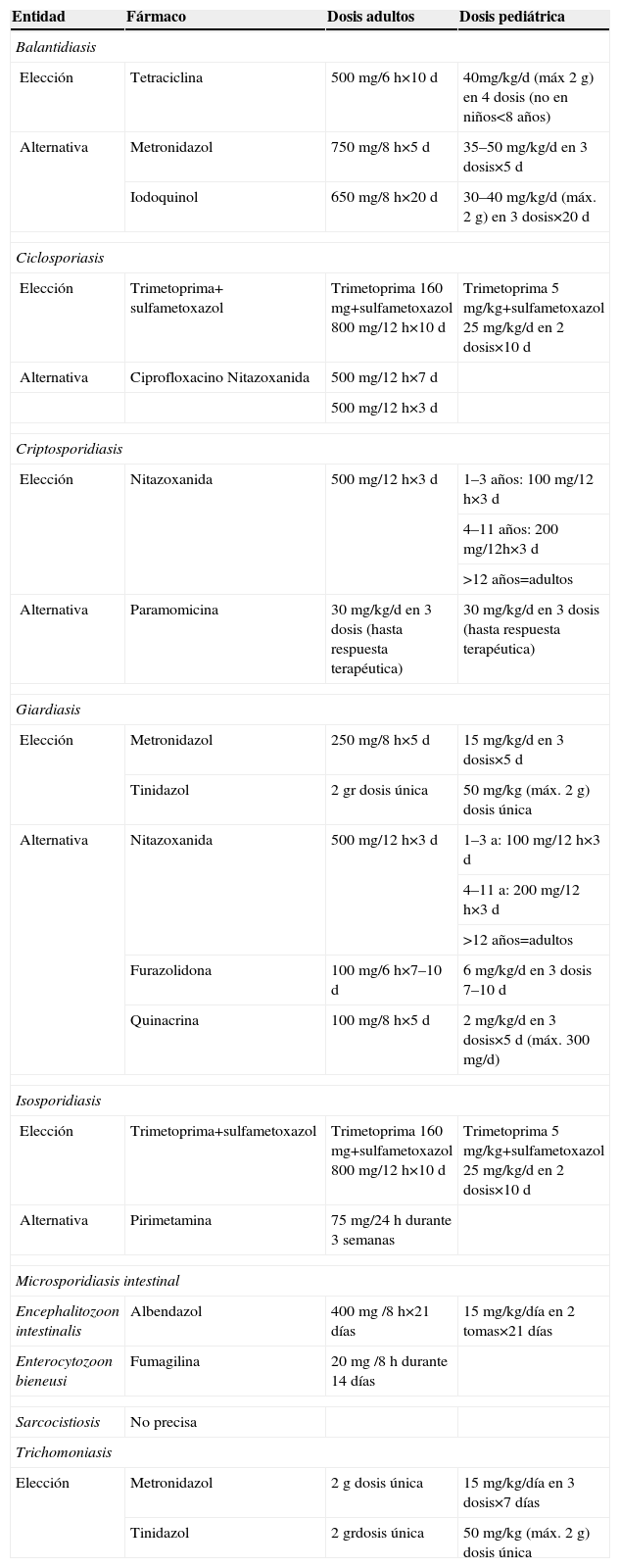
BalantidiosisSe trata de una zoonosis cuyo reservorio principal es el cerdo. Producida por el Balantidium coli y sus trofozoítos, son las únicas formas protozoarias ciliadas que infectan el colon humano. Causa diarrea sanguinolenta, que puede ser grave en pacientes inmunodeprimidos. Se trata tanto la forma sintomática como la asintomática (expulsión de quistes con las heces). El tratamiento de elección son las tetraciclinas, y una opción alternativa es el metronidazol (tabla 2). Hay alguna evidencia de que la nitazoxanida puede ser de utilidad6.
Tratamiento farmacológico de protozoosis intestinales y genitales
| Entidad | Fármaco | Dosis adultos | Dosis pediátrica |
| Balantidiasis | |||
| Elección | Tetraciclina | 500mg/6h×10 d | 40mg/kg/d (máx 2 g) en 4 dosis (no en niños<8 años) |
| Alternativa | Metronidazol | 750mg/8h×5 d | 35–50mg/kg/d en 3 dosis×5 d |
| Iodoquinol | 650mg/8h×20 d | 30–40mg/kg/d (máx. 2 g) en 3 dosis×20 d | |
| Ciclosporiasis | |||
| Elección | Trimetoprima+ sulfametoxazol | Trimetoprima 160mg+sulfametoxazol 800mg/12h×10d | Trimetoprima 5mg/kg+sulfametoxazol 25mg/kg/d en 2 dosis×10 d |
| Alternativa | Ciprofloxacino Nitazoxanida | 500mg/12h×7 d | |
| 500mg/12h×3 d | |||
| Criptosporidiasis | |||
| Elección | Nitazoxanida | 500mg/12h×3 d | 1–3 años: 100mg/12h×3 d |
| 4–11 años: 200mg/12h×3 d | |||
| >12 años=adultos | |||
| Alternativa | Paramomicina | 30mg/kg/d en 3 dosis (hasta respuesta terapéutica) | 30mg/kg/d en 3 dosis (hasta respuesta terapéutica) |
| Giardiasis | |||
| Elección | Metronidazol | 250mg/8h×5d | 15mg/kg/d en 3 dosis×5 d |
| Tinidazol | 2gr dosis única | 50mg/kg (máx. 2g) dosis única | |
| Alternativa | Nitazoxanida | 500mg/12h×3d | 1–3 a: 100mg/12h×3d |
| 4–11 a: 200mg/12h×3d | |||
| >12 años=adultos | |||
| Furazolidona | 100mg/6h×7–10d | 6mg/kg/d en 3 dosis 7–10d | |
| Quinacrina | 100mg/8h×5d | 2mg/kg/d en 3 dosis×5d (máx. 300mg/d) | |
| Isosporidiasis | |||
| Elección | Trimetoprima+sulfametoxazol | Trimetoprima 160mg+sulfametoxazol 800mg/12h×10d | Trimetoprima 5mg/kg+sulfametoxazol 25mg/kg/d en 2 dosis×10 d |
| Alternativa | Pirimetamina | 75mg/24h durante 3 semanas | |
| Microsporidiasis intestinal | |||
| Encephalitozoon intestinalis | Albendazol | 400mg /8h×21 días | 15mg/kg/día en 2 tomas×21 días |
| Enterocytozoon bieneusi | Fumagilina | 20mg /8h durante 14 días | |
| Sarcocistiosis | No precisa | ||
| Trichomoniasis | |||
| Elección | Metronidazol | 2g dosis única | 15mg/kg/día en 3 dosis×7 días |
| Tinidazol | 2 grdosis única | 50mg/kg (máx. 2g) dosis única | |
Son causa de diarrea, que puede cursar en forma de brotes, diarrea persistente o diarrea del viajero en sujetos que se han desplazado a países en desarrollo. En ocasiones, el cuadro clínico es autolimitado. La respuesta al tratamiento es mejor en los sujetos inmunocompetentes que en los inmunodeprimidos, especialmente pacientes con infección por el VIH, en los que el control de la inmunidad es básico para una respuesta favorable.
Las infecciones por Isospora belli y por C. cayetanensis se tratan con cotrimoxazol (tabla 2). En inmunodeprimidos, se usan dosis más altas (se administra cada 6–8h) y prolongadas (durante 3 semanas). En pacientes infectados por el VIH con isosporosis hay que realizar profilaxis secundaria (un comprimido diario de cotrimoxazol 160/800mg) cuya duración no está establecida. Como alternativa para el tratamiento se puede administrar primimetamina (75mg/día), y se requieren dosis de 25mg diarios en profilaxis secundaria. En la ciclosporidiosis se ha utilizado como tratamiento, con menor eficacia, ciprofloxacino y nitazoxanida. La infección por Sarcocystis hominis no requiere tratamiento.
La criptosporidiosis, causada principalmente por Cryptosporidium parvum y Cryptosporidium hominis, se trata en personas inmunocompetentes con soporte hidroelectrolítico y en los niños o en los adultos, cuando persisten los síntomas, se añade tratamiento farmacológico con nitazoxanida (tabla 2). En pacientes con infección por el VIH ningún tratamiento antiparasitario ha demostrado ser eficaz; el tratamiento antirretroviral es la base7. Además, puede asociarse nitazoxanida (500–1.000mg/12h durante 2–8 semanas) u otros esquemas terapéuticos de eficacia variable, como paromomicina (1gr/12h) +azitromicina (600mg/día) durante 4 semanas, seguido de paromomicina sola durante 8 semanas, pirimetamina (25mg/día) durante 20 semanas o trimetoprima (160mg) +sulfametoxazol (800mg/12h) durante 7 días8.
GiardiosisLa G. lamblia es uno de los parásitos intestinales más comunes y causa de enfermedad tanto autóctona como importada. Produce desde colonización asintomática hasta diarrea crónica; pasa por cuadros oligosintomáticos caracterizados por la presencia de náuseas, borborigmos o flatulencia acompañadas o no de disminución de consistencia de las heces. El tratamiento se basa en el uso de nitroimidazoles. En nuestro medio, además de los sujetos sintomáticos, también se trata a los colonizados. En los niños, el albendazol es tan efectivo como el metronidazol, aunque su uso en adultos es controvertido. En embarazadas se suele posponer el tratamiento hasta después del parto, pero si la clínica es muy florida, se puede utilizar paromomicina (25–35mg/kg/día en 3 dosis durante 7 días). La diarrea postratamiento suele deberse a intolerancia transitoria a la lactosa, por lo que se recomienda dieta sin lácteos durante un mes. En los casos de ineficacia del tratamiento, se puede administrar el mismo u otro fármaco efectivo en mayor dosis y duración, o combinaciones de 2 de ellos: la de metronidazol+albendazol es la más eficaz de todas. Las dosis recomendadas son 750mg/8h de metronidazol durante 5–7 días+400mg/día de albendazol durante 5 días en los adultos y 15mg/kg/día en 3 dosis de metronidazol durante 5–7 días+15mg/kg/día de albendazol durante 5 días en los niños9. Otra opción es el empleo de nitazoxanida.
Microsporidiosis intestinalEl Enterocytozoon bieneusi y el Encephalitozoon intestinalis son las 2 especies de microsporidios que con más frecuencia afectan al ser humano. Las manifestaciones clínicas dependen, fundamentalmente, de la situación inmunológica del paciente. En inmunocompetentes cursan habitualmente de forma asintomática, aunque en algunos sujetos, como ancianos y viajeros a países en vías de desarrollo, puede ocasionar diarrea autolimitada o, mucho más raramente, diarrea crónica. En pacientes inmunodeprimidos, especialmente infectados por el VIH, produce diarrea acuosa sin productos patológicos, con importante pérdida de peso y a veces afectación de la vía biliar.
El tratamiento se basa en la reposición hidroelectrolítica, la corrección de la inmunosupresión en la medida de lo posible (tratamiento antirretroviral en el caso de la infección por el VIH) y tratamiento antiparasitario3 (tabla 2). El albendazol es eficaz frente a Encephalitozoon sp., mientras que la fumagilina lo es frente a E. bieneusi.
TrichomoniasisLa Trichomonas vaginalis es causa de vaginitis infecciosa y suele asociarse a la presencia de otras enfermedades de transmisión sexual. El tratamiento de elección se basa en el uso de nitroimidazoles (tabla 2) y se debe tratar siempre a la pareja sexual. En caso de ineficacia, se recomienda metronidazol en dosis altas (2–4 g divididos en 2 dosis), asociado a metronidazol vaginal (500mg/día) durante 7–14 días. Si esta pauta produce toxicidad, se puede utilizar tinidazol, que se tolera mejor, y del que se han descrito múltiples dosificaciones10. Aunque el metronidazol es de clase B, en embarazadas se recomienda su uso, dado que el riesgo para el feto de una tricomoniasis materna es mayor que el posible riesgo relacionado con la exposición al metronidazol. En este caso, se sugiere no tratar mujeres asintomáticas hasta la semana 37 de gestación porque puede incrementar el riesgo de parto prematuro.
Tratamiento de las enfermedades producidas por protozoos extraintestinalesAmebiosis de vida libreSu distribución es mundial y pueden vivir libremente en la naturaleza o como parásitos del hombre. Pueden afectar a la córnea, la piel y el sistema nervioso central (SNC) y ocasionalmente ponen en peligro la vida del individuo infectado. Las especies patógenas en humanos son Naegleria fowleri, varias especies de Acanthamoeba, Balamuthia mandrillaris y Sappinia diploidea. El tratamiento no está estandarizado y se basa en series cortas o casos aislados.
Para el tratamiento de la encefalitis por N. fowleri se usa anfotericina B en dosis altas, intravenosa (1–1,5mg/kg/día durante 10 días) e intratecal (1–1,5mg/día durante 10 días), combinada o no con miconazol (350mg/m2 de superficie corporal/día), que también puede administrarse por vía intratecal (10mg/día)11. Para la encefalitis granulomatosa por Acanthamoeba spp. se han empleado combinaciones de pentamidina, sulfadiacina, flucitosina asociada a fluconazol o itraconazol con aparente eficacia12. Recientemente se ha publicado una respuesta favorable con miltefosina13. En el caso de la queratitis es importante que los fármacos tengan acción no solamente frente a los trofozoítos, sino también frente a los quistes, pues su persistencia es la causa más frecuente de recurrencias. Se ha empleado con éxito la clorhexidina y el polihexametileno de biguadina en forma tópica, solos o asociados a isotianato de propamidina o hexamidina3.
MalariaLa malaria es la enfermedad parasitaria más importante del mundo. Está producida por protozoos parásitos del género Plasmodium: P. falciparum, P. vivax, P. ovale, P. malariae y el más recientemente descrito P. knowlesi. La resistencia a la cloroquina en P. falciparum (causante casi exclusivo de las formas más graves de malaria) está muy extendida, y se distribuye en la mayor parte de las zonas donde la transmisión de malaria es alta14 (África subsahariana, sudeste asiático, India, Indonesia y cuenca del Amazonas). La resistencia a la mefloquina se ha descrito en la frontera de Tailandia con Myanmar y con Camboya así como en Vietnam. Recientemente también se han detectado cepas resistentes al artesunato en la frontera de Tailandia con Camboya15. La resistencia de P. vivax a la cloroquina se ha descrito fundamentalmente en Papúa Nueva Guinea e Indonesia14.
Siempre que se trate una malaria y se desconozca la especie o se sospeche una parasitación mixta, el tratamiento deberá ser efectivo contra P. falciparum resistente a la cloroquina por su potencial gravedad. Se consideran como grupos de especial riesgo los viajeros de países no endémicos, las embarazadas, los niños y las personas infectadas por el VIH.
La malaria no grave puede tratarse por vía oral con el paciente en régimen ambulante o ingresado para observación 24–48h. Por el contrario, la malaria grave es una urgencia médica que requiere hospitalización, medicación parenteral y monitorización estrecha. En ausencia de otra causa que justifique los síntomas, se considera que un paciente presenta una malaria grave por P. falciparum si tiene una o más de las siguientes alteraciones clínicas o de laboratorio14: postración, disminución del nivel de consciencia, distrés respiratorio, crisis convulsivas, shock, edema pulmonar, diátesis hemorrágica, ictericia, hemoglobinuria, anemia grave, hipoglucemia, acidosis, insuficiencia renal, hiperlactatemia o hiperparasitemia (≥5% en un no inmune y ≥20% en un semiinmune).
Las embarazadas, además, tienen un riesgo mayor de complicaciones, especialmente de hipoglucemia, que puede empeorar por fármacos utilizados en el tratamiento de la malaria como la quinina y la quinidina. Dado que la bacteriemia de origen intestinal es frecuente en estos pacientes, se recomienda la extracción de hemocultivos y el tratamiento empírico con una cefalosporina de tercera generación.
El tratamiento específico de la malaria falcípara recomendado por la OMS para las áreas endémicas se basa en el uso de combinaciones de derivados de la artemisinina con otros fármacos14 (tabla 3): artemether-lumefantrina (Co-artem® o Riamet® en Europa), artesunato-mefloquina, dihidroartemisina-piperaquina (Duo-Cotecxin®) artesunato-sulfadoxina/pirimetamina o artesunato-amodiaquina. Estas combinaciones proporcionan una elevada eficacia incluso frente a cepas resistentes a otros fármacos, disminuyen la transmisibilidad al tener actividad gametocida y reducen el riesgo de desarrollo de resistencias. En España sólo está disponible la combinación de artemether-lumefantrina como medicamento extranjero. Los medicamentos más comúnmente utilizados en nuestro medio para el tratamiento por vía oral de la malaria son la combinación de atovacuona-proguanil, mefloquina, cloroquina y quinina, además de los antibióticos doxiciclina y clindamicina.
Tratamiento de la malaria
| Entidad | Dosis adulto | Dosis pediátrica |
| Malaria no complicadaa | ||
| Plasmodium falciparum sensible a cloroquina, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae y Plasmodium knowlesi | Cloroquina v.o. 25mg/kg de base, dosis total, dividido en una dosis diaria (10-10-5mg/kg) durante 3 días, o administrado a las 0, 6, 24 y 48h (10-5-5-5mg/kg) | Cloroquina v.o. 25mg/kg de base, dividido como en los adultos, sin sobrepasar 600mg de base. |
| En los casos de malaria por P.vivax y P. ovale añadir, además, tratamiento erradicador con primaquina v.o. 30mg/kg de base al día durante 14 díasb | Primaquina v.o. 0,6mg/kg de base al día durante 14 díasb para el tratamiento erradicador | |
| P. vivax resistente a cloroquina | Quinina (base)c v.o. 25mg/kg día en 3 dosis de 3 a 7 días, más: | Quinina (base)c v.o. 25mg/kg día en tres dosis de 3 a 7 días más |
| Doxiciclina v.o. 100mg/12h, 7 días o | ||
| Tetraciclina v.o. 250mg/6h, 7 días o | Doxiciclina v.o. 4mg/kg/día/ en 2 dosis, 7 días. Niños mayores de 8 años | |
| Clindamicina v.o. 20mg/kg día divididos cada 12 o 6h, 7 días o | Clindamicina v.o. 20mg/kg día dividido en 2 o 4 dosis | |
| Mefloquinae v.o. 25mg/kg base, administrada en 2 dosis de 15–10mg/kg separadas por 6–24h. Con ambas pautas, añadir primaquina en las dosis descritas previamente | Mefloquinae v.o. 25mg/kg base, administrada en 2 dosis de 15–10mg/kg separadas por 6–24h | |
| Atovacuona-proguanild v.o. 4 comprimidos (250mg atovacuona+100mg de proguanil) uvd durante 3 días | Atovacuona-proguanild v.o: | |
| <5kg: no indicada | ||
| 5–8kg: 2 comp pediátricos/día, 3 días | ||
| 9–10kg:3 comp pediátricos/día, 3 días | ||
| 11–20kg:1 comp adulto/día, 3 días | ||
| 21–30kg:2 comp adulto/día, 3 días | ||
| 31–40kg:3 comp adulto/día, 3 días | ||
| >40kg: igual que en adultos | ||
| Artemether-lumefantrina v.o. 4 comprimidos (20mg arthemeter+120mg lumefantrina), a las 0 y 8h el primer día y luego cada 12h 2 días más (24 comp. en total) | Artemether-lumefantrina v.o: | |
| 5–14kg:1 comp 0-8-24-36-48-60h | ||
| 15–24kg:2 comp 0-8-24-36-48-60h | ||
| 25–35kg:3 comp 0-8-24-36-48-60h. | ||
| P. falciparum resistente a cloroquina | Quinina más doxiciclina, tetraciclina o clindamicina igual que la anterior | Quinina más doxiciclina, o clindamicina igual que la anterior |
| Mefloquinae igual que la anterior | Mefloquina igual que la anterior | |
| Atovacuona-proguanild v.o. igual que el anterior | Atovacuona-proguanild v.o. igual que el anterior | |
| Artemether-lumefantrina v.o. igual que el anterior | Artemether-lumefantrina v.o. igual que el anterior | |
| Malaria grave | Quininaf i.v. 20mg sal/kg como dosis de carga administrada en 4h, seguida de 10mg sal/kg cada 8h tras la dosis de carga, de 3 a 7 días. Asociar a: | Quininaf i.v. 20mg sal/kg como dosis de carga administrada en 4h, seguida de 10mg sal/kg cada 8h tras la dosis de carga (máximo 1.800mg al día), de 3 a 7 días. Asociar a: |
| Clindamicina i.v. 20–40mg/kg/día i.v. dividido en 3 dosis | ||
| Artesunatog 2,4mg/kg i.v. o i.m. Dosis basal, a las 12h y a las 24h. Después, una dosis diaria hasta que la vía oral sea posible o el tratamiento haya finalizado (7 días) | ||
| Doxiciclina i.v. 100mg dvd. y pasar a oral en cuanto sea posible, 7 días, o tetraciclina v.o. 250mg cvd, 7 días o Clindamicina i.v. 10mg/kg como dosis de carga seguido de 5mg/kg cada 8h y pasar a vía oral en cuanto sea posible, 7 días | Como alternativa: artemetherg 3,2mg/kg i.m. como dosis de carga, seguido de 1,6mg/kg al día | |
| Quinidina (gluconato) i.v.: 6,25mg base/kg (=10mg sal/kg) como dosis de carga en 1–2h, seguido de 0,0125mg base/kg/min (=0,02mg sal/kg/min) en infusión continua al menos durante 24h. Como pauta alternativa puede dosificarse 15mg base/kg (=24mg sal/kg) como dosis de carga infundido en 4h, seguido de 7,5mg base/kg (=12mg sal/kg) infundido en 4h cada 8h a partir de la dosis de carga. Una vez que la parasitación es <1% y el paciente tolera vía oral, completar el tratamiento con quinina oral | ||
| Añadir doxiciclina, tetraciclina o clindamicina como en la pauta anterior | ||
| Artesunatog 2,4mg/kg i.v. o i.m. Dosis basal, a las 12h y a las 24h | ||
| Después, una dosis diaria hasta que la vía oral sea posible o el tratamiento haya finalizado (7 días) | ||
| Como alternativa: artemetherg 3,2mg/kg i.m. como dosis de carga, seguido de 1,6mg/kg al día | ||
cvd: cuatro veces al día; dvd: dos veces al día; i.m.: intramuscular; i.v.: intravenoso; uvd: una vez al día; v.o.: vía oral.
En el embarazo está contraindicado el uso de primaquina y doxiciclina. Con atovacuona y clindamicina existen pocos datos, por lo que por lo general no se recomienda. En el caso de infecciones por P. vivax o P.ovale durante el embarazo se diferirá la cura radical con primaquina hasta después del parto, y se mantendrá a la embarazada en profilaxis con cloroquina una vez tratado el episodio agudo. En los casos de paludismo resistente se valorará el riesgo-beneficio del uso de fármacos como atovacuona proguanil, clindamicina o doxicilina.
La primaquina se utiliza para eliminar las formas durmientes hepáticas de ambas especies y prevenir las recaídas. Dado que la primaquina puede causar anemia hemolítica en personas con déficit de glucosa 6 fosfato deshidrogenasa (G6PDH) los pacientes deben estudiarse previamente a su administración. Si existe un déficit parcial, se puede administrar en dosis de 45mg a la semana durante 8 semanas. En Oceanía y el sudeste asiático puede ser recomendable doblar la dosis de primaquina debido a la aparición de cepas resistentes.
Para las infecciones adquiridas en África y Sudamérica, la quinina se administra 3 días mientras que en las adquiridas en el sudeste asiático se recomiendan 7 días.
Las formulaciones parenterales de artesunato (intravenoso [i.v.]) o artemether (intramuscular) se han mostrado muy eficaces en la malaria grave, y han mejorado la supervivencia frente a la pauta clásica con quinina i.v. Estas presentaciones no pueden conseguirse en España ni en forma comercial ni a través de uso compasivo. Para el tratamiento de la malaria grave, en nuestro medio se usa la quinina o la quinidina i.v., combinada con clindamicina o tetraciclinas.
En el caso de malaria por P. vivax o P. ovale (excepto en aquellos casos adquiridos por transfusión o congénitos) habrá que completar el tratamiento con primaquina para eliminar los hipnozoítos hepáticos y evitar las recurrencias. Idealmente, la primaquina debe administrarse junto con el tratamiento del episodio agudo o lo más cercano a éste, siempre después de haber comprobado que el sujeto no presenta déficit de glucosa-6 fosfato deshidrogenasa. En las embarazadas está contraindicado el uso de primaquina y el de tetraciclinas. Tampoco se recomienda el uso de derivados de la artemisinina o de la combinación de atovacuona-proguanil durante el embarazo, especialmente en el primer trimestre, por falta de información sobre su teratogenicidad en seres humanos16.
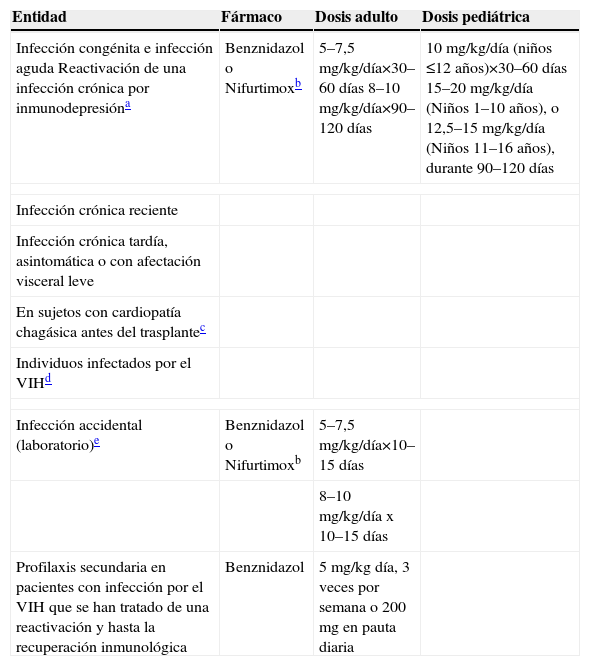
Tripanosomosis americanaLa respuesta al tratamiento de la tripanosomosis americana producida por T. cruzi, o enfermedad de Chagas, depende mucho de la fase de la enfermedad17–20. En la infección aguda, congénita y crónica reciente (niños de menos de 12–19 años o adultos con menos de 10 años de evolución) el tratamiento con benznidazol o nifurtimox resulta eficaz en la disminución de la parasitemia y en la reducción de la gravedad y la duración de los síntomas. La tasa de curación parasitológica estimada es del 60–85% en la fase aguda, y de más del 90% en las infecciones congénitas tratadas durante el primer año. En los niños, el tratamiento se tolera mejor y la infección debe tratarse en cuanto se diagnostique. Por el contrario, en la enfermedad de Chagas crónica tardía la probabilidad de respuesta es baja (10–20%). Ésta es mayor en las formas crónicas asintomáticas que cuando existe afectación orgánica avanzada, donde no se ha demostrado claramente la utilidad del tratamiento antiparasitario (tabla 4).
Tratamiento de la tripanosomosis americana (enfermedad de Chagas)
| Entidad | Fármaco | Dosis adulto | Dosis pediátrica |
| Infección congénita e infección aguda Reactivación de una infección crónica por inmunodepresióna | Benznidazol o Nifurtimoxb | 5–7,5mg/kg/día×30–60 días 8–10mg/kg/día×90–120 días | 10mg/kg/día (niños ≤12 años)×30–60 días 15–20mg/kg/día (Niños 1–10 años), o 12,5–15mg/kg/día (Niños 11–16 años), durante 90–120 días |
| Infección crónica reciente | |||
| Infección crónica tardía, asintomática o con afectación visceral leve | |||
| En sujetos con cardiopatía chagásica antes del trasplantec | |||
| Individuos infectados por el VIHd | |||
| Infección accidental (laboratorio)e | Benznidazol o Nifurtimoxb | 5–7,5mg/kg/día×10–15 días | |
| 8–10mg/kg/día x 10–15 días | |||
| Profilaxis secundaria en pacientes con infección por el VIH que se han tratado de una reactivación y hasta la recuperación inmunológica | Benznidazol | 5mg/kg día, 3 veces por semana o 200mg en pauta diaria | |
VIH: virus de la inmunodeficiencia humana.
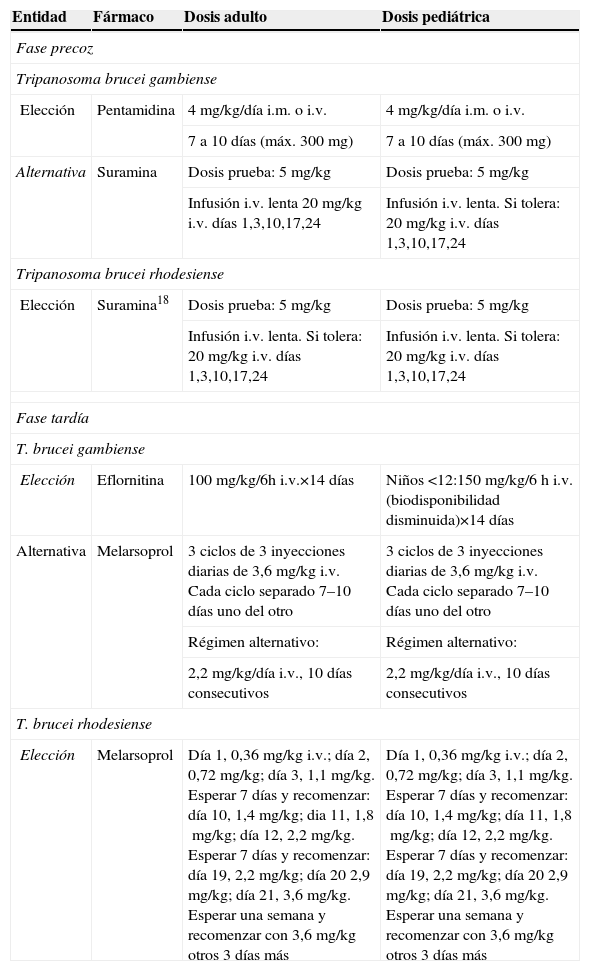
La tripanosomosis africana o enfermedad del sueño es una parasitosis endémica de África subsahariana, que se transmite por la picadura de la mosca tse-tsé (Glossina sp.). La causan 2 subespecies de tripanosoma indistinguibles morfológicamente: Trypanosoma brucei gambiense y Tripanosoma brucei rhodesiense. Las formas más graves y de evolución más rápida se asocian con el segundo21. Los casos de infección importada por T. brucei son excepcionales en nuestro medio, pero se han descrito principalmente en África oriental asociados a safaris de recreo.
La enfermedad cursa en 2 fases: una precoz con un chancro de inoculación, linfadenitis regional y diseminación hematógena, y otra tardía, con afectación del SNC en forma de meningoencefalitis. El tratamiento de esta enfermedad se resume en la tabla 5. Recientemente se ha comprobado que el tratamiento combinado con melarsoprol i.v. durante 10 días más nifurtimox oral entre el 3–10 día es más efectivo que el régimen estándar de melarsoprol en la fase tardía del T. b. gambiense22 y que la combinación de eflortinina i.v. cada 12h durante 7 días más nifurtimox oral durante 10 días es igual de eficaz que el régimen estándar de eflornitina i.v. de 2 semanas también en la fase tardía de la infección por T. b. gambiense23.
Tratamiento de la tripanosomosis africana
| Entidad | Fármaco | Dosis adulto | Dosis pediátrica |
| Fase precoz | |||
| Tripanosoma brucei gambiense | |||
| Elección | Pentamidina | 4mg/kg/día i.m. o i.v. | 4mg/kg/día i.m. o i.v. |
| 7 a 10 días (máx. 300mg) | 7 a 10 días (máx. 300mg) | ||
| Alternativa | Suramina | Dosis prueba: 5mg/kg | Dosis prueba: 5mg/kg |
| Infusión i.v. lenta 20mg/kg i.v. días 1,3,10,17,24 | Infusión i.v. lenta. Si tolera: 20mg/kg i.v. días 1,3,10,17,24 | ||
| Tripanosoma brucei rhodesiense | |||
| Elección | Suramina18 | Dosis prueba: 5mg/kg | Dosis prueba: 5mg/kg |
| Infusión i.v. lenta. Si tolera: 20mg/kg i.v. días 1,3,10,17,24 | Infusión i.v. lenta. Si tolera: 20mg/kg i.v. días 1,3,10,17,24 | ||
| Fase tardía | |||
| T. brucei gambiense | |||
| Elección | Eflornitina | 100mg/kg/6h i.v.×14 días | Niños <12:150mg/kg/6h i.v. (biodisponibilidad disminuida)×14 días |
| Alternativa | Melarsoprol | 3 ciclos de 3 inyecciones diarias de 3,6mg/kg i.v. Cada ciclo separado 7–10 días uno del otro | 3 ciclos de 3 inyecciones diarias de 3,6mg/kg i.v. Cada ciclo separado 7–10 días uno del otro |
| Régimen alternativo: | Régimen alternativo: | ||
| 2,2mg/kg/día i.v., 10 días consecutivos | 2,2mg/kg/día i.v., 10 días consecutivos | ||
| T. brucei rhodesiense | |||
| Elección | Melarsoprol | Día 1, 0,36mg/kg i.v.; día 2, 0,72mg/kg; día 3, 1,1mg/kg. Esperar 7 días y recomenzar: día 10, 1,4mg/kg; dia 11, 1,8mg/kg; día 12, 2,2mg/kg. Esperar 7 días y recomenzar: día 19, 2,2mg/kg; día 20 2,9mg/kg; día 21, 3,6mg/kg. Esperar una semana y recomenzar con 3,6mg/kg otros 3 días más | Día 1, 0,36mg/kg i.v.; día 2, 0,72mg/kg; día 3, 1,1mg/kg. Esperar 7 días y recomenzar: día 10, 1,4mg/kg; día 11, 1,8mg/kg; día 12, 2,2mg/kg. Esperar 7 días y recomenzar: día 19, 2,2mg/kg; día 20 2,9mg/kg; día 21, 3,6mg/kg. Esperar una semana y recomenzar con 3,6mg/kg otros 3 días más |
i.v: intravenoso; i.m: intramuscular.
Está constituida por un grupo heterogéneo de enfermedades que abarcan un amplio espectro, desde la afectación cutánea localizada en forma de una úlcera única hasta cuadros sistémicos viscerales mortales. Está causada por diferentes especies de un protozoo parásito, Leishmania sp., transmitido por un díptero nematocero (Phlebotomus sp. en el Viejo Mundo [VM] y Lutzomyia sp. en el Nuevo Mundo [NM]). No es posible realizar recomendaciones universales sobre regímenes terapéuticos válidos para las distintas presentaciones en todas las áreas geográficas, ya que la eficacia de éstos puede variar de una región a otra (tabla 6).
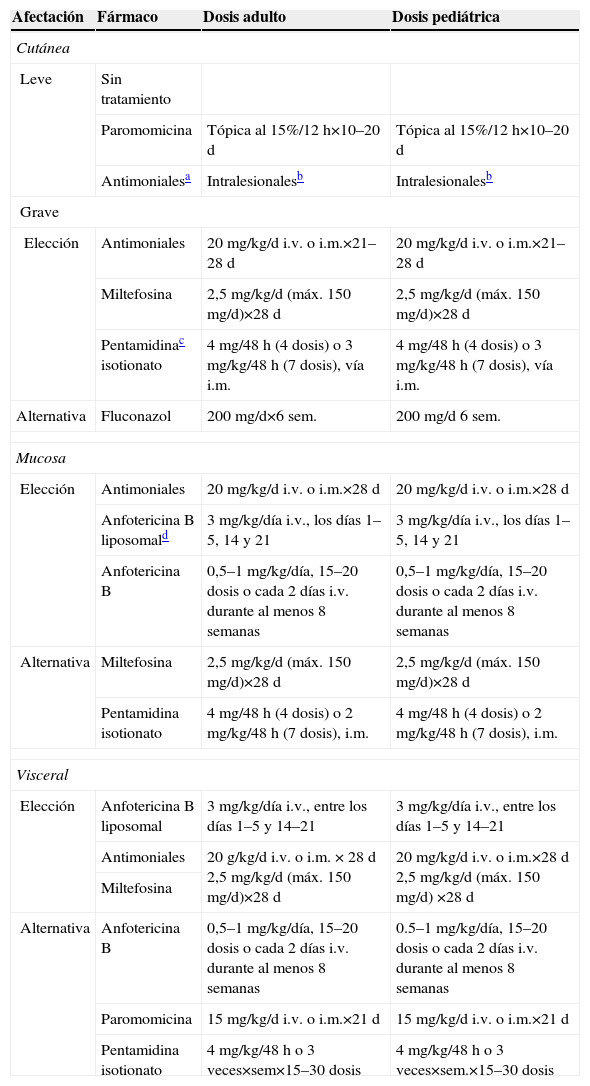
Tratamiento farmacológico de leishmaniosis
| Afectación | Fármaco | Dosis adulto | Dosis pediátrica |
| Cutánea | |||
| Leve | Sin tratamiento | ||
| Paromomicina | Tópica al 15%/12h×10–20d | Tópica al 15%/12h×10–20d | |
| Antimonialesa | Intralesionalesb | Intralesionalesb | |
| Grave | |||
| Elección | Antimoniales | 20mg/kg/d i.v. o i.m.×21–28d | 20mg/kg/d i.v. o i.m.×21–28d |
| Miltefosina | 2,5mg/kg/d (máx. 150mg/d)×28d | 2,5mg/kg/d (máx. 150mg/d)×28d | |
| Pentamidinac isotionato | 4mg/48h (4 dosis) o 3mg/kg/48h (7 dosis), vía i.m. | 4mg/48h (4 dosis) o 3mg/kg/48h (7 dosis), vía i.m. | |
| Alternativa | Fluconazol | 200mg/d×6 sem. | 200mg/d6 sem. |
| Mucosa | |||
| Elección | Antimoniales | 20mg/kg/d i.v. o i.m.×28d | 20mg/kg/d i.v. o i.m.×28d |
| Anfotericina B liposomald | 3mg/kg/día i.v., los días 1–5, 14 y 21 | 3mg/kg/día i.v., los días 1–5, 14 y 21 | |
| Anfotericina B | 0,5–1mg/kg/día, 15–20 dosis o cada 2 días i.v. durante al menos 8 semanas | 0,5–1mg/kg/día, 15–20 dosis o cada 2 días i.v. durante al menos 8 semanas | |
| Alternativa | Miltefosina | 2,5mg/kg/d (máx. 150mg/d)×28d | 2,5mg/kg/d (máx. 150mg/d)×28d |
| Pentamidina isotionato | 4mg/48h (4 dosis) o 2mg/kg/48h (7 dosis), i.m. | 4mg/48h (4 dosis) o 2mg/kg/48h (7 dosis), i.m. | |
| Visceral | |||
| Elección | Anfotericina B liposomal | 3mg/kg/día i.v., entre los días 1–5 y 14–21 | 3mg/kg/día i.v., entre los días 1–5 y 14–21 |
| Antimoniales | 20g/kg/d i.v. o i.m. × 28d 2,5mg/kg/d (máx. 150mg/d)×28d | 20mg/kg/d i.v. o i.m.×28d 2,5mg/kg/d (máx. 150mg/d) ×28d | |
| Miltefosina | |||
| Alternativa | Anfotericina B | 0,5–1mg/kg/día, 15–20 dosis o cada 2 días i.v. durante al menos 8 semanas | 0.5–1mg/kg/día, 15–20 dosis o cada 2 días i.v. durante al menos 8 semanas |
| Paromomicina | 15mg/kg/d i.v. o i.m.×21d | 15mg/kg/d i.v. o i.m.×21d | |
| Pentamidina isotionato | 4mg/kg/48h o 3 veces×sem×15–30 dosis | 4mg/kg/48h o 3 veces×sem.×15–30 dosis | |
i.m.: intramuscular; i.v.: intravenoso; VIH: virus de la inmunodeficiencia humana.
Antimoniales: los 2 fármacos disponibles son el antimoniato de meglumina (Glucantime®), que contiene 85mg de antimonio por ml, y el estibogluconato sódico (Pentostam®), que contiene 100mg de antimonio por ml. Ambos se usan en dosis de 20mg de antimonio por kg de peso.
Leishmaniosis cutánea24: antes de comenzar el tratamiento deben considerarse el riesgo de diseminación mucosa, el número, el tamaño, la evolución, la localización de las lesiones, la presencia de linfangitis u otras complicaciones asociadas. La leishmaniosis cutánea de América Central y del Sur (NM) puede estar producida por Leishmania braziliensis, lo que se ha de tener muy en cuenta a la hora del tratamiento. Estas cepas tienden a recidivar en forma de leishmaniosis mucocutánea si no se tratan o se hace de forma inadecuada. En estos casos se deberán aplicar pautas parenterales durante 28 días. Por el contrario, las especies europeas y asiáticas (VM) tienen un comportamiento más benigno. En las lesiones sin riesgo de complicación, sin repercusión cosmética o producidas por especies poco virulentas (especialmente sin son Leishmania major [VM] o Leishmania mexicana [NM]) se puede considerar el tratamiento tópico o vigilancia de la evolución sin tratamiento (en casi todos los casos se resuelven espontáneamente en unas semanas).
Entre los fármacos de 1a línea están los antimoniales pentavalentes (estibogluconato sódico o antimoniato de meglumina), indicados como primera opción para las especies del NM y para los cuadros graves del VM. Otra posibilidad es la administración tópica intralesional semanalmente o en días alternos; se infiltra en 4 puntos en lados opuestos del borde de la lesión hasta la resolución de las lesiones. La miltefosina es una opción en L. major (VM), para L. braziliensis en Bolivia (aunque no en Guatemala), Leishmania panamensis y tiene efecto limitado en L. mexicana. Está contraindicada en el embarazo. La pentamidina isotionato es tratamiento de primera línea para Leishmania guyanensis en la Guayana Francesa. En otras localizaciones es una alternativa a los antimoniales pentavalentes, aunque hay que tener en cuenta su elevada toxicidad. Como alternativa, el fluconazol puede considerarse para L. major en dosis de 200mg/día por vía oral durante 6 semanas. Sólo se recomienda usar la paromomicina tópica en áreas donde la especie tenga bajo potencial de extensión a mucosas. Se debe considerar especialmente para L. major o L. mexicana. En países con mucha experiencia en el cuidado de la leishmaniosis cutánea, algunos casos se tratan con crioterapia, láser o combinación de antimoniales intralesionales y crioterapia. Hay casos descritos en la literatura médica de resolución con azitromicina: se aplicó en forma de 3–4 ciclos separados 1–2 meses en dosis de 500mg/día durante 10 días cada ciclo a un niño con L. infantum con buena respuesta. Puede ser una opción en niños pequeños, embarazadas e inmunodeprimidos y en pacientes con fallo del tratamiento.
Leishmaniosis mucosa24: las especies que la producen son del género Viannia más comúnmente L. (V.) braziliensis, L. (V.) panamensis, o L. (V.) guyanensis (todas del NM). De elección: antimoniales pentavalentes (estibogluconato sódico o antimoniato de meglumina) o anfotericina B (desoxicolato o en formulación lipídica) cuando no hay respuesta a los antimoniales. También se han usado como alternativa miltefosina, pentamidina y azitromicina (en la misma pauta que la cutánea).
Leishmaniosis visceral25: las especies que más comúnmente la producen son L. infantum y Leishmania donovani en el VM y Leishmania chagasi en el NM. Todas las especies tienen buena respuesta a los antimoniales, excepto L. donovani en la India, donde la tasa de resistencias es de hasta el 30%. En este caso se utiliza como primera opción la anfotericina B liposomal, que muchos autores consideran como de primera elección también en el área del mediterráneo. En pacientes VIH positivos la respuesta es peor y la enfermedad tiene una alta tasa de recidiva, por lo que habría que considerar pautas con dosis más altas o durante más tiempo (anfotericina B liposomal [4mg/kg/día] entre los días 1–5 y 10, 17, 24, 31 y 38). Otras alternativas terapéuticas son la miltefosina por vía oral y la paromomicina parenteral3,25.
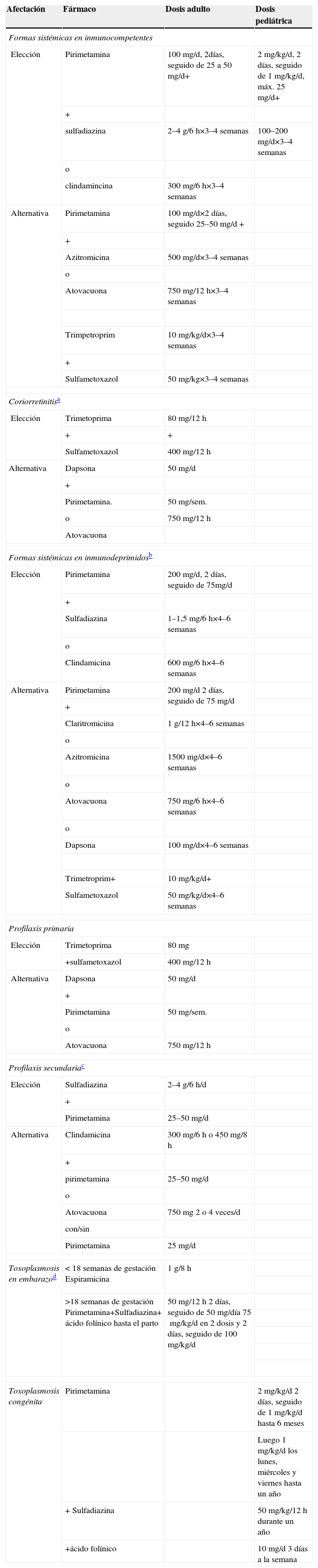
ToxoplasmosisLa toxoplasmosis, infección de distribución mundial, está causada por el protozoo intracelular Toxoplasma gondii. La clínica depende del momento de la infección (o reactivación) y del estado de inmunocompetencia del hospedador, lo que condiciona a su vez la actitud terapéutica (tabla 7). En individuos inmunocompetentes suele cursar de forma asintomática y no precisa tratamiento, salvo si existe gran afectación sistémica26 o si cursa como coriorretinitis. La infección en el paciente inmunodeprimido (fundamentalmente con el VIH con CD4 <100μ/l27) y en pacientes en tratamiento inmunosupresor se manifiesta con mayor frecuencia como encefalitis necrosante multifocal, seguida de afectación cardíaca y pulmonar. Las pautas de tratamiento en inmunodeprimidos son similares a las del inmunocompetente pero en dosis mayores y más prolongadas (hasta 6 semanas) y pueden precisar profilaxis primaria (indicada en pacientes con el VIH con <100CD4μ/l y serología a toxoplasma positiva)28,29 o secundaria. La infección congénita se debe, fundamentalmente, a primoinfecciones maternas adquiridas durante el embarazo (el 80% de los casos cursa asintomática) y más raramente se debe a una recidiva de una infección adquirida previamente a la concepción. El objetivo del tratamiento es prevenir la transmisión maternofetal de la toxoplasmosis30.
Tratamiento de la toxoplasmosis
| Afectación | Fármaco | Dosis adulto | Dosis pediátrica |
| Formas sistémicas en inmunocompetentes | |||
| Elección | Pirimetamina | 100mg/d, 2días, seguido de 25 a 50mg/d+ | 2mg/kg/d, 2 días, seguido de 1mg/kg/d, máx. 25mg/d+ |
| + | |||
| sulfadiazina | 2–4g/6h×3–4 semanas | 100–200mg/d×3–4 semanas | |
| o | |||
| clindamincina | 300mg/6h×3–4 semanas | ||
| Alternativa | Pirimetamina | 100mg/d×2 días, seguido 25–50mg/d + | |
| + | |||
| Azitromicina | 500mg/d×3–4 semanas | ||
| o | |||
| Atovacuona | 750mg/12h×3–4 semanas | ||
| Trimpetroprim | 10mg/kg/d×3–4 semanas | ||
| + | |||
| Sulfametoxazol | 50mg/kg×3–4 semanas | ||
| Coriorretinitisa | |||
| Elección | Trimetoprima | 80mg/12h | |
| + | + | ||
| Sulfametoxazol | 400mg/12h | ||
| Alternativa | Dapsona | 50mg/d | |
| + | |||
| Pirimetamina. | 50mg/sem. | ||
| o | 750mg/12h | ||
| Atovacuona | |||
| Formas sistémicas en inmunodeprimidosb | |||
| Elección | Pirimetamina | 200mg/d, 2 días, seguido de 75mg/d | |
| + | |||
| Sulfadiazina | 1–1,5mg/6h×4–6 semanas | ||
| o | |||
| Clindamicina | 600mg/6h×4–6 semanas | ||
| Alternativa | Pirimetamina | 200mg/d 2 días, seguido de 75mg/d | |
| + | |||
| Claritromicina | 1g/12h×4–6 semanas | ||
| o | |||
| Azitromicina | 1500mg/d×4–6 semanas | ||
| o | |||
| Atovacuona | 750mg/6h×4–6 semanas | ||
| o | |||
| Dapsona | 100mg/d×4–6 semanas | ||
| Trimetroprim+ | 10mg/kg/d+ | ||
| Sulfametoxazol | 50mg/kg/d×4–6 semanas | ||
| Profilaxis primaria | |||
| Elección | Trimetoprima | 80mg | |
| +sulfametoxazol | 400mg/12h | ||
| Alternativa | Dapsona | 50mg/d | |
| + | |||
| Pirimetamina | 50mg/sem. | ||
| o | |||
| Atovacuona | 750mg/12h | ||
| Profilaxis secundariac | |||
| Elección | Sulfadiazina | 2–4g/6h/d | |
| + | |||
| Pirimetamina | 25–50mg/d | ||
| Alternativa | Clindamicina | 300mg/6h o 450mg/8h | |
| + | |||
| pirimetamina | 25–50mg/d | ||
| o | |||
| Atovacuona | 750mg 2 o 4 veces/d | ||
| con/sin | |||
| Pirimetamina | 25mg/d | ||
| Toxoplasmosis en embarazod | < 18 semanas de gestación Espiramicina | 1g/8h | |
| >18 semanas de gestación Pirimetamina+Sulfadiazina+ ácido folínico hasta el parto | 50mg/12h 2 días, seguido de 50mg/día 75mg/kg/d en 2 dosis y 2 días, seguido de 100mg/kg/d | ||
| Toxoplasmosis congénita | Pirimetamina | 2mg/kg/d 2 días, seguido de 1mg/kg/d hasta 6 meses | |
| Luego 1mg/kg/d los lunes, miércoles y viernes hasta un año | |||
| + Sulfadiazina | 50mg/kg/12h durante un año | ||
| +ácido folínico | 10mg/d 3 días a la semana | ||
*Todas las pautas con pirimetamina deben asociar ácido folínico (10–25mg/d).
Se recomienda asociar corticoides por su efecto antiinflamatorio. El tratamiento debe prolongarse hasta 1–2 semanas tras la desaparición de los síntomas (3).
El tratamiento coadyuvante con esteroides (dexametasona 4mg/6h) puede ser necesario en aquellos casos de toxoplasmosis cerebral con datos de desplazamiento de la línea media, hipertensión intracraneal o deterioro clínico en las primeras 48h de tratamiento (2).
Debido al potencial teratogénico de la pirimetamina, se pospone su uso tras las primeras 18 semanas de gestación. Algunos autores proponen que en aquellos casos donde la infección fetal se ha confirmado mediante reacción en cadena de la polimerasa de líquido amniótico, introducir la pirimetamina ya desde las semanas 14–1621.
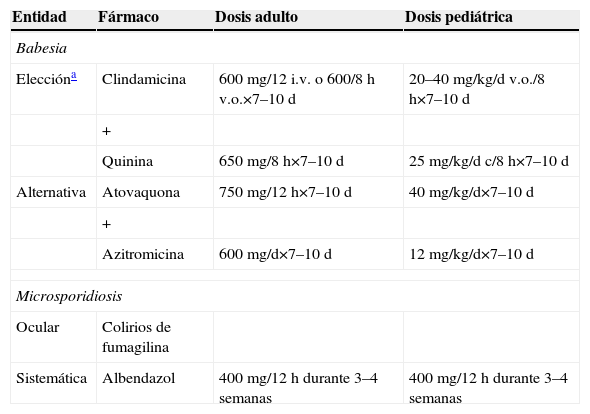
Parasitosis transmitida por garrapatas, que produce clínica que varía desde infección asintomática (Babesia microti) hasta afectación grave (>10% parasitación, anemia hemolítica, fallo multiorgánico) (Babesia divergens), más frecuente en inmunodeprimidos (esplenectomizados, infección por el VIH o tratamiento inmunosupresor). Los pacientes asintomáticos no requieren tratamiento, pero podría considerarse en aquellos que presenten una reacción en cadena de la polimerasa o cultivo positivo durante más de 3 meses. El tratamiento se resume en la tabla 8. Los inmunodeprimidos precisan tratamiento supresor tras la infección aguda durante al menos 6 meses; en algunos casos, de por vida31. Se han probado otros regímenes con distinta eficacia: azitromicina+quinina, pentamidina+trimetroprima/sulfametoxazol, clindamicina+doxiciclina+azitromicina o atovacuona+proguanil. En situación de extrema gravedad se recomienda exanguinotransfusión.
Tratamiento antiparasitario de la babesiosis y la microsporidiosis extraintestinal
| Entidad | Fármaco | Dosis adulto | Dosis pediátrica |
| Babesia | |||
| Eleccióna | Clindamicina | 600mg/12 i.v. o 600/8h v.o.×7–10d | 20–40mg/kg/d v.o./8h×7–10d |
| + | |||
| Quinina | 650mg/8h×7–10d | 25mg/kg/d c/8h×7–10d | |
| Alternativa | Atovaquona | 750mg/12h×7–10d | 40mg/kg/d×7–10d |
| + | |||
| Azitromicina | 600mg/d×7–10d | 12mg/kg/d×7–10d | |
| Microsporidiosis | |||
| Ocular | Colirios de fumagilina | ||
| Sistemática | Albendazol | 400mg/12h durante 3–4 semanas | 400mg/12h durante 3–4 semanas |
i.v.: intravenoso; v.o.: vía oral.
Se trata de protozoos intracelulares obligados que forman esporas. Con más de 100 géneros y casi 1.000 especies identificados, hay 6 géneros implicados en infecciones humanas: Enterozytozoon, Encephalitozoon, Noseman, Pleistophora, Vittaforma y Trachipleistophora. Aquéllos con afectación tisular lo hacen, fundamentalmente, en pacientes inmunodeprimidos con afectación ocular, pulmonar, muscular, renal y neurológica. El tratamiento se describe en la tabla 8.
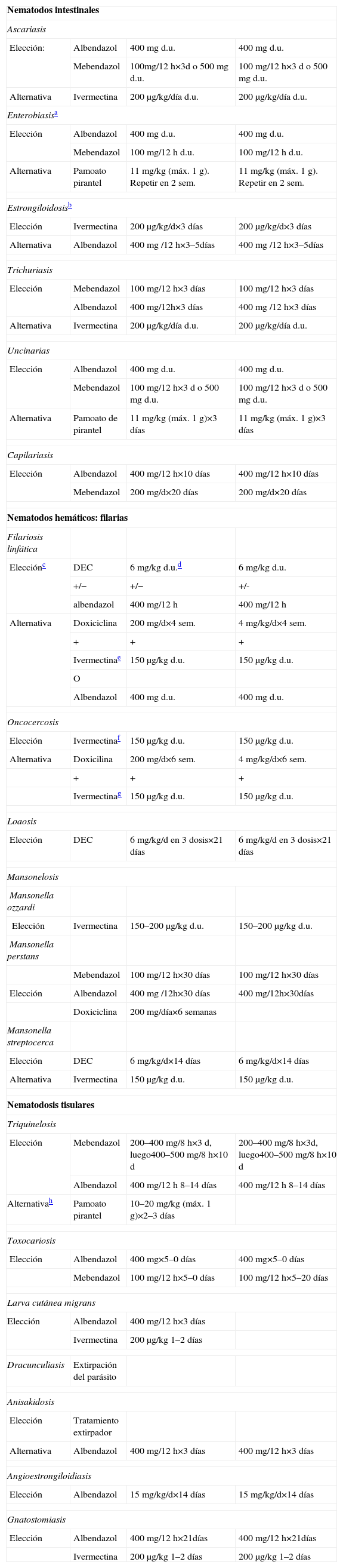
Tratamiento de las enfermedades producidas por nematodosEstas parasitosis pueden clasificarse a efectos prácticos en: nematodosis intestinales, filariosis y nematodosis tisulares.
Nematodosis intestinalesSon una de las parasitaciones más extendidas por el mundo y están presentes también en nuestro medio. Pueden cursar de manera asintomática o producir síntomas gastrointestinales. El Enterobius vermicularis, las uncinarias (Ancylostoma duodenale y Necator americanus), el Ascaris lumbricoides, el Trichuris trichiura, el S. stercoralis y la Capillaria philipinensis responden a benzimidazoles o a ivermectina. Las pautas terapéuticas específicas se muestran en la tabla 932. La actividad de los distintos antiparasitarios en la geohelmintosis se describe en la tabla 1033. Puede ser necesaria la administración de hierro en caso de anemia grave o de corticoides si hay afectación pulmonar asociada. Se ha indicado que la desparasitación periódica masiva de niños de áreas endémicas puede mejorar los parámetros nutricionales y está actualmente promovido por la OMS, aunque faltan estudios concluyentes34. La estrongiloidosis puede diseminarse en pacientes inmunodeprimidos (especialmente en aquéllos con tratamiento corticoideo o infectados por el HTLV-1) y poner en peligro la vida del sujeto. En los casos de estrongiloidosis diseminada se recomienda de manera general administrar ivermectina (200μg/kg/día durante 5–7 días), repetir su administración o combinarla con albendazol (400mg/12h durante 3 días). En caso de intolerancia digestiva, se ha descrito con éxito la administración de ivermectina subcutánea, rectal en enemas o parenteral en formulación veterinaria.
Tratamiento farmacológico de las nematodosis
| Nematodos intestinales | |||
| Ascariasis | |||
| Elección: | Albendazol | 400mg d.u. | 400mg d.u. |
| Mebendazol | 100mg/12h×3d o 500mg d.u. | 100mg/12h×3d o 500mg d.u. | |
| Alternativa | Ivermectina | 200μg/kg/día d.u. | 200μg/kg/día d.u. |
| Enterobiasisa | |||
| Elección | Albendazol | 400mg d.u. | 400mg d.u. |
| Mebendazol | 100mg/12h d.u. | 100mg/12h d.u. | |
| Alternativa | Pamoato pirantel | 11mg/kg (máx. 1g). Repetir en 2 sem. | 11mg/kg (máx. 1g). Repetir en 2 sem. |
| Estrongiloidosisb | |||
| Elección | Ivermectina | 200μg/kg/d×3 días | 200μg/kg/d×3 días |
| Alternativa | Albendazol | 400mg /12h×3–5días | 400mg /12h×3–5días |
| Trichuriasis | |||
| Elección | Mebendazol | 100mg/12h×3 días | 100mg/12h×3 días |
| Albendazol | 400mg/12h×3 días | 400mg /12h×3 días | |
| Alternativa | Ivermectina | 200μg/kg/día d.u. | 200μg/kg/día d.u. |
| Uncinarias | |||
| Elección | Albendazol | 400mg d.u. | 400mg d.u. |
| Mebendazol | 100mg/12h×3d o 500mg d.u. | 100mg/12h×3d o 500mg d.u. | |
| Alternativa | Pamoato de pirantel | 11mg/kg (máx. 1g)×3días | 11mg/kg (máx. 1g)×3días |
| Capilariasis | |||
| Elección | Albendazol | 400mg/12h×10 días | 400mg/12h×10 días |
| Mebendazol | 200mg/d×20 días | 200mg/d×20 días | |
| Nematodos hemáticos: filarias | |||
| Filariosis linfática | |||
| Elecciónc | DEC | 6mg/kg d.u.d | 6mg/kg d.u. |
| +/− | +/− | +/- | |
| albendazol | 400mg/12h | 400mg/12h | |
| Alternativa | Doxiciclina | 200mg/d×4 sem. | 4mg/kg/d×4 sem. |
| + | + | + | |
| Ivermectinae | 150μg/kg d.u. | 150μg/kg d.u. | |
| O | |||
| Albendazol | 400mg d.u. | 400mg d.u. | |
| Oncocercosis | |||
| Elección | Ivermectinaf | 150μg/kg d.u. | 150μg/kg d.u. |
| Alternativa | Doxicilina | 200mg/d×6 sem. | 4mg/kg/d×6 sem. |
| + | + | + | |
| Ivermectinag | 150μg/kg d.u. | 150μg/kg d.u. | |
| Loaosis | |||
| Elección | DEC | 6mg/kg/d en 3 dosis×21 días | 6mg/kg/d en 3 dosis×21 días |
| Mansonelosis | |||
| Mansonella ozzardi | |||
| Elección | Ivermectina | 150–200μg/kg d.u. | 150–200μg/kg d.u. |
| Mansonella perstans | |||
| Mebendazol | 100mg/12h×30 días | 100mg/12h×30 días | |
| Elección | Albendazol | 400mg /12h×30 días | 400mg/12h×30días |
| Doxiciclina | 200mg/día×6 semanas | ||
| Mansonella streptocerca | |||
| Elección | DEC | 6mg/kg/d×14 días | 6mg/kg/d×14 días |
| Alternativa | Ivermectina | 150μg/kg d.u. | 150μg/kg d.u. |
| Nematodosis tisulares | |||
| Triquinelosis | |||
| Elección | Mebendazol | 200–400mg/8h×3d, luego400–500mg/8h×10d | 200–400mg/8h×3d, luego400–500mg/8h×10d |
| Albendazol | 400mg/12h 8–14 días | 400mg/12h 8–14 días | |
| Alternativah | Pamoato pirantel | 10–20mg/kg (máx. 1g)×2–3 días | |
| Toxocariosis | |||
| Elección | Albendazol | 400mg×5–0 días | 400mg×5–0 días |
| Mebendazol | 100mg/12h×5–0 días | 100mg/12h×5–20 días | |
| Larva cutánea migrans | |||
| Elección | Albendazol | 400mg/12h×3 días | |
| Ivermectina | 200μg/kg 1–2 días | ||
| Dracunculiasis | Extirpación del parásito | ||
| Anisakidosis | |||
| Elección | Tratamiento extirpador | ||
| Alternativa | Albendazol | 400mg/12h×3 días | 400mg/12h×3 días |
| Angioestrongiloidiasis | |||
| Elección | Albendazol | 15mg/kg/d×14 días | 15mg/kg/d×14 días |
| Gnatostomiasis | |||
| Elección | Albendazol | 400mg/12h×21días | 400mg/12h×21días |
| Ivermectina | 200μg/kg 1–2 días | 200μg/kg 1–2 días | |
DEC: dietilcarbamazina; d.u.: dosis única.
Precisa repetir la administración en 2 semanas para prevenir recurrencias por reinfección y tratar al núcleo familiar.
La estrongiloidiasis () en inmunocompetentes se trata con ivermectina .Algunos autores recomiendan repetir la dosis en 2 semanas, aunque una única dosis de ivermectina puede ser eficaz4.
La pauta de DEC asociada o no a albendazol se recomienda siempre que el paciente viva en área endémica, no exista coinfección con Onchocerca volvulus ni Loa loa, no presente mucha sintomatología y, si es mujer, que no esté embarazada.
No hay estudios que comparen la eficacia de la DEC en dosis única con la clásica de 12–14 días en dosis ascendente; aunque la dosis única disminuye más rápidamente la microfilaremia, los niveles se igualan a los 6–12 meses.
La doxiciclina+ivermectina se reserva para cuando existe coinfección con O. volvulus, en pacientes que no vivan en área endémica o ante presencia de sintomatología moderada. Esta pauta está contraindicada en mujeres embarazadas y en niños.
No indicado si existe coinfección con L. loa o si se observan microfilarias en córnea o cámara anterior. No hay clara seguridad en mujeres embarazadas, en lactancia, ni en niños <15 años.
La pauta de doxiciclina30+ ivermectina de 4–6 meses tras finalizar la doxiciclina está indicada para pacientes fuera del área endémica, en los que es poco probable que se reinfecten, no en mujeres embarazadas ni en niños menores de 9 años.
Las infestaciones por filarias pueden dividirse en 3 grandes grupos: filariosis linfáticas (Wuchereria bancrofti, Brugia malayi o Brugia timori), filariosis cutáneas (O. volvulus y Loa loa) y las mansonelosis (Mansonella perstans, Mansonella streptocerca y Mansonella ozzardi). El tratamiento se resume en la tabla 9.
Filariosis linfáticas: las manifestaciones clínicas dependen de la presencia de los helmintos adultos en los linfáticos, de la reacción inflamatoria frente a éstos y de la secreción de factores linfangiogénicos promovida por la bacteria endosimbionte Wolbachia sp. Los regímenes clásicos de tratamiento se basan en la dietilcarbamacina, a la que se puede asociar albendazol. La reciente incorporación de doxiciclina (eficaz frente a la Wolbachia sp.) al esquema terapéutico supone añadir actividad macrofilaricida al tratamiento clásico, con lo que se reduce la duración de éste. El tratamiento con doxiciclina se prolongará 2 semanas más si presenta importante sintomatología o si ésta es esperable por historia familiar, e independientemente de que viva en área endémica o no. Como alternativa a la doxiciclina se ha probado con éxito la rifampicina35 y la clofazimina36. En B. malayi se han obtenido muy buenos resultados con doxiciclina (100mg/día durante 6 semanas).
Eosinofilia pulmonar tropical: cuadro clínico caracterizado por eosinofilia significativa, tos no productiva, linfadenopatías y febrícula como respuesta a una reacción inmunológica tras la infección por W. bancrofti, B. malayi o B. timori. Se presenta en menos del 0,5% de los pacientes con filariosis linfática. Se trata con dietilcarbamacina (6mg/kg/día en 3 dosis durante 12–21 días). Si se produce falta de respuesta, puede añadirse a un segundo curso de dietilcarbamacina y albendazol (400mg/12h durante 3 semanas).
Oncocercosis: produce clínica fundamentalmente en la piel (prurito, presbidermia y oncocercomas) y en los ojos (“ceguera de los ríos”). Se trata con ivermectina37 en dosis única, y se repite la administración cada 6 o 12 meses hasta que el paciente esté asintomático o durante un mínimo de 10 años. Si se observan microfilarias en el fondo de ojo, hay que administrar antes prednisolona (1mg/kg/día durante una semana).
Hay publicados casos en Ghana donde se ha demostrado disminución de la eficacia del tratamiento, y se cree que la aparición de resistencias es posible en un futuro cercano38, por lo que se están buscando nuevos tratamientos como la suramina y la amocarzina, macrofilaricidas por sí mismos, pero la primera por su toxicidad conocida y la segunda por su escasa experiencia de uso no se recomiendan. La moxidectina presenta actividad macrofilaricida significativa en diferentes estudios, con mecanismo de acción similar a ivermectina, y actualmente se están realizando estudios en fase iia con resultados esperados para 2010. La emodepside y la clofazimina han demostrado efectos prometedores in vitro.
El tratamiento con doxiciclina, seguido de una dosis de ivermectina a los 4 meses, se ha mostrado muy eficaz y constituirá el tratamiento de elección de esta parasitosis fuera de áreas endémicas.
Loaosis: las 2 formas de presentación clásicas de la loaosis son la reacción por hipersensibilidad al gusano adulto (edema subcutáneo intermitente o edema de Calabar) y la migración del gusano adulto a través del ojo. El tratamiento de elección es la dietilcarbamacina o la ivermectina, aunque si se evidencia alta carga de filarias en sangre (>2.500–3.000microfilarias/ml), existe riesgo importante de encefalopatía con el tratamiento. En estos casos, hay que disminuir primero la carga parasitaria con albendazol (200mg dos veces al día durante 3 semanas) y después administar ivermectina o dietilcarbamacina. La asociación de corticoides (prednisolona [20mg/día desde 3 días antes de iniciar el tratamiento antihelmíntico hasta 3 días después de iniciado]) disminuye el riesgo de efectos secundarios. En coinfectados con O. volvulus hay alto riesgo de ceguera tras el tratamiento, debido a la rápida muerte de microfilarias (reacción de Mazzotti). Una dosis de ivermectina previa a la dietilcarbamacina disminuye este riesgo.
Mansonelosis: para M. perstans no existe consenso sobre el tratamiento óptimo. En general, se recomienda mebendazol o albendazol. La dietilcarbamacina es de eficacia variable, rara vez conduce a la eliminación de las microfilarias mantenida en el tiempo. Se han descrito mejores efectos con mebendazol+dietilcarbamacina, sin que se observara aumento de los efectos secundarios39. La ivermectina generalmente ha demostrado poca eficacia pero las dosis repetidas reducen la microfilaremia. Recientemente, la doxiciclina ha mostrado un excelente perfil de eficacia y seguridad, por lo que probablemente se convertirá en el tratamiento de elección de esta parasitosis40.
El tratamiento de M. streptocerca y M. ozzardi está reflejado en la tabla 7.
Nematodosis tisularesLa triquinelosis en nuestro país suele cursar en forma de brotes tras la ingesta de carne cruda o poco cocinada de cerdo o jabalí que contiene larvas de Trichinella spp. El tratamiento depende de la presencia de clínica muscular, neurológica o cardíaca y consiste en el uso de albendazol o mebendazol, a los que se asocian corticoides (prednisona de 30-60mg/día) para los casos más graves. En la toxocariosis (Toxocara canis, Toxocara catis) no está claramente establecida la duración del tratamiento con albendazol o mebendazol (entre 5 y 20 días). Se recomienda la administración de corticoides en casos de afectación grave cardíaca, del SNC u oftálmica. La larva cutánea Migrans (Ancylostoma braziliensis) se trata con albendazol o ivermectina, y se puede usar tópicamente albendazol al 10% o tiabendazol al 15%. Tanto la dracunculosis (Dracunculus medinensis) como la anisakidosis (Anisakis sp.) se pueden resolver mediante la extracción o la extirpación endoscópica, respectivamente. En la anisakidosis se puede utilizar albendazol. Aunque con dudosa utilidad, la angioestrongiloidiasis (Angiostrongylus cantonensis, Angiostrongylus costaricensis) se puede tratar con albendazol asociado a corticoides para disminuir los síntomas neurológicos en caso de meningitis eosinofílica. La gnathostomiosis (Gnathostoma spinigerum) se trata de manera indistinta con albendazol o ivermectina asociados o no a corticoides, según la gravedad de los síntomas3 (tabla 9).
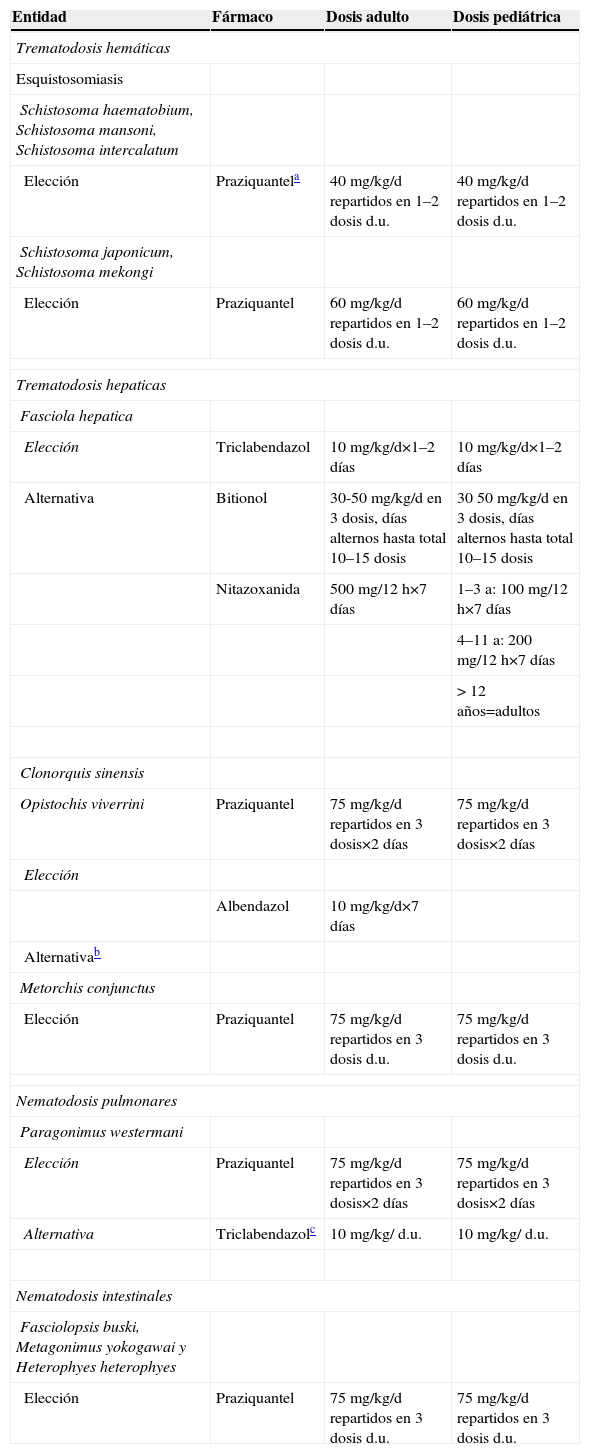
Tratamiento de las enfermedades producidas por trematodosDe forma esquemática, las trematodosis pueden clasificarse en 4 grupos atendiendo a la localización de los gusanos adultos: hemáticas, hepatobiliares, pulmonares e intestinales. El tratamiento se detalla en tabla 11.
Tratamiento farmacológico de las trematodosis
| Entidad | Fármaco | Dosis adulto | Dosis pediátrica |
| Trematodosis hemáticas | |||
| Esquistosomiasis | |||
| Schistosoma haematobium, Schistosoma mansoni, Schistosoma intercalatum | |||
| Elección | Praziquantela | 40mg/kg/d repartidos en 1–2 dosis d.u. | 40mg/kg/d repartidos en 1–2 dosis d.u. |
| Schistosoma japonicum, Schistosoma mekongi | |||
| Elección | Praziquantel | 60mg/kg/d repartidos en 1–2 dosis d.u. | 60mg/kg/d repartidos en 1–2 dosis d.u. |
| Trematodosis hepaticas | |||
| Fasciola hepatica | |||
| Elección | Triclabendazol | 10mg/kg/d×1–2 días | 10mg/kg/d×1–2 días |
| Alternativa | Bitionol | 30-50mg/kg/d en 3 dosis, días alternos hasta total 10–15 dosis | 3050mg/kg/d en 3 dosis, días alternos hasta total 10–15 dosis |
| Nitazoxanida | 500mg/12h×7 días | 1–3 a: 100mg/12h×7 días | |
| 4–11 a: 200mg/12h×7 días | |||
| > 12 años=adultos | |||
| Clonorquis sinensis | |||
| Opistochis viverrini | Praziquantel | 75mg/kg/d repartidos en 3 dosis×2 días | 75mg/kg/d repartidos en 3 dosis×2 días |
| Elección | |||
| Albendazol | 10mg/kg/d×7 días | ||
| Alternativab | |||
| Metorchis conjunctus | |||
| Elección | Praziquantel | 75mg/kg/d repartidos en 3 dosis d.u. | 75mg/kg/d repartidos en 3 dosis d.u. |
| Nematodosis pulmonares | |||
| Paragonimus westermani | |||
| Elección | Praziquantel | 75mg/kg/d repartidos en 3 dosis×2 días | 75mg/kg/d repartidos en 3 dosis×2 días |
| Alternativa | Triclabendazolc | 10mg/kg/ d.u. | 10mg/kg/ d.u. |
| Nematodosis intestinales | |||
| Fasciolopsis buski, Metagonimus yokogawai y Heterophyes heterophyes | |||
| Elección | Praziquantel | 75mg/kg/d repartidos en 3 dosis d.u. | 75mg/kg/d repartidos en 3 dosis d.u. |
d.u.: dosis única.
Su uso está recomendado en embarazadas o mujeres que están lactando cuando existan datos de infección, aunque es preferible iniciar el tratamiento después del primer trimestre si es posible. El praziquantel se debe administrar 6–10 semanas tras la presentación, y se pueden utilizar corticoides cuando existan síntomas graves. En pacientes con enfermedad neurológica se pueden asociar corticoides.
Como alternativa, se puede utilizar albendazol, aunque para Opisthorchis sp. las tasas de curación han sido menores hasta el momento.
El triclabendazol ha demostrado eficacia en varios estudios y se tolera mejor que el praziquantel32.
Trematodosis hemáticas: Schistosoma haematobium, Schistosoma mansoni, Schistosoma japonicum, Schistosoma mekongi, Schistosoma intercalatum. Cursa de manera asintomática, sobre todo en áreas endémicas, y produce clínica en sujetos con alta carga parasitaria. En infección aguda es causa del síndrome de Katayama y del prurito del bañista. En fase crónica puede producir enfermedad genitourinaria (incluyendo cáncer vesical), neurológica, gastrointestinal o hepática (cirrosis). Se recomienda el tratamiento de todos los pacientes con evidencia de infección, tengan o no síntomas, y el fármaco de elección es el praziquantel3. Los derivados de las artemisininas se muestran prometedores en el tratamiento de la infección reciente41.
Trematodosis hepáticas (hepatobiliares): F. hepatica y Fasciola gigantica son causa de fiebre, ictericia, eosinofilia intensa y lesiones múltiples hepáticas. En la fase crónica, la clínica deriva de la obstrucción biliar. El tratamiento de elección es el triclabendazol; es efectivo tanto frente a las formas adultas como a las formas inmaduras. El Clonorchis sinensis y el Opisthorchis viverrini deben tratarse en todos los casos, incluidos los asintomáticos, debido al riesgo de desarrollar en las infecciones crónicas complicaciones irreversibles como el colangiocarcinoma. El Metorchis conjunctus produce epigastralgia, pérdida de peso y fiebre. El praziquantel es el tratamiento recomendado42.
Trematodosis pulmonares: Paragonimus westermani y otras especies son causa de tos, hemoptisis y lesiones cavitadas. Se recomienda el tratamiento incluso en pacientes asintomáticos por el riesgo de desarrollar complicaciones crónicas. Para el tratamiento de la paragonimiasis cerebral se deben asociar corticoides al tratamiento con praziquantel por el riesgo de convulsiones. El triclabendazol está pasando a ser el fármaco de elección, aunque en las formas extrapulmonares aún no existen datos suficientes43. El bitionol se utiliza cada vez menos como alternativa debido a la elevada tasa de efectos secundarios.
Trematodosis intestinalesFasciolopsis buski causa dolor abdominal y diarrea. El tratamiento de elección es el praziquantel.
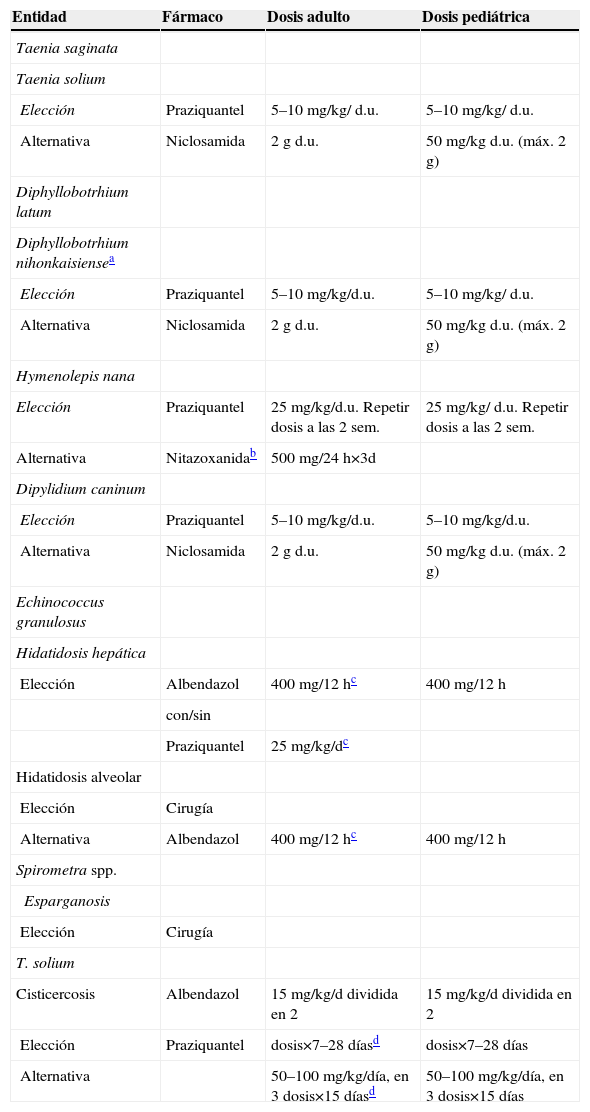
Tratamiento de las enfermedades producidas por cestodosCestodosis intestinalesLas cestodosis son enfermedades cuya clínica es muy diferente según la forma infectante del parásito. Los adultos, o tenias, no producen síntomas en la mayoría de las personas parasitadas. Viven en el intestino humano y ocasionalmente dan lugar a molestias gastrointestinales difusas. El Diphillobothirium latum puede producir déficit de vitamina B12, aunque sólo un 2% cursa como anemia megaloblástica. El Hymenolepis nana es más frecuente en niños, produce clínica cuando está presente en altas concentraciones y puede cursar con eosinofilia. El tratamiento de elección para todos ellos es el praziquantel. El tratamiento se resume en la tabla 12.
Tratamiento farmacológico de las cestoidosis
| Entidad | Fármaco | Dosis adulto | Dosis pediátrica |
| Taenia saginata | |||
| Taenia solium | |||
| Elección | Praziquantel | 5–10mg/kg/ d.u. | 5–10mg/kg/ d.u. |
| Alternativa | Niclosamida | 2g d.u. | 50mg/kg d.u. (máx. 2g) |
| Diphyllobotrhium latum | |||
| Diphyllobotrhium nihonkaisiensea | |||
| Elección | Praziquantel | 5–10mg/kg/d.u. | 5–10mg/kg/ d.u. |
| Alternativa | Niclosamida | 2g d.u. | 50mg/kg d.u. (máx. 2g) |
| Hymenolepis nana | |||
| Elección | Praziquantel | 25mg/kg/d.u. Repetir dosis a las 2 sem. | 25mg/kg/ d.u. Repetir dosis a las 2 sem. |
| Alternativa | Nitazoxanidab | 500mg/24h×3d | |
| Dipylidium caninum | |||
| Elección | Praziquantel | 5–10mg/kg/d.u. | 5–10mg/kg/d.u. |
| Alternativa | Niclosamida | 2g d.u. | 50mg/kg d.u. (máx. 2 g) |
| Echinococcus granulosus | |||
| Hidatidosis hepática | |||
| Elección | Albendazol | 400mg/12hc | 400mg/12h |
| con/sin | |||
| Praziquantel | 25mg/kg/dc | ||
| Hidatidosis alveolar | |||
| Elección | Cirugía | ||
| Alternativa | Albendazol | 400mg/12hc | 400mg/12h |
| Spirometra spp. | |||
| Esparganosis | |||
| Elección | Cirugía | ||
| T. solium | |||
| Cisticercosis | Albendazol | 15mg/kg/d dividida en 2 | 15mg/kg/d dividida en 2 |
| Elección | Praziquantel | dosis×7–28 díasd | dosis×7–28 días |
| Alternativa | 50–100mg/kg/día, en 3 dosis×15 díasd | 50–100mg/kg/día, en 3 dosis×15 días |
d.u.: dosis única.
La fase larvaria es la causante de la invasión tisular y la clínica más grave. La equinococosis quística es producida por E. granulosus y la equinococosis alveolar es producida por Echinococcus multilocularis. El tratamiento de la hidatidosis depende del número de lesiones, su viabilidad y su localización. La cirugía es el método de tratamiento electivo para los quistes de gran tamaño, con efecto masa, abscesificados, con riesgo de rotura y diseminación o que afecten zonas vitales y sean accesibles. En lesiones hepáticas viables no complicadas, sin comunicación con la vía biliar, o en otras localizaciones anatómicas accesibles, puede utilizarse la punción-irrigación-aspiración-reabsorción. En la semana previa a este procedimiento, el paciente debe comenzar tratamiento con albendazol. Se punciona el quiste con una aguja fina y se introduce una solución protoescolicida (etanol al 95% o suero salino al 20%) que posteriormente se aspira. Este procedimiento se repite en varias ocasiones hasta la esterilización del quiste44.
El tratamiento médico se usa como coadyuvante de los anteriores o exclusivamente para casos de quistes extrahepáticos, generalmente pulmonares u óseos, en los que la cirugía curativa no es posible. La duración del tratamiento con albendazol, acompañado o no de praziquantel45, no está bien definida y puede ser de meses o años. En la enfermedad alveolar, el tratamiento de elección es la cirugía, y el albendazol se deja para casos refractarios a éste o inoperables. Varios estudios indican que la nitazoxanida podría ser eficaz46. La esparganosis, infección por las larvas de las diferentes especies de Spirometra spp., se manifiesta como nódulos en múltiples localizaciones, cuyo único tratamiento es la extirpación quirúrgica de la larva.
CisticercosisEstá causada por el estadio larvario de Taenia solium. El hallazgo incidental de un cisticerco no viable en el cerebro no precisa tratamiento, al igual que la cisticercosis subcutánea o intramuscular, pero se deben realizar pruebas de imagen para descartar lesiones en el SNC.
En el tratamiento de la neurocisticercosis hay que tener en cuenta 4 aspectos: 1) el tratamiento sintomático; 2) los antiinflamatorios; 3) los antiparasitarios, y 4) la cirugía. El tratamiento sintomático se basa en los anticomiciales y el control de la hipertensión intracraneal sintomática. Los corticoides se utilizan para controlar la inflamación producida primariamente por la enfermedad (encefalomielitis, cisticercosis subaracnoidea o vasculitis) o la secundaria al tratamiento farmacológico. Las dosis y el tiempo de duración no están claramente establecidos47.
Para el control de las crisis en pacientes con lesiones parenquimatosas únicas, se ha indicado el uso de prednisona (1mg/kg al día durante 10 días)48. En estos casos, otra alternativa es considerar un régimen de praziquantel un día con 3 dosis de 25mg/kg separadas a intervalos de 2h.
El tratamiento inicial de los pacientes con cisticercosis cerebral y signos inflamatorios debe ser sintomático (control de la hipertensión intracraneal y las convulsiones). Los quistes parenquimatosos se tratan con albendazol y corticoides (dexametasona [6mg/día] o prednisona [40–60mg/d] mientras se administren antiparasitarios) durante 8–30 días. Los pacientes con quistes subaracnoideos o quistes muy grandes deben recibir tratamiento prolongado (30 días) o el doble de dosis de albendazol (30mg/kg/día). En los casos de hidrocefalia obstructiva está indicada la cirugía junto con el tratamiento con albendazol y corticoides. El tratamiento de lesiones calcificadas con antiparasitarios no ha demostrado beneficios claros. Siempre que se inicie tratamiento médico hay que descartar la existencia de cisticercosis ocular (aunque se usen corticoides), ya que la reacción inflamatoria puede producir daños irreparables. En el caso de la encefalitis por cisticerco (múltiples lesiones inflamadas, generalmente más de 50, con edema cerebral asociado), el tratamiento antiparasitario está contraindicado y se usarán corticoides49–51.
EsparganosisInfección por las larvas de las diferentes especies de Spirometra sp. Se manifiestan como nódulos en múltiples localizaciones, cuyo único tratamiento es la extirpación quirúrgica de la larva.
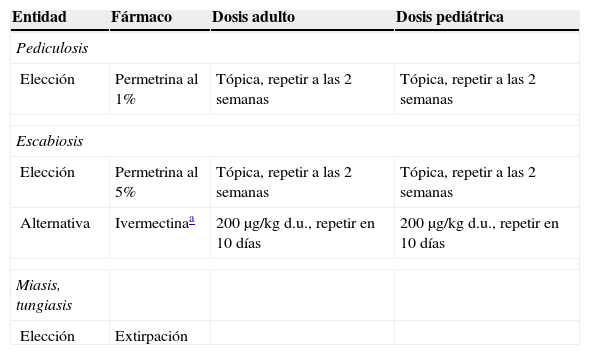
Tratamiento de las infecciones causadas por ectoparásitosEl tratamiento consiste exclusivamente en la extirpación de éstos (garrapatas, tungas, pulgas, chinches, etc.) y el tratamiento farmacológico se reserva para la pediculosis y la escabiosis (tabla 13). En general, el tratamiento tópico con permetrina es eficaz, aunque cada vez más se describen fracasos terapéuticos probablemente por desarrollo de resistencias. Se puede usar ivermectina en casos de resistencia, intolerancia o mal cumplimiento del tratamiento con permetrina local52. En la sarna costrosa, la ivermectina debe asociarse a permetrina tópica semanal hasta la desaparición de las lesiones cutáneas.
Tratamiento de las ectoparasitosis
| Entidad | Fármaco | Dosis adulto | Dosis pediátrica |
| Pediculosis | |||
| Elección | Permetrina al 1% | Tópica, repetir a las 2 semanas | Tópica, repetir a las 2 semanas |
| Escabiosis | |||
| Elección | Permetrina al 5% | Tópica, repetir a las 2 semanas | Tópica, repetir a las 2 semanas |
| Alternativa | Ivermectinaa | 200μg/kg d.u., repetir en 10 días | 200μg/kg d.u., repetir en 10 días |
| Miasis, tungiasis | |||
| Elección | Extirpación | ||
d.u.: dosis única.
Los autores declaran no tener ningún conflicto de intereses.