*El estudio fue parcialmente financiado por FIPSE código 1039/99, y por FIS n.º expediente 00/1165.
**Al final del manuscrito se ofrece la relación de miembros del grupo de estudio para las resistencias primarias del VIH en España.
Introducción
La transmisión de cepas mutadas de virus de la inmunodeficiencia humana (VIH) que confiera resistencia a cualquier antirretroviral, se ha demostrado en pacientes que no han recibido previamente antirretrovirales. La prevalencia de estas resistencias primarias ha variado de forma notable, de acuerdo con la metodología empleada y la población estudiada.
La resistencia del VIH-1 a los fármacos antirretrovirales es junto con la falta de adherencia al tratamiento una causa frecuentemente del fracaso terapéutico. Algunos documentos de consenso no incluyen entre sus recomendaciones la necesidad de realizar estudios de resistencia genotípica a los pacientes crónicamente infectados cuya fuente de contagio haya sido un sujeto sin tratamiento o no se conozca la fuente de contagio. Esta recomendación se basa en la estimación de que la tasa de cepas resistentes en esta población sea baja.
Al igual que ocurre con otros antimicrobianos, el empleo de la terapia antirretroviral en España, puede condicionar un aumento de resistencias primarias en sujetos no expuestos a los antirretrovirales. La proporción de pacientes infectados por el VIH no tratados con antirretrovirales y con algún grado de resistencia puede estar aumentando en España como se ha detectado en otros lugares 1.
Se estudiaron durante 4 años consecutivos la resistencia del VIH a fármacos antirretrovirales en pacientes no tratados previamente procedentes de distintas comunidades autónomas.
Material y método
Se estudiaron muestras de plasma correspondientes a 209 pacientes infectados con el VIH obtenidas desde marzo de 1997 a mayo de 2001 agrupados en dos períodos (de marzo de 1997 a febrero de 1999 y de marzo de 1999 a febrero de 2001). Ninguno había sido tratado con fármacos antirretrovirales y procedían de diversas comunidades autónomas españolas. Se excluyeron los pacientes que presentaban carga viral menor de 1.000 copias/ml, así como los pacientes infectados fuera de España. La selección de los pacientes se realizó mediante la constitución del Grupo de Estudio para las resistencias primarias del VIH en España, con participación voluntaria de clínicos y microbiólogos pertenecientes a 30 hospitales, que aceptaron colaborar, de 14 comunidades autónomas: gallega, valenciana, madrileña, vasca, riojana, canaria, asturiana, castellano-leonesa, castellano-manchega, catalana, cántabra, navarra, andaluza y extremeña. Para evitar sesgos, se limitó el número de pacientes enviados por los centros más colaboradores (a 10 pacientes en cada período) y se estimuló el envío de muestras de comunidades menos activas en la recogida de casos. Se establecieron protocolos de recogida y transporte de las muestras así como de recogida de los datos de los pacientes, que incluían datos demográficos (sexo, edad, factor de riesgo) y clínicos (carga vírica, recuento de linfocitos CD4+ y momento y estadio de la infección). Se consideró la antigüedad de la infección en cuatro categorías: a) menor de 3 meses; b) entre 3 y 12 meses; c) mayor de un año, y d) antigüedad desconocida.
Las muestras de plasma eran enviadas a nuestro laboratorio conservadas en nieve carbónica si habían sido congeladas a 80 °C en el lugar de origen, o a 4 °C si se enviaban inmediatamente. En el laboratorio eran numeradas, alicuotadas y archivadas a 80 °C hasta su procesamiento. Este fue brevemente como sigue: se realizó la extracción del ARN vírico (QIAmp Viral RNA, Qiagen), tras una reacción en cadena de la polimerasa (PCR) con transcriptasa inversa de amplificación y una PCR de secuenciación (TruGene HIV) se secuenció el gen pol que codifica la proteasa (PR) y la retrotranscriptasa (RT) (OpenGene) usando un sistema de secuenciación automático (Visible Genetics Inc.). Se consideró mutaciones relevantes a aquellas incluidas en el documento de consenso del Hirsch et al 2 con las modificaciones propuestas por los miembros del Resistance Mutations Project Panel (junio, 2001) 3.
Para el análisis estadístico se empleó el programa SPSS versión 12.0; se realizó análisis de frecuencias y prueba de chi cuadrado para la comparación de tasas, entre el primer y segundo período de estudio, de pacientes cuyo genoma de VIH presentaba o no mutaciones codificadoras de resistencia.
Resultados
Los pacientes estudiados tenían una carga vírica media de 5,3 log (mediana de 4,8 log, rango de 2,1 a 6,4), y un recuento medio de linfocitos CD4+ de 365/ml (mediana de 306, rango de 2 a 1.764). La media de edad fue de 34,7 (mediana de 34 años, rango de 9 a 80 años). Predominaron los varones con una relación entre varones y mujeres de 3,6:1. Entre los factores de riesgo, se encontraban el compartir jeringuillas para uso intravenoso de drogas en el 53,1% de los casos, prácticas homo o bisexuales en el 15,3% de los casos; la adquisición heterosexual de la infección se estimó en el 21,1% de los casos y en el 10,5% de los casos el origen de la infección no se pudo atribuir a los anteriores factores de riesgo. En el 1,5% de los casos, el tiempo de la infección fue inferior a 3 meses, en el 13,4% < 1 año, en el 45,9% > 1 año y en el 39,2% de duración desconocida. Los pacientes procedían de 30 instituciones sanitarias de las comunidades autónomas antes mencionadas.
En 113 pacientes (54,1%), se encontró al menos una mutación asociada a resistencia al VIH. Once pacientes (5,3%) presentaron mutaciones en la RT, tres presentaron mutaciones primarias a los inhibidores de la PR (1,4%) y en el 50,7% de las muestras (106 pacientes) se detectó al menos una mutación secundaria en la PR. En 7 de los pacientes con mutaciones en la RT o primarias en la PR, la infección había sido de más de un año. Tan sólo apareció una mutación de resistencia (K70R) en un paciente con seroconversión conocida de menos de 12 meses.
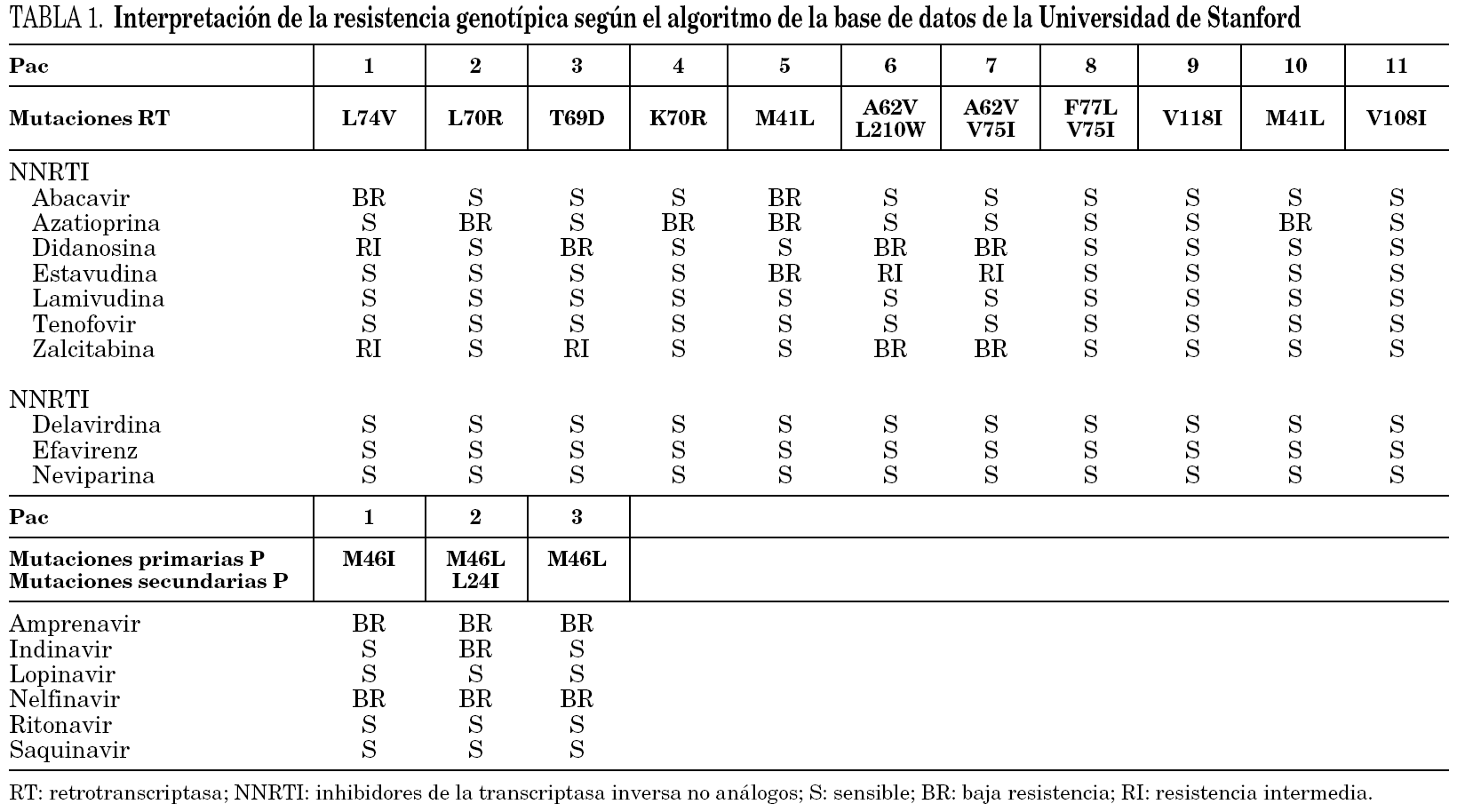
Para los inhibidores de la PR se encontraron las siguientes mutaciones clínicamente significativas: M46I en un paciente y M46L en 2 pacientes. Respecto a los inhibidores de la RT, se encontraron 10 mutaciones asociadas a resistencia en 11 pacientes, distribuidas como se refleja en la tabla 1.
La tasa de resistencia, considerada como presencia de mutaciones en la RT o mutación primaria en la PR, del primer período (de marzo de 1997 a febrero de 1999) fue significativamente inferior a la del segundo período (de marzo de 1999 a febrero del 2001): en 3 de los 111 pacientes estudiados en el primer período se detectaron mutaciones codificadoras de resistencias mientras que, en el segundo período, se identificaron en 10 casos de 98 pacientes (2,7% frente a 10,2%; p = 0,025).
La asociación de las mutaciones a resistencia fue analizada a través del algoritmo de la base de datos de la Universidad de Stanford (http://hiv-4.stanford.edu/cgi-bin/ hivmutlist.pl): 11 de los 14 pacientes con mutaciones se interpretaba como con algún grado de resistencia a los fármacos antirretrovirales (tabla 1).
Discusión
El 6,7% de los pacientes del estudio presentaron infecciones por variantes del VIH-1 con algún grado de resistencia a uno o varios fármacos antirretrovirales a pesar de no haber recibido tratamiento previo. Esto ocurre en una población como la española, con amplio acceso a los fármacos antirretrovirales. Este estudio, por otro lado, sugiere que la prevalencia de resistencias primarias al VIH esté en aumento ya que se incrementó entre los dos períodos de estudio.
Aunque este grupo de estudio para las resistencias primarias en España incluyó 14 comunidades autónomas españolas, algunas regiones no estaban representadas, el número de pacientes fue reducido y la distribución entre centros participantes no homogénea. A pesar de estas limitaciones, el trabajo puede servir, por un lado, como alerta epidemiológica del aumento de las tasas de resistencia a los fármacos antirretrovirales en pacientes no tratados y, por otro lado, como apoyo a la recomendación de no realizar estudios rutinarios de resistencia en virus de pacientes no tratados.
No se encontraron diferencias significativas en cuanto a resistencia entre las diferentes regiones consideradas, en gran medida debido a las bajas tasas encontradas. El incremento de resistencia a lo largo de los años estudiados tampoco se asoció significativamente a ninguna área geográfica.
Es necesario considerar que el estudio contempla pacientes infectados en un período largo de tiempo previo a la extracción de la muestra lo que podría distorsionar en algún caso los datos. El mantenimiento de las tasas de resistencia a niveles bajos en esta población apoya las recomendaciones de no efectuar pruebas de resistencia a pacientes no tratados previamente con antirretrovirales. El aumento significativo de las tasas de resistencia podría aumentar la probabilidad de fracaso en el tratamiento antirretroviral empírico, aunque las combinaciones de antirretrovirales utilizadas más frecuentemente en la actualidad se mostrarían eficaces frente a las cepas con mutaciones de resistencia detectadas en este estudio.
La diferencia de tasas de resistencia en los distintos estudios puede estar condicionada tanto por factores epidemiológicos (variabilidad geográfica en los patrones de uso de los antirretrovirales, variaciones en los factores de riesgo en la exposición al VIH en las poblaciones estudiadas), así como por las metodologías empleadas 4-7. El estudio incluyó sujetos pertenecientes a los diversos grupos de riesgo (el mayor número de pacientes adquirieron la infección por intercambio de jeringuillas) de varias comunidades autónomas españolas. Se utilizó secuenciación automática que, dentro de la metodología de detección de resistencias genotípicas, es la más adecuada. La circulación de virus resistentes en una comunidad depende del grado de utilización de cada uno de los fármacos antirretrovirales en esa población y del número de sujetos tratados que persisten con conductas de riesgo. Se ha detectado la transmisión de variantes del VIH-1 resistentes no sólo a zidovudina sino también a otros inhibidores de la transcriptasa y de la proteasa 8-13. Estudios de cohortes en Europa han identificado variantes resistentes entre el 9 y el 21% de los pacientes 14-16.
Hemos detectado tasas de resistencia más bajas que otros estudios españoles como el ERASE-1 y ERASE-2, en los que, utilizando la prueba de LiPA 5-7, encontraron del 12 al 17% de variantes resistentes. El estudio del grupo ERASE-3, mediante secuenciación genética, mostró una reducción significativa respecto a los estudios previos considerando los infectados crónicos por VIH no tratados 4. En general las tasas de resistencia en los países desarrollados se sitúan en cifras entre el 3 y 7% para IP, entre el 0 y el 13% para inhibidores de la transcriptasa inversa no análogos (NNRTI); y del 8 al 23% para inhibidores de la transcriptasa inversa análogos (NRTI) 11-13,17-20.
Aunque algunas variantes resistentes persisten durante meses tras la infección incluso sin la presión farmacológica, estas variantes resistentes pueden llegar a estar en proporción lo suficientemente pequeña respecto a las variantes sensibles como para no detectarse durante la evolución de la enfermedad 17. El porcentaje de variantes del VIH resistentes encontrado en nuestro estudio no refleja la tasa de variantes resistentes en el momento de la transmisión ya que se suele producir una reversión de mutaciones de resistencia con el paso del tiempo. La presencia de mutaciones de resistencia condiciona generalmente una reducción de la capacidad replicativa fitness del virus mutante 21-23. Todo ello explica que en ausencia de presión farmacológica, la resistencia en la población viral tienda a remitir al ser reemplazada la población mutante por el sobrecrecimiento de una población viral sensible 24,25. Así, este estudio podría infravalorar las tasas de resistencia que pueden encontrarse en España al comienzo de la infección por el VIH ya que predominan los pacientes con infección crónica en los que las cepas de los virus resistentes han podido quedar enmascarados tras el sobrecrecimiento de variantes sensibles. La baja prevalencia de resistencia podría explicarse por la menor capacidad de adaptación de las variantes resistentes. Sin embargo, no es éste el único factor determinante de las bajas tasa de resistencia puesto que las mutaciones encontradas predominan en el grupo de pacientes con infección más reciente en los que puede no haber transcurrido tiempo suficiente para que las variantes sensibles enmascaren a las resistentes.
En conclusión, la tasa de resistencia primaria en pacientes no tratados con antirretrovirales en España es baja, aunque puede existir una tendencia al incremento en los últimos años. Esta situación preocupante no es aún alarmante.
Relación de los miembros del grupo de estudio para las resistencias primarias en España
M. Abalde, J.M. Agud, M. Álamo, R. Alfonso, A. Antela, E. Antón, A. Asorey, R. Barba, J. Belda, A. Cañizares, M. Cartelle, J. Corredoira, I. Dorronsoro, F. Dronda, A. Echániz, J.M. Eiros, A. Espinosa, C. Fariñas, R. Fernández, J. García, F. García de la Llana, L. García San Miguel, P. Geijo, P. Gordo, A. Guerrero, C. Guijarro, V. Ibarra, J.A. Iribarren, P. Labarga, M.J. López, V. López, J.E. Losa, P. Llinares, A. Mateo, E. Míguez, C. Miralles, J.M. Miró, L. Morano, A. Moreno, G. Naval, E. Navas, A. Ocampo, J.A. Oteo, M.J. Pena, C. Quereda, A. Rivero, A. Rodríguez Feijoo, R. Rodríguez Castro, R. Rodríguez Leal, J.M. Santamaría, S. Tomás, M. Telenti y D. Velasco.