La prevalencia de mutaciones primarias de resistencia varía según los estudios. Analizamos dicha prevalencia, así como los subtipos del virus de la inmunodeficiencia humana (VIH) en nuestra área.
MétodosEstudio prospectivo en el que se realiza un test genotípico (Trugene HIV-1 genotyping kit; Bayer Healthcare Diagnostics) de resistencias e identificación del subtipo de VIH a todos los pacientes diagnosticados de infección por VIH en la provincia de Málaga durante el año 2005.
ResultadosSe diagnosticaron 172 casos, 6 de ellos seroconversores recientes. Presentaron mutaciones de resistencia el 7,8% (intervalo de confianza [IC] del 95%: 3,5; 12,0%) de los 153 pacientes en los que se pudo tener un test genotípico (6 a los inhibidores de la transcriptasa inversa no análogos de los nucleósidos [ITINAN], 4 a los inhibidores de la transcriptasa inversa análogos de los nucleósidos [ITIAN], y 3 a los inhibidores de la proteasa [IP]). El 81,8% de los pacientes tenían subtipo B del VIH y el 18,1% no B (51,8% de ellos eran subsaharianos en los que la prevalencia de este subtipo fue del 73,6%). Entre los pacientes europeos sólo los españoles presentaron subtipo no B (prevalencia del 7,7%). El único factor que se asoció con mutaciones de resistencia fue la seroconversión (odds ratio [OR]: 9,2; IC 95%: 1,3-61,9; p < 0,02).
ConclusionesLa prevalencia de mutaciones de resistencia en pacientes con nuevo diagnóstico de infección por el VIH en la provincia de Málaga no es despreciable, y la seroconversión es el único factor que se asoció a su presencia. Destaca la alta prevalencia de VIH subtipo no B en la población española. Con estos datos se debe recomendar la realización de tests genotípicos de resistencia en todos los nuevos diagnósticos de nuestra área.
The reported prevalence of primary resistance mutations differs between studies. An analysis was performed to determine the prevalence of primary resistance mutations and HIV subtypes in our area.
MethodsProspective study performed in all patients diagnosed with HIV in the year 2005 in the province of Malaga (Spain). Plasma samples from these patients were tested for genotypic resistance (TruGene HIV-1 genotyping kit; Bayer Healthcare Diagnostics) and HIV subtype.
ResultsA total of 172 cases were diagnosed, 6 of them recent seroconvertors. Genotype resistance testing disclosed resistance mutations in 7.8% (95% CI 3.5-12.0%) of 153 patients in which it was performed (6 to NNRTIs, 4 to NRTIs, and 3 to PIs). HIV subtype was B in 81.8% of patients, and non-B in 18.1% (51.8% of them of sub-Saharan origin, in whom the prevalence of this subtype was 73.6%). Among European patients, only those from Spain presented the non-B subtype (prevalence 7.4%). The only factor related with the presence of resistance mutations was seroconversion (OR 9.2; 95% CI 1.3-61.9; P <.02).
ConclusionsThere was a considerable prevalence of primary resistance mutations in patients with newly diagnosed HIV infection in Malaga province, with seroconversion being the only related factor. The high prevalence of the non-B HIV subtype in the Spanish population is noteworthy. Genotype resistance testing is recommendable in all newly diagnosed HIV patients in our area.
La prevalencia de resistencias primarias del VIH a los antirretrovirales oscila, según las series, entre menos del 1 y más del 20%1-7 y en España entre el 3 y el 15%8-11. Este porcentaje varía dependiendo del año del estudio y de si se realiza en pacientes con infecciones recientes (primoinfección, seroconversores recientes, etc.) o en pacientes naïve con infección crónica. Aunque los datos aportados por la literatura médica no son concluyentes, con la generalización del uso del tratamiento antirretroviral (TAR) podría estar aumentando el riesgo de transmisión de cepas resistentes al virus de la inmunodeficiencia humana (VIH)5,7, lo que tiene una gran trascendencia clínica por su implicación determinante en la respuesta al TAR, sobre todo a la hora de iniciar el primer régimen2,7,12. Por otra parte, hay que tener en cuenta el fenómeno emergente de la emigración, que puede cambiar algunos parámetros como es el subtipo genético del VIH6,11. Los estudios de cohortes de nuevos diagnósticos de infección por VIH que incluyan los seroconversores recientes son los que nos podrían proporcionar información sobre las características epidemiológicas de estos pacientes y sus cambios a lo largo del tiempo, incluidas la aparición y evolución de mutaciones de resistencia. En España, se dispone de información de los nuevos diagnósticos de infección por el VIH de pocas comunidades autónomas13-17, a pesar de que la vigilancia epidemiológica basada en la notificación de la infección en vez del diagnóstico de caso de sida debería ser el sistema de elección, no sólo para notificar las características demográficas y epidemiológicas de los individuos recientemente diagnosticados, sino también para prever el impacto de la enfermedad en los recursos sanitarios18.
El objetivo de este estudio es conocer la prevalencia de resistencias primarias genotípicas y los subtipos de VIH en todos los pacientes diagnosticados de infección por el VIH en la provincia de Málaga durante el año 2005.
Pacientes y métodosPoblación del estudioTodos los pacientes diagnosticados de infección por el VIH durante el año 2005 en los seis hospitales públicos de la provincia de Málaga fueron incluidos en el estudio. La población de referencia de estos hospitales es aproximadamente 1.500.000 habitantes y en ellos se atienden de forma habitual a todos los pacientes con infección por el VIH. Se consideraron seroconversores recientes todos los pacientes con infección aguda y aquéllos con una serología negativa al VIH en el último año19. Se consideró que tenían enfermedad avanzada aquellos pacientes cuya primera determinación de linfocitos CD4 fue menor de 200 céls./μl.
Variables analizadasSe recogieron datos epidemiológicos y clínicos de todos los pacientes incluidos, así como la primera determinación de linfocitos CD4 y carga viral del VIH. Se recogió también el número de casos de sida en el momento del diagnóstico.
Análisis genotípicoA todos los pacientes incluidos en el estudio se les realizó un estudio genotípico en el centro de referencia (Servicio de Microbiología, Hospital Virgen de la Victoria, de Málaga) mediante secuenciación del gen pol del VIH-1 (Trugene HTV-1 genotyping kit; Bayer Healthcare Diagnostics, Sistema de secuenciación de ADN OpenGene®), con el objetivo de detectar las mutaciones genómicas en la región de la proteasa y en parte de la región de la transcriptasa inversa del VIH. La resistencia genotípica fue definida como la presencia de alguna mutación asociada a resistencia por el consenso de la AIDS Society-USA20. Las mutaciones menores en el gen de la proteasa no se consideraron asociadas a resistencia, dado que no es posible determinar si son variaciones naturales o secundarias a la exposición a fármacos antirretrovirales.
Análisis filogenéticoEn todas las muestras estudiadas, una vez obtenida la secuencia, se realizó el análisis filogenético mediante el alineamiento de la secuencia del gen pol con un conjunto de secuencias de referencia de los distintos subtipos genéticos de VIH-1 obtenidos de la base de datos de Stanford (http://hivdb.stanford.edu).
Aspectos éticosEl estudio fue aprobado por el comité de ética e investigación del centro coordinador (Hospital Virgen de la Victoria). A todos los pacientes se les informó de la naturaleza del estudio y se les pidió su consentimiento informado.
Análisis estadísticoTodos los parámetros del estudio se incluyeron en una base de datos para su posterior análisis. Se utilizó el test de chi al cuadrado o el test exacto de Fisher para comparar variables categóricas y la t de Student o la U de Mann-Whitney para comparar variables continuas. Para conocer los factores asociados a la presencia de mutaciones de resistencia, se realizó un análisis de regresión logística en el que se incluyeron todas aquellas variables con una p < 0,2 en el análisis univariante. Se utilizó el paquete estadístico del programa SPSS® versión 12.0 para Windows (SPSS, Chicago, Illinois, Estados Unidos).
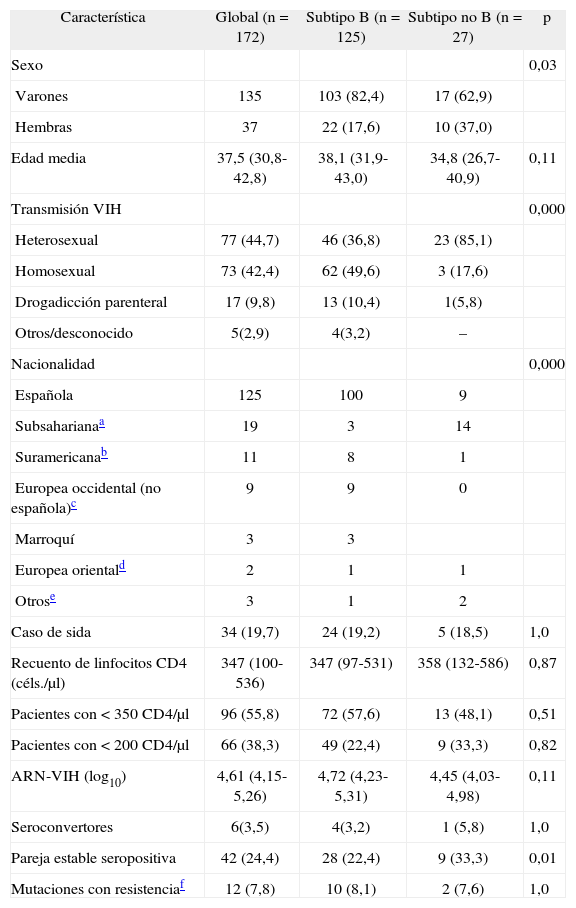
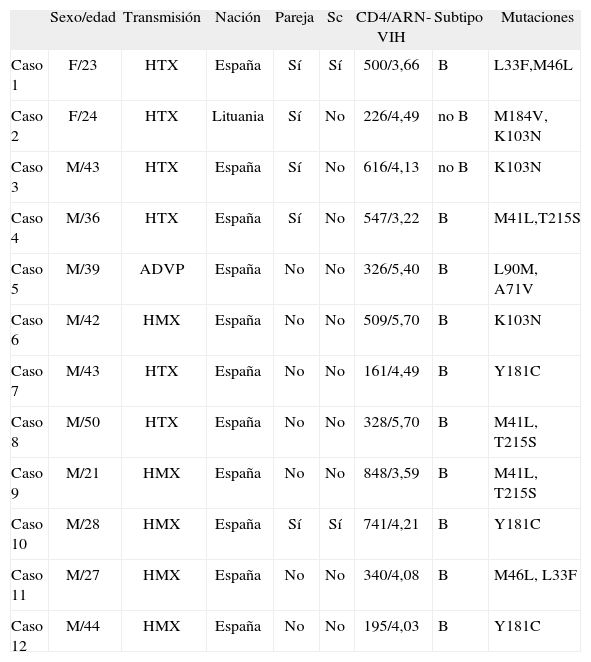
ResultadosUn total de 172 pacientes fueron diagnosticados de infección por el VIH-1 en los centros participantes durante el año 2005. No se detectó ningún caso de infección por el VIH-2 y sólo hubo 6 casos de seroconversión reciente (3,5%). En la tabla 1 se muestran las características epidemiológicas y clínicas de todos los pacientes. El 38,3% de los incluidos tenía enfermedad avanzada (linfocitos CD4 < 200 céls./μl en el momento del diagnóstico) y el 55,8% tenía un recuento de linfocitos CD4 < 350 céls./μl. Se realizó un estudio genotípico en 162 casos (94,1%). En 9 de ellos no se consiguió amplificar la muestra por lo que el análisis genotípico final incluyó 153 casos. Siguiendo las normativas de la International AIDS Society (IAS)20, 12 pacientes (7,8%; intervalo de confianza [IC] 95%: 3,5; 12,0%) presentaron mutaciones de resistencia: 6 a los inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITINAN), 4 a los inhibidores de la transcriptasa inversa análogos de los nucleósidos (ITIAN) y 3 a los inhibidores de la proteasa (IP). En un caso hubo mutaciones a dos familias de fármacos. En la tabla 2 se muestran las características de estos pacientes.
Características epidemiológicas y clínicas de los 172 pacientes incluidos en el estudio y contraste entre subtipo B y no B
| Característica | Global (n = 172) | Subtipo B (n = 125) | Subtipo no B (n = 27) | p |
| Sexo | 0,03 | |||
| Varones | 135 | 103 (82,4) | 17 (62,9) | |
| Hembras | 37 | 22 (17,6) | 10 (37,0) | |
| Edad media | 37,5 (30,8-42,8) | 38,1 (31,9-43,0) | 34,8 (26,7-40,9) | 0,11 |
| Transmisión VIH | 0,000 | |||
| Heterosexual | 77 (44,7) | 46 (36,8) | 23 (85,1) | |
| Homosexual | 73 (42,4) | 62 (49,6) | 3 (17,6) | |
| Drogadicción parenteral | 17 (9,8) | 13 (10,4) | 1(5,8) | |
| Otros/desconocido | 5(2,9) | 4(3,2) | – | |
| Nacionalidad | 0,000 | |||
| Española | 125 | 100 | 9 | |
| Subsaharianaa | 19 | 3 | 14 | |
| Suramericanab | 11 | 8 | 1 | |
| Europea occidental (no española)c | 9 | 9 | 0 | |
| Marroquí | 3 | 3 | ||
| Europea orientald | 2 | 1 | 1 | |
| Otrose | 3 | 1 | 2 | |
| Caso de sida | 34 (19,7) | 24 (19,2) | 5 (18,5) | 1,0 |
| Recuento de linfocitos CD4 (céls./μl) | 347 (100-536) | 347 (97-531) | 358 (132-586) | 0,87 |
| Pacientes con < 350 CD4/μl | 96 (55,8) | 72 (57,6) | 13 (48,1) | 0,51 |
| Pacientes con < 200 CD4/μl | 66 (38,3) | 49 (22,4) | 9 (33,3) | 0,82 |
| ARN-VIH (log10) | 4,61 (4,15-5,26) | 4,72 (4,23-5,31) | 4,45 (4,03-4,98) | 0,11 |
| Seroconvertores | 6(3,5) | 4(3,2) | 1 (5,8) | 1,0 |
| Pareja estable seropositiva | 42 (24,4) | 28 (22,4) | 9 (33,3) | 0,01 |
| Mutaciones con resistenciaf | 12 (7,8) | 10 (8,1) | 2 (7,6) | 1,0 |
Las variables cualitativas se expresan en n (%) y las cuantitativas en media (IQR).
ARN-VIH: carga viral del virus de la inmunodeficiencia humana.
Subsaharianos: 13 de Nigeria, 2 de Senegal, 1 de Tanzania, 1 de Ghana, 1 de Camerún, 1 de Costa de Marfil.
Suramericanos: 3 de Ecuador, 2 de Colombia, 1 de Jamaica, 1 de Paraguay, 1 de la República Dominicana, 1 de Venezuela, 1 de Argentina, 1 de Brasil.
Características de los pacientes con mutaciones primarias de resistencia
| Sexo/edad | Transmisión | Nación | Pareja | Sc | CD4/ARN-VIH | Subtipo | Mutaciones | |
| Caso 1 | F/23 | HTX | España | Sí | Sí | 500/3,66 | B | L33F,M46L |
| Caso 2 | F/24 | HTX | Lituania | Sí | No | 226/4,49 | no B | M184V, K103N |
| Caso 3 | M/43 | HTX | España | Sí | No | 616/4,13 | no B | K103N |
| Caso 4 | M/36 | HTX | España | Sí | No | 547/3,22 | B | M41L,T215S |
| Caso 5 | M/39 | ADVP | España | No | No | 326/5,40 | B | L90M, A71V |
| Caso 6 | M/42 | HMX | España | No | No | 509/5,70 | B | K103N |
| Caso 7 | M/43 | HTX | España | No | No | 161/4,49 | B | Y181C |
| Caso 8 | M/50 | HTX | España | No | No | 328/5,70 | B | M41L, T215S |
| Caso 9 | M/21 | HMX | España | No | No | 848/3,59 | B | M41L, T215S |
| Caso 10 | M/28 | HMX | España | Sí | Sí | 741/4,21 | B | Y181C |
| Caso 11 | M/27 | HMX | España | No | No | 340/4,08 | B | M46L, L33F |
| Caso 12 | M/44 | HMX | España | No | No | 195/4,03 | B | Y181C |
ADVP: transmisión por uso de droga por vía parenteral; ARN-VIH: carga viral del VIH en logio; CD4: recuento de linfocitos CD4 en céls./μl; F: sexo femenino; HMX: transmisión homosexual; HTX: transmisión heterosexual; M: sexo masculino; Sc: seroconversor reciente.
No hubo diferencias entre los pacientes con mutaciones de resistencia y sin ellas en ninguna de las variables analizadas (edad, sexo, nacionalidad, subtipo genético, riesgo para VIH, recuento de linfocitos CD4, carga viral, caso de sida, pareja estable, seropositividad y tratamientos o genotipos previos de ésta) salvo la seroconversión. En el análisis multivariado en el que se incluyeron la edad, sexo, seroconversión, caso de sida y recuento de CD4, persistió significativa la asociación con la seroconversión (odds ratio [OR]: 9,2; IC 95%: 1,3-61,9; p < 0,02).
Se realizó el subtipo del VIH en 149 pacientes. En el 81,8% el subtipo fue B y en el 18,1% no B. La prevalencia de subtipo no B entre pacientes subsaharianos fue del 73,6%. En pacientes de Europa occidental no se identificaron casos de subtipo no B a excepción de pacientes españoles, en los cuales la prevalencia fue del 7,7%. En la tabla 1 se contrastan las características de ambos grupos de pacientes.
DiscusiónEn nuestro medio los pacientes con infección por el VIH se atienden de forma mayoritaria en los hospitales públicos, por lo que este estudio es absolutamente representativo de los nuevos diagnósticos de infección por el VIH de la provincia de Málaga21,22.
La primera peculiaridad de este trabajo estriba en el impacto de la emigración en los nuevos diagnósticos de infección por el VIH en nuestra área. Más del 25% son extranjeros y hay nada menos que 27 nacionalidades entre los 172 nuevos diagnósticos. Es de destacar no solamente el porcentaje de subsaharianos, sino también de suramericanos y de sujetos de países europeos. Este hecho ocurre de forma similar e incluso más acentuado en otras zonas de nuestro país23,24.
Como en otros estudios, la mayoría de las nuevas infecciones son por transmisión sexual, y ha pasado a un lugar muy secundario la transmisión parenteral16,18,21,23,24.
Otro aspecto que se repite en el tiempo es el importante porcentaje de pacientes diagnosticados con enfermedad avanzada, con un porcentaje elevado de casos de sida ya en el momento del diagnóstico y con indicación de iniciar TAR en más de la mitad de los casos. A pesar de las distintas campañas oficiales, no se rebaja este porcentaje25. Este hecho también se sigue presentando en otros lugares de forma similar como se refleja en un reciente artículo de los casos diagnosticados en Inglaterra y Gales26 y en otro de Estados Unidos27.
La prevalencia de resistencias primarias en los nuevos diagnósticos es del 7,8%, afecta a las tres principales familias de fármacos empleados en el TAR y en un caso afectó a más de una familia. Este porcentaje se sitúa por encima del 5%, que es donde algunos expertos ponen el límite coste-beneficio para la realización de estudios genotípicos en pacientes naïve antes de iniciar el TAR28,29.
En este estudio el único factor predictor de presentar mutaciones de resistencias fue la seroconversión reciente. Este hecho se podría explicar por dos motivos. Por una parte, son los diagnósticos más recientes y, por lo tanto, con mayor probabilidad de infectarse con cepas de pacientes que ya han estado en TAR. Y por otra parte, la realización del estudio genotípico cerca del momento de la infección aumenta las posibilidades de detectar cepas con mutaciones que confieren peor fitness y que con el paso del tiempo serán sustituidas por la cepa salvaje, con lo cual no se detectarían posteriormente30. Este hecho no ha sido observado en otros estudios31,32.
La frecuencia de resistencias primarias en pacientes naïve puede variar ampliamente en los distintos estudios, en parte por las poblaciones estudiadas y la metodología empleada1-11,31,32. Lo que sí parece tanto en Europa Occidental como en Estados Unidos es que las resistencias primarias se están incrementando con el paso del tiempo, lo suficiente como para que en las últimas guías del Department of Health and Human Services (DHHS) de octubre de 2006, las de la IAS, las recientemente publicadas en Gran Bretaña y las de GESIDA-PNS recomienden la realización de un estudio genotípico en todos los pacientes naïve antes de comenzar el TAR si no se tiene un estudio previo33-36.
Los subtipos de VIH no B son frecuentes en pacientes procedentes de África subsahariana y de otras zonas del mundo y muy infrecuentes en pacientes de origen europeo10. Las diferencias entre los pacientes con subtipo genéticos B y no B reflejan las características propias de los subsaharianos infectados por el VIH, con mayor frecuencia de mujeres, pareja estable y adquisición de la infección por contacto heterosexual. En nuestro estudio es llamativo el importante porcentaje de pacientes españoles con subtipo no B que quizás esté en relación con cepas provenientes de otros lugares.
La principal limitación de este trabajo es que el ámbito en que se ha realizado podría dificultar la extrapolación de los resultados a otras zonas del territorio nacional. No obstante, nuestros datos no difieren mucho de los aportados por la cohorte de la Red de Investigación en Sida (RIS) en los que el impacto de la inmigración es similar, aunque con predominio de los latinoamericanos en contraste con un predominio de subsaharianos en nuestra serie24.
En resumen, en nuestro estudio se pone de manifiesto el cambio de patrón epidemiológico en los nuevos diagnósticos de infección por el VIH en nuestra área: reducción de la drogadicción parenteral como mecanismo de transmisión del VIH, impacto de la emigración en los nuevos diagnósticos, aparición de subtipos no B y aparición de mutaciones de resistencia en más del 5% de los nuevos casos, lo que haría recomendable la realización de tests genotípicos en la analítica habitual en el momento del diagnóstico.
Se necesitan nuevos estudios en poblaciones centinela como primoinfecciones, seroconversores recientes o nuevos diagnósticos en distintos lugares de nuestro país y hacerlo a lo largo del tiempo para conocer no solamente las características epidemiológicas de estos nuevos casos, sino para conocer la evolución genotípica de las cepas que infectan actualmente a los sujetos susceptibles.
Grupo Malagueño para el estudio de las Enfermedades InfecciosasM. González, J. Ruiz, R. Palacios, I. Domínguez, I. Viciana, F. Ropero, J. Santos y M. Máquez (Hospital Virgen de la Victoria, Málaga); I. de Pedro, F. Orihuela, M. Castaño, F. Jiménez-Oñate, J.M. Antúnez, M. Causse, A. Martín-Farfán y J.D. Colmenero (Hospital Carlos Haya, Málaga); J. de la Torre, J. Olalla y A. del Arco (Hospital Costa del Sol, Marbella); S. Fernández y E. Nuño (Hospital de la Axarquía, Vélez-Málaga); M. Grana y F. Salgado (Hospital de la Serranía, Ronda); J. Roldán y M.A. García-Ordóñez (Hospital Comarcal de Antequera).