La neumonía nosocomial (NN) es una de las infecciones más frecuentes que presentan los pacientes hospitalizados. Dentro de las NN, la neumonía asociada a la ventilación mecánica (NAV) es la complicación infecciosa nosocomial más frecuente entre los pacientes con insuficiencia respiratoria aguda. La NN y la NAV se asocian en algunos casos con un aumento de la mortalidad y con un incremento en los costes hospitalarios. El incremento en la incidencia de NN causada por microorganismos multirresistentes causa también un incremento en la incidencia de tratamiento antibiótico empírico inapropiado que se asocia a un incremento en el riesgo de mortalidad de los pacientes. Es muy importante conocer los microorganismos más frecuentemente responsables de estas infecciones en cada hospital y en cada unidad de cuidados intensivos y los patrones de sensibilidad antimicrobiana local para reducir la incidencia de tratamiento antibiótico inapropiado y mejorar el pronóstico de los pacientes. Además, deben utilizarse de forma rutinaria diferentes estrategias de prevención de la NN y de la NAV con el fin de reducir los factores de riesgo relacionados con la aparición de estas infecciones.
The hospital acquired pneumonia (HAP) is one of the most common infections acquired among hospitalised patients. Within the HAP, the ventilator-associated pneumonia (VAP) is the most common nosocomial infection complication among patients with acute respiratory failure. The VAP and HAP are associated with increased mortality and increased hospital costs. The rise in HAP due to antibiotic-resistant bacteria also causes an increase in the incidence of inappropriate empirical antibiotic therapy, with an associated increased risk of hospital mortality. It is very important to know the most common organisms responsible for these infections in each hospital and each Intensive Care Unit, as well as their antimicrobial susceptibility patterns, in order to reduce the incidence of inappropriate antibiotic therapy and improve the prognosis of patients. Additionally, clinical strategies aimed at the prevention of HAP and VAP should be employed in hospital settings caring for patients at risk for these infections.
Entre las complicaciones que se desarrollan durante el ingreso hospitalario, las infecciones nosocomiales representan alrededor del 40%. Según el estudio EPINE en sus datos referidos a 20111, la prevalencia de infección nosocomial fue de algo más del 6% de los pacientes. De entre las infecciones de adquisición hospitalaria, la neumonía nosocomial (NN) es la segunda infección nosocomial en frecuencia tras la infección urinaria y, según algunos autores, asociada con aumento de la mortalidad2.
DefinicionesLa NN se define como la infección que afecta al parénquima pulmonar, que se manifiesta transcurridas 72h o más del ingreso del paciente en el hospital, y que en el momento de ingreso del paciente en el hospital no estaba presente ni en período de incubación. Además, si la neumonía se relaciona con alguna maniobra diagnóstica o terapéutica también se considera nosocomial, aunque se produzca dentro de este período de 72h, como podría ser tras la intubación endotraqueal. Cuando esta infección se desarrolla en pacientes en ventilación mecánica se denomina neumonía asociada a la ventilación mecánica (NAV). Desde el año 2005 se añadió a esta clasificación otra entidad, la neumonía asociada a la asistencia sanitaria (NAAS o HCAP, por sus siglas en inglés), para definir las infecciones adquiridas en un entorno comunitario pero que ocurrían en pacientes con un contacto periódico o permanente con algún tipo de asistencia sanitaria.
EpidemiologíaLa mayoría de casos de NN se producen en las salas de hospitalización convencional, con una incidencia de entre 3 y 7episodios por cada 1.000admisiones hospitalarias2. En un estudio prospectivo realizado en 12hospitales españoles Sopena y Sabrià3 observaron una incidencia de 3±1,4episodios de NN por cada 1.000admisiones hospitalarias, con una variación entre 1,3 a 5,9 casos por 1.000ingresos hospitalarios. Este estudio, realizado durante 20meses y que incluyó a 186pacientes (con datos completos en 165), mostraba que el 64% de los episodios se diagnosticaron en salas de hospitalización médicas, y el 36%, en salas quirúrgicas.
El riesgo de presentar una neumonía se multiplica, de forma global, por más de 20veces en pacientes que están recibiendo ventilación mecánica4. Se ha estimado que en la primera semana de ventilación mecánica este riesgo es del 3%, disminuye al 2% en la segunda semana y se mantiene alrededor del 1% en la tercera semana de ventilación mecánica y posteriores5. En los pacientes que son portadores de dispositivos artificiales —catéteres intravenosos o tubo endotraqueal— implicados en la patogenia de la infección, el parámetro más comúnmente aceptado para evaluar el número de infecciones es la densidad de incidencia, ajustando el riesgo al número de días de riesgo que corresponde al número de días de permanencia del dispositivo. En conjunto, la densidad de incidencia de NAV oscila entre 10-30episodios por 1.000días de ventilación mecánica. En nuestro país, además de las bases de datos locales, un gran número de unidades de cuidados intensivos (UCI) participan desde 1994 en el Estudio Nacional de Vigilancia de la Infección Nosocomial en UCI (ENVIN-UCI). El análisis de estos datos evidencia una tendencia a ir disminuyendo la densidad de incidencia de NAV en los últimos años6. Así, desde una densidad de incidencia de entre 14 y 17 episodios de NAV por 1.000días de ventilación mecánica desde los primeros años de seguimiento, se ha pasado a una densidad de incidencia de 7,27episodios de NAV por 1.000días de ventilación mecánica en el año 2012. Este descenso continuado se argumenta que se ha atribuido especialmente a la reciente implantación de 2proyectos que van dirigidos a la reducción de la infección nosocomial: el Proyecto Bacteriemia Zero y el Proyecto Neumonía Zero.
PatogeniaLos microorganismos causantes de las neumonías pueden alcanzar las vías respiratorias inferiores por alguna de las siguientes vías: 1)por inhalación a través de las vías respiratorias o del tubo endotraqueal si el paciente está intubado; 2)por aspiración de secreciones colonizadas procedentes de la orofaringe; 3)por vía hematógena a partir de focos de infección distantes del pulmón o de la propia flora intestinal a través del fenómeno de translocación bacteriana, y finalmente, 4)por contigüidad desde infecciones adyacentes a los pulmones. En el caso de las neumonías nosocomiales, y principalmente en el caso de las NAV, la principal vía de acceso de los microorganismos al pulmón es a través de microaspiraciones repetidas de secreciones orofaríngeas colonizadas previamente por los patógenos responsables de la infección pulmonar.
En la década de los sesenta la mayoría de infecciones respiratorias nosocomiales en los pacientes con ventilación mecánica se relacionaban con la contaminación de los diferentes dispositivos de soporte ventilatorio. La introducción de procedimientos efectivos de descontaminación disminuyó radicalmente la colonización de los equipos de terapia respiratoria, y, como consecuencia, la incidencia de neumonías nosocomiales. Por otro lado, la humidificación del aire inspirado, que se realizaba mayoritariamente con sistemas de humidificación con agua, provocaba la presencia de condensado con alto nivel de contaminación7. Además, la práctica de cambios de tubuladuras reglados cada 8h8 inicialmente o cada 24h9 más adelante conllevaba un alto grado de manipulación. Actualmente, la esterilización de los componentes del respirador entre pacientes, el cambio en el sistema de humidificación y la estandarización de los cambios en las tubuladuras hacen muy improbable que el origen de los microorganismos causantes de la infección nosocomial se encuentre en los equipos de terapia respiratoria. Efectivamente, la práctica habitual consiste en el uso de humidificación mediante intercambiadores de calor y humedad, o sistemas de humidificación que no favorecen la producción de condensado, y el cambio de tubuladuras se produce no antes de una semana y habitualmente se mantiene durante todo el ingreso del paciente, disminuyendo en un alto grado la manipulación10,11.
La principal vía de entrada de los patógenos en la vía aérea es por la aspiración de secreciones orofaríngeas previamente colonizadas, y ello en pacientes con o sin ventilación mecánica. Únicamente las infecciones por micobacterias, hongos y algunos microorganismos como Legionella pneumophila o algunos virus alcanzan el pulmón por vía inhalatoria12-15.
En pacientes sin vía aérea artificial los principales factores de riesgo implicados en el desarrollo de una NN son la presencia de alteración del nivel de consciencia, alteración en la deglución, alteración del reflejo tusígeno o de la motilidad gastrointestinal16, todos ellos factores que favorecen las microaspiraciones. En los pacientes en ventilación mecánica la presencia del tubo endotraqueal tampoco evita que se produzcan microaspiraciones a través del espacio comprendido entre la pared traqueal y el balón del neumotaponamiento, que llegan a la tráquea y a los bronquios colonizando las vías respiratorias. En la patogenia de la NAV también se atribuye un papel a la formación de biofilm en la superficie interna del tubo endotraqueal que contiene una gran cantidad de patógenos17. El paso al tracto respiratorio inferior de fragmentos de biofilm con patógenos englobados en su estructura, que se desprenden por sí solos o por el uso de sondas de aspiración, es, por tanto, otro de los mecanismos implicados en la patogenia de la NAV.
Finalmente, el desarrollo de neumonía dependerá de la interrelación entre la virulencia de los patógenos implicados, el tamaño del inóculo y el grado de alteración de las defensas del huésped.
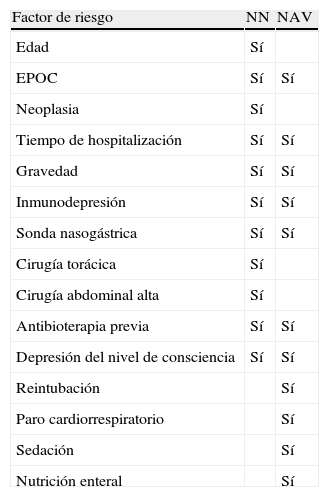
Factores de riesgoLos factores de riesgo para el desarrollo de neumonía en pacientes ventilados y no ventilados presentan algunas similitudes. Así, puede ser común la presencia de factores de riesgo relacionados con el propio huésped como enfermedades crónicas, o de factores relacionados con el uso de antibióticos que pueden aumentar el riesgo de colonización de la orofaringe, y de factores que aumenten el riesgo de aspiración de secreciones orofaríngeas en el tracto respiratorio inferior. La cirugía torácica o abdominal superior, entre otras prácticas, se han identificado como factores de riesgo en pacientes no ventilados. En pacientes en ventilación mecánica presentan una especial relevancia todos los aspectos relacionados con el cuidado de la vía aérea. En la tabla 1 pueden apreciarse los principales factores de riesgo asociados al desarrollo de NN y de NAV.
Factores de riesgo de neumonía nosocomial (NN) y neumonía asociada a la ventilación mecánica (NAV)
| Factor de riesgo | NN | NAV |
| Edad | Sí | |
| EPOC | Sí | Sí |
| Neoplasia | Sí | |
| Tiempo de hospitalización | Sí | Sí |
| Gravedad | Sí | Sí |
| Inmunodepresión | Sí | Sí |
| Sonda nasogástrica | Sí | Sí |
| Cirugía torácica | Sí | |
| Cirugía abdominal alta | Sí | |
| Antibioterapia previa | Sí | Sí |
| Depresión del nivel de consciencia | Sí | Sí |
| Reintubación | Sí | |
| Paro cardiorrespiratorio | Sí | |
| Sedación | Sí | |
| Nutrición enteral | Sí |
La etiología de las neumonías nosocomiales no es homogénea en todos los hospitales y varía dependiendo del tipo de hospital, de los factores de riesgo de la población atendida y de los métodos de diagnóstico empleados. La utilización de técnicas de diagnóstico más específicas, como el catéter telescopado y el lavado broncoalveolar, y la aplicación de cultivos microbiológicos cuantitativos ha permitido identificar con mayor seguridad los agentes causales de la infecciones respiratorias nosocomiales en poblaciones de riesgo como son los pacientes en ventilación mecánica.
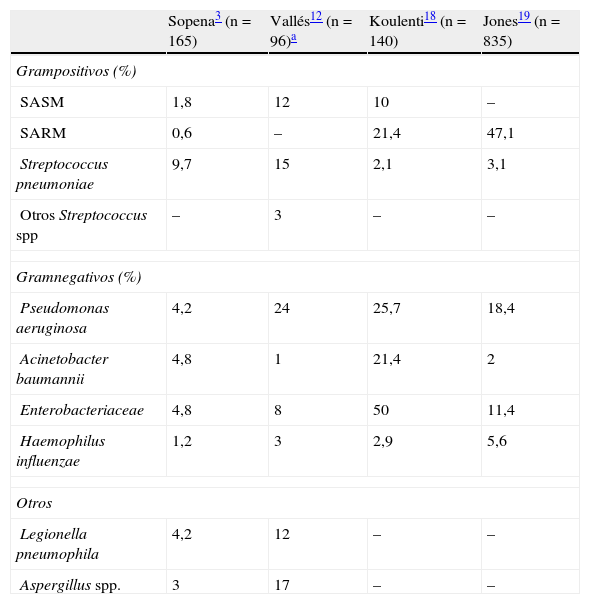
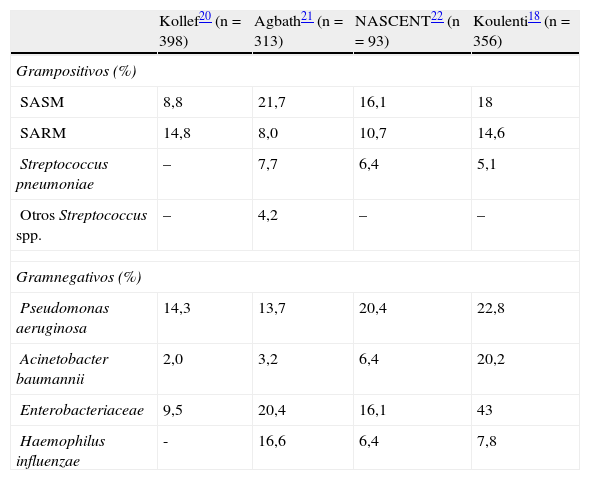
La etiología de la neumonía nosocomial y la de la neumonía asociada a la ventilación mecánica, descritas en diversos artículos, se muestra en las tablas 2 y 33,12,18–22. Los episodios de NAV se han dividido desde hace tiempo en NAV precoz y tardía, según sean episodios diagnosticados en los primeros 4días de ventilación mecánica o sean de diagnóstico posterior. Esta distinción teórica tiene la ventaja de definir 2grupos etiológicos con diferentes patógenos e implicaciones terapéuticas23. Las NAV precoces suelen ser debidas a patógenos como Streptococcus pneumoniae, Haemophilus influenzae y Staphylococcus aureus sensible a meticilina (SASM). Estos microorganismos no suelen presentar dificultades en la elección de su tratamiento antibiótico, y la mayoría de pautas de tratamiento antibiótico empírico están compuestas por fármacos activos contra ellos. En los episodios de NAV tardíos característicamente la etiología está compuesta por microorganismos con un perfil de sensibilidad antibiótica diferente, y en muchos casos con resistencia a diversas familias de antibióticos. Entre estos patógenos nos encontramos episodios producidos principalmente por Pseudomonas aeruginosa, Acinetobacter baumannii y S.aureus resistente a meticilina (SARM), aunque también podemos encontrar otros bacilos gramnegativos19, dependiendo de la flora predominante en cada hospital. Esta distinción no ha quedado tan definida para los episodios de NN no asociados a ventilación mecánica. Sin embargo, en todos los casos de neumonía habrá que tener en cuenta los principales factores de selección de flora durante la estancia hospitalaria, como son el tratamiento antibiótico recibido previamente y el tiempo de hospitalización previo al diagnóstico de la neumonía. Estos factores favorecen la selección y la colonización de microorganismos resistentes responsables de las infecciones pulmonares nosocomiales.
Etiología de neumonía nosocomial en pacientes no ventilados en diversos estudios
| Sopena3 (n=165) | Vallés12 (n=96)a | Koulenti18 (n=140) | Jones19 (n=835) | |
| Grampositivos (%) | ||||
| SASM | 1,8 | 12 | 10 | – |
| SARM | 0,6 | – | 21,4 | 47,1 |
| Streptococcus pneumoniae | 9,7 | 15 | 2,1 | 3,1 |
| Otros Streptococcus spp | – | 3 | – | – |
| Gramnegativos (%) | ||||
| Pseudomonas aeruginosa | 4,2 | 24 | 25,7 | 18,4 |
| Acinetobacter baumannii | 4,8 | 1 | 21,4 | 2 |
| Enterobacteriaceae | 4,8 | 8 | 50 | 11,4 |
| Haemophilus influenzae | 1,2 | 3 | 2,9 | 5,6 |
| Otros | ||||
| Legionella pneumophila | 4,2 | 12 | – | – |
| Aspergillus spp. | 3 | 17 | – | – |
SARM: Staphylococcus aureus resistente a meticilina; SASM: Staphylococcus aureus sensible a meticilina.
Etiología de la neumonía asociada a ventilación mecánica en diferentes estudios
| Kollef20 (n=398) | Agbath21 (n=313) | NASCENT22 (n=93) | Koulenti18 (n=356) | |
| Grampositivos (%) | ||||
| SASM | 8,8 | 21,7 | 16,1 | 18 |
| SARM | 14,8 | 8,0 | 10,7 | 14,6 |
| Streptococcus pneumoniae | – | 7,7 | 6,4 | 5,1 |
| Otros Streptococcus spp. | – | 4,2 | – | – |
| Gramnegativos (%) | ||||
| Pseudomonas aeruginosa | 14,3 | 13,7 | 20,4 | 22,8 |
| Acinetobacter baumannii | 2,0 | 3,2 | 6,4 | 20,2 |
| Enterobacteriaceae | 9,5 | 20,4 | 16,1 | 43 |
| Haemophilus influenzae | - | 16,6 | 6,4 | 7,8 |
SARM: Staphylococcus aureus resistente a meticilina; SASM: Staphylococcus aureus sensible a meticilina.
En el medio extrahospitalario la presencia de síntomas respiratorios como tos, expectoración y dolor torácico de características pleuríticas, junto con la presencia de fiebre, son signos y síntomas que orientan claramente hacia el diagnóstico de neumonía, que se confirma con la presencia de un infiltrado en la radiografía de tórax.
En la neumonía nosocomial, y en especial en la NAV, la combinación de diversos datos clínicos como son la presencia de leucocitosis, fiebre, secreciones purulentas y la aparición de un nuevo infiltrado en la radiografía de tórax o extensión de los ya existentes, junto con un deterioro del intercambio de gases, serán los aspectos en los que se sustentarán los signos clínicos de sospecha de neumonía. Por ejemplo, la ausencia de secreciones purulentas hace improbable el diagnóstico de neumonía hospitalaria, pues pocos patógenos, salvo Legionella, Pneumocystis y algún otro, cursan con infección pulmonar no purulenta. Sin embargo, aunque todos estos datos son sumamente sensibles, no son lo suficientemente específicos para confirmar el diagnóstico de neumonía, puesto que existen múltiples condiciones, en especial en el paciente crítico y con ventilación mecánica, que presentan los mismos signos y síntomas.
Desde hace años, diferentes estudios han demostrado la escasa especificidad de los criterios clínicos en el diagnóstico de la NAV. Estudios realizados en pacientes con sospecha de NAV que fallecían y en los que se practicó estudio necrópsico presentaban un error diagnóstico en hasta el 30% de los casos24. A principios de la década de los noventa Pugin et al.25 publicaron el índice CPIS (clinical pulmonary infection score) con la intención de predecir la probabilidad de presentar una NAV. El resultado final de este score es una puntuación que tiene en consideración información sobre temperatura, recuento leucocitario, oxigenación, radiografía de tórax, cantidad y aspecto de las secreciones y cultivo de las secreciones traqueales. Aunque algunos de estos parámetros tienen cierto grado de subjetividad y otros no se pueden evaluar en el momento de intentar establecer el diagnóstico, el índice CPIS integra muchos de los parámetros que el clínico avezado tiene en consideración al evaluar un paciente con una posible NAV. Una puntuación baja hace que el diagnóstico de NAV sea muy improbable y aumenta su posibilidad con puntuaciones mayores, considerándose como NAV a partir de una puntuación de 6. Variaciones de este índice se han evaluado como parámetros evolutivos en la resolución de NAV. Sin embargo, además de presentar algunos parámetros que requieren su evaluación en unos días (resultado del cultivo de secreciones), no es aplicable a todos los pacientes26. Una versión posterior modificada por Luna et al.27, que no tiene en cuenta aspectos microbiológicos, considera que una puntuación superior a 5 con un máximo de 10 puntos es diagnóstica de NAV.
Desde 1994 el Grupo de Trabajo de Enfermedades Infecciosas (GTEI) de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) realiza un estudio de vigilancia de la infección nosocomial en las UCI españolas (ENVIN-HELICS). Esta actividad continuada recoge información en su último año de más de 170UCI6. Uno de los hechos más relevantes de este arduo trabajo ha sido la estandarización de las definiciones. Así, la definición actual de neumonía presenta unos criterios más exigentes que los previos, como es la necesidad de 2radiografías de tórax con persistencia del infiltrado en pacientes con enfermedad cardíaca o pulmonar subyacente. Además, se tiene en cuenta también el tipo de muestra respiratoria utilizada para el diagnóstico, y se clasifica en diferentes tipos de mayor o menor seguridad en el diagnóstico según la calidad de esa muestra microbiológica28. Esta clasificación se muestra en la tabla 4.
Definición de neumonía adquirida en UCI (modificado de 28)
| A. Diagnóstico clínico | |
| Pacientes SIN patología cardíaca o pulmonar: | 1 RX o TC tórax compatible |
| Pacientes CON patología cardíaca o pulmonar previa: | ≥ 2 RX o TC tórax compatible |
| + 1 de: | |
| - Fiebre >38°C sin otro origen, o | |
| - Leucopenia (<4.000mm3) o leucocitosis (>12.000/mm3) | |
| + 1 de (2 si N4 o N5): | |
| - Esputo purulento o cambio en las características del esputo | |
| - Tos o disnea o taquipnea | |
| - Auscultación sugestiva: crepitantes, roncus, sibilancias | |
| - Deterioro del intercambio gaseoso (desaturación de oxígeno o aumento de las demandas de oxígeno o de la demanda ventilatoria) | |
| B. Diagnóstico etiológico |
| N1. Muestra mínimamente contaminada: |
| - Lavado broncoalveolar ≥104UFC/ml o ≥5% células con bacterias intracelulares |
| - Cepillo protegido ≥103UFC/ml |
| - Aspirado distal protegido ≥103UFC/ml |
| N2. Muestra posiblemente contaminada: |
| - Aspirado endotraqueal >106UFC/ml |
| N3. Métodos microbiológicos alternativos: |
| - Hemocultivo positivo no relacionado con otro foco de infección |
| - Crecimiento patógeno en cultivo de líquido pleural |
| - Punción aspirativa positiva pleural o de absceso pulmonar |
| - Evidencia de neumonía en examen histológico pulmonar |
| - Diagnóstico positivo de neumonía por virus o microorganismos particulares (Legionella, Aspergillus, micobacteria, micoplasma, Pneumocystis jiroveci) |
| • Detección positiva de antígeno viral o anticuerpos a partir de secreciones respiratorias (EIA, FAMA, Shell vial assay, PCR) |
| • Examen directo positivo o cultivo positivo de secreciones bronquiales o tejido |
| • Seroconversión (p.ej., virus influenza, Legionella, Chlamydia) |
| • Detección de antígenos en orina (Legionella o neumococo) |
| N4. Cultivo positivo de esputo o no cuantitativo de muestra de tracto respiratorio |
| N5. Sin microbiología positiva |
Dada la inespecificidad del diagnóstico clínico en la NAV, además de los criterios clínicos de sospecha de infección respiratoria nosocomial es aconsejable obtener muestras de las secreciones pulmonares para confirmar el diagnóstico e identificar el patógeno responsable de la infección y así poder adecuar posteriormente el tratamiento antibiótico que se ha iniciado de forma empírica.
En el paciente sin ventilación mecánica, el cultivo de esputo es la técnica más utilizada. En este sentido, hay que aplicar los mismos criterios que se utilizan en el caso de la neumonía extrahospitalaria para considerar que el esputo es representativo de las vías respiratorias inferiores. Actualmente se sigue utilizando el cribado de ≥25leucocitos por campo y ≤10células epiteliales para considerar la muestra representativa del tracto respiratorio inferior, y adecuada para la tinción de Gram y el cultivo bacteriano29,30.
El principal problema en la obtención de muestras respiratorias representativas de las vías respiratorias inferiores se presenta en los pacientes con una vía aérea artificial. Estos pacientes presentan generalmente un grado de colonización elevado en sus vías respiratorias superiores (tráquea y bronquios principales) que va a dificultar la interpretación de los resultados microbiológicos. En este tipo de pacientes la obtención de un aspirado traqueal para cultivo cualitativo (equivalente al esputo en el paciente no ventilado) se ha mostrado como una técnica muy fácil, con una alta sensibilidad pero con un valor predictivo positivo muy escaso, por el problema de la imposibilidad de diferenciar la flora derivada de colonización de la flora verdaderamente responsable de la infección pulmonar.
Para obviar el problema de la contaminación de las muestras respiratorias con la flora de colonización de las vías respiratorias superiores en los pacientes en ventilación mecánica se han utilizado diversas técnicas diagnósticas.
Catéter telescopadoEsta técnica se basa en la utilización de un cepillo que va protegido dentro de un doble catéter para disminuir la posibilidad de contaminación durante la obtención de la muestra. Habitualmente se realiza a través de un broncoscopio. El volumen de secreciones que se obtiene mediante el catéter telescopado (CT) es aproximadamente de 0,001ml, que se diluye en un mililitro de suero fisiológico. Posteriormente se realiza un cultivo de esa solución y una concentración ≥103UFC/ml, equivalente a una concentración ≥106UFC/ml de secreción respiratoria original.
Con el punto de corte en ≥103UFC/ml la sensibilidad media en el paciente ventilado es del 67±20% y la especificad media del 90±14%. Con tratamiento antibiótico en las 72h previas se pueden encontrar concentraciones menores, y su interpretación es más difícil. Así, una cuantificación inferior puede estar reflejando una verdadera NAV parcialmente tratada. Otro aspecto positivo es que la tinción de Gram del sobrenadante de la muestra del CT diluida en el suero fisiológico puede ser de utilidad en el diagnóstico precoz de la neumonía y ayudar en la elección del tratamiento antibiótico empírico. La presencia de un número superior al 1% de células epiteliales en la muestra sugiere contaminación, con una interpretación del resultado complicada.
Lavado broncoalveolarEl lavado broncoalveolar (LBA) permite obtener material alveolar mediante la instilación y la aspiración secuencial de varias alícuotas de suero salino estéril a través del canal del fibrobroncoscopio enclavado en la vía aérea del segmento pulmonar que se quiere evaluar. Mediante el LBA se analiza una zona más extensa de parénquima pulmonar que con el CT. Se estima que con el material recuperado con el LBA se obtiene muestra de aproximadamente 106alvéolos.
El LBA convencional se realiza mediante 3instilaciones y aspiraciones secuenciales de 50ml de suero fisiológico, recuperándose habitualmente entre un 20-30% del total instilado. Para evitar la contaminación de la muestra a través del canal del fibrobroncoscopio se han ideado también catéteres con o sin protección con balón o tapón distal. En estos casos se reduce la cantidad de suero fisiológico instilado. Variaciones en la cantidad empleada de suero fisiológico pueden valorarse según el estado clínico del paciente, sobre todo del grado de insuficiencia respiratoria31. En cualquier caso, la primera alícuota se considera que proviene del árbol bronquial y se desecha o se reserva para el análisis de patógenos no colonizantes (M.tuberculosis, Legionella…). Las siguientes alícuotas se consideran representativas de la flora existente a nivel alveolar.
En el caso del LBA, el volumen de secreciones respiratorias recuperadas se estima en 1ml diluido en el líquido que se aspira, lo que viene a suponer un factor de dilución de 1/10-1/100 de las secreciones respiratorias originales. El punto de corte generalmente aceptado en el cultivo cuantitativo del LBA representativo de la infección pulmonar es de ≥104UFC/ml. Con este umbral diagnóstico, la sensibilidad media del LBA en el diagnóstico de infección pulmonar es de 73±18%, y la especificad media, de 82±19%. También el tratamiento antibiótico iniciado dentro de las 72h previas a la toma de la muestra puede alterar el resultado y hacer la interpretación más difícil.
El LBA también permite un diagnóstico precoz mediante la tinción de Gram. Además, el LBA permite la investigación de microorganismos intracelulares. Un número igual o superior al 5% de células alveolares (polimorfonucleares y macrófagos) con organismos intracelulares es altamente indicativo de neumonía, y el resultado no se altera por el tratamiento antibiótico previo.
Aspirado traqueal cuantitativoLas secreciones respiratorias obtenidas mediante la aspiración con una sonda a través del tubo endotraqueal es un método sencillo, pero esta muestra se encuentra generalmente contaminada por la flora de colonización de las vías respiratorias superiores. Para evitar esta confusión en la interpretación, se cuantifica el número de microorganismos presentes en el cultivo y se considera representativa cuando el cultivo cuantitativo presenta un crecimiento superior a 106UFC/ml. Las muestras de aspirado traqueal cuantitativo presentan una sensibilidad del 38-100% y una especificidad de entre el 14 y el 100%.
Además de estas muestras respiratorias, la obtención de otras muestras se puede realizar simultáneamente, como hemocultivos, obtención de líquido pleural si hay sospecha de empiema o determinación de antígenos en orina para Legionella o neumococo. Durante unos años en la década de los noventa, y recientemente, aunque con menor intensidad, se han defendido las ventajas de utilizar métodos invasivos (con fibrobroncoscopio) o no invasivos32,33 en el diagnóstico de la NAV. En nuestra opinión, probablemente, en casos de neumonías precoces y sin antibioterapia previa, donde es más previsible que la etiología de la neumonía esté producida por patógenos habituales (SASM, S.pneumoniae o H.influenzae), la ventaja de un método invasivo sobre otro no invasivo es probablemente menor. En cambio, en neumonías de mala resolución, o en episodios con riesgo de patógenos resistentes a las pautas antibióticas habituales, el valor de una muestra más específica será mayor. Un estudio multicéntrico con más de 700pacientes no ha acabado de aclarar este dilema, pues, sin apreciar diferencias entre ambos métodos diagnósticos, los pacientes infectados o colonizados por Pseudomonas o SARM fueron excluidos34. A pesar de todas las teóricas ventajas, globalmente en Europa el uso de métodos invasivos apenas llega al 25% de los episodios18 de NAV. En todo caso, optar por una prueba invasiva no ha de suponer una demora en el inicio del tratamiento antibiótico inicial.
TratamientoLa neumonía nosocomial es la infección intrahospitalaria que se asocia a una mayor morbimortalidad. En diferentes estudios la mortalidad cruda de los pacientes oscila entre el 30 y el 50%, y puede llegar hasta el 70% cuando están implicados microorganismos multirresistentes como P.aeruginosa35.
La rápida identificación del paciente infectado y una selección adecuada del tratamiento antibiótico desde el comienzo van a ser factores de gran impacto en el pronóstico del paciente con neumonía nosocomial. En este sentido, es importante considerar una serie de factores que influirán en la elección del tratamiento antibiótico inicial. Los factores más relevantes pueden apreciarse en la tabla 5.
Factores a considerar en la elección de antibioterapia empírica en un paciente con neumonía nosocomial
| 1. Tiempo previo de hospitalización y/o ventilación mecánica antes de la aparición de la neumonía nosocomial |
| 2. Antibióticos utilizados previamente durante la hospitalización del paciente |
| 3. Epidemiología de los microorganismos responsables de neumonía nosocomial y patrones de susceptibilidad propios de cada hospital, e incluso de cada área |
| 4. Factores de riesgo propios del paciente y gravedad de la neumonía nosocomial |
| 5. Información obtenida mediante el examen microscópico directo de las secreciones pulmonares |
| 6. Actividad intrínseca de los antimicrobianos y de sus variaciones farmacocinéticas |
En ausencia de granulocitopenia o inmunodepresión severa, la gran mayoría de las neumonías nosocomiales estarán causadas por bacterias, en especial por bacilos gramnegativos y S.aureus. El predominio de un microorganismo u otro dependerá, sobre todo, de las características del paciente, del tiempo de aparición de la neumonía, de los antibióticos que haya recibido previamente y de la flora propia de cada hospital o UCI.
En el año 2005 se publicaron las Guías de la American Thoracic Society para el tratamiento de la neumonía nosocomial, de la neumonía asociada a la ventilación mecánica y de una nueva entidad que se denominó «neumonía asociada a la asistencia sanitaria»36. A diferencia de la versión previa, que definía grupos de patógenos, en esta ocasión la elección de tratamiento de amplio espectro o de un espectro más limitado se orientaba en función del tiempo de evolución y/o de la presencia de factores de riesgo para patógenos multirresistentes. En el caso de neumonía precoz sin antibiótico previo y sin factores de riesgo de patógenos multirresistentes se puede optar por monoterapia con amoxicilina-ácido clavulánico, cefalosporina no antipseudomónica, levofloxacino o moxifloxacino, o en algunos casos ertapenem.
La pauta se vuelve más compleja en pacientes con neumonía tardía, con antibiótico previo y la presencia de factores de riesgo para patógenos multirresistentes, donde habrá que iniciar el tratamiento empírico con un carbapenem con actividad antipseudomónica, piperacilina-tazobactam, cefepima o ceftazidima combinado con un segundo fármaco antipseudomónico (ciprofloxacino o aminoglucósido), y considerar vancomicina o linezolid si existe riesgo de SARM. Cuando se disponga de la etiología se podrá reducir el tratamiento si no existe SARM, y con la sensibilidad, si es P.aeruginosa dejar el tratamiento con un solo fármaco activo37. En la actualidad no son extraños los episodios de bacilos gramnegativos con sensibilidad únicamente a colistina y tal vez algún aminoglucósido, sin otras opciones terapéuticas38.
La duración del tratamiento antibiótico en la neumonía nosocomial también es un punto controvertido. Un estudio multicéntrico comparó 2pautas de duración de tratamiento: una de 8días y otra de 15días39. Aunque no hubo diferencias en mortalidad, se apreció que los pacientes con neumonía por bacilos gramnegativos no fermentadores, incluyendo Pseudomonas, y tratados durante 8días presentaron una mayor recurrencia comparado con los tratamientos durante 15días. También destacaba que los que mostraron recurrencias, si habían recibido la pauta de 8días presentaron menos frecuentemente patógenos multirresistentes. Actualmente se recomienda la pauta de 8días en todos los casos, excepto en neumonía por bacilos gramnegativos no fermentadores, en que se mantiene durante 15días.
Las pautas en el caso de neumonía nosocomial en el paciente no ventilado no difieren del paciente ventilado16. Por otro lado, en nuestro medio la etiología de los episodios de neumonía asociada a la asistencia sanitaria no difieren demasiado de la neumonía comunitaria. El neumococo es el más frecuente, con pocos casos de patógenos multirresistentes, y por ello no requerirían un enfoque terapéutico diferente40.
PrevenciónTal vez sea este el campo de la neumonía nosocomial donde más se ha avanzado en los últimos años. El conocimiento de la etiopatogenia de la neumonía nosocomial permite establecer unas pautas preventivas que van orientadas a reducir la colonización orofaríngea, reducir el inóculo (especialmente en NAV), reducir la contaminación cruzada proveniente de otros pacientes o del medio ambiente y evitar la transmisión de patógenos a través de aerosoles.
También la colonización orofaríngea por patógenos multirresistentes puede reducirse mediante la disminución de la transmisión cruzada de microorganismos entre pacientes a través del personal sanitario41, y con menor presión antibiótica. Los métodos de barrera, y especialmente el programa de lavado de manos con soluciones alcohólicas, se muestran útiles en la disminución de los episodios de neumonía11. En los pacientes no intubados, tener la precaución de que la ingesta se realice con la cama incorporada, evitando la aspiración, e incentivar la fisioterapia respiratoria, especialmente en pacientes postoperados, son actividades preventivas relevantes16.
Además de lo reseñado, hay una serie de medidas específicas en el paciente sometido a ventilación mecánica: a)la disminución del inóculo se puede llevar a cabo mediante la intubación orotraqueal en lugar de nasotraqueal, evitando la reintubación, manteniendo una presión del neumotaponamiento entre 25 y 30cmH2O, mediante el uso de tubos endotraqueales dotados de sistemas de aspiración de secreciones subglóticas42,43, el uso de tubos endotraqueales con balón de poliuretano44, o tubos endotraqueales tratados con plata22, y b)la disminución de la colonización orofaríngea puede realizarse mediante lavado de la cavidad oral con clorhexidina en pacientes en ventilación mecánica, y de hecho forma parte de la rutina de cuidados de los pacientes con vía aérea artificial45. El inóculo también puede reducirse mediante la administración de antibioterapia profiláctica en el momento de la intubación en pacientes en coma46. Los protocolos que se asocien a menor tiempo en ventilación mecánica, como los protocolos de weaning, o los que eviten su uso invasivo en caso de ventilación mecánica no invasiva para pacientes seleccionados47, expondrán durante menos tiempo al paciente al riesgo de la vía aérea artificial.
Un caso destacable es el papel de la descontaminación digestiva selectiva. En varios metaanálisis se aprecia disminución en la incidencia de NAV y la reducción de la mortalidad en algún estudio, especialmente en aquellas pautas con una parte del tratamiento con una cefalosporina intravenosa48. Sin embargo, su uso no se ha extendido por la existencia de algunos estudios negativos49 y la potencial aparición de patógenos resistentes durante su instauración.
Sin embargo, la aparición de los paquetes de medida ha sido lo que parece haber impulsado la reducción en las tasas de NAV. El estudio de Resar et al.50 presentó una reducción de la NAV con la aplicación de medidas, varias de ellas de cuidados generales, como la profilaxis de las úlceras de estrés, la profilaxis de la trombosis venosa profunda, la elevación de la cabecera de la cama y la retirada diaria de la sedación y su valoración para ser extubado o no. Diversos grupos posteriormente han presentado resultados en la misma línea, con paquetes de medida, algunos de ellos enfocados directamente al proceso en concreto de prevención de la NAV como la higiene de manos, la higiene oral con clorhexidina, el mantenimiento de la presión correcta del neumotaponamiento, evitar el cambio de las tubuladuras y la aplicación de protocolos de sedación11.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion