Varón de 39años, sin antecedentes de interés, que ingresa por hepatitis aguda grave, sin filiación etiológica en el estudio realizado. Inicialmente se realizan 3 sesiones de diálisis de albúmina (MARS); no obstante, el paciente presenta deterioro analítico y clínico progresivo, por lo que se realiza trasplante hepático urgente. Como profilaxis previa al trasplante, el paciente recibió cobertura antibiótica con cefalosporina de tercera generación, teicoplanina y cotrimoxazol.
Durante las primeras 48h postrasplante desarrolla insuficiencia renal aguda que requiere hemodiálisis venovenosa continua, observándose además otros datos compatibles con malfunción primaria grave del injerto. En consecuencia se realiza retrasplante urgente, sin complicaciones inmediatas, y relativamente buena evolución posterior, sin necesidad de soporte renal y retirada progresiva de fármacos vasoactivos. Dado el elevado riesgo de micosis invasiva y de infecciones graves, el paciente continuó recibiendo antibioterapia de amplio espectro (imipenem y teicoplanina), y además cobertura antifúngica con caspofungina durante 14días, con reintroducción lenta de los inmunosupresores e incorporación tardía de los calcineurínicos.
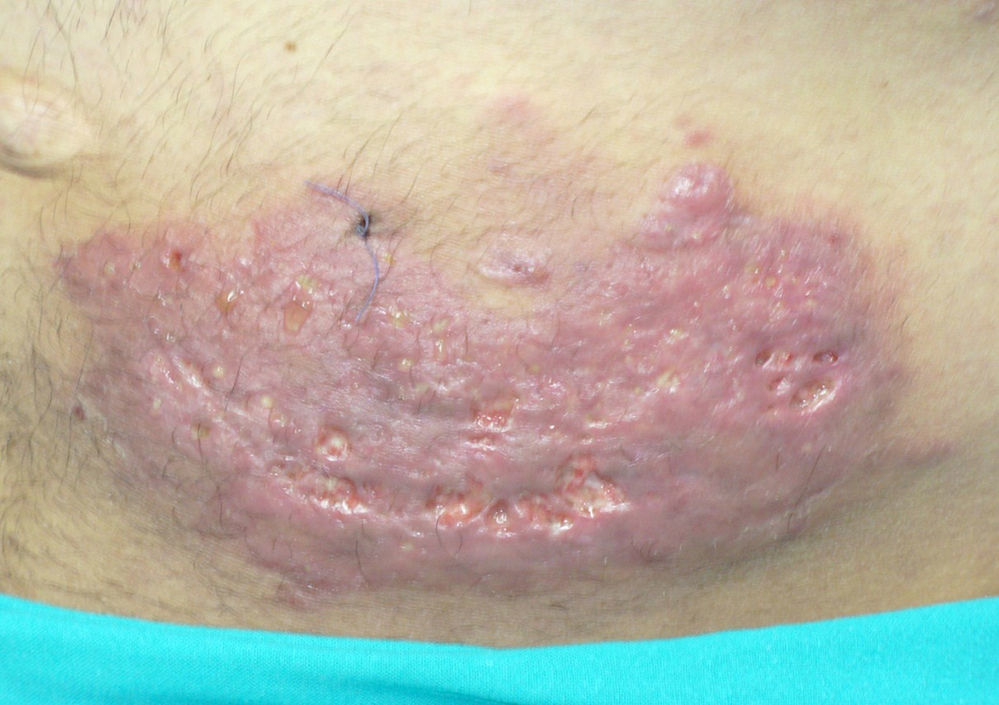
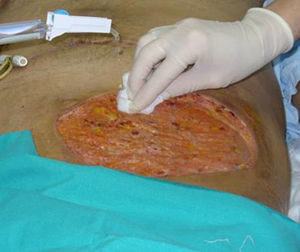
En las siguientes semanas el paciente presentó varias complicaciones, sobre todo infecciosas, destacando diarrea por Clostridium difficile, infección de la herida quirúrgica sin aislamientos en los cultivos y reactivación de citomegalovirus, con buena evolución tras completar el ciclo de tratamiento antibiótico y antiviral (el pautado previamente, completando 35días en total, asociando vancomicina oral por 14días y ganciclovir). Cinco semanas después de la cirugía observamos engrosamiento, eritema y endurecimiento de la pared abdominal localizado en el cuadrante inferior izquierdo, sugestivo de infección, sin respuesta a tratamiento antibiótico y curas locales (fig. 1). En muestras obtenidas se confirma infección por Mucor spp. en análisis tanto microbiológico como histológico.
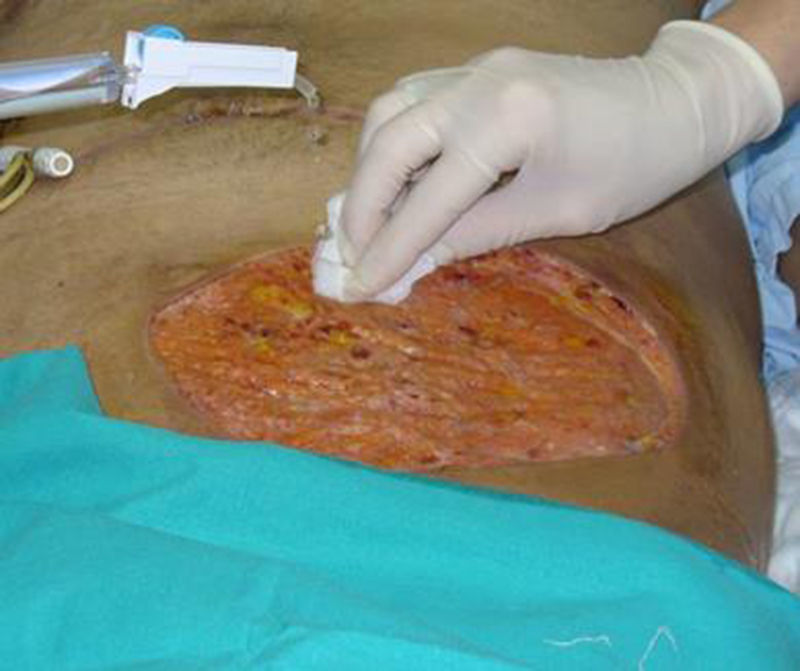
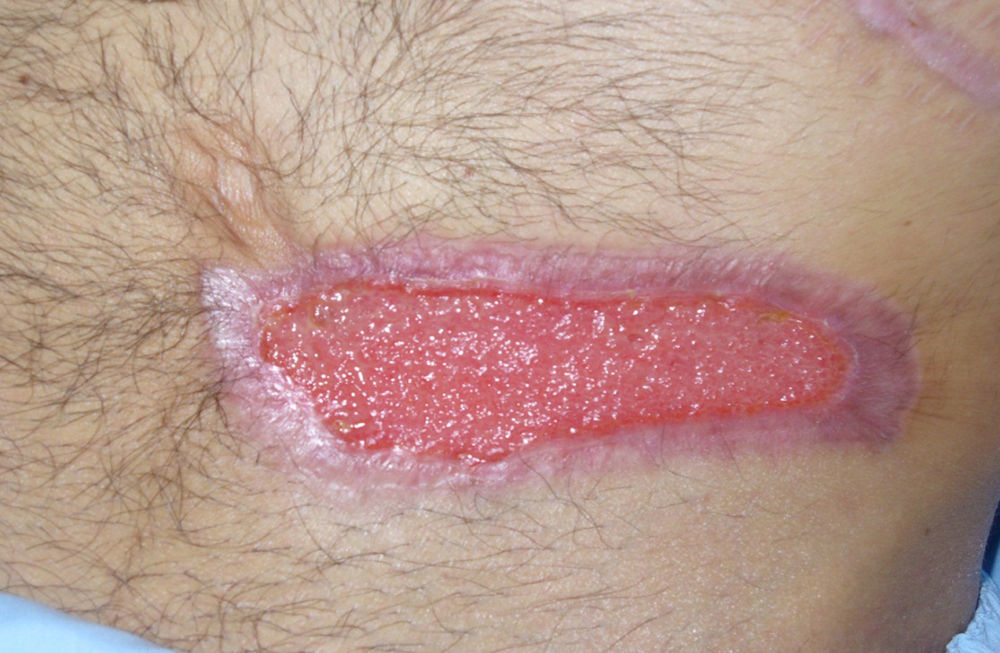
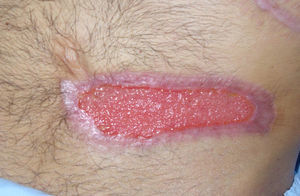
Por sospecha de infección fúngica se procede a administración de anfotericina liposomal a dosis elevada que se mantiene tras confirmar el diagnóstico completando 12días de tratamiento. Por mala respuesta iniciamos posaconazol bajo uso compasivo asociando desbridamiento quirúrgico con resección amplia de la pared abdominal (fig. 2). El paciente evoluciona favorablemente, sin desarrollo de invasión micótica de pared abdominal en profundidad, y con cicatrización de la herida quirúrgica por segunda intención tras 6semanas de tratamiento antifúngico y 4 sesiones de desbridamiento quirúrgico (fig. 3).
Comentario finalLa mucormicosis es una infección fúngica que abarca gran cantidad de síndromes clínicos que van desde infecciones superficiales de piel y partes blandas, rinosinusitis con o sin afectación cerebral (característica de paciente diabético) o afectación de diferentes órganos: pulmonar, gastrointestinal, cerebral y renal principalmente, hasta infección diseminada1-3.
Los hongos causantes de la infección pertenecen al orden Mucorales, dentro del que se pueden destacar los géneros Rhizopus, Mucor y Lichtheimia aislados con mayor frecuencia, habiéndose descrito también infecciones por los géneros Apophysomyces y Saksenaea, que, aunque mucho menos frecuentes, se caracterizan por producir infecciones rápidamente progresivas y en la mayoría de los casos letales4,5. Cada uno de estos géneros incluye numerosas especies difíciles de identificar plenamente sin recurrir a métodos moleculares, aunque todo laboratorio de micología de un centro de tercer nivel debe ser capaz de identificar los aislamientos a nivel de género y de realizar antifungigramas, especialmente si se sospechan infecciones graves6.
La gran mayoría de pacientes con mucormicosis presentan algún grado de inmunosupresión, siendo los factores de riesgo más conocidos las neoplasias (hematológicas o en menor medida las de órgano sólido), infección por VIH y/o sida, trasplante de órgano sólido y diabetes mellitus7,8. También se han descrito casos en pacientes no inmunodeprimidos con afectación de piel y partes blandas en el contexto de desastres naturales o heridas de guerra9.
Las infecciones de herida quirúrgica por hongos Mucorales son infrecuentes, siendo difícil estimar su incidencia, ya que la mayoría corresponden a casos aislados descritos en la literatura10. Casi todos de los pacientes presentan algún factor predisponente, que en general se relaciona con intervenciones quirúrgicas de gran complejidad, complicaciones infecciosas (relacionadas o no con la cirugía), tratamiento antibiótico/antifúngico de amplio espectro e inmunosupresión. Para el diagnóstico es necesario una sospecha clínica precoz, la realización de cultivos microbiológicos específicos para hongos y la demostración histológica de invasión tisular por las hifas, para diferenciar colonización o contaminación de infección verdadera10,11.
El pronóstico es bueno si el diagnóstico es precoz y no hay invasión fúngica en profundidad; de lo contrario, y dependiendo del grado de afectación, se asocia a una mortalidad de hasta el 55% en caso de afectación localizada, o entre el 80 y el 95% en caso de infección diseminada5.
En cuanto a la profilaxis de micosis invasiva en pacientes de alto riesgo, como los sometidos a trasplante de órganos sólidos o médula ósea, la caspofungina ha demostrado ser eficaz12,13. No obstante, se han descrito casos de fracaso de dicha profilaxis, lo que ha hecho revalorar su indicación en algunos pacientes de alto riesgo13. Nuestro paciente recibió tratamiento antibiótico de amplio espectro de forma prolongada y profilaxis antifúngica por 2semanas, y tras 21días de suspenderla se diagnostica la infección por Mucor sp.
El tratamiento antifúngico de elección, tanto empírico como dirigido, es la anfotericinaB (preferiblemente alguna presentación lipídica por su menor toxicidad). Las equinocandinas carecen de actividad in vitro frente a los Mucorales, por lo que no se recomienda su uso, aunque algunas especies de Rhyzopus expresan la diana terapéutica de las candinas y podrían tener algún papel en su tratamiento1,2. Dentro de los azoles, el posaconazol es el agente más activo, aunque debido a la escasa evidencia que respalda su uso para esta indicación se reserva para pacientes que no pueden recibir el tratamiento de primera elección. Hasta la fecha no hay evidencia que justifique el uso de tratamiento antifúngico combinado, que siempre debe ser supervisado por un experto5,6.
El otro pilar del tratamiento de estas infecciones es el desbridamiento quirúrgico, que debe realizarse frecuentemente hasta que la evolución clínica sea favorable y la infección se considere resuelta7.
Es imprescindible que todo paciente con sospecha de mucormicosis sea valorado por un equipo multidisciplinar con experiencia en el diagnóstico y tratamiento de infecciones fúngicas invasivas.
En nuestro caso cabe destacar que la falta de respuesta al tratamiento con anfotericina se debe probablemente a un tiempo corto de tratamiento y a la demora del inicio de desbridamiento quirúrgico asociado, lo que también explica la buena respuesta al tratamiento con posaconazol una vez realizado el tratamiento quirúrgico.