Mujer de 24 años de origen paraguayo, residente en España desde hace 6 años, con diagnóstico tardío de infección por VIH con toxoplasmosis cerebral, neumonía por Pneumocystis jiroveci, viremia por Cytomegalovirus y linfocitos CD4 12μl.
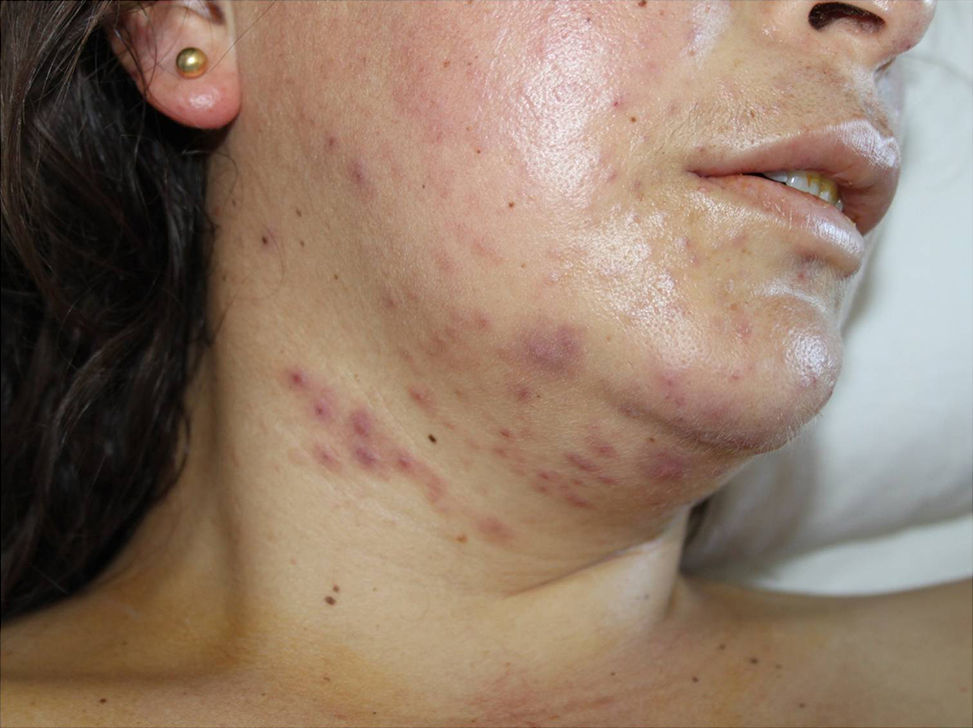
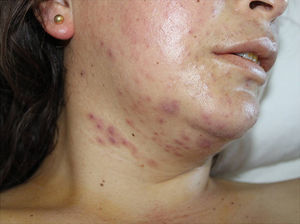
Con pirimetamina 75mg/día vía oral (vo), clindamicina 900mg/8h vía intravenosa (iv), primaquina 30mg/día vo (intolerancia digestiva a sulfamidas) y ganciclovir 300mg/12h iv, evolucionó clínica y radiológicamente de forma favorable, pero a la tercera semana presentó elevación de transaminasas con AST 890U/ml y ALT 1.360U/ml, seguida de reaparición de fiebre, erupción cutánea polimorfa consistente en pápulas, vesículas y nódulos, limitados a cara y región cervical (fig. 1), y pancitopenia progresiva. No se observaron lesiones mucosas.
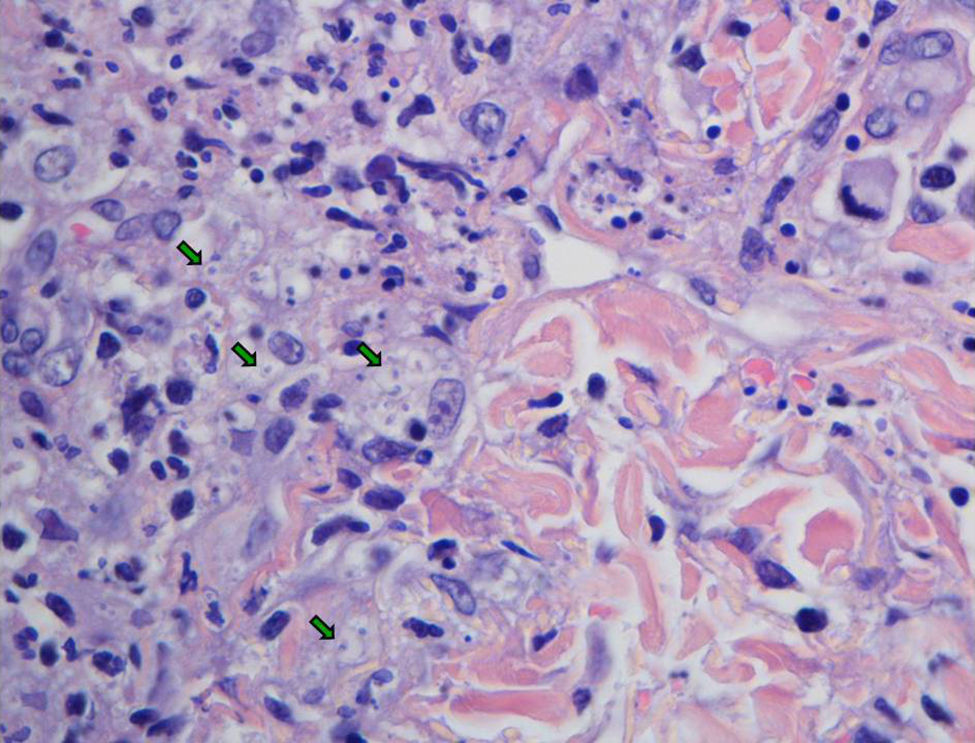
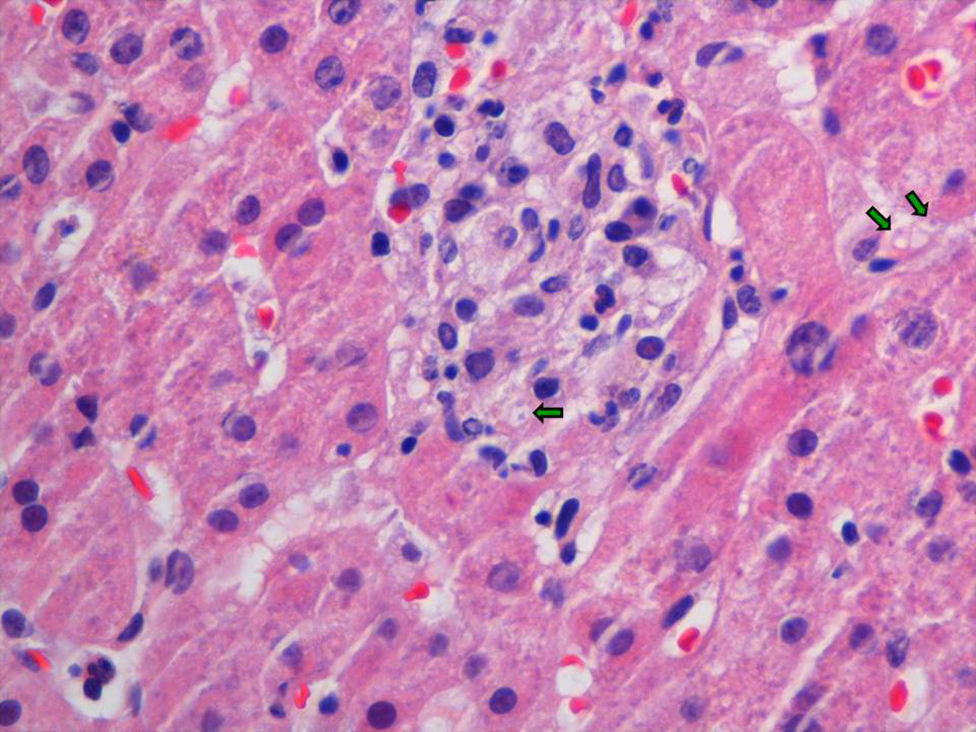
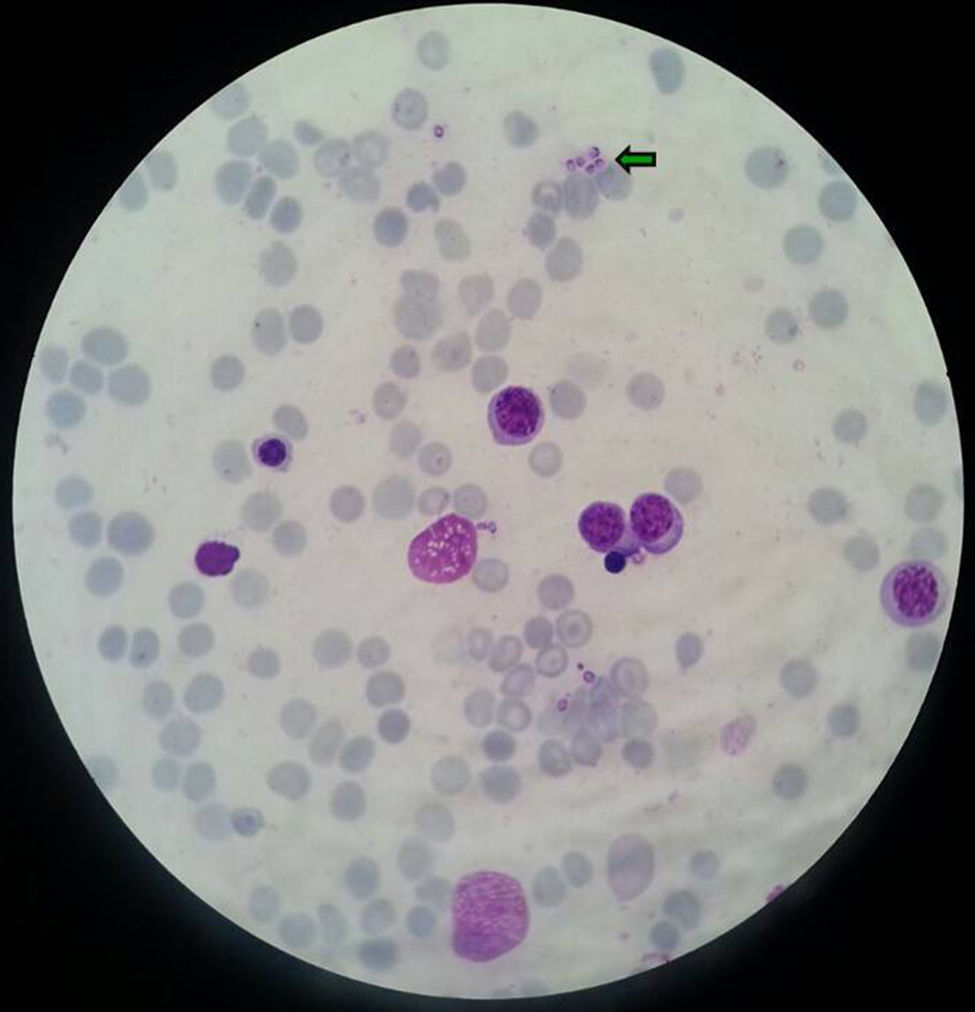
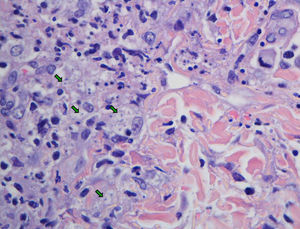
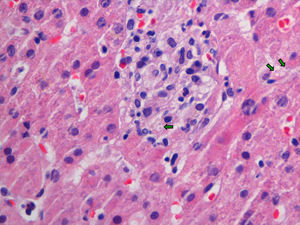
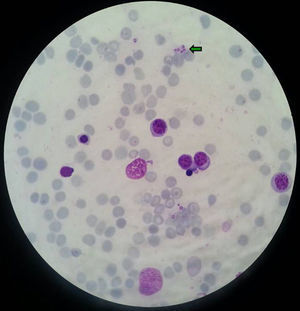
EvoluciónLos hemocultivos, antígeno criptocócico en suero y serología de sífilis, hepatitis B, C y micosis endémicas (Histoplasma capsulatum, Coccidioides immitis, Paracoccidioides y Blastomyces dermatitidis) fueron negativos. La TC abdominal solo mostró esplenomegalia de 14cm. Se realizó biopsia cutánea (fig. 2), hepática (fig. 3) y aspirado de médula ósea (fig. 4), donde se observó levaduras de pequeño tamaño (<5mm) con cápsula fina, compatibles con Histoplasma capsulatum, que creció en placas de agar BHI (brain heart infusión) al 5.° día.
La paciente completó 6 semanas de tratamiento anti-toxoplasma y 3 semanas de anti-Pneumocystis y continuó profilaxis secundaria con pirimetamina 50mg/día y atovaquona 5mg/12h. Se introdujo tratamiento antirretroviral con Truvada® (200mg de emtricitabina y 245mg de tenofovir) un comprimido/24h, darunavir 800mg/24h y ritonavir 100mg/24h e inició anfotericina B complejo lipídico 5mg/kg/día durante 15 días, con buena evolución, seguida de itraconazol oral 200 mg/12h durante 3 meses. Debido a problemas económicos de la paciente, continuó el tratamiento con anfotericina B complejo lipídico durante 13 meses (inicialmente 5mg/kg/semana iv 4 meses, seguido de 5mg/kg/mes durante 9 meses). En el momento de suspensión de la profilaxis secundaria la paciente había recibido 15 meses de TAR, los 6 últimos con CD4>150 células/μl.
DiagnósticoHistoplasmosis diseminada.
ComentarioHistoplasma capsulatum es un hongo dimórfico endémico desde el sur de Estados Unidos a América del Sur, que se comporta como un patógeno oportunista, causando enfermedad localizada pulmonar en pacientes VIH con CD4 altos, y enfermedad diseminada en pacientes con CD4<150 células/μl1. En zonas endémicas, la incidencia anual de histoplasmosis en pacientes con VIH sin tratamiento antirretroviral es del 5%, por lo que se debe considerar profilaxis primaria con itraconazol (200mg/día) hasta mantener CD4>150μl durante al menos 6 meses1.
En nuestra paciente, la primera manifestación clínica atribuible a la histoplasmosis fue una elevación de transaminasas más de 10 veces por encima del límite superior de la normalidad, que no era atribuible a hepatotoxicidad ni a otras causas habituales. La hepatitis como manifestación inicial de reactivación de histoplasmosis es excepcional, sin embargo, se han descrito casos en pacientes con infección por VIH o con otras causas de inmunosupresión celular2–4.
Las lesiones cutáneas se han descrito en el 10-15% de pacientes con histoplasmosis diseminada, y son más frecuentes en pacientes con sida. Las lesiones observables incluyen nódulos, pápulas, placas, úlceras, vesículas, pústulas, abscesos y dermatitis, y nuestro caso presentó la peculiaridad de que las lesiones aparecieron exclusivamente en el cuello y la cara a pesar de tratarse de una infección diseminada. En 2/3 de los pacientes se observa la afectación de las mucosas, sobre todo en el área de la orofaringe5. La serología de histoplasmosis no suele ser útil para el diagnóstico dada su baja sensibilidad en pacientes con inmunodeficiencia grave (como en nuestro caso, en que fue negativa) y la falta de especificidad en residentes en zonas endémicas1.
La administración de itraconazol a dosis de 400mg/día fue bien tolerada (sin toxicidad clínica y con normalización de enzimas hepáticos) a pesar de que la interacción con darunavir potenciado puede hacer que se incrementen los niveles plasmáticos de ambos fármacos (www.hiv-druginteractions.org), por lo que es recomendable monitorizar los niveles de itraconazol si esta técnica está disponible en el centro hospitalario.
AutoríasTodos los autores han contribuido intelectualmente en el trabajo, reúnen las condiciones de autoría, han aprobado la versión final del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.