Introducción
En la actualidad, el trasplante hepático (TH) se ha convertido en la mejor alternativa terapéutica en los pacientes con enfermedad hepática avanzada o terminal. En nuestro medio, la infección por el virus de la hepatitis C (VHC) y en menor frecuencia por el virus de la hepatitis B (VHB) son las causas más frecuentes de enfermedad hepática crónica en los pacientes candidatos a TH. La reinfección del injerto representa uno de los mayores problemas clínicos en el seguimiento de estos pacientes ya que la recurrencia de la enfermedad, ya sea de forma aguda o crónica, puede condicionar la pérdida del injerto o la muerte del paciente.
Virus de la hepatitis C y trasplante hepático
La infección crónica por el VHC es una situación habitual en España, de modo que se calcula que entre el 1-2% de la población está infectada por el VHC. Aunque sólo un pequeño porcentaje de estos pacientes desarrollará cirrosis y carcinoma hepatocelular (CHC), serán, en términos absolutos un número apreciable. Por otro lado, existe una elevada prevalencia de infección por el VHC en la población de pacientes afectados de cirrosis hepática y en los pacientes afectados de CHC (hasta el 75-80%) 1,2. Teniendo en cuenta estos antecedentes, la cirrosis hepática por el VHC constituye la indicación más frecuente de TH en los países de la Europa Occidental y en Estados Unidos 3, de modo que en muchos grupos representa alrededor del 30-50% de los casos.
Tras el TH, la recurrencia de la infección por el VHC, definida como la reaparición de la viremia, ocurre en la práctica totalidad de los casos y de forma inmediata. En este sentido, estudios recientes han demostrado que la viremia en el receptor disminuye inmediatamente después del explante y durante la fase de reperfusión del injerto, pero reaparece a las pocas horas del TH, alcanzando los niveles previos al TH hacia el cuarto día post-TH en la mayoría de casos y, con relación a la situación de inmunosupresión, superan las viremias existentes antes del mismo alcanzando una estabilización hacia el primer mes 4,5.
En la década de los años 1990, existía un pequeño grupo de pacientes que presentaban una infección de novo por VHC postrasplante. En algunos estudios, el riesgo de infección de novo estaba cifrado alrededor del 30% 6. La introducción de técnicas de cribado de sangre anti-VHC+ más sensibles (análisis de inmunoabsorción ligado a enzimas [ELISA] de segunda y tercera generación) que las que se utilizaban a inicios de los años 1990 ha convertido la infección de novo por el VHC en una situación anecdótica.
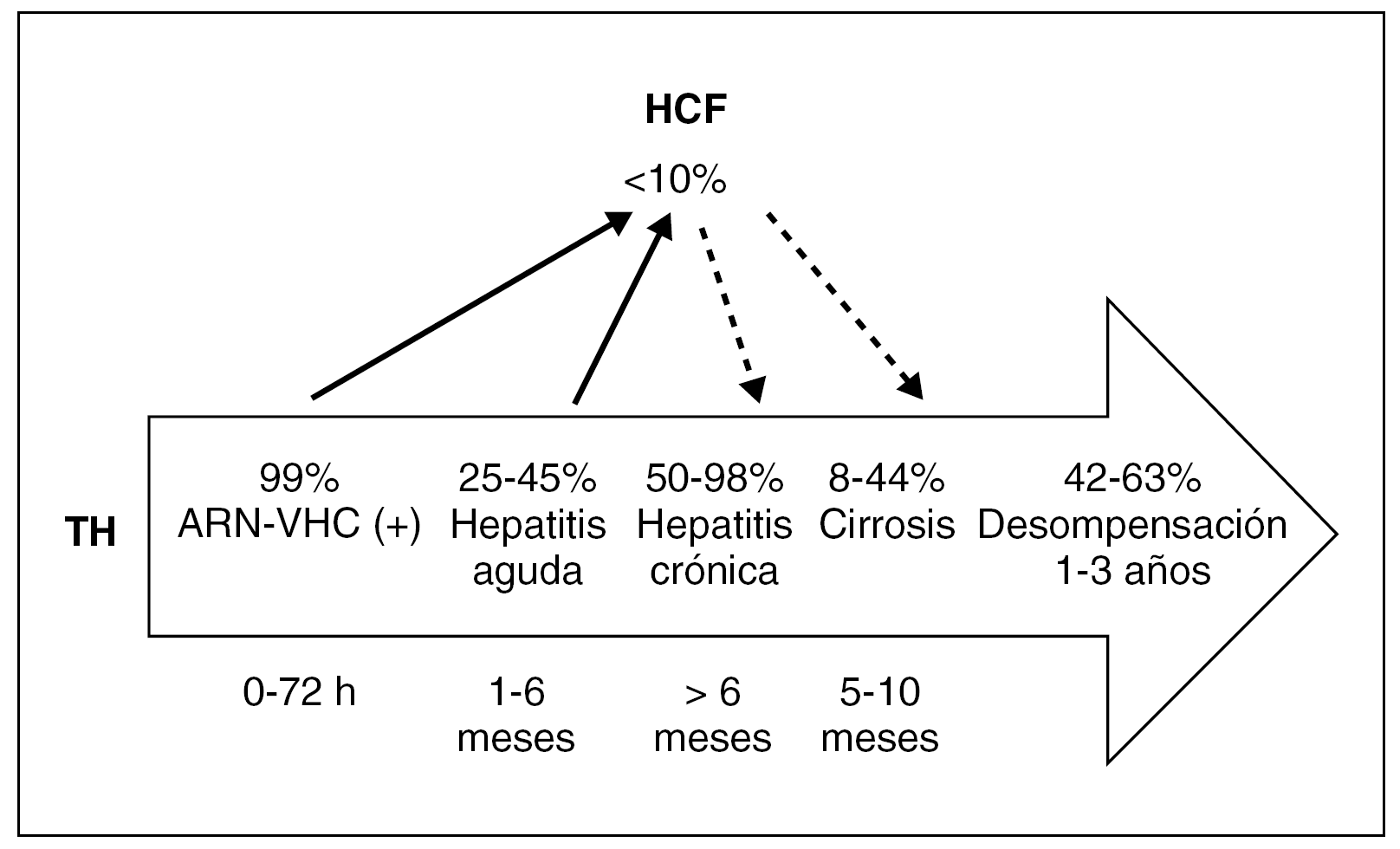
Pese a que la reinfección es universal, no todos los pacientes desarrollan lesiones histológicas significativas. En este sentido, la historia natural y la gravedad de la recurrencia es muy variable, pudiendo oscilar entre pacientes con un mínimo infiltrado inflamatorio, hasta pacientes que desarrollan lesiones agresivas con un elevado índice de actividad inflamatoria y un importante componente de fibrosis hepática que condiciona la aparición de una cirrosis hepática de forma precoz y que conducen a la pérdida del injerto en un breve plazo de tiempo (fig. 1). La hepatitis aguda por VHC en el injerto suele producirse en los primeros meses post-TH. El diagnóstico se establece ante la elevación persistente de la cifra de transaminasas y hallazgos histológicos característicos de hepatitis lobulillar, una vez descartadas otras causas de disfunción del injerto como pueden ser el rechazo agudo, lesiones por isquemia arterial, por obstrucción biliar o debidas a coinfecciones por otros virus hepatotropos (p. ej., citomegalovirus [CMV]). La incidencia de la hepatitis aguda por VHC post-TH varía según los estudios (dependiendo si se realizan o no biopsias protocolizadas), pero oscila entre el 25-45% de los casos 4,7, y algunos autores han sugerido que el desarrollo de una hepatitis aguda bioquímica o histológica puede ser un factor de riesgo para el desarrollo de formas más graves.
Figura 1. Evolución de la infección por el VHC postrasplante hepático. TH: trasplante hepático; HCF: hepatitis crónica fibrosante.
A pesar de la variabilidad de la evolución de la recurrencia del VHC post-TH, la mayoría de autores coinciden en que la reinfección por el VHC post-TH se asocia con una mayor agresividad que en los pacientes no inmunodeprimidos. Mientras que una tercera parte de los pacientes permanecen sin o con lesión hepática mínima a los 5 años post-TH, entre el 8-44% de los pacientes desarrollan una cirrosis hepática a los 5-7 años post-TH 8,9. Una vez la cirrosis está establecida, el riesgo de descompensación clínica es muy elevado a corto plazo (42% al año) lo que condiciona un mal pronóstico tanto del injerto como del paciente 10. Recientemente, algunos autores han sugerido que en los últimos años, y probablemente con relación a pautas de inmunosupresión más agresivas, las tasas de progresión de la enfermedad han aumentado 8. Por otro lado, entre el 5-10% de los pacientes, la recurrencia viral se presenta en forma de hepatitis colestásica que conlleva una evolución rápidamente progresiva hacia la insuficiencia hepática aguda y la pérdida del injerto y del paciente a corto plazo 11. Finalmente, estudios recientes 9 han mostrado una menor supervivencia de los pacientes trasplantados por cirrosis relacionada con infección crónica por el VHC frente a los trasplantados por cirrosis de otras etiologías. Todos estos hechos han convertido a la recurrencia por el VHC post-TH en el mayor problema clínico ante el que nos enfrentamos en el manejo diario de dichos pacientes.
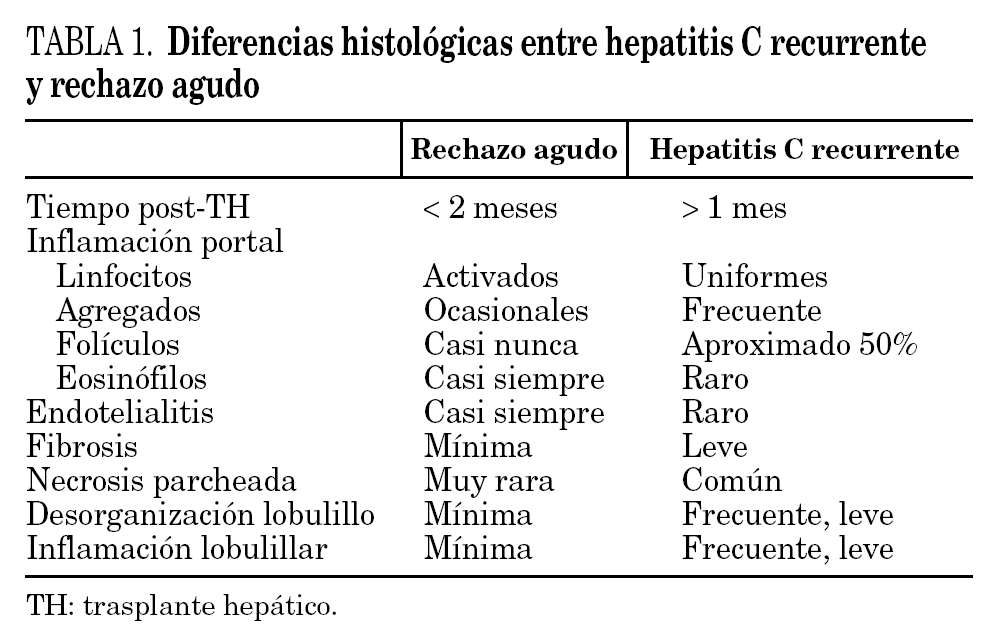
Por dicho motivo, ante todo paciente trasplantado por una enfermedad relacionada por el VHC, la aparición de una disfunción hepática, entre las 2 semanas y 6 meses postrasplante, debe hacernos sospechar una recidiva histológica en forma de hepatitis por VHC. Dado que la respuesta bioquímica hepática es monótona y no permite diferenciarlo de otros procesos, como por ejemplo del rechazo celular agudo, en la mayoría de casos será preciso la realización de una biopsia hepática para establecer un diagnóstico correcto y poder así ajustar la inmunosupresión. Desde un punto de vista histológico, la hepatitis C en pacientes trasplantados, es similar a la que se observa en inmunocompetentes con infiltrado mononuclear parenquimatoso y portal, necrosis acidofílica y hepatocitos tumefactos; también es frecuente la presencia de agregados linfoideos, cambios esteatósicos y lesión de conducto. No obstante, en ocasiones, pueden observarse lesiones como necrosis acidofílica con mínima inflamación que simulan procesos isquémicos o lesión ductal con proliferación colangiolar que simulan rechazo u obstrucción. Ello hace que, a veces, el diagnóstico diferencial sea difícil. Los datos patológicos que apoyan más una entidad que otra se muestran en la tabla 1.
Factores pronósticos en la evolución de la hepatitis C postrasplante
Se desconocen los motivos por los que la evolución de los pacientes es tan variable. En este sentido, se han intentado buscar aquellos factores pronósticos que puedan ayudar a predecir la evolución post-TH. Se han descrito un gran número de factores (tabla 2), algunos asociados al receptor (edad, raza, estado inmunológico, función renal y función hepática en el momento del TH), otros asociados al propio VHC (genotipo y carga viral), otros asociados al donante (edad, grado de esteatosis hepática, peso, donante vivo frente a cadáver) y finalmente factores asociados al manejo del paciente como pueden ser relacionados con el procedimiento quirúrgico (tiempo de preservación), el tipo y la intensidad del tratamiento inmunosupresor, o la coinfección con otros virus (p. ej., CMV). El análisis de todos estos condicionantes ha puesto de manifiesto que algunos de estos factores se relacionan claramente con una evolución más desfavorable. Entre estos destacan, el genotipo 1b del VHC, una carga viral elevada pre-TH así como en las fases más tempranas del post-TH, una mayor diversidad de las quasiespecies del VHC, la precocidad y la intensidad de la recidiva, la edad avanzada del donante, la coinfección por el CMV y la intensidad del tratamiento inmunosupresor. En relación con los fármacos inmunosupresores utilizados, la mayoría de estudios no han demostrado diferencias en la evolución histológica en pacientes tratados con ciclosporina frente a aquellos tratados con tacrolimus. Con relación a la utilización de los nuevos fármacos como el mofetil micofenolato y los anticuerpos antirreceptor de la interleucina 2, los resultados son controvertidos. Un hecho bien contrastado es que el grado de inmunosupresión representa uno de los factores más importantes en la progresión de la enfermedad. Así se ha demostrado que el tratamiento agresivo de los episodios de rechazo agudo con la utilización de bolos de esteroides y la utilización de anticuerpos antilinfocíticos está fuertemente asociado con una mayor agresividad de la recidiva viral. En relación con las nuevas pautas de inmunosupresión, algunos autores han sugerido que la utilización de protocolos de inmunosupresión más agresivos con estos nuevos fármacos, podrían ser, en parte, los responsables de una peor evolución de los pacientes trasplantados por VHC en los últimos años 4. Finalmente, y en relación con la importancia de la integridad del estado inmunológico del receptor, se ha demostrado que la presencia de una respuesta vigorosa y multiespecífica por parte de los linfocitos T del receptor frente a los antígenos virales es esencial para controlar o limitar la lesión histológica en el injerto 12.
Tratamiento de la infección por VHC después del trasplante
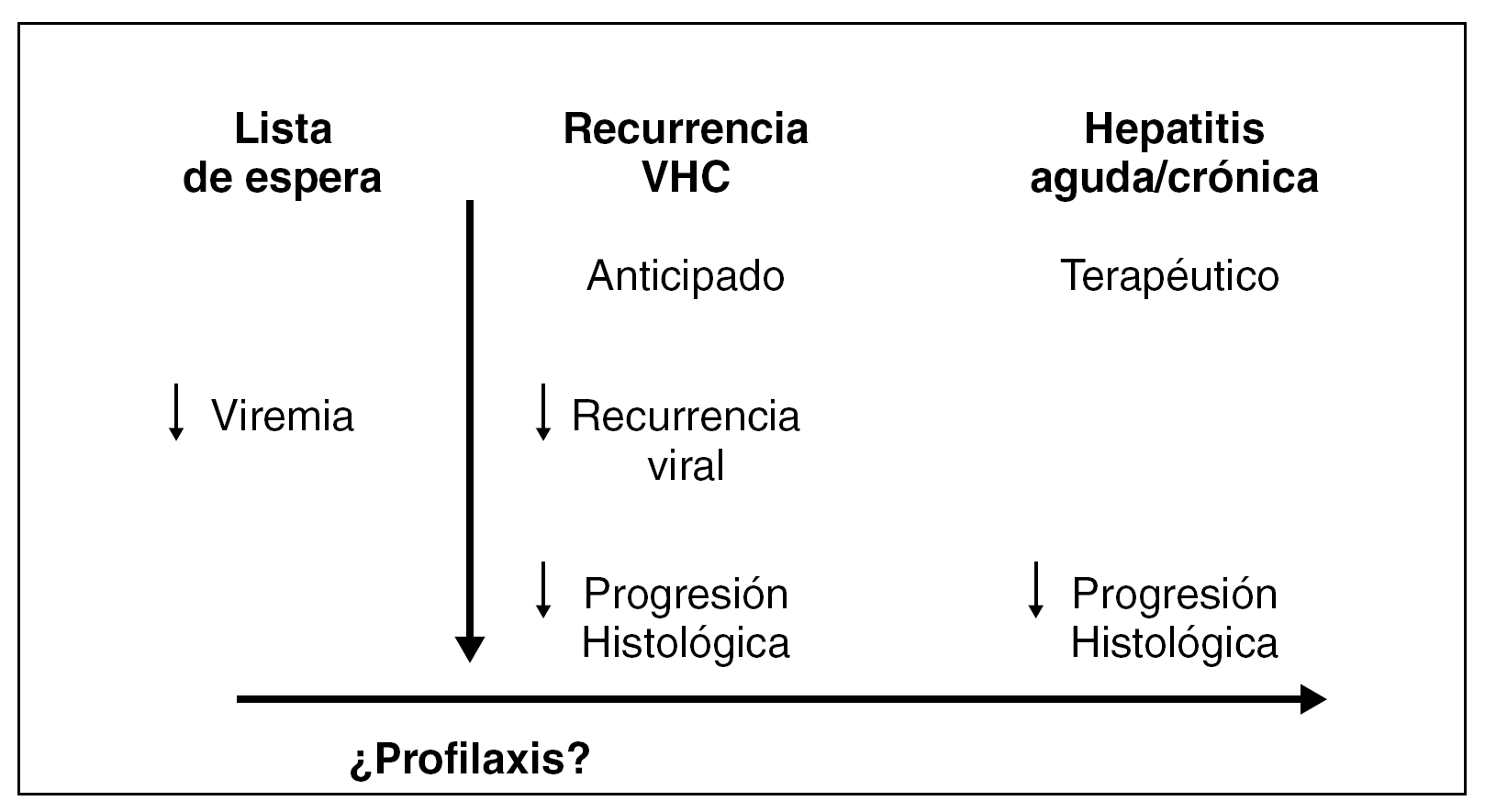
Para intentar minimizar la gravedad de la lesión histológica, se han propuesto diferentes estrategias en el manejo del paciente trasplantado por VHC (fig. 2). Éstas incluirían el tratamiento antiviral antes del TH; la utilización de tratamientos profilácticos, iniciados en el período peritrasplante y continuado en el post-TH; la utilización del denominado preemptive therapy (o tratamiento anticipado) en la fase precoz del post-TH antes de que se establezca la lesión histológica; o bien la realización de tratamiento antiviral una vez el paciente presenta una lesión histológica establecida.
Figura 2. Estrategias terapéuticas frente a la infección por el VHC en el trasplante hepático.
Tratamiento antiviral antes del TH
Con la intención de conseguir la negativización del ARN-VHC antes del TH, y por tanto evitar la reinfección del injerto de igual forma que sucede con el VHB, algunos autores han sugerido que dicha estrategia podría ser útil en la prevención de la reinfección post-TH. Los estudios publicados ponen de manifiesto que con el tratamiento combinado con interferón (IFN) y ribavirina, hasta el 30% de los pacientes consiguen llegar al momento del TH con viremias negativas 13,14. A pesar de ello, el llegar al TH con ARN-VHC negativo no asegura evitar la recurrencia. En este sentido, Forns et al 13 objetivaron que 3 de los 9 pacientes con respuesta virológica pre-TH (negativización del ARN-VHC), presentaron recurrencia de la infección en el injerto post-TH. Este hecho podría explicarse por la existencia de posibles viriones circulantes, o localizados en otros compartimentos, como sería las células periféricas del sistema monocítico o en la médula ósea, capaces de infectar el injerto. El gran inconveniente de dicha estrategia es la elevada tasa de efectos indeseados, lo que obliga a reducciones frecuentes de las dosis de IFN pegilado y ribavirina hasta en el 60% de los casos. Esta elevada tasa de efectos secundarios condiciona que el tratamiento antiviral combinado no sea aplicable a un gran número de pacientes en lista de espera con una cirrosis hepática descompensada. A pesar de dichas limitaciones, el tratamiento antiviral pre-TH puede ser una buena opción terapéutica en aquellos pacientes con buena función hepática (Child A con hepatocarcinoma) y con viremias bajas pre-TH, capaces de tolerar el tratamiento.
Tratamiento profiláctico
Denominamos tratamiento profiláctico a aquel que se inicia en la fase anhepática del TH y se continúa post-TH por un tiempo variable, con la intención de evitar la reinfección del injerto. La introducción de dicha estrategia en la profilaxis de la reinfección por el VHB representó un gran avance, con lo que las tasas de reinfección post-TH disminuyeron hasta alrededor del 10% y las tasas de supervivencia aumentaron de forma significativa. En relación al VHC, a pesar de que existen evidencias a nivel experimental que han sugerido que ésta podría ser una buena estrategia, los resultados obtenidos en estudios clínicos, no han podido demostrar su eficacia en la prevención de la reinfección del VHC post-TH 15.
Tratamiento anticipado o"preemptive therapy"
Los niveles de ARN-VHC presentan un marcado descenso en la fase anhepática, pero en las primeras semanas post-TH, los niveles de ARN-VHC vuelven a aumentar hasta niveles superiores a los previos al TH, llegando a un máximo entre el primer y tercer mes post-TH 5. De la misma forma que en los pacientes no inmunodeprimidos, una viremia baja previa a iniciar el tratamiento representa un factor predictivo de respuesta virológica, por lo que se ha sugerido que el iniciar el tratamiento antiviral en las primeras semanas post-TH (2-4 semanas), podría reducir la tasa de reinfección en el injerto o incluso en aquellos casos en los que no consiguiera negativizar el ARN-VHC, podría atenuar la lesión histológica o reducir la tasa de progresión de la enfermedad 16. Los estudios iniciales con IFN en monoterapia incluyeron pocos pacientes y presentaron resultados dispares. Mientras que Sheiner et al 17 objetivaron una menor incidencia de recurrencia histológica en los pacientes que realizaron tratamiento anticipado con IFN, en comparación con los que no lo realizaron; Singh et al 18, no consiguieron demostrar diferencias ni en la incidencia de la recurrencia histológica ni en la gravedad de la misma, objetivando únicamente que el tratamiento anticipado con IFN conseguía retrasar la aparición de la recurrencia histológica (193 días en los no tratados frente a 408 días en los tratados; p = 0,05). Mazzaferro et al 19 en un estudio no controlado que evaluaba la eficacia de un tratamiento combinado de IFN-a2b y ribavirina iniciado a las 3 semanas post-TH, consiguió una respuesta virológica sostenida (RVS) del 33%, con marcadas diferencias entre los pacientes infectados por genotipo 1 (20%) y aquellos infectados por genotipo no-1 (100%). Más recientemente, los nuevos IFN pegilados han sido utilizados en el tratamiento anticipado. Tanto en monoterapia como asociados a ribavirina se han conseguido tasas de RVS entre 15-22%. El gran inconveniente de la utilización del tratamiento anticipado es la elevada incidencia de efectos indeseados, especialmente anemia hemolítica, astenia, leucopenia y plaquetopenia, lo que junto con la situación clínica de los pacientes en el post-TH inmediato y el mayor riesgo de aparición de rechazo agudo en las primeras semanas post-TH, hace que su aplicabilidad oscile entre 50-60% de los casos 16.
Tratamiento de la hepatitis establecida
Los estudios iniciales con INF en monoterapia fueron desalentadores ya que los resultados descritos, fueron inferiores a los obtenidos en la población inmunocompetente. Por otro lado, la recidiva bioquímica era generalizada tras la retirada del tratamiento. Esta baja eficacia se relacionó con los elevados valores de viremia y la alta tasa de infección por el genotipo 1b del VHC (factores bien conocidos que se relacionan con una mala respuesta en los pacientes inmunocompetentes). Así mismo, estos estudios iniciales sugirieron que la utilización del IFN podría condicionar un aumento en el riesgo de desarrollar un rechazo agudo. En un intento de mejorar los resultados con IFN, algunos autores, basándose en el efecto antifibrótico del IFN, han sugerido el prolongar la duración del tratamiento o incluso iniciarlo en fase de hepatitis aguda pero con resultados escasos y en ocasiones asociados a elevadas tasas de rechazo agudo.
La introducción de la ribavirina (análogo de la guanosina), representó un avance importante en el tratamiento de la hepatitis C en inmunocompetentes. En la población de pacientes trasplantados, su utilización en monoterapia no ha demostrado ser útil, ya que a pesar de que se asocia con una respuesta bioquímica (normalización de transaminasas), no consigue modificaciones de la viremia ni consigue mejoras histológicas. La mejora de los resultados en la población inmunocompetente con la introducción del tratamiento combinado con IFN y ribavirina, condicionó su aplicación en los pacientes portadores de un TH. En un primer estudio piloto no aleatorio, Bizollon et al 20 evaluaron la eficacia y seguridad del tratamiento combinado con IFN-a2b (3 MU/tres veces por semana) y ribavirina (1.000 mg/día) durante 6 meses, seguido de ribavirina de mantenimiento en un grupo de 21 pacientes. Todos los pacientes normalizaron las transaminasas y el 50% negativizó el ARN-VHC al final de los 6 meses de tratamiento. Lo más novedoso e interesante de este estudio fue el hecho de que la mayoría de los pacientes que toleraron el tratamiento, presentaron mejoría histológica en las biopsias de control. Los mismos autores, después de seguir a 11 pacientes tratados que negativizaron el ARN-VHC tras 12 meses de tratamiento con ribavirina de mantenimiento, objetivaron que el 90% mantenían una respuesta virológica a los 3 años y con una marcada mejoría histológica 21. En los últimos años han sido publicados numerosos trabajos evaluando la eficacia del tratamiento combinado con IFN y ribavirina en la recidiva establecida por el VHC. En todos ellos, las tasas de RVS, oscilan entre el 9-33% 4,22-25. En estos estudios, la eficacia del tratamiento se confirma que es superior en los pacientes infectados por genotipos no-1 en comparación con los infectados por genotipo 1 24. Las causas que se han sugerido que pueden explicar estas bajas tasas de RVS son las elevadas viremias, la elevada prevalencia del genotipo 1 y la baja tolerabilidad al tratamiento que conlleva una elevada tasa de reducción de dosis y abandonos del tratamiento, debido al gran número de efectos adversos. En este sentido, Samuel et al 25 en un estudio aleatorizado de 52 pacientes que comparaba el tratamiento combinado (INF-a2b más ribavirina frente a placebo), consiguió una tasa de RVS del 21%, pero hasta en el 43% de los casos se tuvo que abandonar el tratamiento como consecuencia de efectos adversos, especialmente hematológicos. Otro factor que hay que tener en cuenta en esta población, es que muchos pacientes presentan un cierto grado de insuficiencia renal relacionada con el consumo de los diferentes fármacos anticalcineurínicos (ciclosporina A, tacrolimus), lo que conlleva una reducción del aclaramiento renal de la ribavirina, y por consiguiente ocasiona un mayor grado de hemólisis. Por dicho motivo, se aconseja iniciar la ribavirina en dosis de 600-800 mg/día y variar según el grado de función renal y anemia. A pesar de todo, se ha descrito que hasta en el 50% de los casos se requiere una reducción y/o abandono del tratamiento. Para intentar minimizar dichos efectos, la utilización de eritropoyetina o darbopoietina, puede mejorar la tolerabilidad a la ribavirina.
La llegada de los nuevos INF pegilados ha condicionado un gran avance en el tratamiento de los pacientes con hepatitis C, con un significativo incremento en la eficacia antiviral. Sobre la base de estos resultados, estas nuevas formulaciones se han empleado en el tratamiento de la recidiva viral post-TH. La mayoría de los estudios iniciales incluyen un escaso número de pacientes y en los que se describen unas tasas de RVS de entre el 13-66,7%, con una elevada tasa de efectos indeseados, especialmente a nivel de toxicidad medular (plaquetopenia y leucopenia) y depresión 26. En relación con el riesgo de rechazo agudo y/o crónico sugerido en los estudios iniciales con IFN convencional, los primeros estudios con INF pegilado no han confirmado dicho riesgo.
En la actualidad, se desconoce cuál debe ser el momento óptimo para empezar el tratamiento antiviral. Basándose en que el tratamiento de la hepatitis aguda en la población no trasplantada se asocia con una elevada tasas de RVS, y en un intento de limitar las secuelas de la lesión histológica, nuestro grupo realizó un estudio piloto de tratamiento combinado (INF-pegilado α2b más ribavirina) en la fase aguda de la reinfección por el VHC (genotipo 1b) post-TH 27. El diagnóstico de reinfección por VHC post-TH, se estableció ante la elevación persistente de las cifras de transaminasas, presencia de ARN-VHC positivo y evidencia histológica de hepatitis lobulillar, descartando otras causas de lesión histológica como rechazo agudo y/o crónico, lesión de preservación, lesión isquémica o de obstrucción biliar. El tratamiento se inició tras un tiempo medio, entre el TH y la recidiva histológica, de 3,8 meses (intervalo: 1,5-7 meses). Los resultados mostraron que tras evaluar 24 pacientes, el 62,5% presentaron una respuesta virológica precoz (descenso ≥ 2 log carga viral basal a la semana 12 del tratamiento) y hasta un 34,7% de los pacientes presentaron una respuesta virológica sostenida (negativización del ARN-VHC tras 24 semanas de finalizar el tratamiento). A pesar de que un elevado número de pacientes presentaron efectos secundarios (especialmente a nivel hematológico y controlados con factores hematopoyéticos) el tratamiento fue seguro con una baja tasa de abandono del tratamiento y con un bajo riesgo de desarrollo de rechazo hepático.
A pesar de que el tratamiento antiviral debe considerarse ante todo paciente con reinfección post-TH, las bajas tasas de RVS obtenidas, la elevada incidencia de efectos secundarios y el elevado coste económico, han condicionado que algunos autores sugieran delimitar posibles subgrupos de pacientes con elevado riesgo de desarrollar una rápida progresión histológica. A pesar de que se han descrito una serie de factores asociados a un mal pronóstico (elevada viremia pre-TH, recidiva precoz, infección por CMV, edad del donante avanzada, elevado número de bolos de esteroides), no existe ninguna combinación de factores capaz de diferenciar entre aquellos pacientes que desarrollarán una rápida y agresiva lesión histológica de aquellos que presentarán una evolución más benigna, por lo que en la actualidad no puede darse unas recomendaciones generales y deberá esperarse a la realización de estudios multicéntricos con un elevado número de pacientes para poder delimitar mejor aquel perfil de paciente susceptible de recibir el tratamiento antiviral.
Retrasplante
Uno de los problemas ante el que nos enfrentamos en la actualidad es el de decidir la idoneidad o no de indicar un retrasplante (re-TH) en aquellos pacientes que han desarrollado una recidiva del VHC post-TH en fase de cirrosis. Si tenemos en cuenta que en nuestro medio la infección crónica por el VHC representa alrededor del 30-50% de las indicaciones de TH y que hasta el 10-30% de los pacientes trasplantados por cirrosis por VHC, desarrollan a los 5-7 años post-TH una cirrosis hepática en el injerto, es de esperar que en los próximos años aumente de forma significativa el número de pacientes que requieran un segundo TH. Por dicho motivo se hace necesario el establecer criterios para seleccionar de la mejor manera posible aquel grupo de pacientes que puedan beneficiarse de un re-TH. En la actualidad, existe un intenso debate sobre si debe o no someterse a re-TH por recidiva del VHC. En general existe una cierta reticencia a la inclusión de dichos pacientes en lista de re-TH, especialmente si la recidiva es grave y precoz condicionando la pérdida del injerto en un breve período de tiempo (habitualmente en menos de un año). Este rechazo viene condicionado por una serie de factores, entre los que destacan: una mayor morbimortalidad postoperatoria entre los pacientes trasplantados por cirrosis VHC frente a aquellos retrasplantados por otras etiologías; edad avanzada de los pacientes, con existencia frecuente de factores de comorbilidad (p. ej., insuficiencia renal, diabetes mellitus); desconocimiento sobre la evolución de la hepatitis C recurrente sobre el segundo injerto y finalmente la escasez de órganos donantes frente al progresivo aumento de candidatos a un primer trasplante. En este sentido, cabe recordar que la mortalidad en lista de espera en la actualidad en nuestro medio es del 9-10%.
A pesar de todo, cuando se plantea el re-TH, estudios recientes demuestran que los resultados mejoran de forma significativa cuando se realiza antes de que aparezcan complicaciones infecciosas y especialmente insuficiencia renal. En este sentido, resulta muy ilustrativo el estudio de Berenguer et al 10 que intenta definir la historia natural de la reinfección por el VHC en el injerto, los factores predictores de descompensación clínica y re-TH y la tasa de mortalidad. En este estudio fueron evaluados 39 pacientes con una cirrosis compensada sobre el injerto y seguidos durante un año. Durante el seguimiento, el 46% de los pacientes presentaron un episodio de descompensación tras una media de 8 meses de seguimiento. La probabilidad acumulada de descompensación fue del 8, 17 y del 42% a 1, 6 y 12 meses, respectivamente, y las tasas de supervivencia del paciente una vez se presentó la descompensación fueron del 93, 61 y al 41% al mes, 6 meses y 12 meses respectivamente. Los factores que se asociaron con la presentación de descompensación, retrasplante o mortalidad fueron una elevada puntuación de la escala de Pugh-Child, unos niveles bajos de albúmina y un corto período de tiempo (inferior al año) ente el TH y el diagnóstico de la cirrosis hepática post-TH. La demostración de que una vez que la cirrosis en el injerto se descompensa condiciona un muy mal pronóstico a corto plazo, condiciona que si el re-TH se plantea, éste debe realizarse lo más precoz posible y antes de que aparezcan signos de insuficiencia hepática y/o deterioro de la función renal. A partir de estos datos, algunos autores aconsejan la realización de biopsias hepáticas periódicas, lo que permitiría realizar el diagnóstico de la cirrosis hepática en fase compensada y por tanto permitiría valorar la opción del re-TH en las mejores condiciones. Todos estos hechos condicionan que hoy por hoy, la decisión de retrasplantar a un paciente con cirrosis por VHC del injerto se realiza de forma individualizada, no habiéndose establecido una norma al respecto.
VHB y trasplante hepático
A pesar de que inicialmente la cirrosis hepática por el VHB era considerada como una indicación clara de TH, los resultados iniciales demostraron unas altas tasas de reinfección y pérdida de los injertos y una elevada mortalidad lo que condicionó que muchos centros consideraran la infección por el VHB como una contraindicación para el TH. En la actualidad, la mejor selección de los candidatos (pacientes en fase no replicativa), el uso indefinido de inmunoprofilaxis con inmunoglobulina hiperinmune antihepatitis B (HBIG) y la utilización de los nuevos fármacos antivirales han condicionado una mejora espectacular en el pronóstico de estos pacientes. En nuestro medio, la infección crónica por el VHB representa alrededor del 5-8% de las indicaciones de TH.
Mecanismos implicados en la reinfección del injerto
Se han propuesto tres mecanismos que explicarían la reinfección del injerto por el VHB. Por un lado la reinfección puede explicarse por la existencia de partículas virales circulantes durante o en el postrasplante inmediato; por la presencia de partículas del VHB procedentes de fuentes de replicación extrahepática, especialmente en las células mononucleares de sangre periférica, así como en células del páncreas o de la médula ósea. Por otro lado, la utilización de los fármacos inmunosupresores podría potenciar la existencia de una replicación del VHB residual. Aunque de forma mucho menos frecuente, los pacientes portadores de un TH pueden infectarse de novo por el VHB a partir de la reactivación de la infección latente en el receptor 28 o a partir de donantes sin marcadores serológicos de infección por el VHB pero con ADN-VHB positivo en suero y/o en el hígado. Así mismo, el TH de hígados procedentes de donantes antígeno de superficie de la hepatitis B (HBsAg) negativos y antihepatitis B del core (anti-HBc) positivos se ha relacionado con una elevada tasa de infección de novo (30-90%) 29-31. Este impacto negativo queda minimizado con la realización de profilaxis, ya sea con HBIG y/o con lamivudina, lo que permite la utilización segura de dichos injertos 32,33 que en nuestra área representa hasta el 15% de los donantes 31.
Importancia del estado de replicación viral pretrasplante
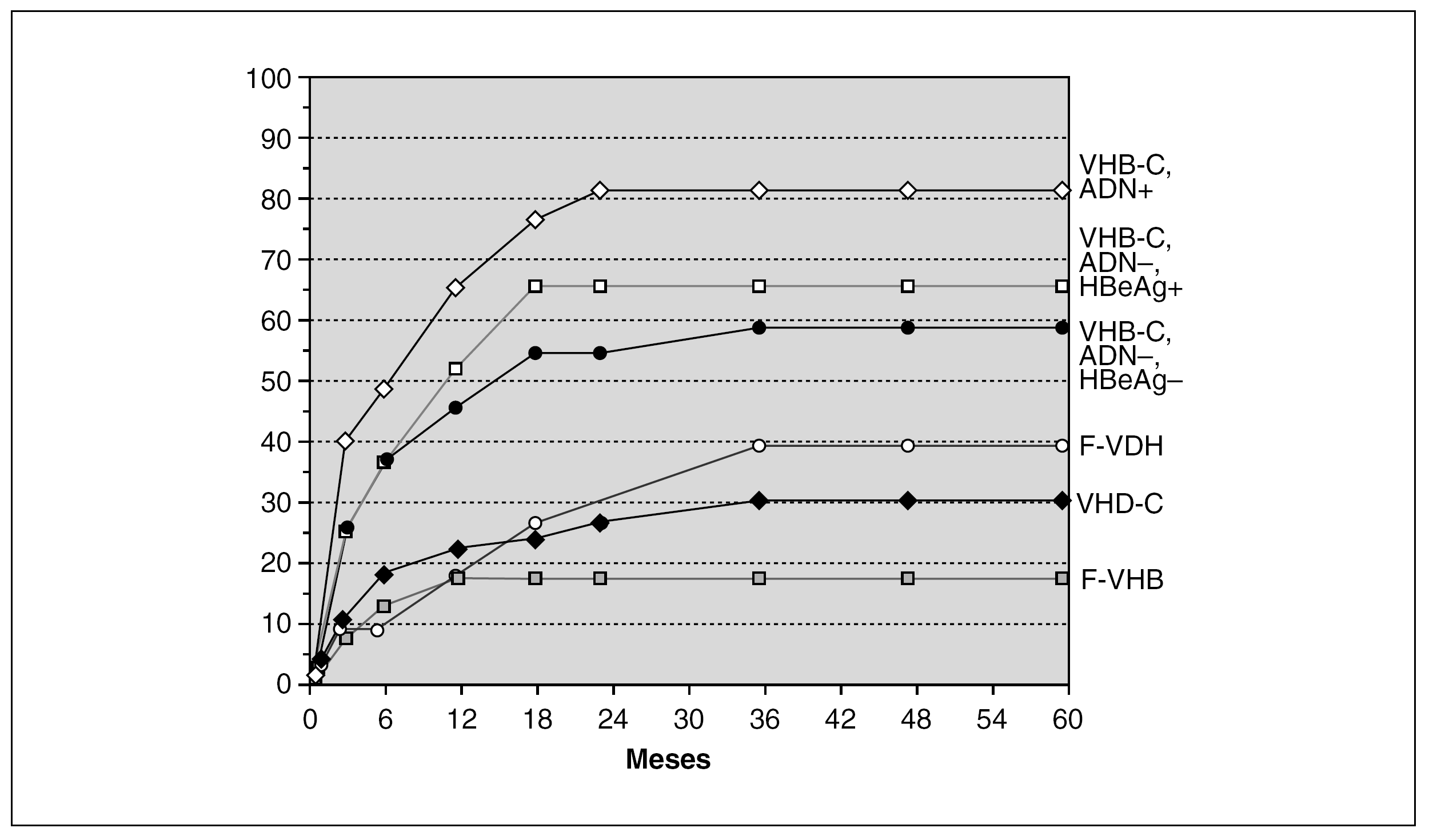
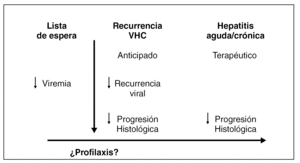
La experiencia acumulada por la mayoría de centros de trasplante hepático pone de manifiesto que el factor pronóstico más importante en la recurrencia del VHB en el injerto es el nivel de ADN-VHB previo al trasplante. En este sentido, Samuel et al 28 en un estudio multicéntrico Europeo en el que se incluyeron 372 pacientes trasplantados por cirrosis hepática por el VHB, encontraron unas tasas de recurrencia de la infección a los 3 años del 83% en los pacientes ADN-VHB y HBeAg (antígeno e de la hepatitis B) positivos; del 66% en los pacientes ADN-VHB negativos y HBeAg positivos y del 58% en los pacientes ADN-VHB y HBeAg negativos (p < 0,05) (fig. 3). El análisis multivariado demostró que la positividad para el HBeAg y el ADN-VHB fueron factores predictores independientes de la recurrencia de la infección. Por otro lado, aquellos pacientes trasplantados por una hepatitis fulminante por el VHB y en aquellos casos en los que existía una coinfección con el virus de la hepatitis delta presentaron unas tasas de recurrencia menores, probablemente debido a que la mayoría de estos pacientes presentan ADN-VHB negativo en el momento del trasplante (tabla 3).
Figura 3. Riesgo actuarial de recurrencia de la infección por VHB, según el estado replicativo y la etiología. (Samuel et al, N Engl J Med 1993) 28. F-VDH: hepatitis fulminante por el virus delta; F-VHB: hepatitis fulminante por el VHB.
Lesión del injerto por el VHB
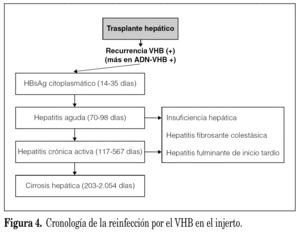
La reinfección por el VHB en el postrasplante puede cursar de forma muy variable. Habitualmente y después de la reaparición del HBsAg en el suero (entre 1-6 meses postrasplante), la mayoría de los pacientes presentan un episodio de hepatitis aguda que suele evolucionar de forma invariable y rápida hacia la cronicidad, de modo que puede reaparecer la cirrosis en el injerto en un período de 12 meses postrasplante. En ocasiones la reinfección por el VHB puede condicionar un curso fulminante a las pocas semanas de la hepatitis (fig. 4). La gravedad de las lesiones producidas por la reinfección por el VHB se han relacionado con la utilización de los fármacos inmunosupresores que condicionarían un aumento muy importante en la replicación viral. Este hecho se traduce en un aumento de los niveles de ADN-VHB y HBsAg en el suero así como de HBsAg y HBeAg en el citoplasma y de HBcAg en los núcleos de los hepatocitos. Las lesiones histológicas producidas por la reinfección del VHB en el injerto se caracterizan por una escasa actividad inflamatoria y por una gran tendencia hacia la fibrosis lo que explicaría la rápida evolución hacia la cronicidad. Davies et al 34 describieron una forma de presentación clínico-patológica caracterizada por una colestasis progresiva que condiciona una rápida evolución hacia la pérdida del injerto y a la que denominaron hepatitis colestásica fibrosante. Histológicamente se caracteriza por la presencia de una extensa fibrosis periportal con colestasis celular y canalicular y balonización de los hepatocitos, con escaso infiltrado inflamatorio a nivel portal y lobulillar. Asociado a estos hallazgos, y de forma característica, se detecta una marcada expresión citoplasmática del HBsAg y una expresión citoplasmática y nuclear del HBcAg y HBeAg variables, a diferencia de lo que ocurre en las formas no colestásicas. Clínicamente, los pacientes afectados de esta variedad clínico-patológica presentan una rápida evolución hacia la insuficiencia hepática (presentando de forma progresiva ictericia, encefalopatía hepática y descenso del tiempo de protrombina) falleciendo entre 4 y 6 semanas después del inicio del cuadro clínico. La utilización de los nuevos fármacos antivirales (lamivudina, adefovir dipivoxil) tanto en la profilaxis como en el tratamiento ha condicionado una disminución importante en la incidencia de estas formas agresivas.
Figura 4. Cronología de la reinfección por el VHB en el injerto.
En relación con los pacientes reinfectados a partir de donantes con anti-HBc positivos, la mayoría cursan de forma subclínica u oligosintomática y presentan un curso clínico y histológico mucho más benigno que el de los pacientes HBsAg positivos, de modo que al año postrasplante el 50% de los pacientes presentan cifras de transaminasas normales y hasta en el 85% de los casos la biopsia hepática muestra mínimos signos de actividad inflamatoria. A pesar de que la utilización de hígados procedentes de donantes anti-HBc positivos se relaciona con un riesgo de infección de novo por el VHB, la supervivencia de los pacientes según el estatus del anti-HBc del donante es similar entre los receptores de órganos anti-HBc positivo o negativos 35.
Existe un grupo de pacientes que presentan la mutación denominada precore en el genoma del VHB que condiciona la imposibilidad por parte del VHB de sintetizar el HBeAg a pesar de persistir la replicación viral. La infección por la mutante precore del VHB se ha relacionado con una menor tasa de respuesta al tratamiento con INF y en los pacientes portadores de trasplante hepático con un peor pronóstico al presentar una mayor probabilidad de desarrollar una hepatitis colestásica fibrosante 36.
Prevención de la reinfección del injerto por el VHB
Los primeros trabajos publicados ya pusieron de manifiesto que sin la utilización de medidas preventivas, el riesgo de reinfección del injerto postrasplante era del 80%37. Esto hizo que se empezaran a realizar estudios basados en la inmunización activa mediante la vacunación preoperatoria así como en la inmunización pasiva con la administración de inmunoglobulina antihepatitis B durante y en el postoperatorio. Los resultados de los estudios iniciales con la utilización de la HBIG, en el trasplante hepático, para evitar la reinfección por el VHB fueron desalentadores por la alta tasa de reaparición del HBsAg cercana al 80%, en el postrasplante inmediato. Estos malos resultados se relacionaron con las bajas dosis de HBIG administradas que resultaron insuficientes para neutralizar las partículas de HBsAg circulantes. Posteriormente, la utilización de altas dosis de HBIG y por un período de tiempo más prolongado lograron tasas de reinfección al año y a los 2 años del 17 y del 29%, respectivamente 28. Samuel et al 28, en el estudio multicéntrico Europeo objetivaron que la tasa de recurrencia de la infección por el VHB fue del 75% en los pacientes que no recibieron profilaxis o que recibieron HBIG durante un corto período de tiempo (< 2 meses) en comparación con el 33% (p < 0,001) en los pacientes que recibieron HBIG durante un período largo de tiempo (6 o más meses). El estudio multivariado demostró que la administración de HBIG durante un período largo de tiempo se asociaba, de forma significativa, con una menor tasa de recurrencia de la infección del injerto por el VHB y con una mayor supervivencia. En la práctica clínica la pauta de inmunoprofilaxis generalmente utilizada es la administración de HBIG vía intravenosa de forma aislada o en combinación con la administración vía intramuscular de forma periódica y indefinida con objeto de mantener niveles plasmáticos de anti-HBs superiores a 100 U/l. Se desconoce el mecanismo exacto por el que la HBIG actúa. Se postula que los anticuerpos contra el VHB podrían unirse a los viriones circulantes impidiendo la reinfección del injerto. Por otro lado, se ha sugerido que los anticuerpos podrían bloquear unos receptores específicos de la superficie de los hepatocitos. A pesar de la eficacia de la administración de HBIG, se ha descrito la aparición de mutaciones en el VHB, denominadas variantes de escape, en relación con la administración prolongada de HBIG (habitualmente a partir de los 6 meses) 38,39. Estos virus presentan alteraciones en la región para el gen S y se ha especulado que estarían inducidas o seleccionadas por la presión inmunológica ejercida por la HBIG sobre el VHB ya que en ocasiones dichas mutaciones revierten al retirar la administración de la HBIG.
La introducción de los nuevos fármacos análogos de los nucleósidos (especialmente la lamivudina) de forma aislada y/o en combinación con HBIG representó un avance crucial en la prevención de la reinfección viral post-TH. Si bien su utilización en monoterapia aporta una eficacia similar a la de la HBIG, su uso de forma indefinida se ha relacionado con una elevada tasa de aparición de mutaciones resistentes a la lamivudina (YMDD). Por dicho motivo, la mayoría de centros utilizan como pauta de profilaxis habitual la combinación de HBIG (ya sea i.v. o i.m.) con lamivudina de forma indefinida, con lo que se consiguen unas tasas de reinfección del injerto inferior al 10% 40. En la actualidad, se desconoce el tiempo exacto que debe mantenerse la profilaxis. Estudios recientes han demostrado que, a los 10 años del TH, hasta el 45% de los pacientes sin evidencia serológica ni histológica de recurrencia viral, presentan ADN-VHB positivo por reacción en cadena de la polimerasa (PCR), lo que apoyaría su utilización de forma indefinida 41. El principal inconveniente de la utilización de HBIG i.v. indefinida es su elevado coste económico, por lo que la demostración de la utilidad y seguridad de la forma i.m., representa una reducción de hasta el 50% del coste económico.
En los últimos años, y con la intención de reducir los costes, se han sugerido diferentes estrategias terapéuticas como la utilización de lamivudina en monoterapia en aquellos pacientes de bajo riesgo de reinfección (ADN-VHB negativo en el momento del TH) 42 que ha demostrado ser eficaz aunque el período de seguimiento es todavía escaso. Otra estrategia que se ha sugerido es la sustitución de la HBIG por la vacunación contra el VHB en pacientes sin evidencia de infección por el VHB (ADN-VHB negativos). Los estudios que han explorado esta estrategia han descrito resultados discrepantes 43,44 por lo que su uso no puede generalizarse.
Tratamiento
A pesar de la mejora que representó la utilización, en la profilaxis de la reinfección del injerto por el VHB, de altas dosis de HBIG todavía existe el 33% de pacientes en los que la reinfección no puede evitarse 28. El tratamiento de la reinfección del injerto por el VHB es dificultoso porque presentan viremias elevadas y una rápida evolución histológica. Cuando esto acontece, habitualmente se procede a la reducción de la inmunosupresión, especialmente los corticoides, y a iniciar el tratamiento antiviral lo antes posible. Los estudios iniciales basados en la administración de IFN tanto en el período pretrasplante como en el postrasplante pusieron de manifiesto su escasa utilidad así como un mayor riesgo de desarrollar rechazo del injerto. Como alternativas terapéuticas al IFN, los análogos de los nucleósidos, por su buena tolerancia y por su eficacia, se han convertido en el tratamiento de elección tanto en la profilaxis como en la recurrencia de la infección del injerto por el VHB. Dentro de este grupo de fármacos destacan el ganciclovir, el famciclovir y la lamivudina.
El ganciclovir (análogo sintético del 2'-deoxyguanosina) fue el primer análogo de los nucleósidos utilizado en el tratamiento de la recurrencia del VHB postrasplante. Gish et al 45 en un estudio piloto, después de tratar 9 pacientes con ganciclovir intravenoso durante un período de entre 3-10 meses, consiguieron una reducción media del 90% (rango: 42-100%) del ADN-VHB plasmático así como la negativización del ADN-VHB al final del tratamiento en 4/9 pacientes. Asimismo objetivaron una marcada reducción de las cifras de transaminasas y del índice de actividad inflamatoria en las biopsias hepáticas. Uno de los mayores inconvenientes del ganciclovir es la de la vía de administración ya que los estudios realizados hasta la actualidad en el tratamiento del VHB, únicamente han utilizado la vía intravenosa. El famciclovir posee una marcada capacidad in vitro para inhibir la actividad transcriptasa inversa de la polimerasa del ADN-VHB. Kruger et al 46, en un estudio multicéntrico Europeo y Australiano evidenciaron una disminución de hasta el 80% de los niveles de ADN-VHB. A pesar de su actividad, se han descrito mutaciones en el gen de la polimerasa del VHB asociadas a la administración de famciclovir durante largos períodos de tiempo.
La lamivudina, dada su gran actividad inhibitoria de la replicación del VHB al inhibir la transcriptasa inversa, su buena tolerancia y sus escasos efectos adversos, hacen que en la actualidad sea el análogo de los nucleósidos de elección. La experiencia con lamivudina es extensa y ha demostrado una marcada eficacia en la negativización del ADN-VHB 47,48. En el mayor estudio de tratamiento la recurrencia de la infección por VHB con lamivudina, hasta el 60% de los pacientes negativizaron el ADN-VHB, el 31% presentaron seroconversión del antígeno e y el 6% de los pacientes perdieron el HBsAg después de 52 semanas de tratamiento 47. En el mismo sentido, en los pacientes con hepatitis B de novo el tratamiento con lamivudina consigue la negativización del ADN-VHB en el 71,4% de los pacientes y seroconversión del antígeno e hasta en el 50% de los pacientes 35.
A pesar de su gran actividad y eficacia, el gran inconveniente del tratamiento a largo plazo es la aparición de mutaciones que confieren resistencia a la lamivudina entre el 14-62% de los pacientes 49. Si bien la aparición de dichas mutaciones conllevan la positivización del ADN-VHB y del HBsAg en el suero del paciente, esto no siempre se correlaciona con un deterioro desde el punto de vista clínico ni bioquímico por lo que la mayoría de autores aconsejan el mantener el tratamiento, aunque se han descrito pacientes que presentan un deterioro clínico significativo. En dicha situación, se aconseja el cambio o la introducción de nuevos fármacos antivirales activos frente a las cepas resistentes a lamivudina, como son adefovir dipivoxil, entecavir o tenofovir. Al igual que en los pacientes inmunocompetentes, tanto adefovir dipivoxil como tenofovir, se han mostrado eficaces en el tratamiento post-TH de la recurrencia por VHB con cepas resistentes a la lamivudina 50,51. Durante el tratamiento con adefovir dipivoxil, debe controlarse la función renal, ya que, por un lado pueden producirse ligeras elevaciones de las cifras de creatinina, especialmente con el uso de los inhibidores de la calcineurina, y por otro lado la dosificación de adefovir dipivoxil deberá ajustarse a la función renal. De forma ocasional se han descrito casos de resistencia al adefovir dipivoxil pero que son sensibles a la lamivudina.
Retrasplante hepático
La experiencia inicial adquirida tanto en Europa como en Estados Unidos de Norteamérica 28,52 pusieron de manifiesto que los resultados del retrasplante por la recidiva de la infección por el VHB eran desalentadores ya que la reinfección era casi constante y la recurrencia histológica se producía de forma más rápida y agresiva, condicionando una mortalidad del 85-95% lo que hacía que muchos centros lo desaconsejaban. La situación cambió cuando algunos autores demostraron que la utilización de altas dosis de HBIG, con el objetivo de mantener niveles de anti-HBs > 500 U/l, eran eficaces en la prevención de la reinfección del injerto consiguiendo buenas tasas de supervivencia tanto del injerto como de los pacientes 53. La utilización de los nuevos fármacos antivirales, conjuntamente con el tratamiento con HBIG a altas dosis, ha demostrado ser una excelente alternativa terapéutica que permite la realización del re-TH por recurrencia de la infección por el VHB de forma segura y eficaz 54,55.
Correspondencia: Dr. Ll. Castells.
Servei de Medicina Interna. Hospital General Universitari Vall d'Hebron.
P.º Vall Hebron, 129. 08035 Barcelona. España.
Correo electrónico: llcastells@vhebron.net
Manuscrito recibido el 3-1-2006; aceptado el 12-1-2006.