En los últimos años se ha observado un aumento de infecciones por hongos filamentosos distintos de Aspergillus. Hongos claros o hialohifomicetos, dematiáceos u oscuros, agentes de la mucormicosis y Pneumocystis jirovecii son en general hongos oportunistas emergentes que producen infección diseminada en pacientes con inmunodepresión severa. Las manifestaciones clínicas en este grupo de pacientes con frecuencia son escasas e inespecíficas debido a que su expresión semiológica se encuentra modificada por el propio cuadro o por los tratamientos concomitantes, lo que dificulta un diagnóstico precoz. Esto, unido a los relativamente escasos recursos terapéuticos con los que todavía contamos, hace que la infección fúngica invasora por estos hongos filamentosos se asocie a una mortalidad importante (30-100%). En la actualidad, la aparición de los nuevos triazoles y de la anfotericina B en formulación lipídica asociada en ocasiones a otros antifúngicos intenta cambiar el pronóstico fatídico de los pacientes con este tipo de infecciones.
An increase in infections by filamentous fungi other than Aspergillus has been observed in the last few years. Clear fungi or hyalohyphomycetes, dematiaceous or dark fungi, agents of mucormycosis, and Pneumocystis jirovecii are generally emerging opportunistic fungi that produce disseminated infection in patients with severe immunosuppression. The clinical manifestations in this group of patients are often non-specific as their expression is modified by the disease itself or by the concomitant treatments, which difficult early diagnosis. This, together with the relatively limited therapeutic resources available, has led to invasive fungal infections by these filamentous fungi being associated with significant mortality (30-100%). Nowadays with the emergence of the new triazole drugs or lipid formulations of amphotericin B, often combined with other antifungal drugs, attempts are being made to change the dire prognosis of patients with these infections.
En los últimos años se ha observado un aumento de la incidencia de infecciones por hongos filamentosos distintos de Aspergillus. Estos hongos patógenos menos frecuentes, pero importantes desde el punto de vista médico, han contribuido a un aumento de las tasas de morbilidad y de mortalidad de las infecciones fúngicas invasoras (IFI), sobre todo en pacientes inmunodeprimidos1–5. Esto puede ser debido a que en ocasiones existe dificultad para establecer un diagnóstico precoz, y en general evidencian una respuesta peor al tratamiento antifúngico, llegando en algunos casos a mostrarse clínicamente resistentes a todos los antifúngicos disponibles6–8.
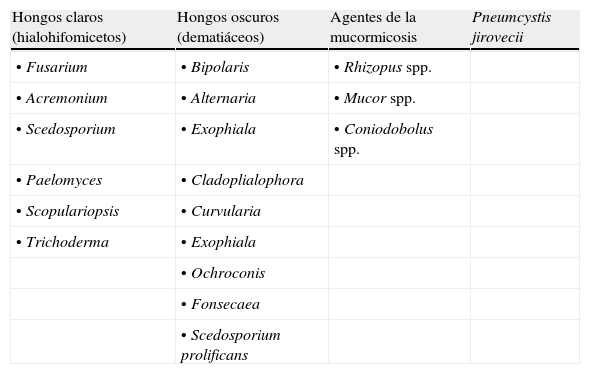
Vamos a clasificarlos como hongos claros o hialohifomicetos, dematiáceos u oscuros, agentes de la mucormicosis y Pneumcystis jirovecii (tabla 1).
Principales especies de hongos filamentosos no Aspergillus
| Hongos claros (hialohifomicetos) | Hongos oscuros (dematiáceos) | Agentes de la mucormicosis | Pneumcystis jirovecii |
| • Fusarium | • Bipolaris | • Rhizopus spp. | |
| • Acremonium | • Alternaria | • Mucor spp. | |
| • Scedosporium | • Exophiala | • Coniodobolus spp. | |
| • Paelomyces | • Cladoplialophora | ||
| • Scopulariopsis | • Curvularia | ||
| • Trichoderma | • Exophiala | ||
| • Ochroconis | |||
| • Fonsecaea | |||
| • Scedosporium prolificans |
Los hialohifomicetos son hongos filamentosos oportunistas que generalmente producen infección después de una exposición ambiental. En algunas series suponen casi el 30% de todas las infecciones por hongos filamentosos (aunque por lo general estas cifras incluyen otros hongos, como los agentes de la feohifomicosis y los agentes de las mucormicosis)8–11.
Las manifestaciones clínicas de la hialohifomicosis son de rango muy amplio, y van desde colonizaciones inocuas hasta enfermedades agudas invasoras. Se han publicado infecciones debidas a más de 30 especies distintas, entre las que destacan los géneros Fusarium, Scedosporium, Paelomyces, Trichoderma, Acremonium y Scopulariopsis. Beauveria, Chrysosporium y Geotrichum son otras causas de hialohifomicosis diseminada en pacientes inmunocomprometidos (tabla 2).
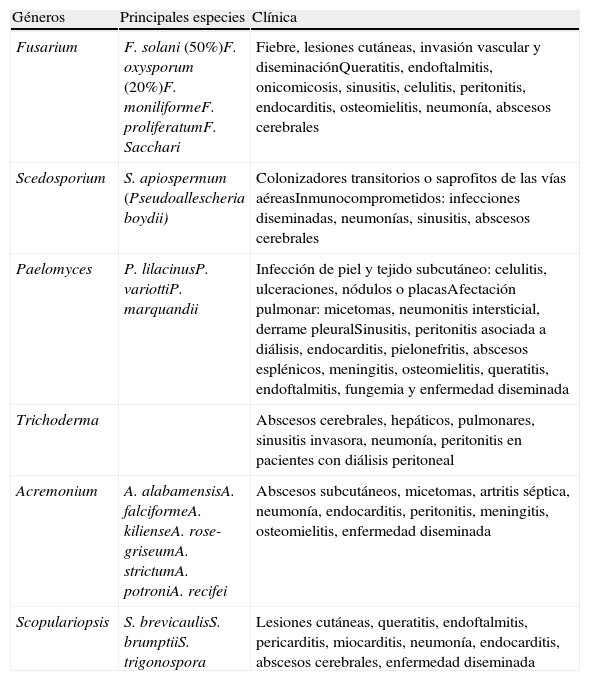
Manifestaciones clínicas de la infección por los principales hialohifomicetos
| Géneros | Principales especies | Clínica |
| Fusarium | F. solani (50%)F. oxysporum (20%)F. moniliformeF. proliferatumF. Sacchari | Fiebre, lesiones cutáneas, invasión vascular y diseminaciónQueratitis, endoftalmitis, onicomicosis, sinusitis, celulitis, peritonitis, endocarditis, osteomielitis, neumonía, abscesos cerebrales |
| Scedosporium | S. apiospermum (Pseudoallescheria boydii) | Colonizadores transitorios o saprofitos de las vías aéreasInmunocomprometidos: infecciones diseminadas, neumonías, sinusitis, abscesos cerebrales |
| Paelomyces | P. lilacinusP. variottiP. marquandii | Infección de piel y tejido subcutáneo: celulitis, ulceraciones, nódulos o placasAfectación pulmonar: micetomas, neumonitis intersticial, derrame pleuralSinusitis, peritonitis asociada a diálisis, endocarditis, pielonefritis, abscesos esplénicos, meningitis, osteomielitis, queratitis, endoftalmitis, fungemia y enfermedad diseminada |
| Trichoderma | Abscesos cerebrales, hepáticos, pulmonares, sinusitis invasora, neumonía, peritonitis en pacientes con diálisis peritoneal | |
| Acremonium | A. alabamensisA. falciformeA. kilienseA. rose-griseumA. strictumA. potroniA. recifei | Abscesos subcutáneos, micetomas, artritis séptica, neumonía, endocarditis, peritonitis, meningitis, osteomielitis, enfermedad diseminada |
| Scopulariopsis | S. brevicaulisS. brumptiiS. trigonospora | Lesiones cutáneas, queratitis, endoftalmitis, pericarditis, miocarditis, neumonía, endocarditis, abscesos cerebrales, enfermedad diseminada |
Los factores de predisposición más comúnmente asociados son: neutropenia prolongada (especialmente en pacientes con leucemia o trasplantados de progenitores hematopoyéticos [TPH]), terapia con corticoesteroides o quimioterapia citotóxica. El patrón típico es un paciente granulocitopénico que ha recibido un tratamiento prolongado con antibióticos de amplio espectro por fiebre de etiología desconocida12. También se ha observado una mayor incidencia de infecciones por estos hongos filamentosos en pacientes con trasplante de órganos sólidos (TOS), que en los trasplantados de pulmón pueden llegar a alcanzar una frecuencia del 20%13–17. Solé et al.15,16 confirman una frecuencia del 27% entre sus pacientes, con una mayor tendencia a la diseminación y mayor mortalidad.
Infecciones por FusariumEs la segunda causa de infecciones por hongos filamentosos tras Aspergillus. Se han identificado más de 50 especies de Fusarium, pero solamente unas 12 se asocian con infección en humanos. Fusarium (sobre todo F. incarnatum, F. moniliforme, F. oxysporum y F. solani) puede causar desde reacciones alérgicas a ser responsable de infecciones superficiales, subcutáneas o invasivas, tanto en pacientes inmunocompetentes como en inmunocomprometidos9,12,18. La especie aislada con mayor frecuencia es F. solani (50%), seguida de F. oxysporum (20%).
A semejanza de Aspergillus, puede ser angioinvasor, con formación de trombosis, infartos, hemorragias y con facilidad para la diseminación metastásica a distancia. Las formas invasoras se producen casi siempre en pacientes con importante deterioro de la respuesta inmunitaria (neutropenia profunda y alteración de la respuesta celular T), por lo que las especies del género Fusarium se han relacionado principalmente con procesos hematológicos9,18. La frecuencia con que Fusarium infecta pacientes neutropénicos va en aumento.
La característica distintiva de la fusariosis diseminada es la aparición de nódulos cutáneos purpúricos con un área de necrosis central. Por lo general, la biopsia de estos nódulos revela la presencia de hifas hialinas tabicadas con ramificaciones que invaden los vasos sanguíneos dérmicos. Los cultivos del material de biopsia y los hemocultivos (positivos en más del 75%) son de utilidad en el diagnóstico de la infección por Fusarium.
Clínicamente se manifiesta con fiebre y grandes lesiones cutáneas ulceradas que progresan a la necrosis. Esta apariencia complica la distinción de este hongo con Aspergillus. Sin embargo, a diferencia de la aspergilosis, los pacientes con fusariosis diseminada suelen tener hemocultivos positivos. La diseminación hematógena de Fusarium puede afectar a múltiples órganos, incluyendo senos nasales, pulmones, piel, cerebro, huesos y articulaciones. Las manifestaciones clínicas que puede producir son queratitis, endoftalmitis, onicomicosis, sinusitis, lesiones cutáneas y celulitis (dedos), peritonitis, endocarditis, osteomielitis, neumonía (o lesiones cavitadas pulmonares) o abscesos cerebrales. La presentación de la clínica depende de la puerta de entrada y de la intensidad y duración de la inmunosupresión. Fusarium también puede producir infecciones en individuos inmunocompetentes9,12,18–20. Estos pacientes suelen desarrollar una fusariosis después de un trauma, de una quemadura o de cirugía mayor.
El tratamiento óptimo de las formas invasivas de Fusarium no está bien establecido, formulaciones lipídicas de anfotericina B con o sin azoles (voriconazol y posaconazol) es lo que su utiliza más comúnmente. Hoy en día se recomiendan dosis altas de anfotericinas lipídicas (fundamentalmente en F. solanii y F. verticillioides) o voriconazol junto con la retirada de catéteres infectados y la resección del material necrótico9,18–22.
Infecciones por ScedosporiumEl género Scedosporium comprende 2 especies de importancia médica: S. apiospermum (y su forma teleomorfa Pseudoallescheria boydii) y S. prolificans. S. prolificans es un hongo dematiáceo y, por tanto, una causa de feohifomicosis10,11. S. apiospermum produce un 6% de formas invasoras, mientras que S. prolificans las ocasiona en casi un 50%23–25.
P. boydii y su forma asexual S. apiospermum producen un amplio espectro de manifestaciones clínicas. También hay que destacar su presencia como colonizadores transitorios de las vías aéreas o como colonizadores saprofitos en pacientes con bronquiectasias o lesiones cavitarias previas.
En pacientes inmunocomprometidos, S. apiospermun/P. boydii tiene una mayor tendencia a producir infecciones diseminadas, como neumonías, sinusitis y abscesos cerebrales10. En pacientes neutropénicos S. prolificans puede producir infecciones cutáneas y de heridas (lesiones cutáneas eritematosas con necrosis central), neumonías, infección osteoarticular, peritonitis, endoftalmitis e infecciones diseminadas con afectación pulmonar, renal o neurológica10,11,16,17,23,24.
El diagnóstico se basa en la sospecha clínica, la citopatología o la histopatología de las muestras y el aislamiento del hongo en un cultivo, con el apoyo ocasional de las técnicas moleculares.
El manejo de las infecciones por Scedosporium spp. se basa en la corrección de factores de base y la resección quirúrgica del material necrótico. El antifúngico recomendado es voriconazol, sobre todo en las infecciones por S. apiospermum. Scedosporium es resistente a la anfotericina B. El voriconazol y el posaconazol se han mostrado eficaces en el tratamiento de rescate de algunas de estas infecciones y pueden ser considerados como tratamiento de primera elección, asociado o no a terbinafina en casos de escedosporiasis por cepas pan-resistentes21,22. El uso de la inmunoterapia con factor estimulante de colonias e interferón se ha ensayado en algunos pacientes oncohematológicos10.
Infecciones por PaecilomycesLas especies principales de Paecilomyces son: P. lilacinus, P. variotti y P. marquandii. P. lilacinus ha ganado notoriedad, desde hace más de una década, como uno de los hongos capaces de causar queratitis fúngica en usuarios de lentes de contacto. Actualmente la infección invasiva debida a este organismo ocurre más frecuentemente en pacientes inmunocomprometidos. En estos se han descrito, sobre todo, infecciones de la piel y del tejido subcutáneo (celulitis, ulceraciones, nódulos eritematovioláceos con escara central, placas, nódulos supurativos y lesiones papulopustulares) y afectación pulmonar (micetomas, neumonitis intersticial, derrame pleural). También hay casos descritos de sinusitis, peritonitis (asociadas a diálisis), endocarditis, pielonefritis, abscesos esplénicos, meningitis, osteomielitis, queratitis, endoftalmitis, fungemia y enfermedad diseminada8,25–29.
Paecilomyces es resistente a la mayoría de los antifúngicos, incluida la anfotericina B. Hasta la aparición de los nuevos azoles las opciones terapéuticas eran escasas. Hoy en día, el voriconazol presenta buena actividad in vitro, y en varias series de casos clínicos ha mostrado una buena eficacia clínica. Pastor y Guarro26, en una revisión de 119 pacientes con infección por P. lilacinus describen la curación clínica en 4 de los 5 casos con afectación ocular y en los 3 pacientes con infecciones cutáneas o subcutáneas que recibieron tratamiento con voriconazol. El voriconazol también ha mostrado ser eficaz en casos de infección diseminada27. El posaconazol presenta una actividad in vitro comparable a la del voriconazol26,28. Sin embargo, hay que tener en cuenta que Paecilomyces puede ser resistente tanto in vitro como in vivo al voriconazol y al posaconazol, y que es obligatorio determinar la sensibilidad.
Infecciones por TrichodermaDurante bastante tiempo se consideraron contaminantes, aunque en la actualidad es un típico patógeno oportunista en pacientes inmunocomprometidos (neoplasias hematológicas, TPH, TOS) o en pacientes en diálisis peritoneal8,30–33. La fuente más probable de contaminación es la inhalación de aerosoles de agua no estéril. Se han identificado 5 especies de Trichoderma como patógeno para el hombre: T. longibrachiatum, T. harzianum, T. koningii, T. pseudokoningii y T. viride. T. longibrachiatum es la especie que se ha asociado más frecuentemente a infecciones invasivas.
Se han descrito casos de abscesos (cerebrales, hepáticos y pulmonares), sinusitis invasora, neumonía, estomatitis necrosante, peritonitis en pacientes en diálisis peritoneal y pacientes con infección diseminada. El diagnóstico puede realizarse mediante la observación en los tejidos de finas hifas hialinas septadas o por aislamiento en los cultivos de las muestras8,32,33. En el tratamiento se han utilizado los triazoles, la anfotericina B y asociaciones con caspofungina. Los resultados son diversos. Se aconseja siempre determinar la sensibilidad in vitro, aunque no siempre se correlaciona con la eficacia clínica.
Infecciones por AcremoniumAcremonium es un hongo saprofito ambiental que se encuentran en el suelo y en la vegetación en descomposición. Las puertas de entrada son la respiratoria y la digestiva.
Se han identificado diferentes especies, como A. alabamensis, A. falciforme, A. kiliense, A. rose-griseum, A. strictum, A. potroni y A. recifei.
Son causa muy infrecuente de abscesos subcutáneos, micetomas, artritis séptica, enfermedad pulmonar (neumonía), endocarditis, peritonitis, meningitis, osteomielitis y formas diseminadas en pacientes trasplantados (se han comunicado casos, sobre todo, en pacientes con trasplantes renal y cardiaco)8,34.
ScopulariopsisScopulariopsis brevicaulis, S. brumptii y S. trigonospora (anamorfo Microascus trigonosporus) son las especies de este género descritas como responsables de distintas infecciones en pacientes inmunocomprometidos.
Se han comunicado casos con lesiones cutáneas, queratitis y endoftalmitis, y casos más graves con pericarditis, miocarditis, neumonía, endocarditis, abscesos cerebrales y enfermedad diseminada, con una elevada mortalidad35.
Se ha descrito que Scopulariopsis es resistente a la anfotericina B, a la terbinafina y a los azoles. La cirugía asociada a combinaciones de antifúngicos se ha utilizado con distinto éxito35.
FeohifomicosisLas feohifomicosis constituyen un grupo de infecciones fúngicas caracterizadas por la presencia de hifas septadas dematiáceas (pared oscura, debido a la presencia de melanina en la pared de la célula vegetativa, en los conidios o en ambos), algunas veces de levaduras, o de la combinación de ambas estructuras morfológicas en los tejidos1,6,8,11,36,37. Pueden ser causadas por una gran variedad de hongos dematiáceos. Se han descrito más de 150 especies, de las que unos 70 géneros pueden producir enfermedad en el hombre (Bipolaris, Alternaria, Exophiala, Cladoplialophora, Curvularia, Ochroconis, Fonsecaea y el ya mencionado previamente S. prolificans)8,35,38,39. Este amplio grupo de hongos dematiáceos es heterogéneo en relación al espectro clínico de las infecciones que producen y su respuesta al tratamiento.
Son hongos ubicuos y se aíslan en el aire, en las plantas y en detritus orgánicos. Se adquieren por inhalación o por inoculación percutánea, y se han descrito brotes hospitalarios por contaminación de los sistemas de distribución de aguas y de diálisis8.
Constituyen un grupo importante de micosis oportunistas, con un aumento de su prevalencia. En pacientes inmunosuprimidos la incidencia es baja, aunque se ha publicado que puede llegar al 9% de todas las IFI en algunas series. Las formas clínicas predominantes son la sinusitis, la neumonía, los abscesos cerebrales y las formas diseminadas. Las especies asociadas a la forma diseminada son S. prolificans, Bipolaris, Curvularia y Exophiala. Se calcula que la mortalidad global está en torno al 18-57% (mayor en las formas cerebrales y diseminadas) y hasta del 7% en las formas localizadas de piel y ostearticulares6,38 (tabla 3).
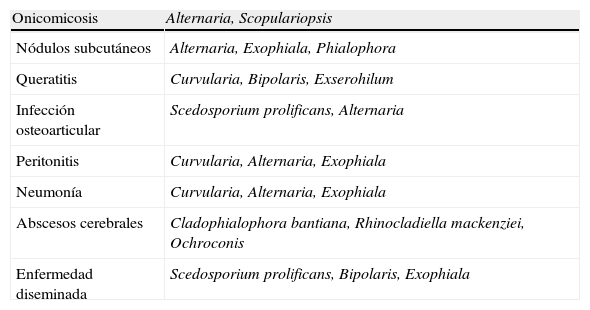
Feohifomicosis. Síndromes clínicos asociados
| Onicomicosis | Alternaria, Scopulariopsis |
| Nódulos subcutáneos | Alternaria, Exophiala, Phialophora |
| Queratitis | Curvularia, Bipolaris, Exserohilum |
| Infección osteoarticular | Scedosporium prolificans, Alternaria |
| Peritonitis | Curvularia, Alternaria, Exophiala |
| Neumonía | Curvularia, Alternaria, Exophiala |
| Abscesos cerebrales | Cladophialophora bantiana, Rhinocladiella mackenziei, Ochroconis |
| Enfermedad diseminada | Scedosporium prolificans, Bipolaris, Exophiala |
En pacientes inmucompetentes se presentan principalmente en zonas templadas (áreas endémicas tropicales: cromoblastomicosis y eumicetoma) y afectan con más frecuencia a hombres adultos del área rural. Pueden manifestarse de forma superficial, cutánea, subcutánea y sistémica, con lesiones que aparecen principalmente en áreas expuestas. Los pacientes con feohifomicosis subcutánea suelen referir un antecedente de traumatismo local o inoculación de material extraño, produciendo nódulos o quistes subcutáneos sin síntomas sistémicos y/o inflamación de tejidos blandos. Las lesiones crecen lentamente y con frecuencia son confundidas con granulomas producidos por cuerpos extraños, quistes de inclusión epidérmicos o quistes ganglionares. Suele ser una infección crónica, destructiva, con formación de fístulas. A veces la feohifomicosis se manifiesta como una enfermedad alérgica, infecciones corneales, sinusitis, infecciones osteoarticulares o formas sistémicas con afectación pulmonar y diseminación al sistema nervioso central (abscesos cerebrales), hígado, bazo o páncreas (como abscesos localizados)6,38.
Algunos dematiáceos parecen ser neurotrópicos, como Cladophialophora bantiana, Bipolaris spicifera, Exophiala dermatitidis, Ramichloridium obovoideum y Chaetomium atrobrunneum (tabla 2)29,37.
Actualmente se considera que S. prolificans es el principal agente causante de feohifomicosis sistémica, de grave pronóstico. S. prolificans produce infecciones diseminadas sobre todo en pacientes neutropénicos. También produce infecciones cutáneas y de heridas, neumonías, afección osteoarticular, peritonitis, endoftalmitis, afectación pulmonar, renal, neurológica y lesiones cutáneas eritematosas con necrosis central10,11,37. Los hemocultivos son positivos en el 70% de los casos de infección diseminada. La mortalidad global de esta complicación es del 47%, y la de la forma diseminada, del 88%38.
El tratamiento consiste en la administración de azoles (itraconazol) y cirugía en los casos de infección local. Se han descrito casos tratados con voriconazol o con itraconazol más terbinafina. In vitro, Scedosporium es resistente a la anfotericina, al ketoconazol y el miconazol, y la mayoría de los aislamientos también son resistentes al fluconazol y al itraconazol21,22,29.
Agentes de la mucormicosis (zigomicosis)Zigomicosis o mucormicosis son términos que con frecuencia se intercambian en la literatura médica para referirse a un grupo de infecciones fúngicas con frecuencia letales que tienen predilección por afectar a pacientes diabéticos o que reciben tratamiento con esteroides, o a otros pacientes muy inmunodeprimidos, como los son los receptores de TPH. Los zigomicetos son hongos que pertenecen al orden de los Mucorales. Son ubicuos en el suelo y en la vegetación en proceso de descomposición. La infección se adquiere por inhalación (senos paranasales, pulmón), por ingestión o por contaminación de heridas por esporangiosporas presentes en el entorno. Los agentes de la mucormicosis son patógenos angioinvasores y producen necrosis hemorrágica, trombosis vascular e infartos en los tejidos3,35,38-40 (tabla 4).
Factores que hacen sospechar un diagnóstico de mucormicosis frente a aspergilosis
| Factores epidemiológicos y factores del huésped |
| • Altas tasas institucionales de mucormicosis |
| • Sobrecarga de hierro |
| • Hiperglucemia (con o sin diabetes mellitus) |
| • Tratamiento previo con voriconazol o equinocandinas. |
| Factores clínicos, analíticos o radiológicos |
| • Sinusitis adquirida en la comunidad |
| • Lesiones necróticas en paladar duro o cornetes nasales |
| • Celulitis de pared torácica adyacente a infarto pulmonar |
| • Evento vascular agudo (infarto de miocardio, hemorragia digestiva…) |
| • Presencia de más de diez nódulos pulmonares con derrame pleural |
| • Signo del halo en radiografía simple o TC |
| • Sospecha de neumonía fúngica (TC) con mala respuesta a niveles adecuados de voriconazol |
| • Sospecha de neumonía fúngica (por criterios radiológicos) con galactomanano y G-glucano repetidamente negativos |
TC: tomografía computarizada.
Adaptada de Kontoyiannis y Lewis43.
En el momento actual se considera una infección fúngica emergente. En los últimos años se ha dado un aparente aumento en la incidencia de infección por mucorales en algunos centros que se ha atribuido al incremento en el uso de voriconazol41, aunque este hecho es controvertido. Las formas clínicas clásicas de la infección son las afectaciones rinocerebral y orbitaria, cutánea, pulmonar y gastrointestinal. En pacientes inmunosuprimidos las formas predominantes, en orden de frecuencia, son la pulmonar en el 50% de los casos (infección primaria o como parte de la enfermedad diseminada), la rinosinuorbitaria, la cutánea, la rinocerebral diseminada, la gastrointestinal y la renal. En este grupo de pacientes el agente predominante suele ser Rhizopus spp. (Leichteimia spp. parece más implicado en las formas pulmonares tras la diseminación)41,42.
El tratamiento de la zigomicosis descansa en 3 pilares básicos: precocidad en el diagnóstico y tratamiento, corrección de factores predisponentes, y tratamiento combinado médico-quirúrgico (tabla 5)42,43. El tratamiento antifúngico de elección es la anfotericina B en formulación lipídica administrada de forma precoz a dosis ≥5mg/kg/día44. Hay una mínima evidencia de que el uso combinado de caspofungina con anfotericinas B en complejo lipídico muestra sinergismo in vitro y ha sido eficaz en algún caso clínico45. El empleo de posaconazol se ha mostrado eficaz en el tratamiento de rescate46. La asociación con deferasirox, un quelante del hierro de gran afinidad, se ha mostrado eficaz en algunos casos47 (tabla 6).
Factores de riesgo de desarrollo de infecciones fúngicas invasoras por zigomicetos
| • Diabetes (especialmente cetoacidosis o mal controlada) |
| • Neutropenia |
| • Uso de corticoides |
| • Trasplante de progenitores hematopoyéticos |
| • Trasplante de órgano sólido |
| • Infección por VIH |
| • Tratamiento con hierro o quelantes de hierro |
| • Uso de drogas |
| • Solución de continuidad en piel o tejidos blandos (heridas, quemaduras…) |
| • Prematuridad |
| • Desnutrición |
| • Enfermedad neoplásica (especialmente hematológica) |
| • Profilaxis prolongada con voriconazol |
Adaptada de Cornely40.
Tratamiento de las principales infecciones fungicas por hongos filamentosos no Aspergillus
| Tratamiento | |
| Hialohifomicetos | |
| Fusarium | • Dosis altas de formulaciones lipídicas de anfotericina B y/o azoles (voriconazol o posaconazol)• Retirada de catéteres infectados y desbridamiento de tejido necrótico |
| Scedosporium | • Voriconazol• Posaconazol |
| Paecylomyces | • Voriconazol• Posaconazol |
| Trichoderma | • Triazoles, anfoterina B |
| Feohifomicosis | • Anfotericina B• Azoles• Cirugía si existe infección local |
| Zigomicosis | • Formulaciones lipídicas de anfotericina B (posible beneficio de la asociación a caspofungina)• Posaconazol• Puede ser eficaz la asociación de Deferasirox |
| Pneumcystis jirovecii | • Trimetroprim-sulfametoxazol• Pentamidina, clindamicina, atovaquona• Valorar la asociación de prednisona según la gravedad del cuadro |
Inicialmente Pneumocystis fue considerado un protozoo basándose en criterios morfológicos y en la respuesta a los fármacos antiprotozoarios. Hoy en día, todos los análisis filogenéticos recientes apuntan a incluirlo dentro de los hongos. Sin embargo, presenta rasgos «fúngicos» atípicos, ya que no crece en medios de cultivo, responde clínicamente a antiparasitarios como la pentamidina o el cotrimoxazol, y su membrana contiene colesterol en lugar de ergosterol. Las especies se clasifican en la actualidad en el filo Ascomycota, en la única clase Pneumocystidomycetes, orden Pneumocystidales y familia Pneumocystidacae48.
P. jirovecii es la especie que causa infección en los humanos. Presenta una distribución mundial. La mayoría de las personas se infectan en la infancia. Estudios serológicos sugieren que el 90% de los niños adquieren anticuerpos entre los 2 y los 4 años. Tiene predilección por determinados grupos de población. Pacientes con infección por el VIH (no necesariamente con neumonía), con neumopatías crónicas, personal sanitario y, ocasionalmente, embarazadas pueden estar colonizados (estado de portador) y podrían actuar como reservorio y potencial fuente de transmisión. Aunque inicialmente se pensó que la enfermedad por Pneumocystis se producía tras la reactivación de una infección latente (adquirida en la infancia o siendo previamente colonizado en otros escenarios) en una situación de inmunodepresión, los estudios más recientes avalan la posibilidad de nuevas reinfecciones, siendo la vía aérea el mecanismo principal de transmisión.
P. jirovecii tiene tropismo por el pulmón, de ahí que la neumonía sea la manifestación clínica más frecuente. Sin tratamiento, esta neumonía puede causar la muerte hasta en el 40% de los casos, especialmente en pacientes muy inmunocomprometidos (TPH, TOS, pacientes que reciben inmunosupresores para el tratamiento de neoplasias o enfermedades autoinmunes). Este grupo de pacientes pueden tener un curso más agudo que los pacientes con infección por VIH, aunque no está claro si es debido o no la presencia de otras infecciones (citomegalovirus) u otras medicaciones concomitantes48–50.
El diagnóstico de infección por P. jirovecii sigue siendo difícil, ya que la mayoría de las veces no hay signos ni síntomas específicos. Desde el punto de vista microbiológico se basa en el estudio microscópico del material clínico con tinciones convencionales, inmunofluorescencia con anticuerpos monoclonales y, en su caso, técnicas de diagnóstico molecular48–50.
El cotrimoxazol es el fármaco de elección para la profilaxis y el tratamiento de cualquier forma o gravedad de la neumonía por Pneumocystis. La pentamidina, la clindamicina y la atovaquona se pueden utilizar como tratamiento alternativo50. Se debe valorar la asociación de prednisona según la gravedad del cuadro.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.