La relevancia de la tuberculosis en los pacientes receptores de un trasplante de órgano sólido viene dada por las dificultades en su diagnóstico que condicionan un retraso en el inicio del tratamiento médico, así como por la toxicidad farmacológica asociada. Todo esto conduce a un gran número de complicaciones clínicas y a una elevada mortalidad en estos pacientes.
En este documento de consenso del Grupo de Estudio de las Infecciones en el Paciente Trasplantado se definen las indicaciones para la profilaxis de la infección tuberculosa latente en estos pacientes, especialmente en las situaciones de elevado riesgo de toxicidad farmacológica, como es el caso del trasplante de hígado.
Se recoge también una serie de recomendaciones con respecto a la elección de los fármacos y la duración del tratamiento de la enfermedad tuberculosa en el paciente trasplantado, con mención especial a la vigilancia del desarrollo de interacciones farmacológicas entre rifampicina y los fármacos inmunosupresores (ciclosporina, tacrolimus, rapamicina y esteroides).
The relevance of tuberculosis in solid organ transplant recipients stems from the difficulties in the diagnosis, which delay the start of treatment, and the associated toxicity of pharmacological therapy. These facts are responsible for the large number of clinical complications and the high mortality in this population.
This Consensus Document from GESITRA (Spanish Transplantation Infection Study Group) defines the indications for prophylaxis of latent tuberculosis infection in patients undergoing solid organ transplantation, in particular those with a high risk of pharmacological toxicity, as is the case of liver transplant recipients.
This Consensus Document also establishes recommendations for the choice of drugs to use and duration of treatment for tuberculosis in solid organ transplant recipients, with special mention of vigilance for the development of pharmacological interactions between rifampin and immunosuppressive drugs (cyclosporine, tacrolimus, rapamycin, and steroids).
La tuberculosis (TB) es una de las infecciones oportunistas más importantes en los pacientes receptores de un trasplante de órgano sólido (TOS)1–4. Su importancia viene determinada fundamentalmente por su alta morbimortalidad. Además, todavía hay graves dificultades en el tratamiento de la TB en estos pacientes, como las dificultades que se deben a las interacciones existentes entre fármacos antituberculosos e inmunosupresores, la ausencia de indicaciones claras sobre el tratamiento de la infección tuberculosa latente (ITL) o el elevado riesgo de toxicidad de los fármacos antituberculosos, particularmente en los trasplantados hepáticos.
Por este motivo, el Grupo de Estudio de las Infecciones en el Paciente Trasplantado (GESITRA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) ha decidido elaborar este documento con la idea de homogeneizar el tratamiento de la TB en el paciente con TOS.
Definiciones y metodología utilizadaEl documento se ha elaborado de acuerdo con las normativas de elaboración de los documentos de consenso SEIMC (disponible en: http://www.seimc.org) y las recomendaciones internacionales en la elaboración de documentos de consenso5. Todos los expertos son socios de la SEIMC y sus recomendaciones se valoraron según el grado de las pruebas científicas, de acuerdo con la clasificación de los CDC (Centers for Diseases Control and Prevention ‘Centro para el Control y prevención de enfermedades’) americanos que se exponen en el anexo 16. Los autores y los coordinadores han consensuado el contenido y las conclusiones de este documento.
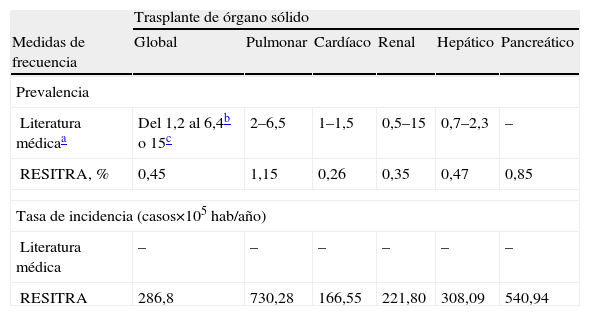
Epidemiología y factores de riesgoNo se conoce exactamente cuál es la incidencia de la enfermedad por Mycobacterium tuberculosis en los receptores de TOS. Aunque a menudo la literatura médica se refiere a la prevalencia, ésta no puede convertirse ni compararse con la tasa de incidencia. En la tabla 1 se recoge la prevalencia y la tasa de incidencia de la TB en el TOS descrita en las series más numerosas de la literatura médica y se la compara con la información disponible (datos no publicados) de GESITRA, que se recogió a través de la Red Española de Investigación de la Infección en el Trasplante (RESITRA). Estos datos muestran el considerable mayor riesgo de TB que presentan los receptores de TOS con respecto a la población general.
Frecuencia de tuberculosis en el trasplante de órgano sólido
| Trasplante de órgano sólido | ||||||
| Medidas de frecuencia | Global | Pulmonar | Cardíaco | Renal | Hepático | Pancreático |
| Prevalencia | ||||||
| Literatura médicaa | Del 1,2 al 6,4b o 15c | 2–6,5 | 1–1,5 | 0,5–15 | 0,7–2,3 | – |
| RESITRA, % | 0,45 | 1,15 | 0,26 | 0,35 | 0,47 | 0,85 |
| Tasa de incidencia (casos×105hab/año) | ||||||
| Literatura médica | – | – | – | – | – | – |
| RESITRA | 286,8 | 730,28 | 166,55 | 221,80 | 308,09 | 540,94 |
RESITRA: Red Española de Investigación de la Infección en el Trasplante.
La mayoría de los casos de TB en receptores de TOS se deben a la reactivación de una infección latente tras el inicio del tratamiento inmunosupresor. Sin embargo, pocos factores de riesgo de desarrollo de enfermedad tuberculosa se han definido con claridad en estos pacientes7,8. La principal limitación viene dada por las características de los estudios: la mayoría son retrospectivos y describen series pequeñas de casos y, además, carecen de grupos control que incluyan a los pacientes trasplantados que no han desarrollado TB, lo que hace difícil obtener información fiable sobre los factores de riesgo de TB en esta población. Por tanto, la información referente a los factores de riesgo tiene en general un bajo grado de pruebas. Por otra parte, la mayoría de la información disponible se refiere al trasplante renal y esta información no es necesariamente aplicable a los receptores de otros trasplantes. En la tabla 2 se exponen los diferentes factores de riesgo de TB postrasplante que se han descrito en la literatura médica7–10. Cabe asumir que otros factores que en la población general se asocian a un aumento del riesgo de TB son también aplicables a los receptores de trasplante. Entre estos factores se encuentra el tabaco, la desnutrición o la infección por virus de la inmunodeficiencia humana (VIH).
Factores de riesgo de tuberculosis postrasplante
| Tratamiento inmunosupresor* |
|
| Historia de exposición previa a Mycobacterium tuberculosis |
|
| Condiciones clínicas |
|
OKT3: muromonab, anticuerpo monoclonal anti-CD3; PPD: purified protein derivative ‘derivado proteico purificado’; TB: tuberculosis.
En la evaluación del candidato a TOS, en lo que se refiere a la TB, se debe investigar si hay antecedentes de infección o enfermedad, y en ese caso si recibió tratamiento, con qué fármaco y durante cuánto tiempo.
Es importante conocer si hubo contacto con casos de TB activa en el ámbito familiar o en el lugar de trabajo y si se le ha realizado al paciente una prueba cutánea con PPD (purified protein derivative ‘derivado proteico purificado’) (B-III). Se debe hacer mención en la anamnesis sobre las posibles exposiciones institucionales y viajes a áreas con alta endemicidad de TB. Para interpretar correctamente la prueba cutánea con PPD es fundamental saber si el candidato a trasplante ha recibido profilaxis para ITL y si se ha vacunado con bacilo de Calmette y Guérin (BCG)11,12.
Siempre debe descartarse enfermedad tuberculosa activa mediante radiografía de tórax. Se debe realizar una prueba cutánea con PPD a todos los candidatos, incluso a aquellos pacientes con historia de vacunación con BCG (A-II). Se recomienda repetir la prueba a los 7 a 10 días (“efecto booster”). El único motivo para no realizar la prueba cutánea con PPD es la constancia de que el paciente tenía una prueba cutánea con PPD positiva o enfermedad tuberculosa previa12.
Si al momento de la evaluación el candidato a trasplante presentara una clínica compatible con enfermedad tuberculosa activa, es obligatorio descartarla ya que esta situación contraindica el trasplante y es necesario el inicio del tratamiento antituberculoso11. Puede llegar a considerarse la realización de un TOS (no pulmonar) en un paciente con enfermedad pulmonar tuberculosa activa siempre y cuando el paciente esté recibiendo tratamiento antituberculoso y las tinciones para la detección de bacilos resistentes al ácido y al alcohol en esputo sean negativas al momento de llevarse a cabo el trasplante.
Tratamiento de los candidatos con una prueba cutánea con derivado proteico purificado positivaLo más importante es descartar que el paciente presente TB activa (A-II). Si hay datos clínicos o radiológicos compatibles con TB se deben realizar baciloscopias y cultivo de esputo, y si esto no fuera posible se debe realizar broncoscopia con cultivo del aspirado y lavado broncoalveolar (LBA). En algunos casos, puede ser necesario realizar exploraciones adicionales, pero esto depende de la clínica concreta como ecografía abdominal (con el fin de investigar si hay adenopatías abdominales) o biopsia y cultivo de adenopatías.
Si el paciente no tiene síntomas de TB pero hay lesiones residuales en la radiografía de tórax, se recomienda llevar a cabo cultivo de esputo y, en casos concretos, broncoscopia y cultivo del material aspirado y LBA.
Una vez que se descarta TB activa, hay que plantearse el tratamiento de la ITL (v. más adelante). El candidato a trasplante puede iniciar el tratamiento de la ITL (anteriormente denominada quimioprofilaxis), incluirse en lista de espera y, si fuera posible, continuar el tratamiento después del trasplante.
Tratamiento de los candidatos con una prueba cutánea con derivado proteico purificado negativaConviene repetir la prueba cutánea con PPD a los 7 a 10 días (“efecto booster”) en caso de que la prueba inicial sea negativa. Si la induración es menor de 5mm, se considera negativa; por el contrario, una induración igual o mayor de 5mm indica que la prueba es positiva (B-III). Es frecuente que los pacientes que están a la espera de un TOS presenten anergia cutánea debido a su enfermedad de base, por lo que se aconseja realizar una prueba de inmunidad celular (Multitest® u otros antígenos seleccionados, como el de Candida albicans o el toxoide tetánico) en el momento en que se lleve a cabo la segunda prueba cutánea con PPD, con el fin de determinar la presencia de anergia.
Tratamiento de los candidatos con anergia cutáneaNo se conoce cuál es el riesgo de desarrollo de TB en estos pacientes. Se recomienda tratarlos como si tuvieran una prueba cutánea con PPD positiva hasta que haya estudios que demuestren cuál es el riesgo real en esta situación11.
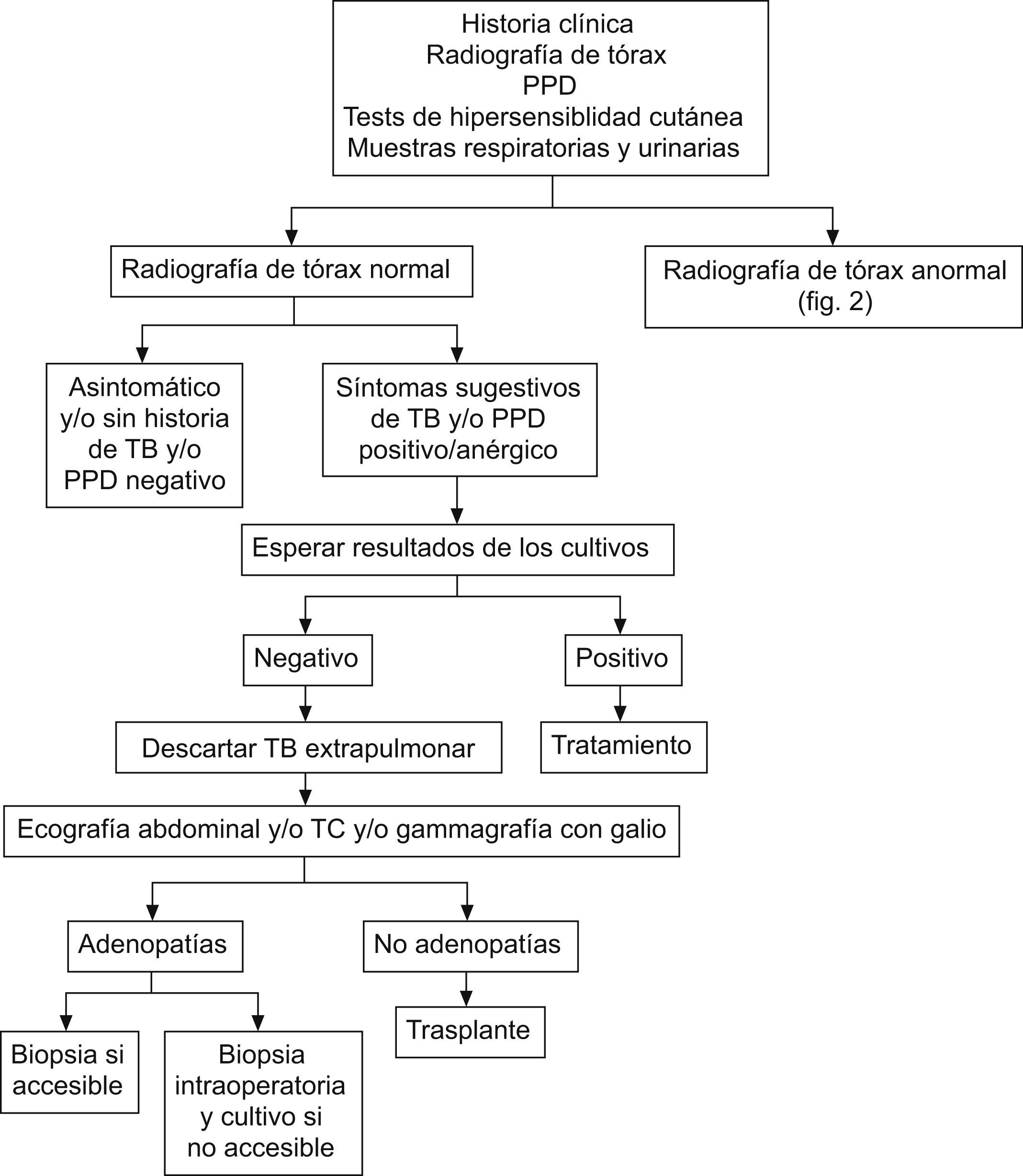
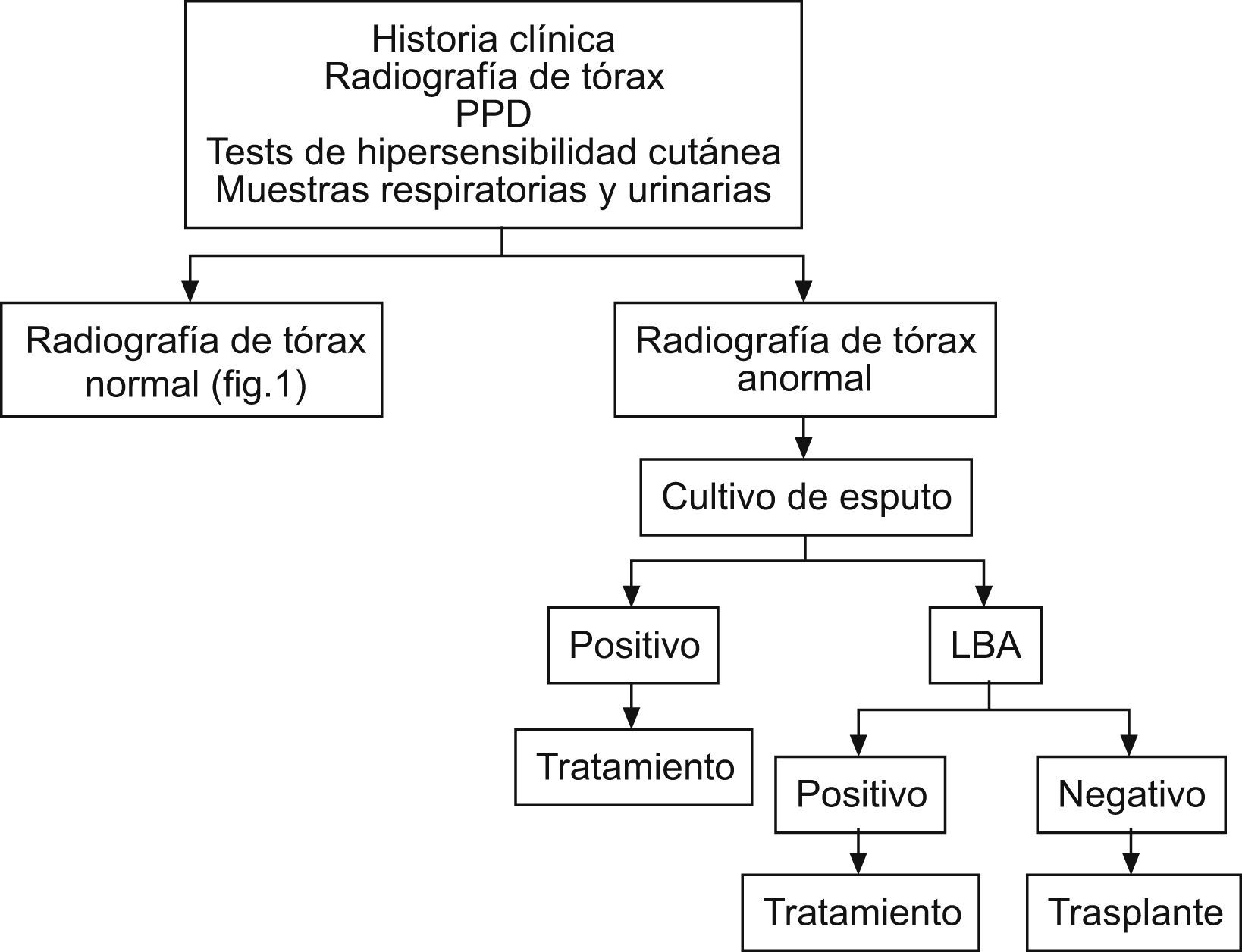
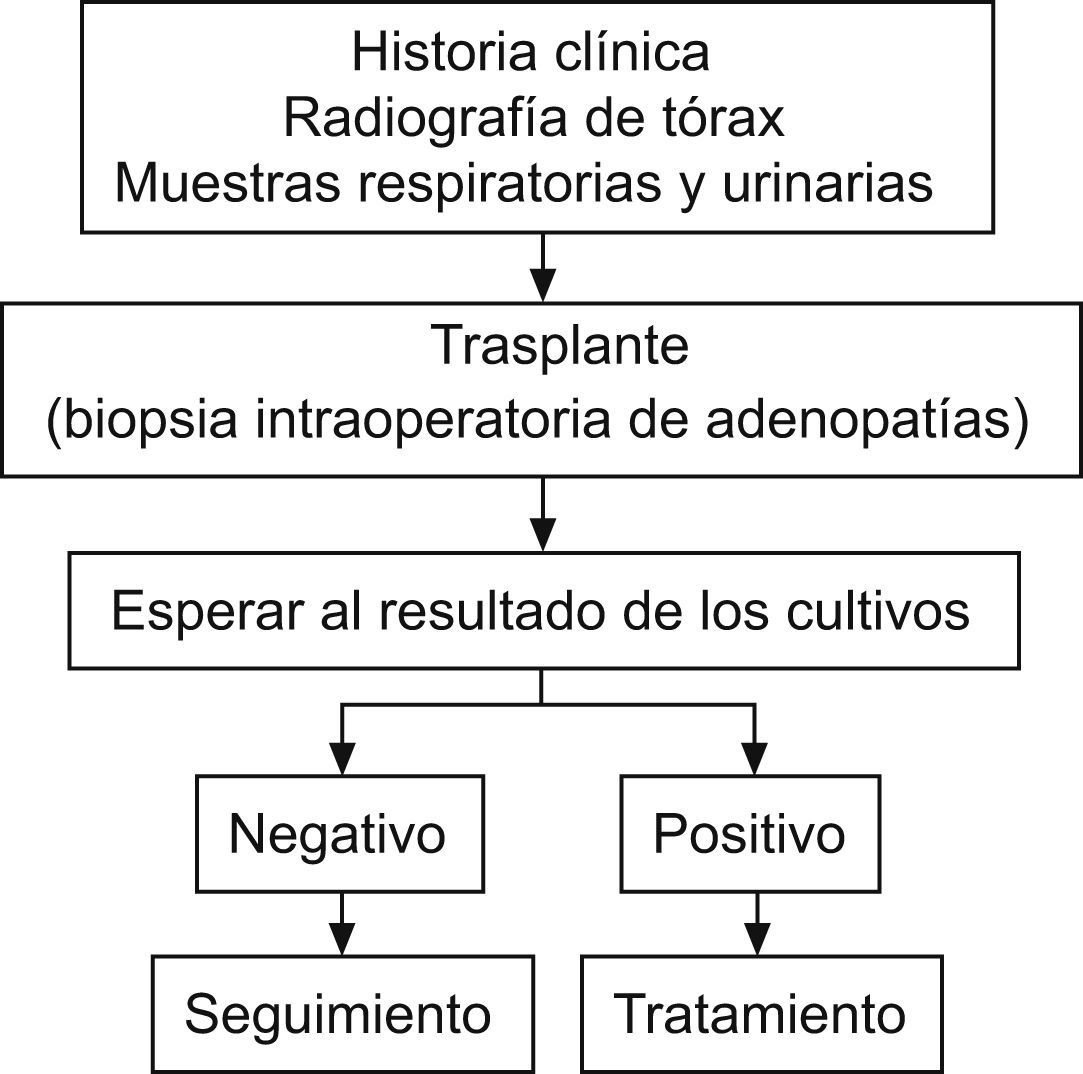
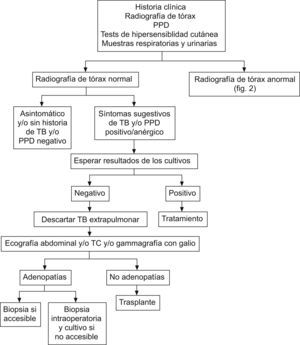
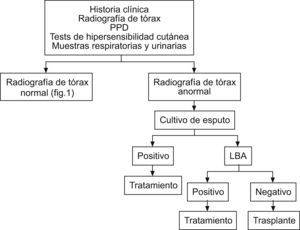
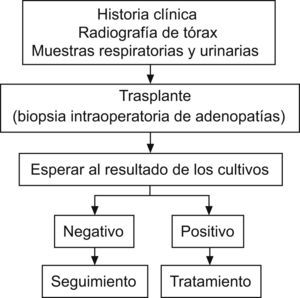
Aunque la rentabilidad de la prueba cutánea con PPD en un paciente candidato a trasplante es baja, sigue siendo el primer paso en la evaluación de estos pacientes con el fin de descartar infección tuberculosa. Actualmente se están desarrollando y validando nuevas técnicas, como la cuantificación de la liberación de interferón Χ en respuesta a antígenos de M. tuberculosis (QuantiFERON®-TB Gold test) que pueden contribuir a mejorar el diagnóstico de ITL en los pacientes candidatos a trasplante. En las figuras 1, 2 y 3 se propone una aproximación al tratamiento diagnóstico de la TB en el paciente candidato a TOS13.
Tratamiento diagnóstico de tuberculosis en trasplante no urgente y radiografía de tórax normal13. PPD: purified protein derivative `derivado proteico purificado'; TB: tuberculosis; TC: tomografía computarizada.
Tratamiento diagnóstico de tuberculosis en trasplante no urgente y radiografía de tórax anormal13. LBA: lavado broncoalveolar; PPD: purified protein derivative `derivado proteico purificado'.
Tratamiento diagnóstico de tuberculosis en trasplante urgente13.
Si hay una infección latente por M. tuberculosis en el donante, ésta puede reactivarse en el receptor, especialmente si se tiene en cuenta la inmunosupresión que recibe en el período postrasplante. Se ha descrito la transmisión de TB a través del injerto en el trasplante de riñón, pulmón e hígado.
Por todo esto, a los donantes vivos se les debe realizar una prueba cutánea con PPD. En el caso de que la prueba sea positiva se debe descartar TB activa (A-II)12. En los donantes cadáver la situación es más compleja ya que, con frecuencia, no se dispone de información suficiente que permita descartar la existencia de ITL o de TB activa. Por esto, no sólo la TB activa, sino la sospecha fundada de ésta debe contraindicar en principio la utilización de órganos para el trasplante (A-II).
Se tienen pocos datos acerca de cómo los antecedentes de infección o de enfermedad tuberculosa (con tratamiento correcto o no) pueden influir en la transmisión al receptor de una TB, en especial si se trata de un receptor con una prueba cutánea con PPD negativa. Por todo esto, es esencial la toma de biopsias y cultivos en el momento del trasplante con el fin de descartar una TB activa en el donante.
Las lesiones residuales pulmonares en el donante contraindican el trasplante de pulmón, aunque no el de otros órganos. En estos casos, se recomienda el estudio anatomopatológico y microbiológico del pulmón del donante con el fin de descartar infección activa. Las técnicas de amplificación de ácidos nucleicos de M. tuberculosis tienen una alta sensibilidad y especificidad en muestras respiratorias y pueden ser útiles en la evaluación de los donantes14. La enfermedad tuberculosa diseminada contraindica de forma absoluta la utilización de cualquier órgano para trasplante15.
Situación en trasplante urgenteCuando la indicación de trasplante es urgente, se deben obtener previamente muestras respiratorias y urinarias para cultivo de M. tuberculosis. Asimismo, durante la intervención quirúrgica deben tomarse muestras de las adenopatías del lecho quirúrgico, en el caso de que se encontraran, tanto en el donante como en el receptor. Un cultivo positivo indica que se debe iniciar tratamiento específico (fig. 3)13.
Situación en trasplante de pulmónEn los pacientes trasplantados de pulmón, aunque puede haber una reactivación extrapulmonar o pulmonar (trasplante unipulmonar) a partir del propio receptor, el principal riesgo para el desarrollo de TB procede de la reactivación pulmonar a partir del injerto (sobre todo en los trasplantes bipulmonares). Como se ha comentado anteriormente, las lesiones residuales pulmonares contraindican el trasplante de pulmón, aunque no el de otros órganos. En estos casos, se recomienda el estudio anatomopatológico y microbiológico del pulmón con el fin de descartar enfermedad activa.
Tratamiento de la infección tuberculosa latente (profilaxis) en el paciente con trasplante de órgano sólido o candidato a trasplanteIndicaciones de tratamiento de la infección tuberculosa latenteLa TB en el paciente receptor de TOS se desarrolla generalmente a partir de un foco de infección latente en el receptor. Por tanto, la profilaxis debe iniciarse idealmente antes del trasplante. Si no fuera posible finalizarla antes del trasplante debe completarse después de éste. Lamentablemente, en la mayoría de los casos no es posible o no se realiza profilaxis antes del trasplante y es preciso realizarla después.
Deben recibir tratamiento de la ITL todos los pacientes en lista de espera de trasplante o ya trasplantados que tengan una o más de las siguientes condiciones: a) una prueba cutánea con PPD (inicial o tras un “efecto booster”) superior a 5mm; b) antecedentes de TB previa tratada incorrectamente, y c) antecedentes de contacto con un paciente con TB activa. Se recomienda también administrar profilaxis a los pacientes con cambios en la radiografía de tórax compatibles con TB pasada no tratada (lesiones fibronodulares apicales, nódulo solitario calcificado, ganglios linfáticos calcificados o engrosamientos pleurales) (A-II)16. El valor de estos datos radiológicos como indicación de TB previa es mayor en países como España, en los que no hay micosis regionales (histoplasmosis, coccidioidomicosis, blastomicosis) que puedan causar lesiones similares.
La transmisión de una TB activa a partir del donante es menos frecuente, pero se ha descrito17. Por lo general, salvo en el caso de donantes vivos18, pueden no estar disponibles los datos clínicos que permitan conocer si el donante tenía una TB. Es por tanto esencial, como se dijo antes, la toma de biopsias al momento del trasplante con el fin de descartar TB activa en el donante. Se recomienda administrar tratamiento de ITL a los receptores de un órgano de un donante que tenga historia o datos indicativos de TB no tratada3.
Antes de iniciar el tratamiento de la ITL se recomienda que los pacientes reciban un estudio exhaustivo con el objeto de descartar la existencia de TB activa (cultivo y reacción en cadena de la polimerasa para micobacterias de sangre, esputo y orina)3,10,19. En pacientes con alteraciones en la radiografía pero que no expectoran debe considerarse la inducción de esputo con suero hipertónico o la realización de una fibrobroncoscopia. Los pacientes con una TB bien tratada en el pasado no precisan recibir profilaxis20.
Recomendaciones sobre el tratamiento de la infección tuberculosa latenteEl fármaco de elección es la isoniacida (INH) (300mg/día) suplementada con vitamina B6 durante 9 meses3,10,21–24. La profilaxis con INH ha demostrado que previene la TB en estudios aleatorizados en trasplante renal21,25,26 (A-I).
Es ideal realizar el tratamiento de la ITL antes del trasplante, excepto posiblemente en el trasplante hepático (del que se hablará posteriormente). La duración y posología del tratamiento con INH son iguales, se realice antes o después del trasplante. Los pacientes que han completado el tratamiento antes del trasplante no deben repetirlo después.
Hay que tener presente en estos pacientes la posibilidad de hepatotoxicidad por INH. En general, la tolerancia a la INH es buena27,28 y la interacción con inhibidores de calcineurina es muy limitada29. Se recomienda monitorizar las enzimas hepáticas y suspender la profilaxis si éstas se elevan 3 veces y el paciente está sintomático o si se elevan 5 veces en pacientes sin clínica acompañante30.
Antes de la administración de la INH hay otras alternativas, como la rifampicina (con o sin INH) durante 4 meses29 (B-II) o rifampicina con pirazinamida durante 2 meses31 (C-III). Sin embargo, esta última combinación se ha asociado a casos de hepatotoxicidad grave y por lo general no se recomienda, salvo que sea necesario completar la profilaxis en un período breve y siempre bajo estrecha supervisión de un experto32. Se desaconseja esta pauta en pacientes con hepatopatía previa, que ingieren alcohol o que han presentado hepatotoxicidad por INH16. Los regímenes que incluyen rifampicina sólo se aconsejan para realizar la profilaxis antes del trasplante, debido a las interacciones medicamentosas de este fármaco.
En casos de toxicidad grave sólo se recomienda la biopsia hepática cuando haya duda diagnóstica o ausencia de normalización analítica al suspender el tratamiento. Una vez que se precisa suspender la profilaxis por toxicidad se recomienda realizar un seguimiento estrecho del paciente y tratar de completar la profilaxis con otros fármacos distintos a la INH sólo en pacientes de muy alto riesgo, como los conversores recientes de la prueba cutánea con PPD. Se recomienda para estos casos utilizar levofloxacina con etambutol durante al menos 6 meses (B-III).
Cuando no puede excluirse con certeza que un paciente trasplantado tenga una TB activa, se recomienda iniciar un tratamiento con 3 fármacos (INH, etambutol y pirazinamida). Si tras 8 semanas de incubación de las muestras el cultivo de M. tuberculosis es negativo y la radiografía de tórax permanece estable, puede completarse el tratamiento sólo con INH.
Exclusiones del tratamiento de la infección tuberculosa latente y precaucionesLos trasplantados hepáticos presentan un problema especial a la hora de administrarles un tratamiento de ITL por el riesgo de hepatotoxicidad. Algunos autores consideran que este riesgo supera el potencial beneficio ya que la frecuencia de reactivación no es demasiado elevada10. Sin embargo, otros autores no han observado un incremento de la toxicidad con la administración de INH a candidatos de trasplante hepático33.
Se recomienda retardar la administración del tratamiento de la ITL en los trasplantados hepáticos hasta después del trasplante, cuando la función hepática ya es estable, dado que cuando el paciente está aún en la lista de espera (que es lo deseable en el resto de los trasplantes), la administración puede desequilibrar la situación y obligar a realizar el trasplante de forma urgente (B-III). La conveniencia de administrar el tratamiento de la ITL a los trasplantados hepáticos es más clara en caso de que haya factores de elevado riesgo, como son: a) conversión reciente de la prueba cutánea con PPD; b) antecedentes de TB incorrectamente tratada; c) contacto directo con un enfermo con TB no tratada; d) lesiones tuberculosas residuales en la radiografía de tórax, y e) factores de inmunosupresión añadidos, como tratamiento de episodios de rechazo en pacientes con una prueba cutánea PPD positiva que no hayan recibido profilaxis.
Prevención de tuberculosis nosocomial. Medidas de aislamientoSe han descrito casos de TB nosocomial de forma aislada o en brotes tras la realización de maniobras diagnósticas o terapéuticas a pacientes con TB pulmonar bacilífera. Entre las más peligrosas se encuentran las maniobras de intubación orotraqueal, la realización de fibrobroncoscopias y la inducción de esputos.
Las formas de TB que deben recibir aislamiento respiratorio son la TB pulmonar y sobre todo la TB laríngea, que es la más transmisible. Las normas internacionales recomiendan que el aislamiento respiratorio se mantenga hasta: a) demostrar que el paciente no tiene TB, si el aislamiento se realizó por sospecha de la enfermedad; b) en pacientes con TB que reciban tratamiento, estén mejorando clínicamente y tengan 3 tinciones de esputo consecutivos negativos, y c) que asegure que no estará en contacto con pacientes especialmente susceptibles (niños pequeños, inmunodeprimidos, etc.).
Los pacientes con TB bacilífera deben estar en habitaciones individuales con presión negativa con respecto al pasillo. Las ventanas deben permanecer cerradas, así como las puertas, salvo cuando se entre o salga de la habitación34.
Tratamiento de la tuberculosis en el paciente con trasplante de órgano sólidoLas recomendaciones del tratamiento de la TB en pacientes trasplantados son similares a las que se recomendaron para la población general16, sólo hay 2 aspectos diferenciales: a) la interacción de rifamicinas (rifampicina, rifabutina o rifapentina) con los fármacos inmunosupresores de la familia de los inhibidores de la calcineurina (ciclosporina, tacrolimus), con rapamicina y con esteroides, y b) la duración del tratamiento.
Utilización de rifamicinas en el paciente trasplantadoLa inclusión de rifamicinas, fundamentalmente rifampicina, en las pautas del tratamiento de la TB en los pacientes trasplantados es el aspecto más controvertido del tratamiento de estos pacientes. Hay argumentos a favor y en contra de su uso y las recomendaciones varían de unos autores a otros.
La rifampicina se ha utilizado ampliamente en pacientes trasplantados. Algunas series, fundamentalmente realizadas en trasplantes renales, han confirmado el éxito de pautas que incluyen rifampicina con un riguroso ajuste de concentraciones de los inmunosupresores en el tratamiento de estos pacientes, con una respuesta favorable y sin incremento del riesgo de rechazos35,36. Las guías europeas para el tratamiento de la TB en el paciente con trasplante renal recomiendan un tratamiento similar al de la población general: 2 meses de tratamiento con INH, rifampicina y pirazinamida, se puede incorporar etambutol si la frecuencia de resistencia a INH en la comunidad es superior al 4%, seguido de INH con rifampicina durante 4 meses más (B-III)37.
Sin embargo, el razonamiento para la elección definitiva de esta pauta, con una eficacia completamente demostrada en la población general16, deja muchos puntos oscuros en el paciente trasplantado. La rifampicina reduce las concentraciones séricas de tacrolimus con ciclosporina y también, aunque de forma menos estudiada, los de rapamicina (sirolimus), everolimus y corticoides. Esto se ha asociado en algunas series con un riesgo de rechazo elevado y muy superior al observado en los pacientes tratados sin rifampicina38,39. Por tanto, se recomienda incrementar la dosis de inhibidores de la calcineurina aproximadamente 3 a 5 veces cuando se utilice simultáneamente rifampicina en estos pacientes y realizar un control estrecho de las concentraciones de los inmunosupresores1,2.
No hay muchos trabajos que hayan evaluado el papel del empleo o no de la rifampicina en la evolución de pacientes trasplantados con TB. Se ha documentado que la asociación de rifampicina con ciclosporina incrementa la frecuencia de rechazo, la pérdida del injerto, así como la mortalidad global y la mortalidad directamente relacionada con la TB, a pesar de que se incremente la dosis de ciclosporina y se realice una monitorización adecuada de las concentraciones del fármaco1–3.
La rifabutina es un inductor enzimático del citocromo p450 hepático más débil que la rifampicina. Se usa como alternativa a la rifampicina en pacientes con infección por el VIH y puede ser una alternativa también en pacientes trasplantados ya que los pacientes requerirían un incremento menor de las dosis de inhibidores de la calcineurina. Hay algunas experiencias favorables con el uso de rifabutina en pacientes con trasplante renal40–42. Sin embargo, la experiencia en este colectivo es todavía escasa y la capacidad de interacción persiste.
Es conveniente recordar también que al igual que lo que ocurre en los enfermos con infección por VIH, en los pacientes con TOS y TB se puede desarrollar un síndrome de reconstitución inmune relacionado con los cambios en el tratamiento inmunosupresor y con las interacciones de los fármacos inmunosupresores y la medicación utilizada para el tratamiento de la TB, especialmente con las rifamicinas.
Utilización de otros fármacos antituberculosos en el paciente trasplantadoLa INH y la pirazinamida se han utilizado ampliamente en pacientes trasplantados con TB. Dado el riesgo de hepatotoxicidad, es necesario un especial seguimiento de las enzimas hepáticas, especialmente en pacientes que reciben un trasplante hepático.
La administración de estreptomicina y aminoglucósidos en los pacientes trasplantados debe sopesarse con prudencia dado el riesgo de potenciación de nefrotoxicidad de estos fármacos con los inhibidores de la calcineurina.
Las fluoroquinolonas pueden ser una alternativa para considerar en estos pacientes dados los inconvenientes asociados al uso de rifamicinas y aminoglucósidos y en determinadas ocasiones pueden pasar a ser fármacos de primera línea43. No obstante, el uso indiscriminado de estos fármacos en la población general se ha asociado a un incremento de resistencia de M. tuberculosis a fluoroquinolonas en los últimos años44. La utilización conjunta y prolongada de levofloxacina con pirazinamida se ha asociado a una pobre tolerancia, fundamentalmente digestiva, en pacientes receptores de TOS45.
En casos especiales de resistencia o toxicidad la utilización de linezolid ha sido eficaz en pacientes con TB46. Sin embargo, el uso prolongado de éste se asocia al desarrollo frecuente de trombocitopenia y anemia y en algunos casos con polineuropatía, sobre todo en pacientes con otras enfermedades asociadas, como diabetes o nefropatía, lo que puede limitar su uso en trasplantados.
Tolerancia del tratamiento antituberculoso en el paciente trasplantadoEn los pacientes trasplantados hepáticos es especialmente preocupante el desarrollo de toxicidad hepática durante el tratamiento de una TB1. En el paciente trasplantado no hepático la INH se tolera bien generalmente, aunque también se ha descrito riesgo de hepatotoxicidad en trasplantados renales3,47.
Como se comentó anteriormente, la rifampicina debe usarse con precaución extrema en el tratamiento de la TB en pacientes trasplantados debido al elevado riesgo de hepatotoxicidad. Su uso en combinación con INH se asocia a un incremento considerable de la hepatotoxicidad, especialmente en pacientes con trasplante hepático48. El tratamiento inicial con INH, rifampicina y pirazinamida en trasplantados hepáticos con TB se ha asociado a hepatotoxicidad con confirmación histológica hasta en el 88% en algunas series49 y, como se comentó anteriormente en el apartado de profilaxis, también se ha documentado un especial riesgo de hepatotoxicidad con el uso combinado de rifampicina con pirazinamida durante el tratamiento de TB50.
Consideraciones especiales en pacientes trasplantados con infección por virus de la inmunodeficiencia humanaUna situación especial la plantea el paciente con infección por VIH que ha recibido un trasplante hepático. Se han comunicado en la literatura médica más de 200 trasplantes hepáticos en pacientes infectados por VIH y no parece que el riesgo de TB sea significativamente mayor en estos pacientes comparado con el que ya tenían antes de ser trasplantados51,52. Por otro lado, el tener una TB previa no es un criterio estricto de exclusión de trasplante hepático en los pacientes infectados con VIH, ni parece que estos pacientes tengan un mayor riesgo de reactivación de TB si recibieron tratamiento antituberculoso correcto.
Los principales problemas en el período postrasplante son las interacciones farmacocinéticas y farmacodinámicas entre los antirretrovíricos, los tuberculostáticos y los agentes inmunosupresores y la recurrencia de la infección por virus de la hepatitis C que parece incrementar el riesgo de TB8 y favorece la toxicidad farmacológica. Hay especial riesgo de interacción farmacológica entre las rifamicinas y 2 familias de antirretrovíricos: los inhibidores de la proteasa y los inhibidores de la transcriptasa inversa no análogos de nucleósidos. El problema radica en la capacidad de inducción o inhibición que poseen los 3 grupos de fármacos sobre la familia de isoenzimas del citocromo P450, lo que condiciona interacciones de difícil tratamiento.
Aunque la experiencia que se ha publicado es muy escasa, la pauta estándar de tratamiento de la TB en pacientes trasplantados infectados por VIH parece tener la misma eficacia que en pacientes no trasplantados infectados por VIH51. Por tanto, las recomendaciones en cuanto a regímenes de tratamiento de la TB realizadas para pacientes trasplantados infectados por VIH son aplicables a pacientes no trasplantados infectados por retrovirus.
En estos pacientes el uso de rifamicinas es especialmente problemático ya que no sólo condiciona mayor hepatotoxicidad, sino que puede poner en riesgo un tratamiento antirretrovírico eficaz. En caso de decidir no emplear rifampicina o rifabutina se recomienda la asociación de INH a pirazinamida y etambutol, así como a una quinolona. El uso de aminoglucósidos queda limitado por el riesgo de favorecer la nefrotoxicidad por inhibidores de la calcineurina.
Duración del tratamiento antituberculoso en el paciente trasplantadoHay 2 motivos de controversia en estos pacientes, la duración y el tipo de los fármacos que se debe utilizar tras los primeros 2 meses, sobre todo si no se utiliza rifampicina en los 2 primeros meses o ésta debe suspenderse por intolerancia. La experiencia en la población general con las pautas antituberculosas que no incluyen rifampicina debe hacer reflexionar sobre algunos aspectos. La mayoría de los pacientes con un tratamiento adecuado que incluye rifampicina si recidiva lo suele hacer con una cepa sensible. Sin embargo, en pautas que no incluyen rifamicinas, sobre todo si no son supervisados, la aparición de resistencia suele ser más frecuente.
En la población general, INH, pirazinamida y estreptomicina administradas durante 9 meses han demostrado eficacia16, pero es difícil mantener fármacos inyectables durante largos períodos, además la utilización de fármacos inyectables en los pacientes trasplantados debe evitarse dado el riesgo de nefrotoxicidad que conllevan. No hay estudios sobre la utilización de etambutol en lugar de estreptomicina en estas circunstancias. No obstante, en la población general y, por tanto, aplicable también al paciente trasplantado, se recomienda mantener 12 a 18 meses las pautas orales y se debe valorar el beneficio de agentes inyectables en los primeros 2 a 3 meses en las formas extensas o cavitadas.
En un estudio español se apreció que una duración del tratamiento inferior a 9 meses fue un factor asociado a una mayor mortalidad1. En otro estudio, el único factor que se asoció de forma significativa a una mayor recurrencia de enfermedad tuberculosa fue la duración del tratamiento, no se observó ninguna recurrencia en los pacientes que lo recibieron por más de 12 meses, independientemente de que incluyeran o no rifampicina53.
Recomendaciones finales del tratamiento1. Tratamiento de inicioLos pacientes con formas no diseminadas y en los que no haya sospecha de infección por cepas resistentes pueden tratarse inicialmente con una combinación de INH, pirazinamida y etambutol (en las dosis habituales) y así se evita el uso de rifamicinas o con monitorización muy estrecha de las concentraciones de inmunosupresores con los que interaccionan (B-III).
En las formas más graves, principalmente formas diseminadas, o en caso de sospecha o pruebas de resistencia a la INH, debe valorarse añadir al tratamiento rifampicina o rifabutina (B-III) y puede recomendarse en algunos casos la incorporación al tratamiento de levofloxacina, especialmente si hay toxicidad a otros fármacos (C-III). El uso de rifampicina o rifabutina obliga a incrementar las dosis de ciclosporina o tacrolimus y a una monitorización más estrecha de las concentraciones de estos fármacos (A-II).
Pueden utilizarse fármacos inyectables (estreptomicina, amikacina, kanamicina o capreomicina), linezolid u otros fármacos de segunda línea en casos de multirresistencia o cuando haya alguna limitación para el uso de los fármacos anteriormente mencionados (C-III).
La resistencia a rifampicina se asocia de forma casi sistemática a resistencia cruzada a rifabutina y rifapentina, por lo que éstas no son una alternativa adecuada (D-II). No hay resistencia cruzada en los casos de resistencia a estreptomicina respecto a los otros fármacos inyectables (amikacina, kanamicina, capreomicina); sin embargo la resistencia cruzada entre amikacina y kanamicina es universal. No obstante, no es recomendable la asociación de fármacos inyectables debido a su intolerancia y la asociación de efectos secundarios (D-II).
Si el tratamiento se inicia de forma precoz no es necesaria una reducción de la inmunosupresión (C-III).
2. Tratamiento de mantenimientoLa recomendación de no incluir rifampicina en las pautas de inicio en estos pacientes hace difícil estimar la duración y el tipo de fármacos a utilizar tras los primeros 2 meses. En pacientes estables sin afectación extrapulmonar se recomienda utilizar INH y etambutol (o pirazinamida) durante 12 a 18 meses (C-III). La incorporación de un tercer fármaco, como pirazinamida o levofloxacina, puede acortar esta duración a 12 meses (C-III). Es preciso tener en cuenta que el uso prolongado de fluoroquinolonas se puede asociar a la aparición de artralgias y la asociación de pirazinamida a levofloxacina puede ser especialmente mal tolerada en estos pacientes desde el punto de vista digestivo.
Si no pudiera utilizarse INH ni alguna rifamicina en las pautas de tratamiento de estos pacientes deben utilizarse pautas de inducción y mantenimiento que incluyan de 4 a 6 fármacos durante al menos 24 meses (C-III). No hay experiencia en el uso de pautas de tratamiento intermitentes, que en cualquier caso no están recomendadas en el tratamiento de TB multirresistentes, excepto el uso de fármacos inyectables una vez que se ha completado un período de al menos 2 a 3 meses de aplicación diaria (D-II).
Conflicto de interesesNinguno de los autores refiere tener ningún conflicto de interés.
Antonio Doblas y Yolanda Meije han recibido ayuda económica como becarios de la Red Española de Investigación de la Infección en el Trasplante (RESITRA G03/075) y de la Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Clasificación de las recomendaciones del documento sobre la base de la potencia y la calidad de las pruebas analizadas
| Potencia de la pruebas | |
| A | Pruebas fuertes de eficacia y beneficio clínico |
| B | Pruebas fuertes o moderadas de eficacia, pero el beneficio clínico es limitado |
| C | Pruebas insuficientes de eficacia o los posibles beneficios en eficacia no compensan el costo o los riesgos (toxicidad medicamentosa, interacciones); hay otras alternativas válidas |
| D | Pruebas moderadas de falta de eficacia o de mala evolución |
| E | Pruebas fuertes de falta de eficacia o de mala evolución |
| Calidad de las pruebas | |
| I | Pruebas de al menos un estudio aleatorizado bien diseñado y realizado |
| II | Pruebas de al menos un estudio clínico no aleatorizado bien diseñado, estudios de cohortes o de casos y controles, estudios experimentales no controlados pero de resultados concluyentes |
| III | Opiniones de expertos basadas en experiencias clínicas, estudios descriptivos o informes de comités de expertos |
La versión en inglés de este artículo se ha publicado en: Clin Infect Dis. 2009;48:1276-84.