La inflamación hepática o hepatitis tiene causas diversas, tanto infecciosas como no infecciosas. Entre las primeras, cabe destacar la etiología viral que es la causa de, al menos, la mitad de todas las hepatitis en el mundo. Se han descrito distintos virus con tropismo primario por el tejido hepático. Estos microorganismos se han ido nombrando sucesivamente con las letras del abecedario: A, B, C, D, E y G. El objetivo de este artículo es revisar este grupo heterogéneo de virus en sus aspectos más básicos, sus implicaciones clínicas, su tratamiento, las principales medidas preventivas frente a estas infecciones y, con especial interés, las aproximaciones diagnósticas, tanto serológicas como moleculares, que se utilizan para su detección, cuantificación y caracterización.
Liver inflammation or hepatitis has many different causes, both infectious and non-infectious. Among the former, viral infection is responsible for at least half of all hepatitis worldwide. Different viruses have been described with primary tropism for liver tissue. These microorganisms have been successively named with letters of the alphabet: A, B, C, D, E and G. The aim of this paper is to review this heterogeneous group of viruses in its most basic aspects, including clinical implications, treatment, main control, and prophylactic measures and, of special interest, diagnostic approaches, both serological and molecular, which are used for their detection, quantification and characterization.
Se han descrito distintos virus con tropismo primario por el tejido hepático. Estos microorganismos se han ido nombrando sucesivamente con las letras del abecedario: A, B, C, D, E y G. El objetivo de este artículo es revisar este grupo heterogéneo de virus en sus aspectos más básicos, sus implicaciones clínicas, su diagnóstico, su tratamiento y sus principales medidas profilácticas1–3.
Hepatitis ALa hepatitis A está causada por un virus ARN de la familia Picornaviridae con morfología icosaédrica sin envuelta y ARN lineal de polaridad positiva. El virus se elimina en grandes cantidades en las heces de los individuos infectados y se transmite por contacto directo orofecal y por ingestión de agua o alimentos contaminados. La prevalencia de la enfermedad está en relación directa con el grado de desarrollo socioeconómico y sanitario del entorno. En el mundo, las infecciones por el virus de la hepatitis A (VHA) ascienden aproximadamente a 1,4 millones de casos al año. Se estima que más del 50% de la población mayor de 40 años posee anticuerpos de tipo lgG contra el virus3,4.
ClínicaEl periodo de incubación es de 15-50d, con una fase inicial preictérica de pocos días a 2 sem. Cursa como un cuadro de aparición brusca, seudogripal, con fiebre, astenia, mialgias o artralgias, anorexia, náuseas y vómitos, también, con estreñimiento o diarrea, dolor en el hipocondrio derecho, a veces con prurito e ictericia, que dura entre 1-2sem. En la exploración pueden detectarse adenopatías y exantema. Un 70% de los niños y un 30% de los adultos no tienen síntomas. Normalmente evoluciona en forma de hepatitis aguda no complicada, con desaparición de los síntomas y signos y vuelta a la normalidad completa, sin infección crónica. Tras la infección, el sistema inmune produce anticuerpos contra el virus que confieren inmunidad al sujeto contra futuras infecciones.
DiagnósticoFrecuentemente, la hepatitis A no puede distinguirse de las otras hepatitis virales por las características clínicas o epidemiológicas. Los marcadores virológicos (serológicos y moleculares) del VHA son herramientas utilizadas en el manejo de la hepatitis A, son la base para su diagnóstico y permiten a su vez la caracterización de la historia natural de la infección en sus distintas fases4.
IgM antivirus de la hepatitis AEn general el diagnóstico de la infección aguda por el VHA se establece por la presencia de anticuerpos específicos frente al virus de tipo IgM (IgM anti-VHA), que son los primeros en aparecer y se detectan durante un periodo de tiempo prolongado (de 3 a 6m); además su presencia coincide con la fase sintomática, cuando esta se manifiesta. Virtualmente, todos los pacientes con hepatitis aguda A tienen anticuerpos IgM anti-VHA en niveles detectables. Estos anticuerpos pueden ser detectados desde los 5-10d antes de la aparición de los síntomas hasta los 6m del momento de la infección, cuando comienzan su declive hasta su desaparición.
IgG antivirus de la hepatitis APor lo que respecta a los anticuerpos específicos de clase IgG (IgG anti-VHA), aparecen posteriormente, durante la fase de convalecencia, coinciden durante un tiempo con los de clase IgM y persisten indefinidamente, confiriendo inmunidad permanente que protege de la enfermedad. Estos anticuerpos no distinguen entre infección actual o pasada y, además, también aparecen después de la inmunización, pudiendo cuantificarse, por lo que su finalidad se circunscribe a estudios epidemiológicos de prevalencia o de investigación inmunitaria.
Los marcadores moleculares del VHA se basan en la detección del ARN viral y permiten la detección directa del virus o su caracterización a través del genotipo viral.
ARN del virus de la hepatitis ALa detección directa molecular del ARN viral (por RT-PCR) no suele usarse habitualmente con fines diagnósticos en la práctica asistencial. Es posible utilizarla durante la fase aguda de la infección a partir de muestras de heces o suero. Estos métodos también han sido aplicados a la detección del virus en alimentos y muestras ambientales.
Genotipo viralTomando como base su diversidad genética en la región VP1 del genoma viral, el VHA se clasifica en 6 genotipos (i al vi). Solo 3 de ellos, el i, el ii y el iii y sus correspondientes subtipos A y B, son capaces de infectar al hombre. La caracterización molecular, en laboratorios de investigación, de las secuencias amplificadas por RT-PCR del ARN genómico mediante secuenciación y posterior análisis filogenético permite determinar los diferentes genotipos virales, que son de gran utilidad en los estudios de epidemiología molecular.
Tratamiento y profilaxisNo existe un tratamiento antiviral específico para la hepatitis aguda por el VHA. En algunas situaciones son necesarias medidas generales de soporte, hasta la resolución de la fase sintomática.
Las medidas generales de higiene personal y ambiental son fundamentales para prevenir la adquisición de la infección. La vacunación está indicada en personas susceptibles que pertenecen a grupos de riesgo. Las vacunas inducen una protección superior al 95%. La protección inducida es muy prolongada y no se considera necesaria la dosis de recuerdo. Las inmunoglobulinas anti-VHA están indicadas en niños y adultos que no han recibido ninguna dosis de vacuna y conviven con pacientes infectados. Durante mucho tiempo ha constituido la medida habitual de prevención de la hepatitis A, pero actualmente casi ha sido sustituida por la vacuna por su mayor eficacia y duración de la protección.
Hepatitis BEl virus de la hepatitis B (VHB), descrito en 1963, pertenece a la familia Hepadnaviridae. Cuenta con una nucleocápside icosaédrica y una envuelta lipídica. El genoma consiste en una molécula circular de ADN circular bicatenario de 3,2kb, cuya cadena positiva está parcialmente incompleta en su extremo 3′. Este pequeño genoma contiene 7 señales de iniciación de la transcripción que definen genes parcialmente solapantes, con una capacidad de codificar proteínas muy superior a la que cabría esperar de su tamaño. Se distinguen 4 genes: el gen C que codifica para la proteína del core o HBcAg y la proteína precore que por proteolisis genera el HBeAg; el gen P que codifica para la ADN polimerasa viral; el gen S que cuenta con 3 señales de iniciación de la transcripción que definen las regiones preS1, preS2 y S que codifica para el HBsAg y el gen X que codifica una proteína no estructural (HBxAg) que es un potente transactivador de la transcripción, quizás implicado en la cronificación de la enfermedad y en la evolución a carcinoma hepatocelular3.
Consideraciones clínicasHoy existen unos 240 millones de personas portadoras de esta infección, que se perpetúa en la población con la aparición de 2-3 millones de casos nuevos cada año, y es una de las principales causas de hepatitis crónica, cirrosis y carcinoma hepatocelular cuyas secuelas son responsables de la muerte de unas 600.000 personas cada año. Cuando la infección ocurre en un escenario de inmunotolerancia del paciente (recién nacidos y niños) la tasa de evolución a la cronicidad es muy alta (cerca del 90% en la infección perinatal y 30% en la infancia), mientras que en la infección en jóvenes y adultos es más frecuente la forma ictérica que refleja una fuerte respuesta inmune. La curación clínica va a depender finalmente del resultado de la interacción entre la respuesta inmune y la actividad replicativa viral. La persistencia de pequeños reservorios de ADNccc en el núcleo del hepatocito puede ser suficiente para que la enfermedad se mantenga de forma silente, asintomática y sin marcadores de replicación detectables, pero lista para reactivarse si concurren ciertas situaciones clínicas, como la inmunodepresión.
DiagnósticoMientras que el malestar, la astenia, la fatiga, la fiebre, los dolores musculares y articulares, las náuseas, los vómitos, las orinas colúricas y la ictericia acompañados de alteraciones importantes del perfil bioquímico hepático son los síntomas más frecuentes y relevantes del cuadro agudo sintomático, en la forma crónica los síntomas son leves, inespecíficos e intermitentes variando entre pequeñas dispepsias e intolerancias alimenticias concretas a cuadros de cansancio y astenia más o menos prolongada y elevaciones moderadas y oscilantes de las transaminasas. La forma fulminante cursa con fallo multisistémico, por anulación de la función hepática con una rápida caída de los factores de coagulación y alteraciones bioquímicas muy llamativas.
En el laboratorio, las mejoras realizadas en los marcadores serológicos han supuesto la posibilidad de cuantificar el antígeno de superficie (HbsAg), el aumento de las sensibilidades y especificidades de las técnicas y su automatización. En el campo de las pruebas moleculares utilizadas para la detección y cuantificación del ADN viral, los avances han sido aun mayores y han permitido su realización estandarizada en muchos laboratorios donde hace pocos años esto era impensable5.
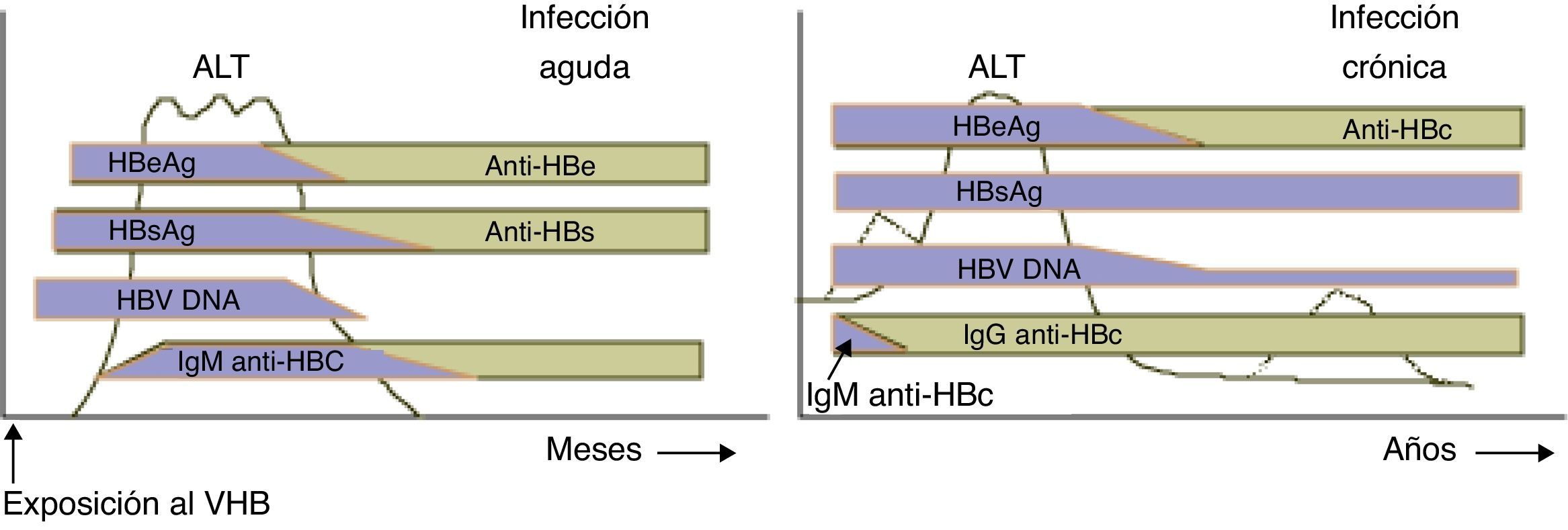
Los marcadores que se pueden observar en cada momento en el suero del paciente son consecuencia de la actividad replicativa viral en el hepatocito y de sus consecuencias inmunológicas. La secuencia de aparición de los marcadores es la siguiente: ADN-VHB, HBsAg, anti-HBc (IgM e IgG), HBeAg, anti-HBe y anti-HBs. Los marcadores relacionados con la replicación viral son: ADN-VHB y HBeAg y de forma indirecta anti-HBc IgM. El marcador de curación es el anti-HBs y los marcadores anti-HBc IgG y anti-HBe conviene interpretarlos dentro del contexto del paciente6. En la actualidad están disponibles para el diagnóstico de la infección los siguientes marcadores serológicos.
Antígeno de superficie del virus de la hepatitis BEl HBsAg, antígeno de superficie o antígeno Australia, expresión de la ORF S del gen S, se sintetiza en el citoplasma del hepatocito. Libre y en gran cantidad, se excreta al torrente sanguíneo con formas de agregados esféricos o filamentosos según sea la cantidad de proteína preS1 o preS2 que contengan. Otra pequeña parte de proteína de superficie, con proporciones reguladas de fracciones preS1 y preS2, entra a formar parte de la estructura del virión. La concentración de este antígeno en la sangre puede oscilar entre 50μg/mL y 1mg/mL. El HBsAg es un marcador muy precoz, puede ser detectable en el periodo de incubación, y lo es en la fase aguda y el estadio crónico. En caso de evolución favorable, desaparecerá a los 3 o 6m de la enfermedad. Por ello la positividad de este marcador más allá del sexto mes de la enfermedad define la situación clínica de hepatitis crónica. Se han reconocido diferentes expresiones fenotípicas del HBsAg responsable de la complejidad antigénica del virus. La calidad de una prueba para la determinación de HBsAg viene dada, entre otros factores, por poder detectar al menos 0,25ng/mL de esta proteína ya sea en su conformación salvaje de epítopos o en la de variantes surgidas. Aunque los ensayos de detección del HBsAg más utilizados son los cualitativos, en la actualidad existen ensayos que demuestran la utilidad de la cuantificación del HbsAg. La determinación cuantitativa del HBsAg puede ser útil en la predicción de la respuesta al tratamiento con interferón, en la monitorización de la progresión de la enfermedad y en la identificación de los verdaderos portadores inactivos de la infección. Los resultados de HBsAg pueden confirmarse mediante técnicas de neutralización o mediante otra prueba que utilice diferentes moléculas de captura.
Anticuerpos frente al antígeno de superficie del virus de la hepatitis BEl HBsAg provoca la aparición de anticuerpos neutralizantes. El anti-HBs es el último marcador en aparecer. Su seroconversión sucede poco después de la desaparición del HBsAg, a los 2 o 3meses de la infección en los cursos agudos autolimitados. La presencia de este marcador indica inmunidad de larga duración frente a la reinfección. En los vacunados es el único marcador de VHB presente y se considera que un individuo está protegido si la concentración de este anticuerpo supera las 10-20mUI/mL. Se piensa que incluso los individuos vacunados no respondedores permanecen protegidos de la infección y que se mantendría una memoria inmunológica que elevaría títulos de anticuerpos ante cualquier estímulo antigénico. Se ha evidenciado también la presencia de inmunocomplejos circulantes HBsAg/anti-HBs. La existencia de estos grandes inmunocomplejos también permite implicar al VHB en procesos de base inmunológica tales como la poliartritis nudosa, la glomerulonefritis membranosa en niños y la crioglobulinemia mixta esencial.
Anticuerpos frente al core del virus de la hepatitis B: clase IgM e IgGLos anti-HBc producidos inicialmente son predominantemente de clase IgM hasta hacerse indetectables en el plazo de unos 3 a 6m. Solo en el caso del establecimiento de la infección crónica es posible nuevamente, y de forma intermitente, su detección en concentraciones más bajas (reactivación). El anti-HBc IgG es ya detectable con los síntomas iniciales de la infección y persiste en el suero durante toda la enfermedad y más allá de la curación clínica y permanece detectable de por vida. Su positividad indica contacto con el virus. En algunos pacientes es posible que el anti-HBc sea el único marcador visible. Esta situación puede deberse a diferentes casusas: la primera y más frecuente es la curación de la enfermedad en la que, con el tiempo, se pueden haber perdido el resto de los marcadores; la segunda, una prolongada etapa de «seroconversión HBsAg/anti-HBs» en la que el HBsAg es negativo por producirse en cantidades que la prueba diagnóstica no puede detectar o por estar conjugado con anti-HBs; y tercera, pacientes infectados crónicos replicadores que producen muy poco HBsAg. Hay que considerar además como posibilidad el falso positivo del anti-HBc.
Sistema «e»: antígeno e del virus de la hepatitis B y anticuerpos frente al antígeno e del virus de la hepatitis BEl HBeAg es una proteína no estructural del VHB y se le supone un papel importantísimo en la inmunomodulación y la «tolerancia» viral. El HBeAg es detectable en algunos pacientes HBsAg positivos, ya estén en la fase aguda o crónica de la enfermedad. El valor diagnóstico de la detección de este antígeno se fundamenta en la excelente correlación de su presencia con la existencia de una alta actividad replicadora del virus y concentraciones elevadas de viremia (entre 105 y 108 equivalentes genómicos por mililitro de suero), por ello, la sangre de estos pacientes siempre se ha considerado como altamente infecciosa. La determinación de su presencia es obligatoria en todas las muestras HBsAg positivas. Parece que altas concentraciones de HBeAg en las primeras semanas o su persistencia más allá de las 6-8sem de la infección podría indicar un curso crónico de la enfermedad. En los casos de buena evolución su reactividad disminuye con el tiempo, haciéndose indetectable siempre antes de la desaparición del HBsAg. Algunos pacientes con replicación activa (ADN detectable) y enfermedad hepática no producen o han dejado de producir HBeAg. Se sabe que esta situación se genera por la presencia de una mutación en la posición 1896 de la región precore del genoma viral. Esta mutación (pre-core «minus») convierte el codón salvaje en un codón de parada, por lo que en la síntesis de las proteínas virales el precursor del HBeAg no se produce. Los títulos de HBeAg también pueden disminuir independientemente de la replicación viral, cuando las variantes con mutaciones en precore y promotor basal del core emergen previamente a la seroconversión del HBeAg; por estos motivos no se puede considerar al HBeAg estrictamente como un marcador de replicación viral, ya que su negatividad no se relaciona con la ausencia de replicación. Si en el seno de una hepatitis crónica replicadora aparece el virus mutante y este prolifera, la lesión hepática tiene peor pronóstico. La aparición de anticuerpos anti-HBe en el curso de una infección aguda indica generalmente un buen control de la infección y una disminución progresiva de la infectividad. En algunos pacientes con infección crónica puede coexistir el anti-HBe con el HBsAg, lo cual indica escasa actividad replicativa viral. En la mayoría de los casos crónicos la seroconversión a anti-HBe sucede pasados varios años (2-6% anual) y en estos casos es necesaria la comprobación de la actividad replicadora para instaurar un seguimiento correcto.
Interpretación de los marcadores serológicosLa valoración de los resultados analíticos debe hacerse de manera global. La solicitud al laboratorio del estudio de marcadores del VHB responde principalmente a 2 situaciones: el conocimiento del estado de susceptibilidad o protección de un individuo que, generalmente, está sano, y el diagnóstico de una infección clínicamente compatible con una hepatitis B. Adicionalmente, los marcadores del VHB se solicitan en el seno de actividades preventivas como el estudio en la gestación, en los pacientes en programas de hemodiálisis, profilaxis anti-VHB en pacientes inmunodeprimidos y el protocolo para donantes de sangre y de órganos. La monitorización del tratamiento sería otra de las posibles situaciones en las que puede requerirse la realización de determinados marcadores6,7.
Estado de susceptibilidad o protección. Se realiza mediante la determinación del anti-HBs. La inmunidad conseguida tras la vacunación es eficaz en casi la totalidad de los individuos estudiados. La inmunidad producida por la primoinfección viral provoca en la mayoría de los individuos considerados sanos una excepcional concentración de anticuerpos. Aunque la concentración de los anticuerpos, tanto los vacunales como los obtenidos mediante la infección, va disminuyendo con el tiempo, en general el individuo no deja de estar protegido. Es digno de mención que los pacientes recientemente vacunados pueden mostrar niveles detectables de HBsAg (vacunal) durante algunos días. La antigenemia en estos casos es transitoria, no denota infección y se aclara en una o 2sem. La presencia de anticuerpos «protectores» para el VHB en el recién nacido, en la mayoría de los casos, responde a la transferencia desde la madre durante los meses de gestación y son por tanto transitorios.
Diagnóstico en pacientes con cuadros agudos. La hepatitis B aguda suele estar producida por primoinfección y se presenta con gran sintomatología. En los tiempos actuales en los que la inmunosupresión nos ha concedido muchos beneficios terapéuticos, las reactivaciones de algunas formas crónicas, ayudadas por tratamientos adyuvantes, pueden ser también responsables de estos cuadros. En estos pacientes, se detectarán normalmente HBsAg y anticuerpos IgG e IgM frente al antígeno «core». Muy frecuentemente, estos pacientes presentarán también, en el segundo nivel de diagnóstico, positividad para el HBeAg. Con el tiempo las seroconversiones a anti-HBe y anti-HBs nos harán sospechar el control y curación de la infección. En pacientes inmunosuprimidos que desarrollan cuadros agudos, ya por primoinfección, ya por reactivación, es posible constatar la presencia de HBsAg con ausencia de anticuerpos frente al sistema «core». En estos pacientes, incapaces de establecer una respuesta inmune detectable, es muy probable que en el segundo nivel de diagnóstico se produzca reactividad para el HBeAg lo que nos confirmará el diagnóstico, descartando un resultado falso positivo del HBsAg. Su seguimiento serológico podría ser complejo por su escaso poder de respuesta y por la administración de globulinas e inmunomoduladores si esto se produce.
Diagnóstico en pacientes con cuadros crónicos. En un 5-10% de los pacientes infectados, la antigenemia puede persistir más de 6m y esto define la forma crónica de la enfermedad (fig. 1). El 90% de los niños infectados por vía perinatal llegan al estado de portador con casi nula oportunidad de curarse a lo largo de su vida. Lo mismo sucede con los pacientes que de alguna manera tienen comprometidos sus mecanismos naturales de respuesta como son los coinfectados con VIH, virus delta o en tratamiento con inmunosupresores. Estos enfermos mantienen niveles anormales de transaminasas, aunque inferiores a los de las formas agudas8.
En la forma activa el HBsAg se mantiene en concentraciones muy elevadas sin poder inducir la aparición de anti-HBs. El anti-HBc es de clase IgG aunque en algunos pacientes, en las fases de intensificación de la necrosis, pueden detectarse anticuerpos a títulos bajos de la clase IgM hasta negativizarse, pero los marcadores de replicación, HBeAg y ADN viral (>105copias/mL), permanecen detectables a concentraciones elevadas. El aumento de las transaminasas indica la actividad de la enfermedad.
En la forma inmunotolerante, los pacientes, a pesar de mantener una replicación viral intensa, HBeAg y ADN viral detectable, no son capaces de producir una respuesta inflamatoria y continúan durante tiempo en esta situación manteniendo las transaminasas con escasas alteraciones que nos indican poca necrosis o inflamación hepática.
Cuando se consolida la forma crónica activa, el HBeAg tiende a desaparecer de forma espontánea o por acción del tratamiento, ocurriendo la seroconversión a anti-HBe. La tasa anual de esta seroconversión es del 3-25% y cuando esto sucede el virus deja de replicarse con intensidad, ADN<105copias/mL, las transaminasas se normalizan y el enfermo entra en la forma inactiva o de «portadores asintomáticos verdaderos» con escasa lesión histológica.
Es posible la alternancia de una a otra forma a lo largo del tiempo y dependiendo de las circunstancias del paciente.
Infección oculta por el VHB. En el año 2008, la European Association for the Study of the Liver (EASL) definió la infección oculta por el VHB como la presencia de ADN del VHB en el hígado (con o sin ADN viral en suero) en individuos categorizados como negativos para el HBsAg. A pesar de ello, varios aspectos de la infección oculta por VHB son todavía desconocidos y necesitan ser aclarados en posteriores estudios.
Los marcadores moleculares del VHB son aquellos basados en la detección del ADN viral como la determinación de la carga viral, el genotipo, las caracterización de las diferentes variantes genómicas, y el ADNccc intrahepático2,3.
Carga viral del virus de la hepatitis BLa progresión de la enfermedad se encuentra estrechamente relacionada con factores de origen viral y del huésped; de todos ellos, el factor más importante es sin duda el mantenimiento de una replicación viral activa en el paciente infectado. La utilización de marcadores moleculares directos de la replicación viral es, por tanto, fundamental en el manejo de los pacientes infectados por el virus. La carga viral es, además, el mejor predictor de la progresión a cirrosis y carcinoma hepatocelular y esta progresión es proporcional a los niveles de carga viral. Las principales aplicaciones de este marcador de replicación en la práctica clínica se fundamentan en la definición de la presencia de la infección (sea esta oculta o no), en la demostración y diferenciación de la condición de portador inactivo o asintomático mediante la estimación de la infectividad, en la toma de decisiones terapéuticas, en la monitorización de la respuesta al tratamiento de cara a la consecución de la respuesta virológica, en la predicción y en la detección de la aparición de mutantes resistentes, y por último, en la prevención del riesgo de recurrencias en los pacientes trasplantados. En consecuencia, la monitorización seriada de la carga viral es más importante que cualquier valor aislado de corte arbitrario especialmente en el pronóstico y en la decisión del tratamiento. Por estos y otros motivos, son necesarias pruebas que sean sensibles, específicas, seguras, precisas, reproducibles, automatizables y con un amplio rango dinámico de cuantificación que permita la interpretación fiable de los datos de carga viral.
ADNccc intrahepáticoEl aclaramiento de los reservorios de ADNccc de las células infectadas parece ser precisamente el factor limitante de la eliminación del VHB, ya que estos persisten a pesar de las reducciones experimentadas en los niveles séricos de ADN viral, como la provocada por el tratamiento, y parecen ser los responsables de la replicación viral tras cesar el mismo. Estos datos indicarían el posible interés de la monitorización del ADNccc en tejido hepático. Un interés ciertamente limitado por el requerimiento de biopsia hepática y la ausencia de métodos moleculares sensibles y específicos para su detección y cuantificación. La buena correlación observada en algunos estudios con los niveles de HBsAg sugiere que la determinación cuantitativa de este antígeno podría ser una alternativa práctica a la determinación del ADNccc en tejido hepático.
Genotipo viralUno de los aspectos esenciales del VHB es su gran variabilidad genética. En líneas generales, los genotipos A y D son los más prevalentes en Europa. Mientras que, los genotipos B y C lo son en Asia, el genotipo E lo es en África y los genotipos F y H lo son en América del Sur y Central respectivamente. Hay que señalar que el genotipo es una variable que potencialmente puede influir en el pronóstico de la infección y en el éxito de la terapia antiviral, estableciendo una incidencia o riesgo para el genotipo C superior al resto. En cuanto a la respuesta al tratamiento, se ha observado que los genotipos C y D se asocian a una peor respuesta a la terapia basada en interferón que los genotipos A y B en términos de seroconversión del HBeAg. No se ha demostrado por el momento ninguna relación entre los genotipos y la respuesta al tratamiento con análogos de nucleósidos/nucleótidos. A pesar de estas evidencias y de las tímidas recomendaciones aparecidas en las últimas guías, especialmente en la europea, se necesitan datos adicionales antes de poder recomendar definitivamente su determinación en la práctica clínica.
Caracterización de variantes genómicasSe han descrito grupos de variantes genéticas que parecen tener implicaciones en el diagnóstico, patogénesis y tratamiento de la hepatitis crónica B. Entre estas variantes se encuentran las de la envuelta viral, las de la región precore/core, y las de la polimerasa viral, asociadas a la resistencia a antivirales.
Variantes en el genS. Se han descrito mutantes de HBsAg que pueden escapar a la protección de la vacuna. Además, la generación de estos mutantes de escape puede ocasionar también reactivaciones del VHB en pacientes previamente inmunizados con inmunoglobulina específica anti-HBs, así como afectar a los inmunoanálisis que detectan HBsAg.
Variantes en la región precore y en la región del promotor basal del core. Las principales variantes que impiden la expresión del HBeAg se detectan en la región precore. Las variantes que disminuyen la expresión del HBeAg contienen en su mayoría cambios en la región del promotor basal del core. La presencia de estas variantes (junto a la deleción preS) suele asociarse a formas más graves de enfermedad hepática con progresión a cirrosis y carcinoma hepatocelular y a casos de hepatitis fulminante.
Variantes en el genPOL. La terapia antiviral tiene como objetivo asegurar un grado de supresión virológica que conduzca a la remisión bioquímica, a la mejora histológica y a la prevención de las complicaciones. Además, la reducción sostenida de la carga viral a niveles indetectables también es necesaria para reducir el riesgo de resistencia a los antivirales de acción directa (análogos de nucleósidos y nucleótidos). Actualmente, la terapia antiviral oral con los agentes de mayor potencia y barrera genética como el entecavir y el tenofovir se ha convertido en el pilar del tratamiento de la hepatitis B. Las mutaciones de resistencia se seleccionan en diferentes regiones del gen de la polimerasa y son específicas de cada fármaco o familia de fármacos, aunque también se han identificado mutaciones que pueden conferir resistencia cruzada entre los diferentes antivirales. En la actualidad, las pruebas de resistencia no se realizan de forma extensiva, al asumirse que los incrementos en la carga viral son indicativos de la resistencia antiviral.
TratamientoLas hepatitis B en fase aguda no tienen indicación de tratamiento dado que muchas de ellas son autolimitadas. La decisión de tratar o no una hepatitis B crónica depende de diferentes factores. Existen distintas opciones terapéuticas para el tratamiento de la hepatitis B. El interferón, preferentemente pegilado (Peg-IFN), cuenta con la ventaja de utilizarse en tratamientos relativamente cortos y no generar mutaciones de resistencia. Su tolerancia es el principal inconveniente. Por otra parte, la terapia antiviral oral se ha convertido en el pilar del tratamiento de la hepatitis B, principalmente debido a los efectos de su profunda supresión viral y también debido en parte a la sencillez de su dosificación y a la ausencia de efectos adversos a pesar de su duración. Entre estos antivirales análogos de nucleósido y nucleótido se encuentran los siguientes: la lamivudina, el tratamiento es económico, pero selecciona fácilmente mutantes resistentes; el adefovir, que puede utilizarse para tratar a pacientes infectados por cepas resistentes a la lamivudina, aunque su potencia antiviral a dosis no nefrotóxicas no es óptima; la telbivudina, que cuenta con mayor actividad antiviral que la lamivudina y el adefovir, pero selecciona las mismas mutaciones de resistencia que la lamivudina y se han descrito casos de miopatías y neuropatías periféricas; el entecavir tiene una gran potencia antiviral y su tasa de resistencias es muy baja por su alta barrera genética; el tenofovir también utilizado en las pautas de tratamiento del VIH, tiene una gran potencia antiviral, puede utilizarse en pacientes naïve o con historia de resistencias a la lamivudina, la telbivudina o el entecavir. Los tratamientos combinados muestran una potencia antiviral ampliada respecto a las monoterapias, una mayor respuesta viral sostenida y una mayor dificultad en la aparición de resistencias3.
ProfilaxisLa transmisión del virus se produce por el contacto de sangre o fluidos corporales de pacientes infectados. Es interesante que, a pesar de conocerse los mecanismos de transmisión, en al menos un 30% de los casos se desconoce el factor de riesgo de la infección. Los medios más importantes para la prevención de la transmisión vienen constituidos por medidas generales de higiene. La vacunación está teniendo un impacto innegable en la prevención de la infección y de las complicaciones asociadas a ella. En España, su inclusión en el calendario vacunal de las comunidades autónomas se inició en 1991 y se completó en el año 2002. La inmunización pasiva con la administración de inmunoglobulinas también es de gran utilidad en determinadas situaciones como en el trasplante hepático por VHB o en los niños nacidos de mujeres infectadas. En los pacientes inmunodeprimidos o que van a sufrir inmunosupresión es fundamental la vacunación y, si existe la posibilidad de reactivación viral, se recomienda incluso la administración de tratamientos antivirales preventivos. El tratamiento de los pacientes virémicos es también un factor clave para limitar la transmisión de la enfermedad.
Hepatitis CEl virus de la hepatitis C (VHC), identificado en 1989, pertenece a la familia Flaviviridae y su tamaño aproximado es de 60nm. Posee ARN monocatenario de polaridad positiva, de 9,5kb, una nucleocápside icosaédrica y una envuelta. Se caracteriza por una alta tasa de mutaciones debido a que la ARN polimerasa dependiente del virus no posee actividad exonucleasa 3′-5′ correctora de errores (alta heterogeneidad del virus, se conocen 6 genotipos y, al menos, 50 subtipos diferentes). El virus es capaz de originar infecciones agudas y persistentes. La principal vía de transmisión de este virus es la parenteral (85%), por contacto percutáneo o de mucosas con material contaminado con sangre, hemoderivados o fluidos corporales infectados. En niños, el mecanismo más importante es la transmisión vertical (10%). La transmisión por vía sexual es poco probable (menos del 2% de los casos). La prevalencia global de la infección es de aproximadamente un 3%, variando de un 0,4-1,1% en Europa occidental y EE. UU., a un 9,6-28% en el norte de África. En nuestro medio se estima en alrededor de un 2-2,5%. En poblaciones de riesgo la prevalencia puede elevarse hasta un 70%. El VHC es el causante del 20% de los casos de hepatitis aguda pero, debido a su forma silente de presentación, rara vez se diagnostica. Existe un periodo ventana de 4-8sem en el cual no hay un aumento de transaminasas, ni seroconversión anti-VHC, pero la viremia es detectable. Aproximadamente el 80% de los infectados son portadores crónicos del virus, un 20% muestran valores de transaminasas persistentemente elevados con riesgo de evolucionar a una cirrosis tras más de 20 años de evolución y solo un 10% aproximadamente pueden desarrollar una cirrosis hepática precozmente. Un 5% de los casos desarrollan hepatocarcinoma1,3,9,10.
ClínicaLa infección por el VHC puede cursar de forma aguda o crónica. Las infecciones agudas son frecuentemente asintomáticas. Las hepatitis agudas por VHC evolucionan a la cronicidad en un 80% de los casos y raramente presentan una evolución fulminante. La hepatitis crónica por VHC es la principal causa de cirrosis hepática y de trasplante hepático. Las mayores complicaciones de la infección por el VHC son la cirrosis, con descompensación hepática, ascitis, varices esofágicas, hemorragias y encefalopatía hepática, y el carcinoma hepatocelular. Son frecuentes, además, las manifestaciones extrahepáticas de la enfermedad de carácter autoinmune como la tiroiditis, la crioglobulinemia mixta, la artritis o la glomerulonefritis.
DiagnósticoLa primera aproximación diagnóstica ante una sospecha de infección por VHC debe de incluir una historia clínica completa y un examen físico del paciente seguido de una analítica general. Generalmente está indicada una biopsia hepática para conocer la posible presencia de fibrosis y su grado. En los últimos tiempos han entrado en juego ciertos marcadores para predecir el pronóstico de la infección así como la eficacia terapéutica con Peg-IFN y ribavirina frente al VHC. Se trata de los polimorfismos del gen de la interleucina IL28B. Parece que los pacientes con genotipos favorables en las posiciones rs12979860 y rs8099917 en el gen de la IL28B, genotipos CC y TT respectivamente, tendrían mejores respuestas al tratamiento; estos pacientes, además, tendrían una menor probabilidad de cronificar la infección y una mayor probabilidad de aclaramiento viral espontáneo.
El diagnóstico microbiológico específico para la detección de la infección por el VHC se basa en la demostración de anticuerpos anti-VHC o antígenos y detección del ARN viral por técnicas moleculares9,10.
Las técnicas indirectas (anticuerpos) constituyen la primera línea diagnóstica y son indicativas de infección activa o pasada, mientras que las técnicas directas de demostración de viremia (ARN o antígenos) indican infección activa.
Detección de anticuerpos antivirus de la hepatitis CLos ensayos de tercera generación, de tipo EIA o CLIA, detectan anticuerpos a antígenos recombinantes del core, NS3, NS4 y NS5. Son sistemas de alta especificidad y muy alta sensibilidad y su periodo ventana está en torno a las 6 o 7sem. Existen test rápidos basados en técnicas de inmunocromatografía que ofrecen resultados en menos de 30min. Otro formato disponible son los inmunoblots con antígenos recombinantes (RIBA y LIA). Estos sistemas permiten detectar anticuerpos del paciente frente a diferentes antígenos de forma independiente. Los resultados se evidencian sobre una tira de celulosa o nailon sobre la que se han depositado antígenos recombinantes. Son ensayos con excelente especificidad por lo que suelen ser utilizados como confirmatorios, y son útiles para descartar reacciones falsamente positivas de los test de screening. En recién nacidos de madres infectadas y en algunos pacientes inmunodeprimidos, con una respuesta humoral reducida, es posible que no se detecten fácilmente los anticuerpos anti-VHC. En estos casos, está indicada la utilización de técnicas moleculares para la detección del ARN del VHC para descartar la infección. La detección de anticuerpos también tiene una utilidad reducida en la sospecha de la infección muy reciente, debido al periodo ventana. En este caso, también debería utilizarse alguna técnica directa para la detección del virus dado que evidenciaríamos las primeras etapas replicativas del virus en las que se alcanzan altos niveles de viremia11.
Detección de antígenos del virus de la hepatitis CExisten ensayos comerciales de detección de antígeno del core del VHC en suero o plasma, en formato de detección enzimática en microplaca (EIA) o por quimioluminiscencia (CLIA). Se trata de ensayos de detección directa de viremia y, en cierto sentido, serían equivalentes a las técnicas de detección molecular. Estas técnicas cuentan con ciertas ventajas sobre la PCR, son mucho más económicas, pueden realizarse sin necesidad de acumular muestras y son muy rápidas. Alguna ofrece resultados en 40min. A pesar de estas ventajas, el uso de estas técnicas no está muy extendido, básicamente porque son algo menos sensibles en cargas virales bajas (no son reactivas por debajo de 5.000-10.000UI/mL de ARN) y porque la técnica de referencia en muchas guías de diagnóstico y tratamiento es la PCR, que cuenta con muchísimos datos publicados que la avalan.
Carga viral del virus de la hepatitis CLa detección del ARN-VHC en plasma implica infección activa y por lo tanto capacidad infectiva. Sin embargo, un resultado negativo (o indetectable) no excluye totalmente la infección, ya que el virus puede encontrarse en los hepatocitos o en los linfocitos. Su determinación es útil en diversas circunstancias; así, proporciona evidencias de infección aguda cuando los anticuerpos anti-VHC aun no son detectables, sirve para verificar el diagnóstico de infección vertical, confirma una hepatitis crónica C, confirma la infección en pacientes con una alteración de la inmunidad humoral y que no expresan el anti-VHC, y, además, es muy importante en la monitorización de la respuesta al tratamiento antiviral. Aunque tradicionalmente las técnicas se dividían en cualitativas y cuantitativas, en la actualidad las primeras están cayendo en desuso y las cuantitativas cuentan con excelentes sensibilidades, permitiendo la detección hasta un nivel de 15UI del VHC/mL de plasma y requieren entre 500μL y 1mL de plasma o suero. La mayoría de las técnicas utilizadas se basan en RT-PCR a tiempo real con sondas fluorescentes. Son rápidas y permiten rangos dinámicos amplios (15-108UI/mL). En todas ellas, la introducción de la extracción automática de ácidos nucleicos ha supuesto un considerable ahorro de trabajo manual y reduce las posibilidades de variabilidad en una de las fases más críticas del procedimiento12,13.
Genotipado del virus de la hepatitis CLa determinación del genotipo es fundamental en la evaluación del paciente, para la predicción del pronóstico y la planificación del tratamiento. El método de referencia para el genotipado del VHC es la secuenciación directa de las regiones NS5B, E1 o E2 del genoma viral, pero se utiliza poco por su laboriosidad. La mayoría de los métodos disponibles detectan correctamente los 6 genotipos principales, aunque algunos no logran identificar el subtipo en el 10-25% de los casos14,15.
Tratamiento de la hepatitis crónica CEl tratamiento actual de la infección, con la combinación de Peg-IFN y ribavirina, consigue respuesta viral sostenida en alrededor del 50% de los casos de los enfermos infectados por el genotipo 1, que es la forma más común en nuestro entorno (75% de los infectados). La reciente comercialización del boceprevir y del telaprevir, los primeros inhibidores de la proteasa del virus de la hepatitis C, supone un cambio esperanzador en el tratamiento de la hepatitis crónica por el VHC. La introducción de la triple terapia que incluye, además de Peg-IFN y ribavirina, un agente antiviral directo como telaprevir o boceprevir puede permitir que se alcance una tasa de curación del 75% en los enfermos infectados por el genotipo 1 que no hayan recibido tratamiento alguno (enfermos naïve) y de cerca del 50% en los que no hayan presentado respuesta a un tratamiento doble previo. El boceprevir y el telaprevir no están actualmente indicados en el tratamiento de la hepatitis crónica por el VHC causada por otros genotipos. Existen otros fármacos inhibidores de la proteasa que están ofreciendo excelentes resultados como el simeprevir, e incluso fármacos de otras familias como el sofosbuvir (inhibidor de la polimerasa viral) que es, además, activo frente a virus de genotipos diferentes al 1 (2 y 3). Hay otros muchos fármacos en diferentes etapas de desarrollo, más o menos próximas a su utilización en clínica, como el daclatasvir, el faldaprevir, el asunaprevir, el mericitabine, el danoprevir y micro-ARN. Este panorama terapéutico tan prometedor probablemente cambiará muchos aspectos de la infección por el VHC en un tiempo relativamente corto así como las necesidades del diagnóstico3.
ProfilaxisNo se dispone de una vacuna específica que pueda evitar esta infección, debido a la gran variabilidad genómica del VHC. La IgG polivalente tiene poca utilidad y no hay disponible una hiperinmune. Hay que evitar la transmisión parenteral mediante el control de los anticuerpos anti-VHC en los donantes de sangre y pacientes en hemodiálisis, luchar contra la drogadicción y a favor del empleo de material desechable por los adictos a drogas por vía parenteral, usar guantes si se ha de tocar sangre de otra persona, no compartir objetos de higiene personal con una persona infectada, comprobar que toda escoriación o perforación (tatuajes, pendientes, «piercings», etc.) sea hecha con instrumentos desechables o correctamente esterilizados, y fomentar el uso del preservativo en las relaciones sexuales de riesgo. Para evitar la transmisión vertical no está recomendado el uso de la cesárea electiva, con la excepción de los casos de madre coinfectada por VIH. La lactancia materna no está contraindicada, siendo escasa la capacidad infecciosa de las partículas detectadas en leche asociadas al pH ácido del estómago que las inactiva.
Hepatitis deltaEl virus delta o virus D (VHD) es un virus defectivo que necesita la presencia del VHB para producir infección. El virión cuenta con una envuelta lipoproteica formada por el HBsAg y una estructura proteica interna donde reside el genoma viral, constituido por una única hebra de ARN que forma un complejo con el único antígeno codificado por el propio virus, el HDAg. La infección es muy frecuente en niños e individuos jóvenes. La transmisión es permucosa o percutánea y se favorece con la falta de higiene. La infección por VHD debe sospecharse en pacientes que provienen de zonas endémicas (países de Europa del Este, mediterráneos y América Central) y en usuarios de drogas administradas por vía parenteral y nunca en ausencia de infección por VHB. Las diferentes situaciones clínicas relacionadas con la infección del VHD como la coinfección VHB/VHD, la sobreinfección por VHD en pacientes ya infectados por VHB o la infección crónica por VHD pueden caracterizarse estudiando la presencia o ausencia del ARN viral, el HDAg y los anticuerpos anti-VHD16–18.
ClínicaLas presentaciones clínicas de la infección pueden variar de formas agudas benignas, formas crónicas a veces asintomáticas a cuadros de hepatitis fulminante. La infección simultánea por VHD y VHB (coinfección) normalmente condiciona una hepatitis aguda, muchas veces autolimitada e indistinguible de una hepatitis aguda por VHB exclusivamente. La infección por VHD en pacientes previamente infectados por VHB (sobreinfección) suele tener un peor pronóstico, causa una hepatitis aguda severa o una exacerbación de una hepatitis B crónica. La evolución a una forma crónica de hepatitis por VHD ocurre en casi la totalidad de los pacientes.
DiagnósticoNo debe buscarse la presencia de VHD en ausencia del VHB. El diagnóstico microbiológico del VHD se basa en la detección y/o cuantificación de antígenos, anticuerpos y del genoma del virus. Las muestras de elección son el suero y, en determinadas ocasiones, la biopsia hepática.
Detección de antígenos del virus de la hepatitis D en sueroEl HDAg puede detectarse en sistemas tipo EIA o RIA, aunque su utilización no es frecuente en los laboratorios de diagnóstico. En la infección aguda, la antigenemia es muy transitoria y puede, por ello, pasar desapercibida. Es ligeramente más duradera en los pacientes inmunodeprimidos. En la fase crónica, aunque existen altos títulos de HDAg y su presencia circulante es más prolongada, la mayor parte están formando complejos con anticuerpos, por lo que su detección es compleja.
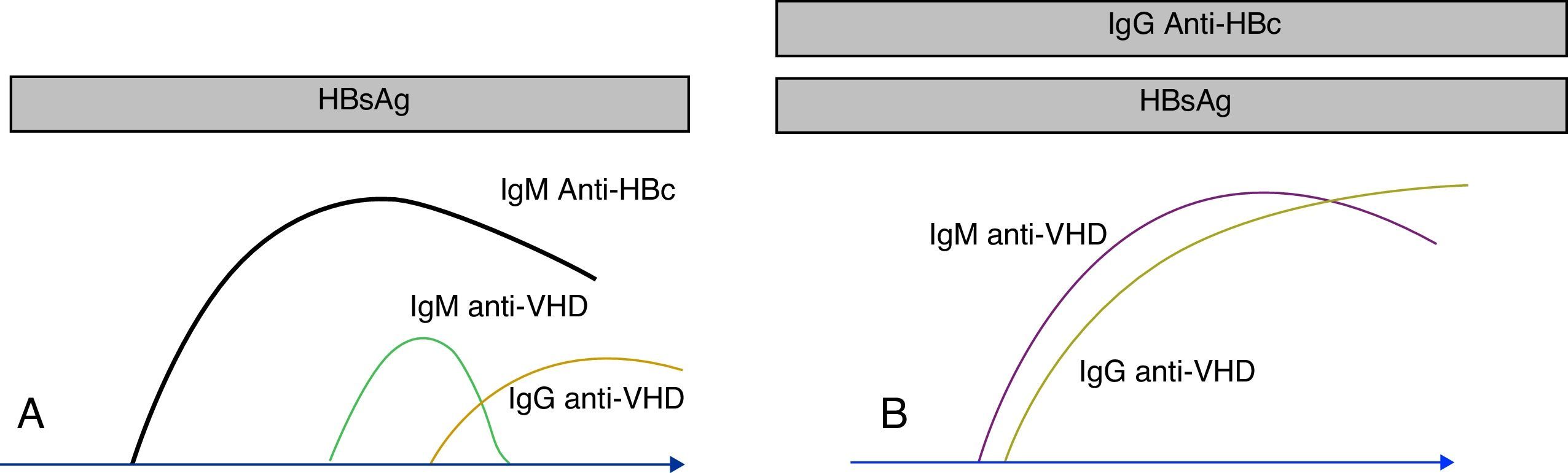
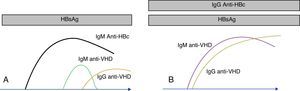
Detección de anticuerpos antivirus de la hepatitis DLos primeros anticuerpos se elevan a las pocas semanas de la infección. La seroconversión es una buena forma de diagnosticar la infección en estas fases iniciales. La presencia exclusiva de anticuerpos de clase IgM es también indicativa de esta fase de la infección. Aunque la IgM desaparece pronto en las formas autolimitadas y en las formas agudas, puede ser muy perdurable en las formas crónicas, especialmente en las sobreinfecciones (VHD sobre VHB). Una buena forma de diferenciar las sobreinfecciones de las coinfecciones (VHD+VHB) es que en este último caso coexiste la IgM anti-VHD con la IgM anti-HBc (fig. 2). Es frecuente que, en pacientes con infección crónica, la IgM muestre un declive (e incluso desaparezca) después del tratamiento efectivo o después del trasplante18.
Marcadores serológicos del VHD. Los anticuerpos anti-VHD aparecen en presencia del antígeno de superficie del VHB. En la coinfección (A) los anticuerpos anti-VHD se elevan conjuntamente con la IgM anti-HBc. En la sobreinfección (B), la seroconversión de VHD se presenta sobre anticuerpos anti-HBc de clase IgG.
Los marcadores moleculares en la infección (coinfección/sobreinfección) por el VHD están basados en la detección y caracterización del ARN del VHD.
ARN del virus de la hepatitis DEl ARN del VHD es el marcador de replicación viral en la infección por el VHD y permanece detectable en todos los pacientes con infección aguda y crónica. Este marcador se negativiza con el aclaramiento viral, ya sea de modo espontáneo, ya por acción del tratamiento. La disminución del nivel de ARN del VHD y del título de HBsAg durante el tratamiento puede representar un indicador del éxito terapéutico.
Genotipos del virus de la hepatitis DTomando como base su variabilidad genética, se han descrito 8 genotipos del VHD con diferentes propiedades y distribución geográfica. La infección por el genotipo 1, el más prevalente en Europa, está asociada con un peor pronóstico de la enfermedad. El genotipado del VHD está solo disponible en centros especializados.
Tanto la detección del HDAg como del ARN de VHD pueden realizarse sobre biopsias hepáticas. Es un hecho que las técnicas histológicas son tediosas, lentas y de difícil interpretación, y que las técnicas de detección de genomas y antígenos en sangre circulante son cada vez más sensibles y específicas, por lo que las primeras han entrado en desuso en la actualidad.
Tratamiento y profilaxisEl único fármaco aprobado para la infección por el VHD es el interferón alfa en su forma estándar o pegilada. Se desconoce su mecanismo de acción, pero parece que pudiera basarse en su actividad sobre el VHB más que sobre el propio VHD o en sus efectos inmunomoduladores. En cuanto a las nuevas opciones de tratamiento, se incluyen los inhibidores de la prenilación y los inhibidores de la entrada del VHB los cuales están en las primeras fases de desarrollo clínico. La eficacia de otros compuestos con una amplia eficacia antiviral, como la nitazoxamina, podrían ser interesantes en la investigación frente al VHD. Finalmente, varios interferones alternativos bajo desarrollo clínico, incluyendo el IFNλ, también se podrían explorar para la hepatitis D.
Existen diferentes estudios de administración de vacunas específicas frente al VHD en modelos animales que se basan en fragmentos del HDAg modificados por tratamientos químicos, producidos por ingeniería genética o de péptidos sintéticos del citado antígeno.
Hepatitis ESe trata de la primera causa de hepatitis e ictericia en el mundo con 20 millones de nuevas infecciones, 3 millones de hepatitis agudas y 57.000 muertes cada año. La hepatitis E es una infección viral de transmisión típicamente orofecal, fundamentalmente a través de aguas contaminadas. Sus características clínicas son las de una hepatitis aguda similar a la producida por el VHA. El virus de la hepatitis E (VHE) pertenece a la familia Hepeviridae y constituye el género Hepevirus. Se trata de un virus ARN, de polaridad positiva y pequeño tamaño, sin envuelta, e icosaédrico. Existen 4 genotipos descritos, de los cuales el i y el ii afectan exclusivamente al hombre y el iii y el iv al hombre y a los animales, muy especialmente al ganado porcino. Su mecanismo de transmisión es muy similar al de la hepatitis A y, al igual que esta, la hepatitis E generalmente no se cronifica. Aunque la enfermedad generalmente presenta una baja mortalidad (0,2-0,3%), puede llegar a ser extremadamente grave en mujeres gestantes, en las que con frecuencia origina un fallo hepático fulminante con tasas de mortalidad entre el 20-30% y en pacientes imnunodeprimidos19,20.
Manifestaciones clínicas y diagnóstico clínicoEl periodo medio de incubación de la hepatitis E es de unos 40 días. La elevación de los valores séricos de enzimas hepáticas se produce normalmente entre los 30 y 120 días después de la infección. La excreción fecal del VHE comienza alrededor de una semana antes del inicio de los síntomas de la enfermedad y continúa durante 2 o 3sem después. La fase «ictérica» se caracteriza por la aparición de una coloración amarillenta en la piel y mucosas, asociada a un cuadro seudogripal. También se puede observar coluria, heces de color arcilloso, hepato- y esplenomegalia, eritema y rash con prurito, etc.
Diagnóstico microbiológicoLos inmunoanálisis enzimáticos constituyen la herramienta de diagnóstico principal para la detección de anticuerpos frente al VHE. El genoma (ARN) del VHE se puede detectar en heces y en suero mediante RT-PCR. Su detección indica infección activa. El diagnóstico de la infección por el VHE es muy similar al de la infección por el VHA y está basado en la detección indirecta de anticuerpos específicos de tipo IgM e IgG que constituyen los marcadores serológicos de la infección21,22.
IgM antivirus de la hepatitis EEl diagnóstico de la infección aguda por el VHE se fundamenta en la detección de los anticuerpos específicos de tipo IgM (IgM anti-VHE) que son los primeros en aparecer y que permanecen detectables durante periodos prolongados, aunque experimentan una disminución progresiva desde el final de la fase aguda.
IgG antivirus de la hepatitis ELos anticuerpos específicos de clase IgG (IgG anti-VHE) se hacen detectables casi a la vez que los de clase IgM, permanecen detectables durante años y no sirven para diferenciar la infección aguda de la pasada, si bien su presencia junto a los de tipo IgM y a un incremento significativo en su titulación de hasta 4 veces apoyan el diagnóstico de hepatitis E. Su presencia en solitario en ausencia de clínica es indicativa de infección pasada. No está claro si los anticuerpos IgG anti-VHE confieren una acción protectora eficaz y si mantienen títulos duraderos.
ARN del virus de la hepatitis EAl igual que en otras infecciones cuyo diagnóstico se basa en la detección indirecta, el diagnóstico de infección aguda por el VHE basado en la detección de anticuerpos de clase IgM se puede confirmar mediante la detección molecular del ARN del VHE. La detección del ARN del VHE mediante técnicas de amplificación de ácidos nucleicos es una alternativa para el diagnóstico y confirmación de la infección por el VHE, en muestras de suero o heces. Estos ensayos moleculares son también los más adecuados para utilizar en el diagnóstico de pacientes inmunodeprimidos. Una aplicación determinante del ARN del VHE es el diagnóstico de la infección crónica (que es excepcional) por el VHE, definida por la presencia persistente de dicho ARN-VHE en el suero del paciente durante al menos 6m.
Genotipo viralLa caracterización molecular del VHE mediante secuenciación de los fragmentos genómicos amplificados y posterior análisis filogenético con las secuencias de las cepas de referencia permite clasificarlo en 4 genotipos bien conocidos (1-4).
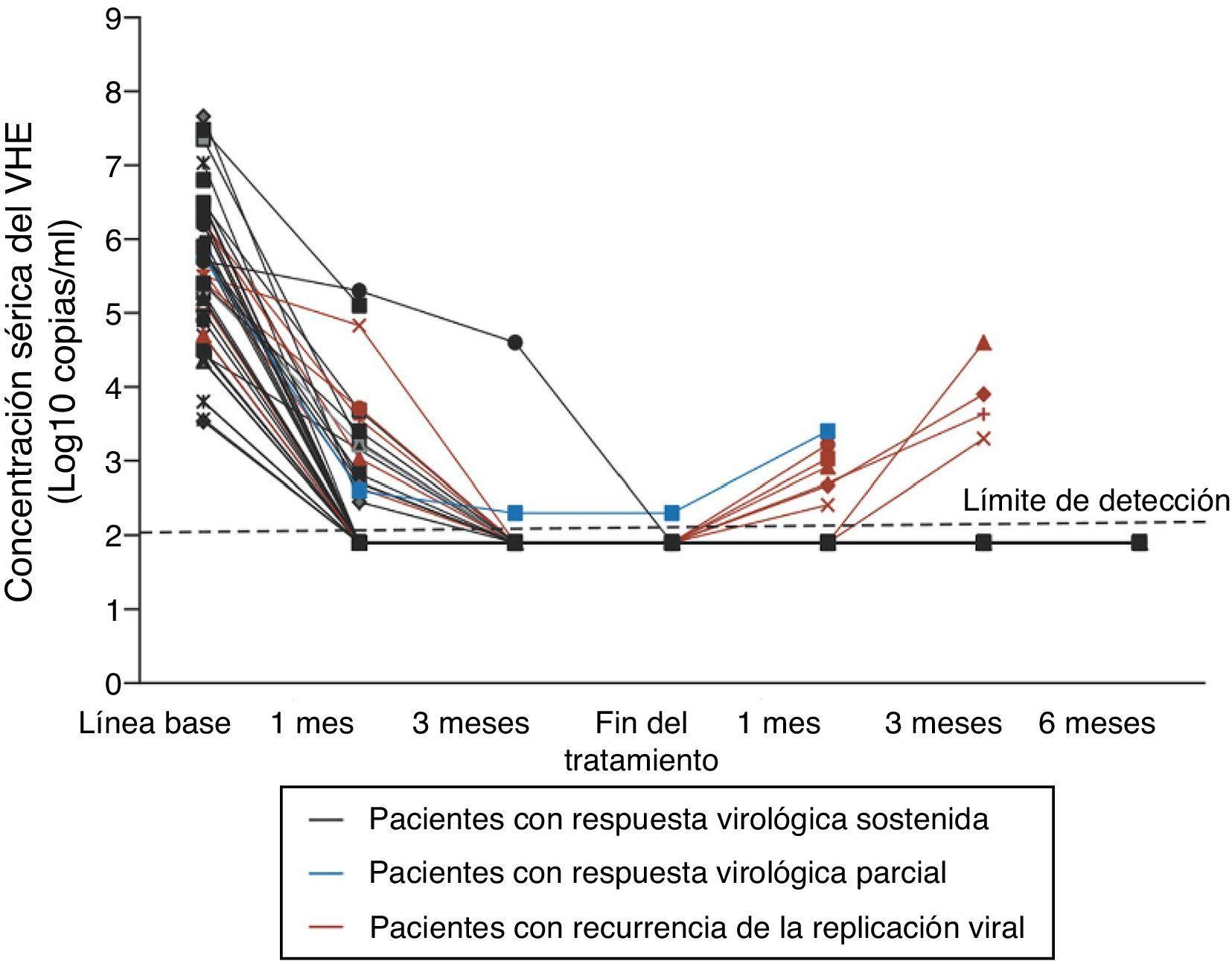
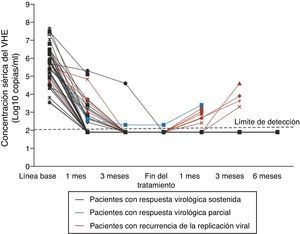
Tratamiento y profilaxisEl tratamiento de la hepatitis E es generalmente innecesario dado que la infección sintomática es muy frecuentemente autolimitada. Existe, sin embargo, alguna experiencia en el tratamiento de determinados grupos de pacientes, como los receptores de trasplantes, aunque es experimental y ningún fármaco ha sido aprobado para este uso. El tratamiento con ribavirina (600-800mg/d durante 12 semanas) o combinada con Peg-IFN ha demostrado reducir la carga viral de VHE y proporcionar una supresión virológica mantenida (fig. 3)23,24.
Concentración sérica del VHE durante el tratamiento con ribavirina. Adaptada de: Kamar et al.23.
Es fundamental la aplicación de medidas generales de higiene para prevenir la infección. La utilidad de la administración de inmunoglobulinas pre- o postexposición es muy dudosa. Desde hace algunos años están siendo investigadas en diferentes fases de ensayos clínicos 2 vacunas recombinantes que han demostrado seguridad e inmunogenicidad aceptable en sus primeros resultados.
Hepatitis G y otros virusVirus TT y otros anellovirusEl virus TT (VTT) se describió en 1997 como asociado a hepatitis postransfusionales de etiología desconocida. Aunque inicialmente ciertas características del virus como su alta concentración en hígado frente a plasma y que se asociaba a altos niveles de transaminasemia apuntaban a su naturaleza hepatotropa; en la actualidad este hecho es controvertido. El VTT se clasifica dentro de la familia Anelloviridae. La familia incluye otros 2 virus humanos muy relacionados, el torque teno minivirus y el torque teno midivirus. Estos virus son muy similares al VTT en cuanto a morfología, distribución etc. Los viriones tienen morfología esférica y no tienen envuelta. Su genoma está formado por una molécula de ADN circular de cadena sencilla. El genoma presenta varias ORF parcialmente solapadas con una alta variabilidad entre cepas y un gran número de genotipos que se agrupan en 5 grupos filogenéticos (1-5) con diferencias de secuencia del 40% de nucleótidos. Los grupos 1 y 3 son los más frecuentes y el grupo 2 el más raro. La variante más caracterizada se denomina virus SEN. La distribución del VTT es más amplia de lo que se pensó inicialmente y su prevalencia en la población general es muy elevada, pudiendo oscilar entre el 2% comunicado en el Reino Unido y el 62% en Brasil (11% en España). Algunos autores proponen incluso prevalencias del 80-90% en la población general. Su significación clínica es muy controvertida. El VTT se ha aislado de la práctica totalidad de los tejidos del cuerpo, con excepción del sistema nervioso central y se excreta en grandes cantidades en las heces, orina, saliva y fluidos nasales, además es muy resistente al medio ambiente y su vía de transmisión comprende rutas muy diversas.
El diagnóstico se basa en la utilización de técnicas de amplificación genética. Los sistemas comerciales, tanto de PCR como de serología están en fase de desarrollo25,26.
Virus de la hepatitis GSe trata de un virus ARN de la familia Flaviviridae. La distribución del VHG (o VGB-C) es universal y su prevalencia es alta incluso en países desarrollados e industrializados. Existen pocas evidencias de su implicación en patología humana. Aunque el ARN del VHG se ha detectado en pacientes con hepatitis aguda no-A no-E, en pacientes con hepatitis crónica, en pacientes con cirrosis criptogénica e incluso en pacientes con carcinoma hepatocelular, su alta tasa de coinfección con el VHC hacen difícil su valoración como agente etiológico. La coinfección por VHG en pacientes VIH positivos parece tener un cierto efecto protector a nivel de los linfocitos T-helper y de la producción de citocinas. Ese efecto protector sería muy evidente en pacientes no tratados y no tanto en pacientes tratados con antirretrovirales, y no prevendría frente a la transmisión vertical del virus.
El virus se diagnostica por amplificación de su ARN por medio de sistemas de RT-PCR. También es posible detectar anticuerpos frente al virus. Parece que la elevación de los anticuerpos se correlaciona con el aclaramiento del ARN viral por lo que dichos anticuerpos tendrían un efecto protector. No existen, sin embargo, grandes desarrollos comerciales para el diagnóstico del virus3.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.