Las infecciones producidas por Strongyloides stercoralis y otros geohelmintos, como las uncinarias (Necator americanus y Ancylostoma duodenale), representan un importante problema a nivel mundial, especialmente en áreas en vías de desarrollo. Clínicamente son difíciles de sospechar ya que producen cuadros inespecífi-cos y muchas veces solapados entre ellos. Asimismo, los largos períodos prepatentes que presentan dificultan la detección de las formas parasitarias. El diagnóstico microscópico continúa siendo la herramienta más utilizada en los laboratorios asistenciales, pero aún dista mucho de ser la herramienta ideal para detectarlos debido a su baja sensibilidad. Además, morfológicamente estos nematodos presentan similitudes importantes, por lo que el diagnóstico microbiológico aún es un reto. La serología ha permitido avanzar en cuanto al diagnóstico de la infección por S. stercoralis, pero esta opción no está disponible todavía para las uncinarias. Las técnicas de biología molecular han demostrado aumentar discretamente esta falta de sensibilidad, pero al igual que en otras infecciones parasitarias, actualmente no están disponibles para su uso en los laboratorios de microbiología clínica. Información sobre el suplemento:este artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. y Sociedad Española de Enfermedades Infecciosasy Microbiología Clínica. Todos los derechos reservados.
Infections caused by Strongyloides stercoralis and other soil-transmitted worms such as hookworms (Necator americanus and Ancylostoma duodenale) represent a major problem worldwide, especially in developing areas. They are difficult to suspect clinically since they produce non-specific and often overlapping signs and symptoms. Likewise, their long prepatent periods hamper the detection of parasitic structures. Microscopic diagnosis is still the most commonly used tool in healthcare laboratories but it is still far from being the ideal technique to detect these infections due to its low sensitivity. In addition, these nematodes have strong morphologic similarities and consequently microbiological diagnosis remains a challenge. Serology has made progress in the diagnosis of S. stercoralis infection but this option is not yet available for hookworms. Molecular biology techniques have been shown to slightly increase this lack of sensitivity, but as with other parasitic infections, they are not currently available for use in clinical microbiology laboratories. Supplement information: This article is part of a supplement entitled «SEIMC External Quality Control Programme. Year 2016», which is sponsored by Roche, Vircell Microbiologists, Abbott Molecular and Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. and Sociedad Española de Enfermedades Infecciosasy Microbiología Clínica. All rights reserved.
Más de 1.500 millones de personas en el mundo (aproximadamente, el 25% de la población mundial) están infectadas con algún geohelminto. Aunque algunos de estos parásitos presentan una distribución cosmopolita, los datos epidemiológicos circunscriben su localización a zonas tropicales y subtropicales que afectan a las comunidades más pobres y desfavorecidas. Las mayores cifras se registran en África subsahariana, el continente americano (especialmente Centroamérica y Sudamérica), China y Asia Oriental1. Etimológicamente, el nombre de geohelminto deriva de la necesidad de estos vermes de realizar un proceso madurativo en el suelo y su definición sería la de aquellos helmintos cuyas formas infectantes se encuentran en el suelo y penetran en el ser humano por vía oral o transcutánea. De ello se puede deducir que este término engloba diferentes especies de gusanos que pueden producir infecciones en el hombre, bien por ingestión de huevos eliminados a través de las heces de las personas infectadas (vía oral), bien por larvas que maduran hasta transformarse en una forma que puede penetrar de forma activa en la piel (vía transcutánea). En este aspecto, 2 geohelmintos serán objeto de esta revisión y presentan precisamente esta ruta: el Strongyloides stercoralis y las uncinarias (Necator americanus y Ancylostoma duodenale). Cabe destacar la dificultad que ambos helmintos presentan a la hora de establecer un diagnóstico ya que las técnicas comúnmente utilizadas, el examen en fresco de muestras fecales concentradas o la técnica de Kato-Katz, poseen baja sensibilidad tanto para S. stercoralis como para las uncinarias, y además esta sensibilidad disminuye en regiones de baja endemicidad2. A pesar de que la Organización Mundial de la Salud (OMS) recomienda diversas técnicas para establecer el diagnóstico de las infecciones por geohelmintos3, aún estamos muy lejos de contar con una herramienta lo suficientemente sólida. A esta falta de precisión diagnóstica, se le suma que todas estas técnicas reposan en el diagnóstico microscópico, no exento de subjetividad y dependiente de la experiencia de la persona que realiza la observación.
La morbilidad causada por este tipo de helmintos no es para nada despreciable. Los últimos datos sugieren que los años de vida ajustados por discapacidad (DALY, Disability-Adjusted Life-Years) han disminuido, pero esto ha sido a expensas de países de renta alta o media, no así en los países de renta baja, en los cuales es probable que no se haya podido estimar realmente la magnitud del problema (como las anemias crónicas no atribuidas a infecciones por uncinarias)4.
En ambas infecciones, los síntomas son inespecíficos, vagos y de difícil definición clínica. A continuación se describen algunas claves para su correcta diferenciación.
Strongyloides stercoralisDistribución geográfica y epidemiologíaStrongyloides stercoralis es un nematodo intestinal de distribución cosmopolita, especialmente prevalente en zonas tropicales y subtropicales, como África, el Sudeste Asiático o América Latina5,6, aunque también se ha descrito en áreas templadas, como algunos países de Centroeuropa y Europa del Este (existen focos endémicos en regiones próximas al Mediterráneo, en el sudeste de España, el norte de Italia y Rumanía). Se estima que afecta a 30-100 millones de individuos en el mundo7 aunque no se conoce la prevalencia exacta en regiones endémicas debido, entre otras causas, al hecho de que la infección se presenta a menudo de forma asintomática. En países desarrollados, la infección es rara aunque los casos comunicados han ido en aumento durante los últimos años como consecuencia de los movimientos migratorios, los viajeros y los refugiados8,9.
Ciclo biológicoEl ciclo vital de Strongyloides es único y complejo por presentar una alternancia entre ciclos de vida libre (con machos y hembras en el exterior) y ciclos parasitarios en el intestino del hospedador. También es singular su capacidad de autoinfección y multiplicación en el hospedador, especialmente en pacientes inmunocomprometidos.
Las hembras parásitas habitan en el epitelio del duodeno y el yeyuno proximal, donde producen (por partenogénesis, es decir, sin necesidad de fecundación) huevos, los cuales eclosionan rápidamente y liberan larvas rabditoides (L1) que son eliminadas con las heces (fig. 1). En este estado madurativo, la elección de un ciclo parásito o uno exterior dependerá de la capacidad del nematodo de adaptarse al medio. En condiciones ambientales favorables, la larva L1 madura mediante 4 mudas hasta alcanzar el estado de adulto en vida libre. Las hembras son fecundadas y liberan huevos al exterior, desde donde eclosionan larvas L1. El ciclo de vida libre se puede perpetuar de manera indefinida; sin embargo, ante condiciones adversas, la larva L1 puede transformarse incluso en larva filariforme (L3) con capacidad infectiva, la cual es capaz de penetrar a través de la piel intacta del hospedador humano e iniciar el ciclo parásito.
La larva L3 migra a través del sistema circulatorio venoso hasta los pulmones, atraviesa los alvéolos y asciende por el árbol respiratorio hasta la faringe. Al ser deglutida, llega al intestino, donde, mediante 2 mudas, se desarrolla la hembra madura partenogenética.
En pacientes con un sistema inmunitario debilitado puede producirse el fenómeno de autoinfección, en el cual la maduración de la larva L1 en filariforme infectiva L3 se produce en el intestino del hospedador. Si lo hace en la luz intestinal, se elimina por las heces y atraviesa la piel de la zona perianal volviendo al torrente sanguíneo (ciclo exógeno), pero si la transformación tiene lugar en la mucosa intestinal, la larva L3 pasa a través de los vasos al plexo mesentérico (ciclo endógeno). En cualquiera de los 2 casos, el resultado es la expansión, diseminación y persistencia del parásito en el mismo hospedador durante años con múltiples rondas de autoinfección (hiper-infección), lo que determina el desarrollo de infecciones crónicas con consecuencias mortales en individuos inmunodeprimidos5,8,9.
Manifestaciones clínicasLa presentación clínica de la infección por Strongyloides es variable debido a la complejidad de la interacción entre el hospedador y el parásito. Además, el estado inmunológico del individuo infectado también influirá en el grado de gravedad de la enfermedad. Pueden distinguirse 3 tipos de situaciones clínicas relacionadas con el momento del ciclo biológico del parásito:
- •
Infección aguda: se produce durante la penetración de la larva L3 a través de la piel del individuo y el alcance de las vello-sidades intestinales una vez que ha recorrido el árbol traqueobronquial, donde el parásito permanece de manera crónica. Se desarrolla una reacción local cutánea en el lugar de entrada y ligeros síntomas y signos respiratorios y digestivos aunque las manifestaciones pueden pasar inadvertidas. En algunos pacientes se detecta eosinofilia importante.
- •
Infección crónica: generalmente es una etapa asintomática, que puede mantenerse décadas en individuos inmunocompetentes. Si se presentan síntomas, estos afectan básicamente al aparato gastrointestinal (dolor abdominal, náuseas, vómitos, pérdida de peso, prurito anal, etc.) y a la piel (urticaria inespecífica y larva currens).
- •
Infección grave: comprende los fenómenos de hiperinfección e infección diseminada, presentación más grave propiciada por tratamientos inmunodepresores y otros factores debilitadores del sistema inmunitario. El síndrome de hiperinfección se produce como resultado de una aceleración del proceso de autoinfección del ciclo del parásito y provoca síntomas más graves en los territorios normalmente afectados (piel, intestino y pulmones). En las infecciones diseminadas, la larva puede alcanzar otros órganos aparte de los propios de su ciclo biológico, como el sistema nervioso central, el sistema linfático o el sistema urinario. Esta situación puede presentarse o no en el contexto de una hiperinfección5,8-10. Por ello es de especial importancia establecer un diagnóstico adecuado para detectar casos crónicos que pueden llevar a estadios fulminantes cuando el estado inmunológico del individuo se ve o se va a ver comprometido.
El diagnóstico de la enfermedad producida por Strongyloides requiere un alto grado de sospecha, dada la inespecificidad de los síntomas y signos que produce. Algunos parámetros, como la eosinofilia, pueden ayudar a establecer el diagnóstico aunque no existan síntomas. Ninguna técnica diagnóstica reúne las cualidades necesarias para ser la de referencia, por lo que es preciso combinarlas, así como disponer de múltiples muestras para alcanzar el diagnóstico. Las técnicas diagnósticas disponibles pueden clasificarse en:
- •
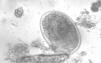
Parasitológicas: se basan en la detección de las formas parasitarias (generalmente, larvas rabditoides) mediante examen microscópico de muestras fecales (fig. 2). Esta larva mide, aproximadamente, 180-380 μm de longitud por 14-20 μm. Tiene una cápsula bucal corta y un prominente primordio genital (tabla 1). Cabe destacar que el diagnóstico definitivo requiere la identificación morfológica del parásito puesto que en zonas de elevada endemicidad puede existir coinfección con otros helmintos.
Tabla 1.Claves diagnósticas de las infecciones por Strongyloides stercoralis y uncinadas
Strongyloides stercoralis Necator americanus Ancylostoma duodenale Huevo Detectable en caso de diarrea profusa. Ovoides, transparentes; 50-58 x 30 μm Ovalado, cubierta fina; 56-75 X 36-40 μm; 4-16 blastómeros Larva rabditoide Cápsula bucal corta. Esófago rabditoide. Primordio genital prominente; 180-380 x 14-20 μm En caso de muestra fecal sin fijación > 48 horas Extremo anterior romo, esófago bulboso. Primordio genital puntiforme o no visible; 250 x 20 μm Larva filariforme Sin vaina. Extremo caudal romo o bifurcado. Esófago cilindrico que ocupa la mitad del cuerpo; 500-630 x 14-16 μm Tienen vaina. Extremo caudal puntiagudo. Esófago cilindrico que ocupa un tercio del cuerpo; 500-630 x 14-16 μm Gusano adulto Las hembras miden, aproximadamente, 1 mm de longitud. Muestran una hilera de huevos dentro del útero Macho: extremo posterior con bolsa copuladora sostenida por costillas radiales; 7-9 x 0,3 mm. Hembra: 10-13 x 0,6 mm de diámetro. Extremo posterior conoide sin terminación puntiaguda. Cápsula bucal grande con 2 placas cortantes ventrales y 2 dorsales pequeñas Macho: extremo posterior acampanado. Hembra: 10-13 x 0,6 mm de diámetro. Extremo posterior conoide con final puntiagudo.Cápsula bucal grande con 2 pares de dientes Serologia Comercializada No disponible No disponible PCR No disponible No disponible No disponible PCR: reacción en cadena de la polimerasa.
Para aumentar la rentabilidad diagnóstica, es recomendable disponer de varias muestras fecales, así como realizar procedimientos de concentración de heces con acetato de etilo, técnicas de Baermann, Harada-Mori o cultivos con carbón activado o en placa de agar8. Estas aprovechan la migración de la larva fuera del material fecal hacia el agua o la superficie del cultivo, y el líquido recuperado se observa al microscopio, previa centrifugación. El cultivo en placa se incuba 5 días a 30 °C en una bolsa cerrada herméticamente5. A diario se revisa con el fin de encontrar larvas L1 o, menos frecuentemente, formas L3 o adultos, cuya existencia también puede notarse en los surcos que dejan en el agar. Esta técnica presenta los mejores resultados de sensibilidad y, además, es fácil de implementar en laboratorios asistenciales6. Hay que mencionar que se requiere un especial cuidado al manipular estas muestras ya que estas larvas son infectivas. El patrón de eliminación de larvas de Strongyloides es muy variable entre individuos infectados, especialmente en situaciones crónicas y con baja carga parasitaria. En la hiperinfección, una sola muestra de heces puede ser suficiente para la observación de larvas, las cuales también pueden encontrarse en esputo, lavado broncoalveolar y otros líquidos biológicos.
Existen otras técnicas alternativas para la detección de formas parasitarias aunque más agresivas y menos sensibles que las anteriores, como la utilización del Entero-test, que consiste en la recogida de contenido duodenal mediante una cápsula que es ingerida por el paciente9.
- •
Serológicas: se pueden clasificar en técnicas de detección de antígenos de larvas infectantes de Strongyloides o detección de anticuerpos.
Los métodos de detección de anticuerpos son los más extendidos. La técnica serológica que cuenta con los mejores resultados de sensibilidad y especificidad es el enzimoinmunoensayo (ELISA) dirigido contra inmunoglobulinas específicas de tipo IgG aunque en pacientes inmunodeprimidos graves la sensibilidad puede verse disminuida9. Las IgG pueden detectarse a partir de las 2 semanas posinfección, mientras que la IgM puede detectarse desde la primera semana y permanecer detectable hasta la segunda o tercera. Diferentes muestras biológicas pueden estudiarse con esta técnica: suero, líquido cefalorraquídeo, saliva, heces, etc. Como otras técnicas serológicas, tiene como desventaja la reactividad cruzada con otros nematodos. Además, un resultado positivo no permite distinguir entre infección activa o erradicada dada la capacidad de las IgG de mantenerse elevadas en el tiempo, sobre todo en zonas endémicas. Sin embargo, en áreas con prevalencias más bajas, la detección de anticuerpos puede utilizarse como método de cribado poblacional11 e incluso como seguimiento de la eficacia del tratamiento. Dada la variabilidad en la respuesta inmunológica entre individuos, hasta el momento no se han podido definir valores de curación.
Se han desarrollado también immunoblots con proteínas inmunodominantes de larvas filariformes (como técnicas de confirmación), pruebas con radioalergoabsorbentes específicos para la inmunoglobulina E o técnicas de inmunofluorescencia indirecta con larvas muertas, generalmente de otras especies zoonóticas de Strongyloides. A pesar de presentar valores elevados de sensibilidad y especificidad, no son raras las reacciones cruzadas con otros nematodos, por lo que se reserva como técnica auxiliar10. Recientemente se ha descrito una nueva técnica basada en la inmunoprecipitación de luciferasa (LIPS), que utiliza un antígeno recombinante de Strongyloides, con buenos resultados de sensibilidad y especificidad, y sin reactividad cruzada con otros nematodos, como las filarias9. Si se demuestra rentable y fácil de aplicar, podría ser una buena técnica de cribado sustituta del ELISA.
Las pruebas de detección de antígenos permiten solventar los problemas mencionados derivados de la detección de anticuerpos. Se han desarrollado diferentes ELISA de captura para la detección de coproantígenos de Strongyloides mediante productos policlonales del parásito y, aunque los resultados son prometedores, todavía son preliminares10.
- •
Moleculares: las técnicas de reacción en cadena de la polimerasa (PCR) para el diagnóstico de la estrongiloidiasis no están exentas de inconvenientes. De la misma forma que ocurre con las técnicas parasitológicas, la eliminación escasa e intermitente de larvas en individuos infectados dificulta su detección, especialmente en pacientes con baja carga parasitaria. La extracción de ADN a partir de la muestra no es tarea fácil ya que la larva está formada por una pared de cutícula muy resistente. También influye en la baja sensibilidad de estas técnicas la pequeña cantidad de muestra analizada, lo que produce falsos negativos. Además, las heces contienen una gran cantidad de restos que pueden actuar como inhibidores de la amplificación de ADN, por lo que es importante incluir en la técnica controles de amplificación.
Se han diseñado PCR a tiempo real con diferentes dianas. No obstante, los resultados de sensibilidad no son mejores que los obtenidos con los métodos de Baermann o el cultivo en placa de agar9,10. También se ha desarrollado una PCR múltiple para parásitos intestinales con buenos resultados preliminares, que podría utilizarse para el cribado de viajeros e inmigrantes10. Así, parece que los métodos moleculares no son más útiles para el cribado universal ni como prueba única para el diagnóstico de esta enfermedad, pero, dada su elevada especificidad, se presentan como una buena opción como prueba confirmatoria12.
La ivermectina una vez al día durante 2 días es el tratamiento recomendado tanto para individuos asintomáticos como sintomáticos. Como alternativa, se puede utilizar albendazol o tiabendazol4. En el caso de síndrome de hiperinfección, la ivermectina es el único tratamiento recomendado y debe continuarse hasta 2 semanas después de haber conseguido la negativización de las muestras (esputos, heces, etc.). En caso de que sea posible, el tratamiento inmunodepresor debería reducirse o suspenderse. Los pacientes han de ser evaluados estrechamente mediante un estudio seriado de heces, al menos, durante las 2-4 semanas posteriores a la finalización del tratamiento. La serología de Strongyloides podría ser útil para definir la curación una vez pasados 6 meses tras el tratamiento. En cualquier caso, los pacientes con hiperinfección requieren un estrecho seguimiento, incluyendo información sobre medidas preventivas para evitar la recurrencia4.
UncinariasDistribución geográfica y epidemiologíaLa anquilostomiasis es la segunda infección por helmintos más común (tras la ascaridiosis). Se estima que más de 500 millones de personas están infectadas con anquilostomas en todo el mundo, especialmente en zonas tropicales y subtropicales4,13,14. N. americanus predomina en América y Australia, mientras que A. duodenale, en Oriente Medio, norte de África y sur de Europa, aunque ambas especies pueden encontrarse en África, Asia y América. Los factores de riesgo más importantes son la defecación en el entorno, el uso de heces humanas como abono, el hábito de ir descalzo y, en zonas endémicas, el consumo de carne poco cocinada. La principal población, por tanto, está compuesta por niños y personas con profesiones relacionadas con terrenos y suelos húmedos, como mineros, agricultores y otros.
Junto a las 2 especies principales de anquilostomas que causan infección en el hombre, existe un amplio grupo de nematodos zoonóticos capaces de parasitar al ser humano, como A. ceylanicum (anquilistoma de perros y gatos, con amplia prevalencia de infecciones humanas en India y Sudeste Asiático)5,15 u otras especies que penetran a través de la piel y provocan lo que se conoce como larva migrans cutánea, como A. braziliense, A. caninum o Uncinaria stenocephala.
Ciclo biológicoAmbos ciclos pueden describirse conjuntamente dado que solo se diferencian en pequeños detalles: los gusanos adultos viven en la mucosa intestinal (duodeno y yeyuno) y se alimentan de la sangre extravasada de los capilares (el propio ser humano es el depósito del parásito). Tras la copulación, comienza la puesta de huevos (8.000-10.000 huevos/día en Necator, 10.000-20.000 huevos/día en Ancylostoma), que se prolonga durante toda la vida de las hembras. Los huevos son eliminados por las heces del hospedador y, si las condiciones ambientales son favorables, en 1-2 días se liberará una larva rabditoide de primer estadio (L1), que en unos días evoluciona (L2) y una semana más tarde completa una nueva muda, transformándose en una larva estrongiloide metacíclica (L3). Estas L3 son capaces de penetrar a través de la piel del ser humano cuando este se pone en contacto con un suelo contaminado. Realizan una migración sanguínea hasta el corazón y los pulmones, donde rompen los capilares pulmonares y acceden al sistema respiratorio hasta ser deglutidos para pasar al intestino delgado, donde evolucionan a formas adultas. En el caso de Ancylostoma, existen pequeñas variaciones: existe la posibilidad de la ingestión directa de larvas L3 presentes en el agua o de un hospedador intermediario accidental (paraténico) infectado, las cuales se desarrollarán a formas adultas en el intestino. Además, algunas de las larvas, tras la penetración cutánea, pueden convertirse en larvas hipobióticas («durmientes») en el músculo o la pared intestinal, que pueden reactivarse tiempo después.
Manifestaciones clínicasLos síntomas producidos están directamente relacionados con la fase del ciclo biológico en que nos encontremos:
- •
Fase invasiva (dérmica): durante la penetración transcutánea, puede encontrarse una erupción maculopapular pruriginosa en el lugar de penetración (normalmente, entre los dedos de los pies) de resolución espontánea. También se pueden producir hemorragias locales, inflamación y trayectos serpiginosos debido a la migración larvaria, similares a la larva migrans cutánea.
- •
Fase migratoria (pulmonar): en la mayoría de los casos es asintomática, pero pueden aparecer síntomas consistentes en tos no productiva, sibilantes, cuadros asmatiformes y pequeñas hemorragias pulmonares. Ambas especies son capaces de provocar una reacción de hipersensibilidad de tipo I durante la migración (síndrome de Loeffler) aunque no se observan en este caso infiltrados eosinofílicos16,17.
- •
Fase intestinal: durante la migración de las larvas al intestino delgado, pueden aparecer náuseas, vómitos, dolor abdominal, diarrea con sangre y pérdida de peso. Se observa un gran impacto en el estado nutricional del paciente y se instaura de forma lenta una anemia microcítica ferropénica (la ingesta de sangre por cada parásito oscila entre 0,3 y 0,5 ml de sangre/día) e hipoalbuminemia, especialmente en casos de infección grave.
El diagnóstico de los anquilostomas debe basarse en un cuadro clínico compatible junto con una exposición o la existencia de eosinofilia no explicable por otras causas. Las herramientas disponibles para establecer el diagnóstico son similares a las descritas anteriormente aunque con algún matiz, especialmente en lo referente a la serología, y no existe ninguna técnica serológica disponible, por lo que las técnicas de microscopia son las más comúnmente empleadas.
El diagnóstico definitivo debe establecerse por la visualización de huevos en heces y, más excepcionalmente, de larvas. Este hecho puede presentarse en caso de una conservación inadecuada de las heces, donde el proceso de maduración del huevo continúa produciendo la larva rabditoide, difícilmente diferenciable de las de Strongyloides. Los huevos pueden detectarse, aproximadamente, 8 semanas tras la penetración dérmica. Si la infección no es demasiado alta, para visualizar los huevos o larvas, hay que recurrir a técnicas de concentración, como las anteriormente mencionadas, o al cultivo larvario. Entre las técnicas de concentración se encuentra la técnica de Kato-Katz, útil para la investigación de huevos y larvas de helmintos. En la fase de migración tisular de las larvas, raramente se establece el diagnóstico por visualización de larvas en esputo o aspirados gástricos.
Para una correcta identificación del parásito, debe tenerse en cuenta tanto la morfología de los huevos como la de las larvas estudiadas (tabla 1):
- •
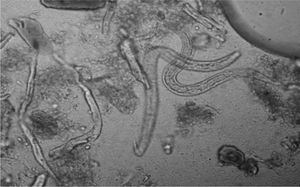
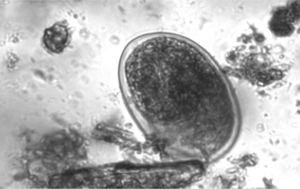
Huevos: a nivel morfológico, la apariencia de los huevos es similar entre Strongyloides y uncinarias, lo que nos impide su diferenciación. Entre las uncinarias, en el caso de A. duodenale los huevos son ovales con cubierta fina (60 × 40 μm) y los de Necator son parecidos, pero no es una identificación segura ya que suelen ser un poco más largos (70 × 40 μm) (fig. 3).
- •
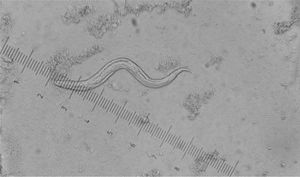
Larvas: las larvas L1 de Strongyloides son morfológicamente distintas respecto a las uncinarias, pero, para diferenciar Ancylostoma de Necator, deben evaluarse larvas filariformes (L3). Las larvas de primer estadio (L1) de uncinarias miden entre 250 y 350 μm, poseen un canal bucal largo, esófago rabditoide y primordio genital no aparente.
- •
Larvas de tercer estadio (L3): 500-700 μm, esófago filariforme corto (1/3 de la longitud corporal) y extremo caudal fino. A. duodenale posee una cutícula lisa, mientras que en N. americanus es estriada, lo que nos permite diferenciar ambas especies.
En el caso de afectación cutánea, el diagnóstico de la larva migrans es clínico. Otra opción para el diagnóstico es el empleo de técnicas moleculares. Existen diversos estudios de distintas variantes de PCR para el diagnóstico de geohelmintos, pero estas técnicas no están ampliamente distribuidas en los laboratorios clínicos en la actualidad18-22.
TratamientoEl tratamiento de las infecciones por uncinarias se basa en 2 pilares. El primero es corregir la anemia ferropénica del paciente con suplementos de hierro y el segundo, la administración de antiparasitarios efectivos, como albendazol, mebendazol o pamoato de pirantel. La dosificación es común, independientemente de la edad del paciente. El albendazol es el tratamiento de elección y se suministra en monodosis. Otra opción es el mebendazol, administrado durante 3 días o 500 mg en monodosis aunque algunos estudios indican la superioridad de la triple toma23. Otra alternativa es el pamoato de pirantel durante 3 días. En el caso de las gestantes, todos estos fármacos están autorizados por la OMS en el segundo y el tercer trimestres de embarazo.
ConclusionesEl diagnóstico microbiológico de estas infecciones aún es hoy día un reto. Debido a la baja sospecha clínica, fundada especialmente en su baja prevalencia en nuestro medio, así como las dificultades diagnósticas anteriormente expuestas, estas infecciones permanecen infradiagnosticadas. Asimismo, las técnicas parasitológicas son aún las más utilizadas en los laboratorios asistenciales a pesar de la baja sensibilidad que presentan. Con el desarrollo y la aparición de diferentes productos comercializados para la realización de serología frente a S. stercoralis, parece que este problema se ha subsanado. Sin embargo, esto solo es aplicable a S. stercoralis ya que, en el caso de las infecciones por uncinarias, aún continúa teniéndose este déficit. En este sentido, la realización de la serología frente a S. stercoralis en pacientes por cuyas características clínicas se sospeche que van a sufrir una inmunodepresión farmacológica (tratamientos biológicos, altas dosis de corticoides, quimioterapia, etc.), unida a un factor epidemiológico compatible, puede ser una buena herramienta para evitar fenómenos de hiperinfección, cuyas consecuencias podrían ser nefastas para el paciente.
La biología molecular puede ser la solución a la falta de sensibilidad de las técnicas convencionales. No obstante, las técnicas moleculares evaluadas generalmente son técnicas in house y tan solo están disponibles en centros de referencia.
Los esfuerzos para el diagnóstico de las infecciones por geohelmintos han de estar basados en una importante comunicación entre el profesional clínico y el microbiólogo. El desarrollo y la facilidad de uso de técnicas alternativas al estudio microscópico pueden ayudar a mejorar la detección de estas infecciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.