La detección de la multirresistencia a betalactámicos en Escherichia coli y Klebsiella pneumoniae es una cuestión clínicamente relevante. Por otro lado, es interesante diferenciar entre la producción de betalactamasas de espectro extendido (BLEE) y otros mecanismos de resistencia para evitar el tratamiento inadecuado de infecciones causadas por este tipo de cepas. El objetivo del presente estudio fue comparar la capacidad de las pruebas confirmatorias de los sistemas automatizados Vitek 2 y Phoenix para detectar la producción de BLEE en E. coli y K. pneumoniae.
Material y métodosSe ensayaron 193 aislamientos clínicos fenotípicamente productores de BLEE (174 E. coli y 19K. pneumoniae) por Vitek 2 y BD Phoenix System y se utilizaron las tarjetas AST-N058 y los paneles UNMIC/ID-62, respectivamente. Se consideraron métodos fenotípicos de referencia la prueba de sinergia con doble disco y Etest. Como controles positivos y negativos se ensayaron 12 cepas genotípicamente caracterizadas.
ResultadosEn el caso de los aislamientos clínicos, la sensibilidad fue del 99,5% para Vitek 2 y del 95,3% para Phoenix. En las cepas control no hubo diferencias entre ambos sistemas. La ejecución del sistema experto elevó la sensibilidad del Phoenix al 100%. Sin embargo, el sistema experto de Vitek 2 consideró incoherentes los resultados obtenidos en 7 aislamientos con la prueba para BLEE positiva.
ConclusiónLa sensibilidad de la prueba confirmatoria para la producción de BLEE es superior en las tarjetas N-058 de Vitek. No obstante, la actuación de los sistemas expertos sitúa a ambos sistemas a la misma altura en su capacidad de detección de BLEE en E. coli y K. pneumoniae.
Detection of beta-lactam resistance in Escherichia coli and Klebsiella pneumoniae strains is clinically relevant. Moreover, it is important to differentiate between extended-spectrum beta-lactamase (ESBL) production and other mechanisms of resistance to avoid inadequate treatment of infection caused by these strains. The aim of this study was to compare the performance of the Vitek 2 and BD Phoenix automated systems for confirmatory testing of ESBL production.
Material and MethodsA total of 193 clinical isolates of phenotypically confirmed ESBL producers (174 E. coli and 19 K. pneumoniae) were assayed by the Vitek 2 and BD Phoenix systems using AST-N058 cards and UNMIC/ID-62 panels, respectively. The double-disk synergy test and the Etest were used as phenotype reference methods. Twelve strains characterized by genotyping were used as positive and negative controls.
ResultsIn the clinical isolates, the sensitivity of the tests was 99.5% for Vitek and 95.3% for Phoenix. There were no significant differences between the 2 systems in the control strains. Execution of the expert system raised the sensitivity of Phoenix to 100%. However, the Vitek 2 expert system considered the results obtained in 7 strains with ESBL-positive tests to be incoherent.
ConclusionConfirmatory testing for ESBL production with the Vitek 2 system (AST-N058 card) showed higher sensitivity than the Phoenix (UNMIC-ID 62 panel) system. Nevertheless, the performance of the expert systems in the 2 automated tests was similar for ESBL detection in E. coli and K. pneumoniae.
Escherichia coli y Klebsiella pneumoniae son bacterias pertenecientes a la familia Enterobacteriaceae que frecuentemente expresan betalactamasas (principalmente de tipo TEM 1, TEM 2 y SHV 1) que confieren resistencia a penicilinas, pero no a cefalosporinas de espectro extendido. A partir de la década de 1980, como consecuencia de las mutaciones en los genes que codifican este tipo de enzimas, aparece un nuevo tipo de betalactamasas capaz de hidrolizar, además, a oxiiminocefalosporinas, como ceftazidima, cefotaxima o ceftriaxona. Por esta razón, se les dio el nombre de betalactamasas de espectro extendido (BLEE)1. Más recientemente se ha descrito un nuevo tipo de BLEE conocido como CTX-M con mayor afinidad de hidrólisis sobre cefotaxima que sobre ceftazidima2,3. La detección fenotípica de la resistencia mediada por BLEE es problemática debido, primero al número limitado de cefalosporinas habitualmente ensayadas y, segundo, a que el valor de la concentración mínima inhibitoria (CMI) para las cefalosporinas de tercera y cuarta generación no siempre es superior al punto de corte propuesto por los comités de estandarización. Sin embargo, estudios in vitro y en modelos animales demuestran que este tipo de cepas pueden mostrarse resistentes a medida que aumenta el tamaño del inóculo, lo que conduce al fracaso terapéutico y al incremento de la mortalidad en pacientes infectados por este tipo de microorganismos4,5. Otra razón importante para detectar fiablemente la producción de BLEE en los laboratorios de microbiología clínica es que las infecciones causadas por E. coli y K. pneumoniae productoras de este tipo de enzimas están asociadas a estancias hospitalarias más largas y a mayor gasto sanitario6,7.
El objetivo del presente trabajo fue evaluar la capacidad de los pocillos de detección de BLEE de los sistemas Vitek 2 y BD Phoenix en aislamientos clínicos usando como controles cepas de E. coli y K. pneumoniae productoras de betalactamasas genotípicamente caracterizadas.
Material y métodosBacterias: se ensayaron 193 aislamientos clínicos (174 de E. coli y 19 de K. pneumoniae) fenotípicamente productores de BLEE y 25 (22 de E. coli y 3 de K. pneumoniae) no productores de BLEE.
Como control se usaron 12 cepas genotípicamente caracterizadas.
Sistemas automatizados: los aislamientos y cepas control se ensayaron por el sistema Vitek 2 y se usaron tarjetas AST-N058 (BioMérieux, Francia), y por el sistema BD Phoenix con paneles UNMIC/ID-62 (Becton-Dickinson Biosciences, Sparks, Maryland).
Método fenotípico de referencia: todos los aislamientos y cepas control se estudiaron con el método de sinergia con doble disco modificado8,9 y doble tira de Etest (ceftazidima y ceftazidima con ácido clavulánico, cefotaxima y cefotaxima con ácido clavulánico, cefepime y cefepime con ácido clavulánico) (ABBiodisk, Solna, Suecia). En los casos en los que se obtuvieron discrepancias en la detección de BLEE por ambos sistemas automatizados se realizó un estudio de sinergia mediante combinación de tiras de Etest entre amoxicilina con ácido clavulánico y cefpodoxima, cefotaxima, ceftazidima y cefepime. El protocolo e interpretación se hizo de acuerdo con las especificaciones propuestas por el fabricante, según el cual se considera que hay una relación de sinergia cuando el cociente entre los valores de CMI frente a los antibióticos ensayados, solos y en combinación, es igual o superior a 2 diluciones. También se utilizó Etest para resolver las diferencias en los valores de cefepime encontrados entre ambas técnicas.
Pruebas genotípicas: los aislamientos en los que no coincidieron los resultados de Vitek y Phoenix se estudiaron para la presencia de todas las variantes de los genes blaTEM, blaSHV, blaCTX−M y las más relevantes de blaOXA mediante Multiplex PCR (polymerase chain reaction 'reacción en cadena de la polimerasa') y posterior hibridación con sondas específicas mediante hyplex® ESBL ID.
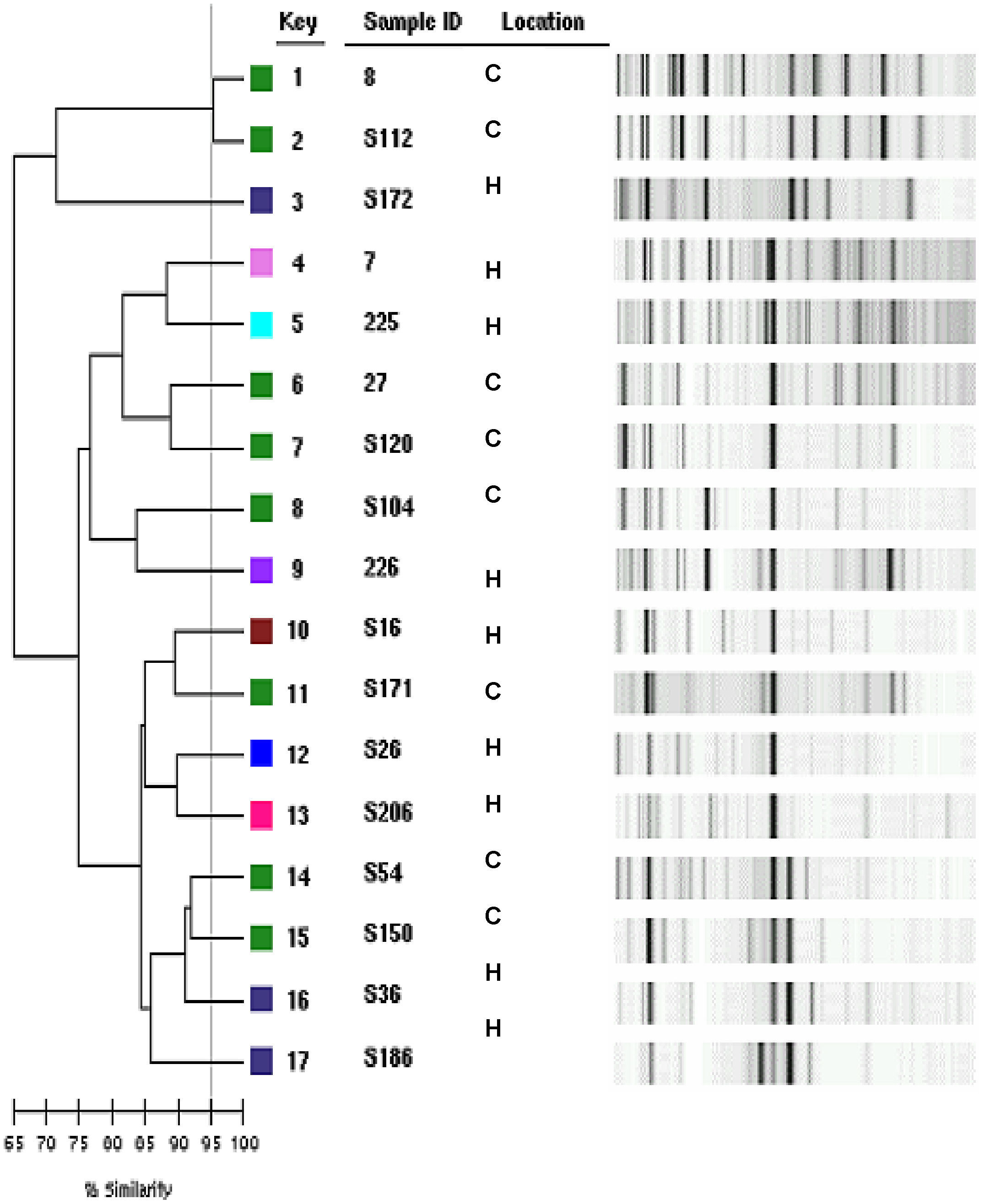
Tipificación genética de los aislamientos clínicos: el 10% de los aislamientos clínicos de E. coli se tipificó genéticamente mediante el sistema DiversiLab (repetición de PCR automatizada) (BioMérieux, Francia). Se consideró que 2 aislamientos eran genotípicamente distintos si su coeficiente de similitud era inferior al 95% y sus electroferogramas diferían en 3 o más bandas. El cálculo del coeficiente de similitud se hizo utilizando el coeficiente de Pearson.
Análisis estadístico: se calculó la sensibilidad de cada una de las pruebas en ambos sistemas automatizados antes y después de la actuación de los sistemas expertos. Las diferencias entre proporciones se compararon usando la prueba de χ2 para datos apareados. En los casos en los que hubo discrepancias entre los métodos se repitieron los ensayos por duplicado.
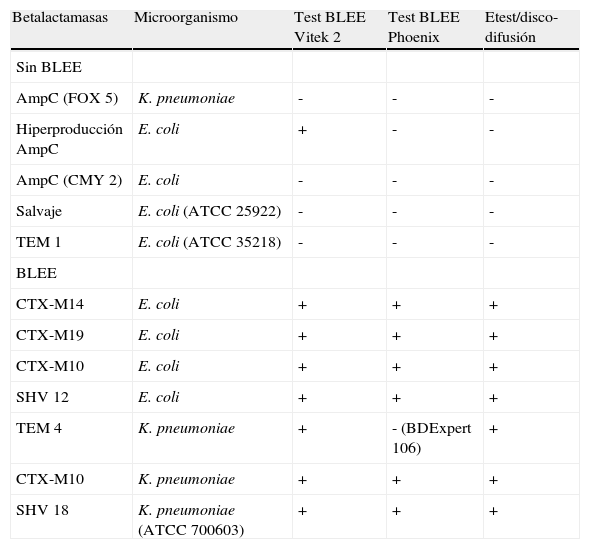
ResultadosEvaluación de los resultados en relación con las cepas controlLos resultados de los sistemas automatizados y Etest/sinergia con disco se muestran en la tabla 1. La especificidad y sensibilidad del uso conjunto de Etest y el estudio de sinergia con discos fueron, ambas, del 100%. El sistema Vitek demostró una sensibilidad del 100% y una especificidad del 80% debido a un falso positivo en el caso de una cepa hiperproductora de AmpC. En el sistema Phoenix la prueba de detección de BLEE fue negativa para una cepa de K. pneumoniae productora de TEM 4; sin embargo, la regla desatada por el sistema experto (n.o 106) alerta sobre la necesidad de investigar, mediante otros métodos, la producción de BLEE como consecuencia de los valores de CMI obtenidos para ureidopenicilinas y cefalosporinas de tercera generación. Así pues, para Phoenix, los valores de sensibilidad y especificidad de la prueba de detección de BLEE en relación con las cepas control fueron del 86 y del 100%, respectivamente. Tras la actuación posterior del sistema experto la sensibilidad para BD Phoenix es del 100%.
Resultados de la detección fenotípica de la producción de betalactamasas de espectro extendido en cepas control
| Betalactamasas | Microorganismo | Test BLEE Vitek 2 | Test BLEE Phoenix | Etest/disco-difusión |
| Sin BLEE | ||||
| AmpC (FOX 5) | K. pneumoniae | - | - | - |
| Hiperproducción AmpC | E. coli | + | - | - |
| AmpC (CMY 2) | E. coli | - | - | - |
| Salvaje | E. coli (ATCC 25922) | - | - | - |
| TEM 1 | E. coli (ATCC 35218) | - | - | - |
| BLEE | ||||
| CTX-M14 | E. coli | + | + | + |
| CTX-M19 | E. coli | + | + | + |
| CTX-M10 | E. coli | + | + | + |
| SHV 12 | E. coli | + | + | + |
| TEM 4 | K. pneumoniae | + | - (BDExpert 106) | + |
| CTX-M10 | K. pneumoniae | + | + | + |
| SHV 18 | K. pneumoniae (ATCC 700603) | + | + | + |
BLEE: betalactamasas de espectro extendido.
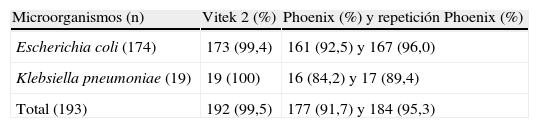
La tabla 2 muestra los resultados obtenidos con los sistemas automatizados estudiados cuando se ensayaron los aislamientos clínicos. Todos éstos fueron positivos para la producción de BLEE por Etest y el método de sinergia con discos. Inicialmente, 17 aislamientos fueron discrepantes en relación con el método de referencia: un aislamiento (E. coli) en el caso de Vitek 2 y 16 aislamientos (13 de E. coli y 3 de K. pneumoniae) en el caso de Phoenix. Tras repetir los ensayos, 7 aislamientos, inicialmente falsos negativos por Phoenix, dieron la prueba positiva; los 9 restantes se consideraron resultados negativos para la prueba de detección de la BLEE. La sensibilidad final calculada fue del 99,5% para Vitek 2 y del 95,3% para Phoenix. Estos resultados son estadísticamente significativos con p<0,01.
Resultados de la prueba de detección de betalactamasas de espectro extendido en aislamientos clínicos con los sistemas Vitek 2 y BD Phoenix en cepas productoras de betalactamasas de espectro extendido
| Microorganismos (n) | Vitek 2 (%) | Phoenix (%) y repetición Phoenix (%) |
| Escherichia coli (174) | 173 (99,4) | 161 (92,5) y 167 (96,0) |
| Klebsiella pneumoniae (19) | 19 (100) | 16 (84,2) y 17 (89,4) |
| Total (193) | 192 (99,5) | 177 (91,7) y 184 (95,3) |
Los estudios genéticos en los aislamientos discrepantes confirmaron 6 falsos negativos de E. coli productores de CTX-M (uno en Vitek y 5 en Phoenix). En otros 4 aislamientos discrepantes, la PCR consenso para genes asociados a BLEE fue positiva y no se detectó CTX-M: 2 de E. coli con producción simultánea de cefalosporinasas (resistencia elevada a cefoxitina y amoxiclavulánico) y 2 de K. pneumoniae, una de éstas también produce AmpC plasmídica (sinergia entre cefalosporinas de tercera generación y ácido borónico o cloxacilina). Estos aislamientos son probablemente productores de BLEE tipo TEM o SHV.
Los 25 aislamientos no productores de BLEE por los métodos fenotípicos de referencia (entre éstos, 2 de K. pneumoniae productores de AmpC y 15 de E. coli productores de betalactamasas de amplio espectro) se reconocieron como tales por Phoenix, que mostró una especificidad del 100%. Sin embargo, el sistema Vitek dio 2 falsos positivos, uno de éstos se corrigió al repetir el ensayo, por lo que la especificidad fue del 93%, inicialmente, y del 96% tras la repetición.
Actuación del sistema expertoEn el caso de Vitek, 7 aislamientos productores de BLEE se reconocieron como tales (prueba confirmatoria para BLEE positiva), pero el sistema experto los consideró como resultados incoherentes por no corresponder su perfil de sensibilidad a uno de los asociados a la especie identificada en la base de datos del sistema. En este caso, a pesar del resultado positivo de la prueba para BLEE, no se interpretan los resultados de acuerdo con el fenotipo. Estos aislamientos se repitieron, por duplicado, y se obtuvo el mismo resultado en 6 de ellos. En cualquier caso, estos resultados se consideraron positivos ya que la prueba específica de confirmación de BLEE dio un resultado correcto. Para el sistema Phoenix la ejecución del sistema experto desata una regla de alerta sobre la posibilidad de la producción de BLEE (regla 106) en los 9 falsos negativos. Al considerar esta situación, en lo que respecta a la información al clínico, el valor de la sensibilidad del sistema sería del 100% y no hubo diferencias significativas entre ambos sistemas.
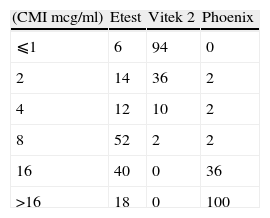
En relación con los resultados del ensayo de sensibilidad cabe destacar la notable discrepancia que se observó en los valores de CMI para cefepime. En 142 aislamientos (72%) se obtuvo una diferencia de más de 2 diluciones entre ambos métodos, lo que ocasionó en el 67% de éstas un cambio de categoría, siempre más sensible en los resultados de Vitek (tabla 3). Mediante la ultilización de Etest para resolver las diferencias, en el 41% de los casos discrepantes, el Vitek comete un error mayor aunque tras la corrección posterior del sistema experto, de acuerdo con el fenotipo reconocido (microorganismo productor de BLEE), se interpreta como resistente.
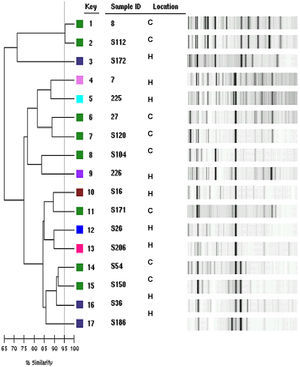
Relación genética de las cepas clínicasLos 17 aislamientos estudiados, que suponen el 10% de los aislamientos ensayados, presentaron una gran variabilidad genética tanto en muestras de origen hospitalario como comunitario (fig. 1).
DiscusiónLa producción de BLEE es un importante mecanismo de resistencia frente a antibióticos betalactámicos en enterobacterias. La identificación de estas enzimas por medio de pruebas fenotípicas es la estrategia más comúnmente utilizada en los laboratorios de microbiología clínica. Sin embargo, la detección de BLEE puede ser problemática porque, en muchos casos, no se alcanzan los puntos de corte propuestos para la interpretación de la sensibilidad/resistencia a cefalosporinas de tercera y cuarta generación10. Además, a causa de sus diferentes propiedades enzimáticas, los productores de BLEE se diferencian en sus capacidades para hidrolizar específicamente los betalactámicos. Otros factores de confusión adicionales pueden ser la producción de diferentes tipos de betalactamasa por parte de un mismo organismo, así como la influencia que el grado de producción de enzima tiene en la actividad hidrolítica. La producción de BLEE también debe ser diferenciada de la hiperproducción de betalactamasas cromosómicas de tipo AmpC o K1. Aunque la secuenciación es el método estándar para la determinación específica del gen productor de betalactamasa presente en una cepa, tiene limitaciones (variaciones según el método, dependencia de los conocimientos disponibles sobre secuencias de las distintas familias de BLEE, falta de correlación con el grado de expresión génica) y, además, el perfil fenotípico puede estar afectado por otros mecanismos superpuestos como alteraciones de la permeabilidad.
Se han diseñado distintas combinaciones de antibióticos para la detección de BLEE3, aspecto de gran importancia en la sensibilidad de los métodos diseñados. Los paneles del sistema BD Phoenix utilizan cefpodoxima, ceftazidima, cefotaxima y ceftriaxona solas y en presencia de ácido clavulánico. A diferencia, las tarjetas del sistema Vitek 2 usan cefepime, cefotaxima y ceftazidima solas y en combinación con ácido clavulánico.
La incorporación simultánea de ceftazidima y cefotaxima con ceftriaxona es importante debido a las diferentes afinidades que por estos sustratos tienen los distintos tipos de BLEE11. Por otro lado, y de acuerdo con distintos estudios12–14, la cefalosporina más sensible para el cribado de BLEE es la cefpodoxima. No obstante, según los resultados de este trabajo, la incorporación de cefepime ± ácido clavulánico podría aumentar la sensibilidad en la detección de BLEE en los casos de aislamientos en que coexistan otras betalactamasas que hidrolicen la cefpodoxima y otras cefalosporinas de tercera generación pero no cefepime, como puede ser el caso de AmpC. Esta razón justificaría la mayor sensibilidad de la tarjeta AST-N058, especialmente en los aislamientos con resistencia a amoxiclavulánico. Los estudios genéticos en los aislamientos discrepantes confirman 6 falsos negativos de E. coli productores de CTX-M (uno en Vitek y 5 en Phoenix). En otros 4 aislamientos discrepantes, la PCR consenso para genes asociados a BLEE fue positiva y no se detectó CTX-M: 2 E. coli con producción simultánea de cefalosporinasas (resistencia elevada a cefoxitina y amoxiclavulánico) y 2 K. pneumoniae, una de éstas también produce AmpC plasmídica (sinergia entre cefalosporinas de tercera generación y ácido borónico o cloxacilina).
Hay otro estudio que evalúa la capacidad de la prueba confirmatoria de BLEE en estos 2 sistemas15. Si bien en este estudio el Phoenix se mostró más sensible y menos específico que el Vitek 2, en el presente trabajo los resultados son, justamente, los inversos. En el estudio de Thomson et al no se analizó la significación estadística de los resultados pero en este caso hay diferencias estadísticamente significativas entre las sensibilidades de ambas pruebas.
Aunque la actuación de los sistemas expertos no es objeto de valoración en este estudio, se deja constancia de que su ejecución alerta sobre la posibilidad de producción de BLEE en los 9 falsos negativos del Phoenix mejorando, sustancialmente, los resultados definitivos.
Los valores de la CMI y las categorías interpretativas de los antibióticos ensayados en ambos sistemas fueron similares (ampicilina, amoxicilina con ácido clavulánico, ceftriaxona o cefotaxima, ceftazidima, imipenem, gentamicina, tobramicina, amikacina, cotrimoxazol, fosfomicina, nitrofurantoína y ciprofloxacina) con excepción de cefepime para el que se detectó una diferencia de más de 2 diluciones en el 72% de los aislamientos clínicos y una discrepancia entre categorías en el 67% de éstas. Al utilizar Etest para resolver estas diferencias, se observó que el 24% del total de las tarjetas AST-N058 rinden falsa sensibilidad a este antibiótico. A pesar de esto, la actuación del sistema experto cambia a resistente la interpretación de cefepime en aquellos casos en los que sea positiva la prueba de detección de BLEE, lo que corrige el error a efectos de la emisión final del informe. Por esta razón, a pesar de ser un error técnico muy grave, es importante dejar claro que todos los resultados reconocidos con fenotipo productor de BLEE por el sistema Vitek se interpretan como resistentes a cefepime.
En conclusión, aunque la prueba para la detección de BLEE es significativamente más sensible en Vitek 2 (AST-N058) que en Phoenix (UNMIC/ID-62), la actuación del sistema BDExpert (Phoenix) sitúa a los 2 sistemas a una altura similar respecto a su capacidad para alertar sobre la producción de BLEE en E. coli y K. pneumoniae.