Los pólipos gástricos (PG) son lesiones originadas en la mucosa gástrica que se presentan frecuentemente y de manera incidental en las esofagogastroduodenoscopias. Las características endoscópicas y el contexto del paciente son útiles en su evaluación, de tal manera que factores como el sitio anatómico de presentación, la historia heredofamiliar, el uso de medicamentos como los inhibidores de la bomba de protones y el tamaño de los PG ayuda a la caracterización adecuada de los PG.
Las tecnologías como la NBI/magnificación y la cromoendoscopia vital ayudan a predecir mejor la histología de estas lesiones. Es importante realizar biopsias para la mejor caracterización del pólipo si el contexto clínico así lo sugiere. Existen indicaciones para tratar estas lesiones y para su seguimiento.
Los factores mencionados arriba se discuten en esta revisión.
Gastric polyps (GP) are lesions originated in the gastric mucosa that are a frequent incidental finding in upper endoscopy procedures. The endoscopic characteristics and the patients¿ clinical setting are useful for their evaluation; in this regard characteristics such as anatomical localization, genetic background, use of certain drugs like proton pump inhibitors and the size of the GP need to be taken into account for an accurate characterization.
NBI/magnification and chromoendoscopy are useful tools for histological prediction of GP. If the clinical background is not clear it is essential to obtain biopsies to better characterize the lesion. Several indications for treatment and follow-up of patients with GP are available.
The topics mentioned above are discussed in this review.
Los pólipos gástricos (PG) son lesiones luminales que protruyen de la mucosa y se descubren de modo incidental en aproximadamente el 2% de las esofagogastroduodenoscopias (EGD)1. La mayoría de los pacientes se encuentran asintomáticos y rara vez presentan complicaciones como sangrado u obstrucción gástrica.
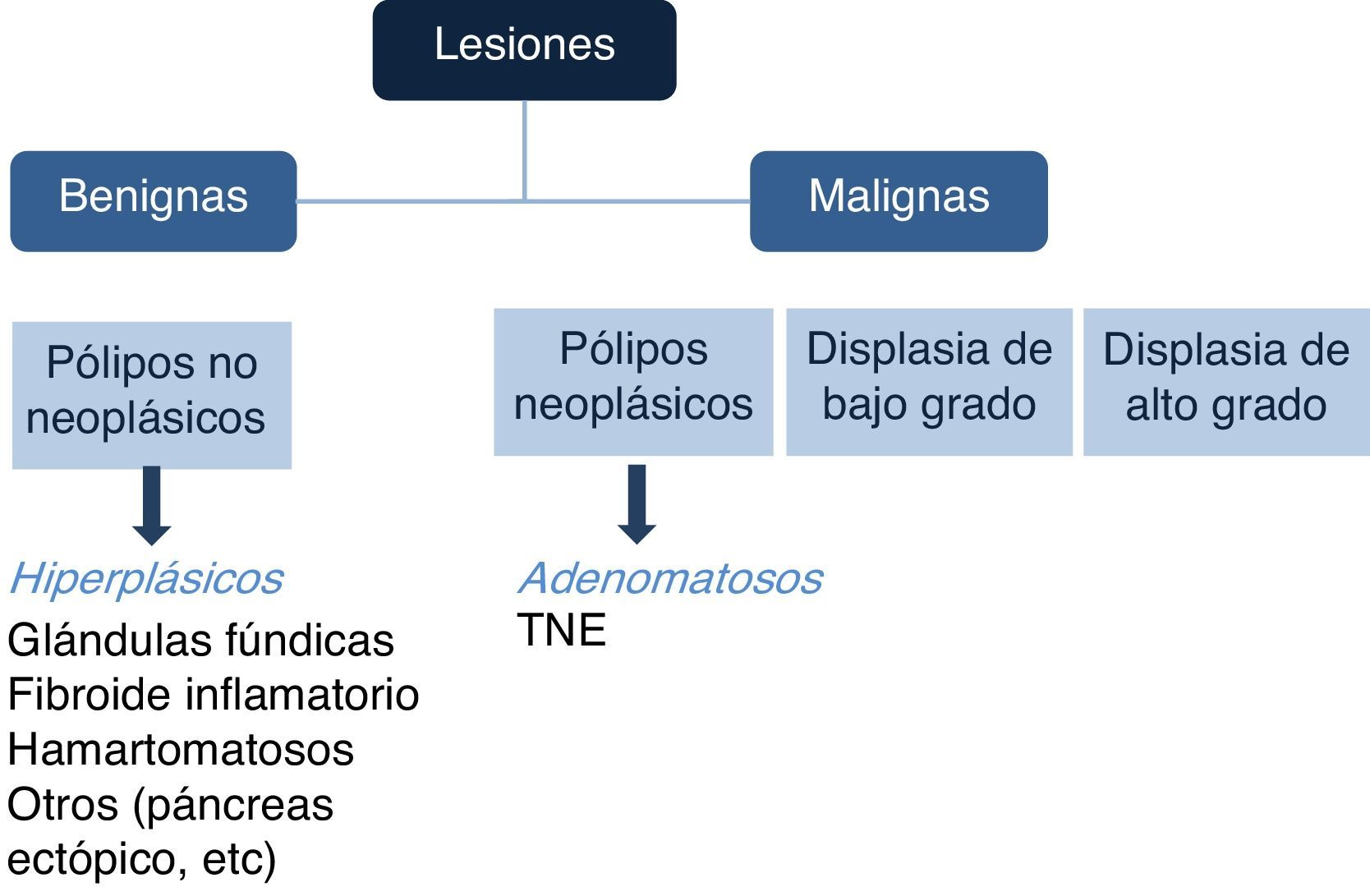
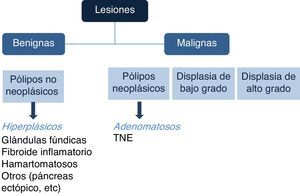
Existen diferentes tipos de PG, y de acuerdo con su aspecto endoscópico pueden relacionarse con potencial maligno. Sin embargo, la caracterización histopatológica es la que dictará el potencial neoplásico o el grado de malignidad de los pólipos (fig. 1).
Topográficamente, los pólipos de glándula fúndica (PGF) por lo general ocurren en el cuerpo o fondo gástrico, y los adenomas, en el antro. Algunos pólipos, como los pólipos hiperplásicos, los PGF, los tumores neuroendocrinos y las metástasis suelen ser lesiones múltiples.
Clásicamente se asocia a los pólipos adenomatosos con riesgo de transformación maligna.Este riesgo es muy bajo para los PG hiperplásicos y es prácticamente nulo en los pólipos esporádicos o los PGF2.
Como consecuencia, el diagnóstico de un PG adenomatoso asigna al paciente a un programa de vigilancia endoscópica, mientras que el seguimiento limitado generalmente se emplea en los pacientes con diagnóstico de pólipos hiperplásicos, pólipos inflamatorios o PGF3.
EpidemiologíaLa información disponible en la literatura relacionada con la frecuencia y con las características de los PG varía dependiendo de la población estudiada (edad, raza, coexistencia de trastornos genéticos relacionados con síndromes polipósicos, estado socioeconómico), de las características del centro en donde se realizó el estudio endoscópico (volumen de estudios realizados, tipo de equipo, experiencia en la detección de pólipos), del tiempo de análisis (actualmente mejores métodos de evaluación y mayor uso de inhibidores de la bomba de protones) y, finalmente, de la caracterización histopatológica por un patólogo experto.
Los PG se encuentran hasta en el 5% de las EGD realizadas por diferentes indicaciones4. Esta frecuencia oscila entre el 2 y el 7% en la literatura5,6. La mayoría de los casos se encuentran de manera incidental (80-90%), por estudios realizados por indicaciones como sangrado gastrointestinal y dolor abdominal, entre las indicaciones más frecuentes.
Al igual que en otras enfermedades gástricas, existen importantes diferencias geográficas en la prevalencia de PG. Las tasas de adenomas y carcinomas gástricos son mucho más altas en el este de Europa y Asia que en las poblaciones occidentales, con cifras que se acercan al 27% en comparación con 0.5 a 3.75%, respectivamente7-9.
En un estudio de más de 120,000 pacientes en EUA sometidos a EGD se encontró una prevalencia de PG del 6.35%, distribuidos en PGF 77%, hiperplásicos/hiperplasia foveolar 17%, adenomatosos 0.69% y fibroides inflamatorios 0.1%. Las lesiones polipoideas malignas (adenocarcinoma y linfoma) constituyeron >2%10.
La prevalencia de PGF en un estudio realizado en >100,000 pacientes fue del 5.9%. En este estudio se encontró una asociación negativa de los PGF con infección por Helicobacter pylori y no se encontró asociación con displasia de alto grado/adenocarcinoma5.
Una revisión retrospectiva de 13,000 endoscopias realizadas en población griega encontró 258 PG (1,2%). Hasta el 27% de los pacientes tenían más de un pólipo, y el 75,6% fueron pólipos hiperplásicos. Los adenomas (6,6% de todos los pólipos) se encontraron predominantemente en hombres (proporción hombre-mujer 2:1), y solo en los pacientes mayores de 50años de edad. Los pólipos estromales estuvieron presentes en el 5,2% de los pacientes que se habían sometido previamente a gastrectomía o gastroyeyunostomía11.
Un estudio alemán analizó 5,515 PG examinados entre 1969 y 1989, y encontró que el 47% correspondían a PGF y el 28.3% fueron pólipos hiperplásicos; se encontró un número elevado de adenomas gástricos (9.0%) y adenocarcinomas (7.2%)3.
Un estudio brasileño publicado en 2007 evaluó 26,000 endoscopias e identificó solamente 153 pacientes con PG (0.58%). La frecuencia relativa de los pólipos en esta población refleja la alta tasa de infección por H.pylori: el 71.3% de los pólipos fueron hiperplásicos, el 16.3% eran PGF y el 12.4% eran adenomas gástricos12.
Los datos presentados arriba confirman lo expuesto en relación a la diferencias en la epidemiología debido a los factores mencionados.
Caracterización de pólipos gástricosExiste una secuencia de pasos fundamentales que debe tener en cuenta el endoscopista para el abordaje de los PG:
- -
Contexto clínico del paciente: antecedentes heredofamiliares, comorbilidades, presencia de síndromes genéticos y uso de medicamentos.
- -
Indicación del estudio endoscópico: sangrado, dolor, episodios de obstrucción.
- -
Caracterización endoscópica de las lesiones: realizar una limpieza adecuada de la cámara gástrica, uso de tecnología como la imagen en banda estrecha (NBI), la magnificación, la cromoendoscopia vital, la imagen de alta resolución.
- -
Realizar biopsias para estudio histopatológico.
- -
Seguimiento ponderando los factores previamente descritos.
Actualmente se dispone de diferentes métodos para la caracterización endoscópica de pólipos. Estos métodos, de acuerdo con el patrón mucoso y vascular, ayudan a predecir la histología de las lesiones. Entre estos se encuentran la NBI con magnificación, la cromoendoscopia vital y la endomicroscopia confocal, entre los más importantes.
En un estudio reciente se describieron 4 patrones mucosos y 5 patrones vasculares mediante NBI más magnificación para la caracterización de lesiones polipoideas, y se encontró que los patrones con mayor distorsión mucosa y vascular se relacionan con displasia de alto grado. Además, la variabilidad interobservador fue mejor para este patrón vascular (κ=0.89)13. Además se ha encontrado que las lesiones deprimidas pueden albergar carcinoma intramucoso hasta en el 25% de los casos, en estudios que evaluaron lesiones polipoideas con NBI y cromoendoscopia vital con índigo carmín, con énfasis en la caracterización del patrón vascular14,15.
La utilidad de la cromoendoscopia vital con agentes reactivos, de contraste, o la combinación de ambos, para la caracterización de lesiones gástricas se limita principalmente a la evaluación de superficies grandes, en pacientes con síndromes polipósicos hereditarios y para la delimitación de lesiones polipoideas gástricas pre y post resección16-18. Este tipo de tinciones puede ser muy útiles en escenarios clínicos en donde la disponibilidad de tecnología como la NBI o la magnificación es limitada.
La endomicroscopia confocal láser es una herramienta diagnóstica que permite la caracterización histológica in vivo durante la endoscopia. En el estómago se ha reportado una precisión diagnóstica del 91.7-98.8% para lesiones displásicas de alto grado o cáncer gástrico superficial. También se ha utilizado en la caracterización de metaplasia intestinal y para el diagnóstico de infección por H.pylori. Su utilidad actualmente es limitada, debido a disponibilidad del equipo, a los altos costos y a la experiencia que se tiene con la NBI y magnificación19-22.
Finalmente, la utilidad del ultrasonido endoscópico en las lesiones polipoideas gástricas se limita a esclarecer si se trata de una lesión submucosa o de un pólipo real.
ClasificaciónPólipos hiperplásicosJunto con los PGF, los pólipos hiperplásicos constituyen los PG más frecuentes. El predominio de uno u otro depende de la población y del tiempo en que se realizó el estudio.
La edad media de presentación de los pólipos hiperplásicos es de 65,5-75años, y la mayor parte de los casos se presentan en mujeres (58 a 70,5%)4.
Su etiología es desconocida, aunque se han relacionado con inflamación y atrofia de la mucosa gástrica, y se cree que son resultado de la regeneración excesiva del epitelio foveolar después de daño de la mucosa. El 25% de los pólipos hiperplásicos se acompañan de infección por H.pylori1,23.
Otros factores asociados con estos pólipos son la anemia perniciosa, y se pueden encontrar adyacentes a úlceras, erosiones, o en el sitio de la anastomosis posterior a gastroenterostomía.
Los pólipos hiperplásicos habitualmente son sésiles o pediculados.
Topográficamente, del 24 al 60% de los pólipos hiperplásicos se encuentra en el antro, del 29 al 56,3% en el cuerpo y fondo, y el 2,5% en el cardias. La presentación es única en 2/3 de los casos, y su tamaño por lo general <1cm. Sin embargo, hasta el 10% son >2cm24.
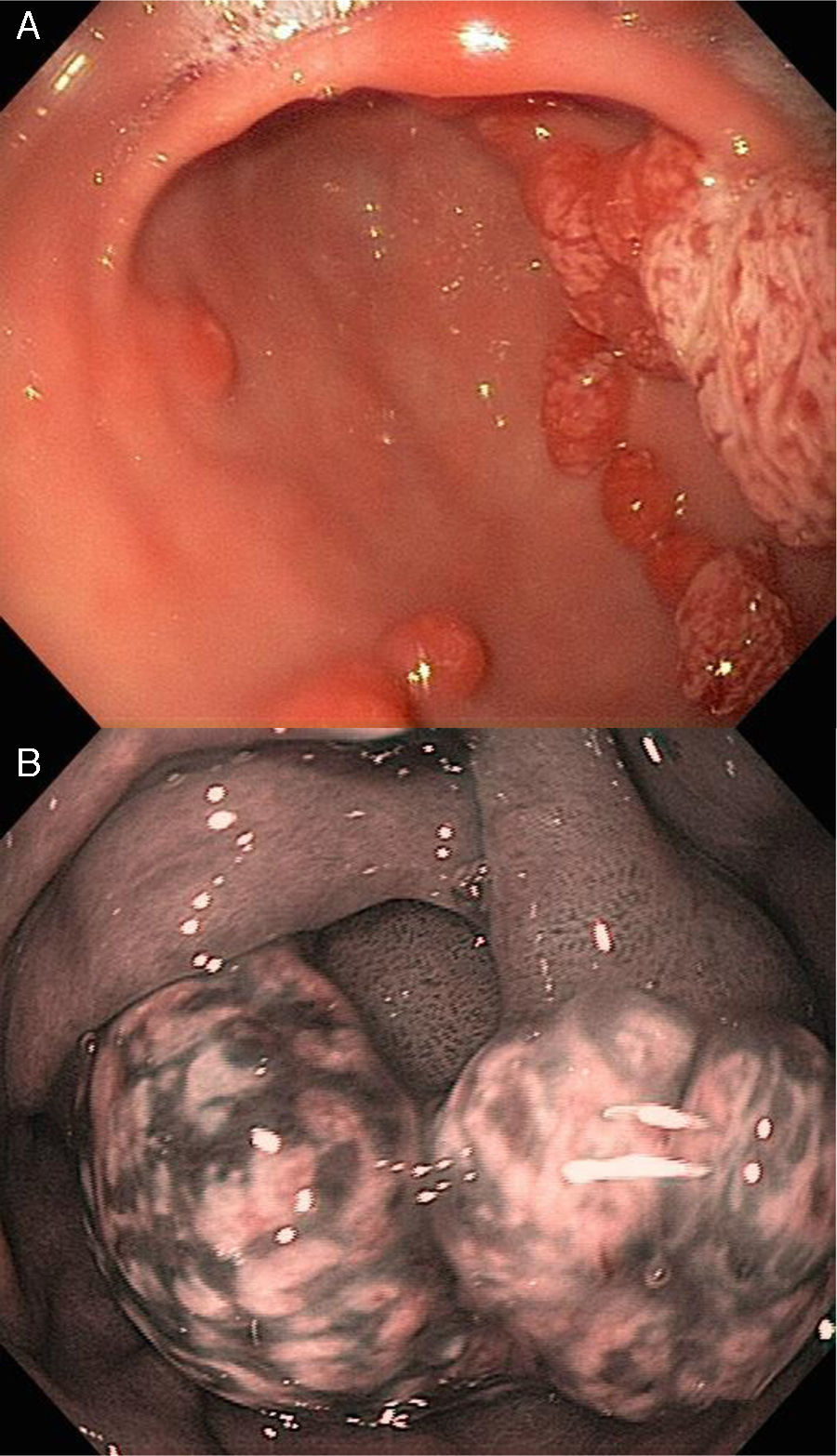
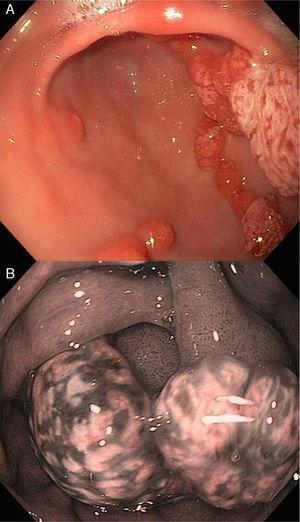
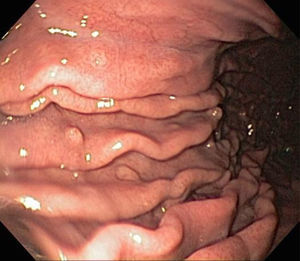
La apariencia endoscópica muestra pólipos de superficie lisa con coloración eritematosa comparado con la mucosa adyacente, friabilidad, así como una pequeña zona de erosión, ulceración o placa sobre la superficie de los pólipos (fig. 2, paneles a y b).
La mayoría de los casos son asintomáticos, pero pueden resultar en hemorragia o anemia y obstrucción, principalmente cuando son de gran tamaño o cuando hay pólipos múltiples25. Debido al componente inflamatorio, se les ha llamado pólipos hiperplásicos/inflamatorios1.
Los pólipos hiperplásicos tienden a revertir, después de la erradicación de H.pylori, hasta en el 70% de los casos26.
La incidencia de la transformación maligna de un pólipo hiperplásico se encuentra entre el 1,5 y el 3%23, siendo más frecuente en pólipos >1cm de tamaño, forma pediculada, estado posgastrectomía y lesiones neoplásicas sincrónicas27.
Pólipos de glándula fúndicaActualmente se consideran los PG más frecuentes encontrados en las EGD, según diferentes autores.
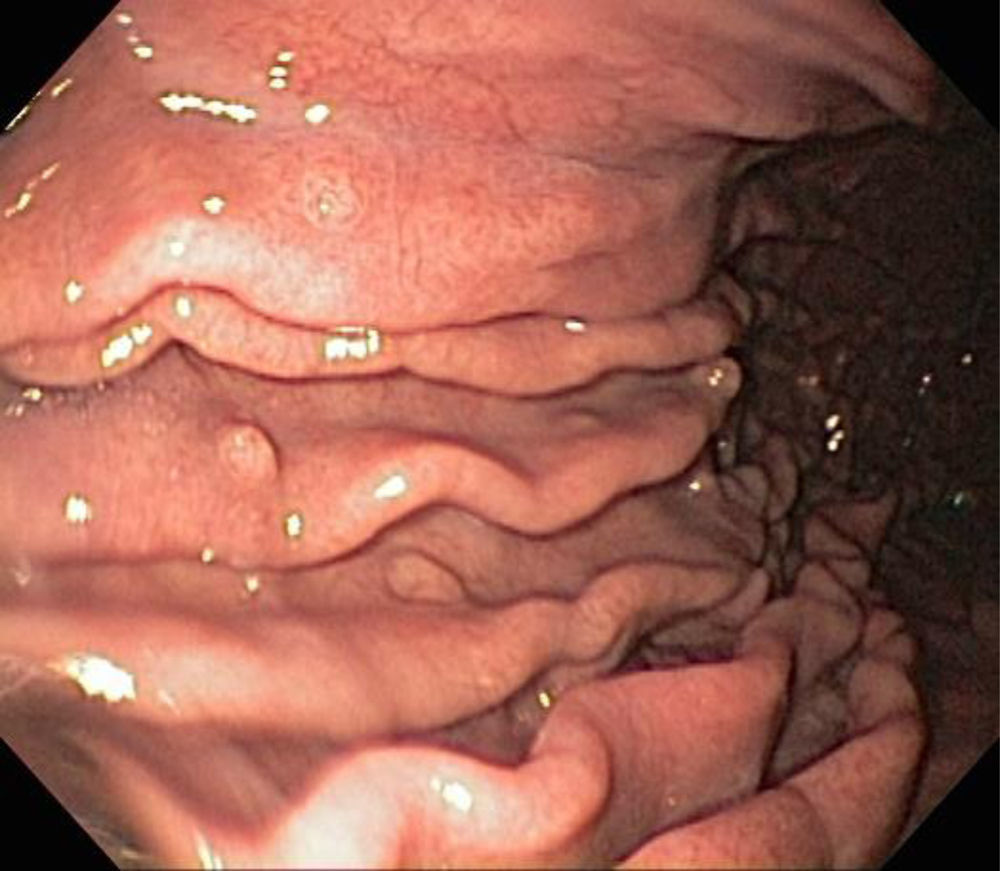
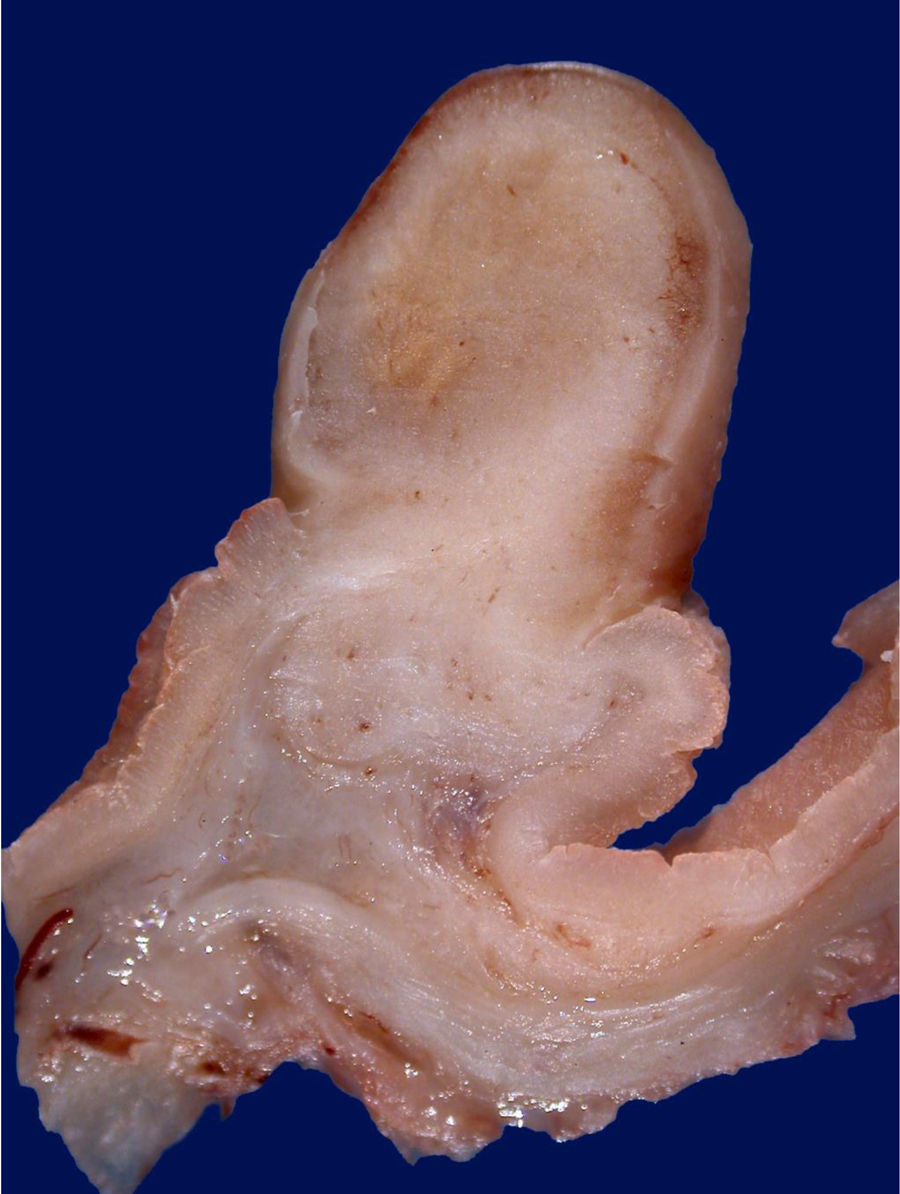
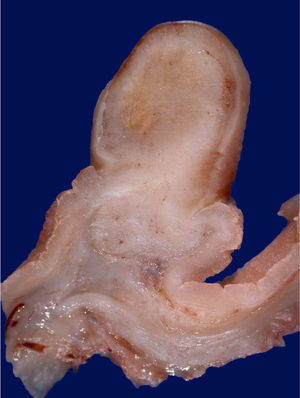
Histológicamente, los PGF se componen de glándulas dilatadas revestidas por epitelio fúndico (células parietales, células principales, mezcladas con glándulas normales)23. Endoscópicamente, estos pólipos son sésiles y habitualmente menores de 0,5cm de diámetro; la mucosa tiene una apariencia transparente, en vidrio deslustrado y del mismo color que la mucosa normal adyacente. Cuando se toman con la pinza de biopsia se desprenden fácilmente en un solo fragmento. Pueden ser múltiples o presentarse como una masa única, y se observan en el fondo o cuerpo en la mucosa que secreta ácido gástrico (fig. 3). La mucosa adyacente suele ser normal, sin inflamación o infección por H.pylori4.
Los PGF suelen ser múltiples cuando se asocian a poliposis adenomatosa familiar (PAF) o al síndrome de Peutz-Jeghers, encontrándose en población relativamente más joven. Existen reportes de casos de adenocarcinoma derivado de PGF en pacientes con PAF28,29 La alteración del gen de la β-catenina se encuentra en el 91% de los pacientes, y dichos pacientes tienen mayor riesgo de pólipos de colon, adenoma y adenocarcinoma en comparación con el grupo de control que no tiene PGF. La ingesta crónica de inhibidores de la bomba de protones (>1año de uso) se relaciona con un riesgo 4 veces mayor de aparición de PGF30.
Pólipo fibroide inflamatorioHistológicamente, la lesión muestra proliferación de células en huso, vasos sanguíneos pequeños e infiltración de células inflamatorias, predominantemente eosinófilos. La etiología exacta es desconocida, y se ha relacionado con estados de hipo/aclorhidria4.
Este tipo de pólipo puede encontrarse en todo el tracto gastrointestinal, pero por lo general se presenta en la región del antro y prepilórica (aproximadamente el 80% de los casos). Generalmente son lesiones únicas, bien circunscritas, sésiles o pediculados y recubiertas de una mucosa de apariencia normal (fig. 4)31. En pólipos de mayor tamaño puede existir una zona de ulceración que puede dificultar el diagnóstico4.
Clínicamente, la mayoría de los pólipos son asintomáticos y se descubren incidentalmente durante la evaluación por sangrado, anemia u obstrucción gástrica. Por lo general estos pólipos no recurren tras la polipectomía4.
AdenomasLos PG adenomatosos representan del 7 al 10% de los PG32. En la evaluación endoscópica estos pólipos son lesiones exofíticas pediculadas o sésiles que se localizan principalmente en el antro y en la incisura y fondo gástrico33. Por lo general son lesiones únicas en el 82% de los casos, de tamaño <2cm (80%) y de tipo tubular (80-96%). El sangrado fácil al contacto no es un hallazgo típico del adenoma gástrico. Las lesiones de mayor tamaño (>2cm de diámetro), rojizas, con depresión central, ulceradas y con patrón velloso tienen aumento del riesgo de transformación neoplásica. Estas lesiones por lo general ocurren en el contexto de gastritis atrófica con metaplasia intestinal34,35.
En la histopatología, estos pólipos se componen de estructuras tubulares y/o vellosas revestidas de epitelio displásico y se subdividen en displasia de bajo y alto grado de acuerdo con el grado de displasia (basado en el grado de aglomeración nuclear, hipercromasia, estratificación, actividad mitótica, diferenciación citoplásmica, y distorsión de la arquitectura)4,36.
La incidencia de adenoma gástrico aumenta con la edad, y la frecuencia de degeneración maligna en estas lesiones oscila entre el 4 y el 60%, aunque lo que se informa más frecuentemente es alrededor del 10%31,34. El riesgo de cáncer invasivo se observa en el 33-55% de las lesiones >2cm vs el 1-5% en lesiones <1cm33.
Existe evidencia de que la erradicación de H.pylori en los pacientes con PG adenomatosos pudiera tener un efecto benéfico en disminuir el riesgo de transformación maligna37 y en el riesgo de recidiva posresección38.
Tumores neuroendocrinosLos tumores neuroendocrinos (TNE) gástricos representan el 1,7% de los PG y hasta el 5% del total de los TNE39. La edad media de presentación es alrededor de los 60años. Histopatológicamente son tumores endocrinos bien diferenciados compuestos de células no funcionales similares a las enterocromafines que surgen de la mucosa oxíntica del cuerpo o fundo gástrico. Se clasifican en dependientes de gastrina (tiposi y ii) y no dependientes de gastrina (tipoiii), estos últimos con un mayor potencial maligno. Los tipoi son los TNE más frecuentes (65%) y se encuentran en la mucosa oxíntica atrófica (cuerpo/fondo).
El cuadro clínico de los TNE incluye dolor, vómito, sangrado gastrointestinal y, en <5%, síndrome carcinoide.
Los TNE gástricos se han relacionado con entidades clínicas que cursan con hipergastrinemia, como la gastritis crónica atrófica/autoinmune, el gastrinoma/NEM-1 y con síndrome de Zollinger-Ellison, y casos esporádicos en los cuales existe normogastrinemia40.
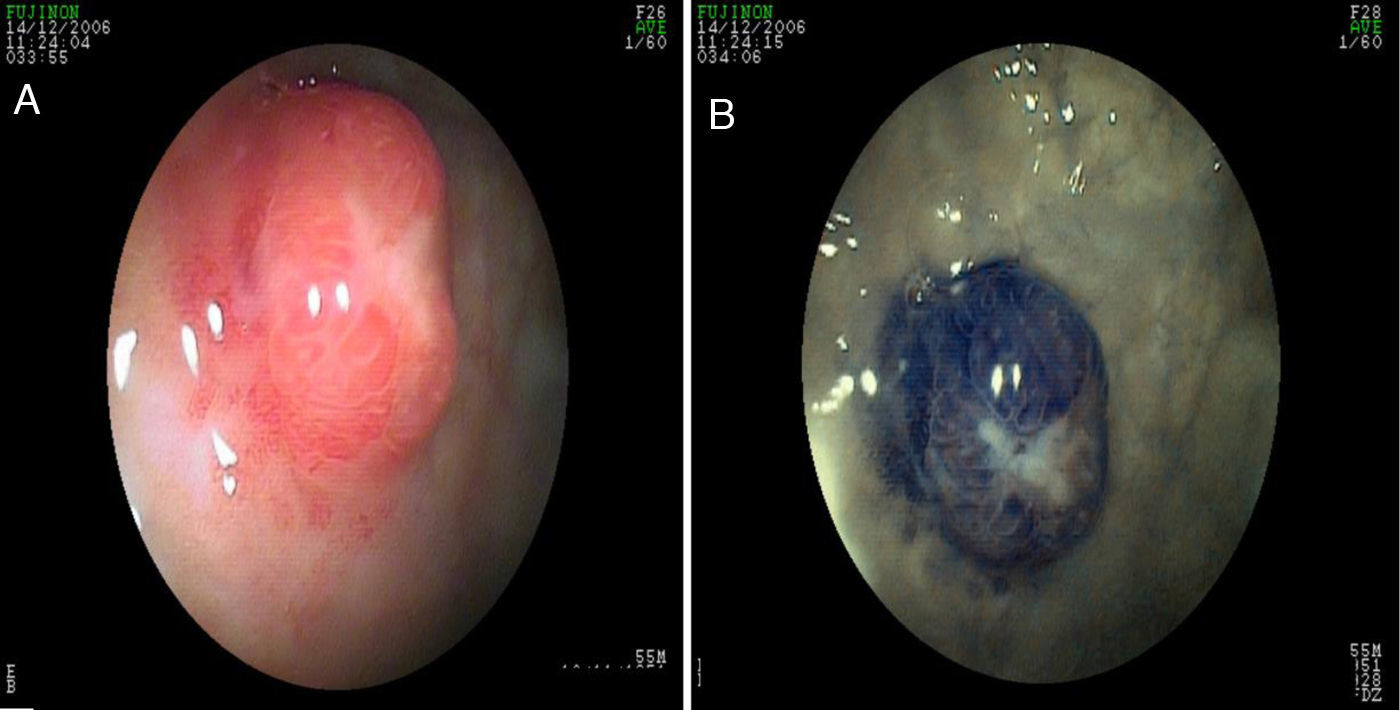
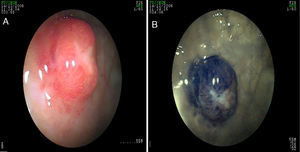
Los casos asociados con hipergastrinemia por lo general son lesiones múltiples, de base amplia, de color amarillento, menores a 2cm de diámetro. La apariencia endoscópica muestra lesiones hipervascularizadas, siendo esto más evidente con NBI/magnificación (fig. 5 paneles a y b). En los casos esporádicos, los tumores son grandes, únicos y similares al carcinoma (se puede presentar sangrado, obstrucción o metástasis)39. En estos casos el ultrasonido endoscópico ayuda a delimitar mejor la lesión y, de acuerdo con ello, determinar si son candidatos a resección endoscópica o quirúrgica. En la evaluación se recomienda realizar niveles séricos de cromograninaA y de gastrina41.
Otros tipos de lesiones polipoideas gástricasXantomasSon lesiones sin relevancia clínica cuya incidencia aumenta con la edad. Son más frecuentes en hombres, y se relacionan con gastritis atrófica, metaplasia intestinal y con reflujo biliar. Etiológicamente no se asocian a hipercolesterolemia ni a infección por H.pylori y se pueden encontrar asociados con pólipos hiperplásicos4,42,43.
Endoscópicamente se observan lesiones sésiles, nodulares o en placas, redondas u ovales, blanco-amarillentas, bien circunscritas, que miden entre 1-2mm de diámetro (por lo general <10mm) y se localizan en la curvatura menor, en el antro y en la región prepilórica44. Histológicamente se observan macrófagos cargados de lípidos que ocupan la lámina propia y contienen colesterol. Los diagnósticos diferenciales incluyen infecciones, enfermedades por depósitos y tumores gástricos raros (células en anillo de sello, tumores de células granulares)44,45.
Páncreas ectópicoConocido también como heterotipia pancreática o páncreas aberrante o accesorio, constituye una lesión rara encontrada de manera incidental en la EGD; se refiere a tejido pancreático sin ninguna comunicación con el páncreas y que contiene vascularidad y sistema ductal propios. La prevalencia de estas lesiones oscila alrededor del 0.8% en EGD y hasta el 13.7% en autopsias1,46, y se puede encontrar en otros sitios anatómicos, como duodeno, yeyuno, vesícula biliar, esófago, colédoco, bazo, mesenterio, mediastino y trompas de Falopio. El estómago es el sitio más frecuente de afección (25-38%), con involucro de la submucosa en el 75% de los casos.
Desde el punto de vista endoscópico se observa una lesión submucosa con forma de domo y centro umbilicado, única, con superficie lisa, de tamaño entre 0.2 y 4cm de diámetro y localizada en el antro y en la región prepilórica. Muchas veces no se puede distinguir de manera macroscópica de otras lesiones como tumores del estroma gastrointestinal (GIST), TNE, linfomas y cáncer gástrico. En este sentido, el empleo del ultrasonido endoscópico ayuda a distinguir al páncreas ectópico con una sensibilidad diagnóstica del 80-100%47.
Diagnóstico diferencial de los pólipos gástricosAlgunas lesiones encontradas en la EGD no constituyen realmente un PG, en términos de las lesiones descritas a lo largo de esta revisión. En un estudio se encontró que el 16% de las lesiones gástricas diagnosticadas endoscópicamente como PG no reunían criterios para esto. La mayoría correspondió a mucosa gástrica inflamada, y en el 14% se encontró infección por H.pylori, lo que sugiere que esta infección puede ocasionar una apariencia endoscópica de pliegues gástricos prominentes o gastritis polipoidea10.
Los pliegues mucosos, edema de la lámina propia, hiperplasia foveolar y los folículos linfoides prominentes pueden dar la apariencia endoscópica de un pólipo. Además, otros diagnósticos histopatológicos bien definidos pueden dar la apariencia endoscópica de una lesión polipoidea; tal es el caso del linfoma, cáncer gástrico en etapas tempranas, lesiones subepiteliales, gastritis granulomatosa (enfermedad de Crohn, reacción a cuerpo extraño, histiocitosis de Langerhans), gastritis eosinofílica o pseudopólipos inflamatorios por hipertensión portal48,49. De esto podemos inferir la importancia de la adecuada valoración del paciente previo al estudio endoscópico y del valor de los hallazgos encontrados en la EGD. Más aún, en caso de duda en el diagnóstico endoscópico de la lesión polipoidea, siempre se debe obtener una biopsia y discutir el contexto clínico y los hallazgos endoscópicos con el patólogo.
Manejo de los pólipos gástricosExisten varias consideraciones que el endoscopista debe tener en cuenta durante el manejo de los pacientes con PG. Uno de los puntos iniciales es determinar si los pólipos ocurren bajo el contexto de algún síndrome polipósico hereditario, como el síndrome de Peutz-Jeghers, PAF, poliposis juvenil o síndrome de Cowden. En estos síndromes se recomienda iniciar escrutinio a los 18años de edad, realizar EGD cada 2-3años, biopsiar >5 pólipos y polipectomía en pólipos >1cm, además del escrutinio en otros órganos de las neoplasias que son específicas en cada síndrome genético.
En los pacientes en los que no exista un síndrome genético como los descritos anteriormente se recomienda iniciar el algoritmo de manejo con una biopsia del pólipo y de la mucosa circundante. Si el resultado es de un adenoma, se recomienda resección endoscópica o quirúrgica. En los pólipos hiperplásicos sintomáticos o con displasia también se recomienda la resección. Cuando existe infección por H.pylori, primero se debe erradicar la infección y realizar una EGD un año después y, según el resultado, tratar. Los pólipos fúndicos o fibroides inflamatorios obligan a sospechar la presencia de PAF, y se recomienda polipectomía solo si son sintomáticos. En el caso de los TNE, el seguimiento es diferente y no se aborda en esta revisión50.
Las indicaciones para polipectomía endoscópica son lesiones con focos de displasia, experiencia suficiente para realizarla y para manejar las complicaciones potenciales y valorar el riesgo-beneficio según el contexto clínico. Se recomienda realizar una EGD de control un año después de la resección completa del pólipo, o 6meses en el caso de que la resección no haya sido completa51.
ConclusionesLos PG son lesiones observadas frecuentemente en las EGD. La histología de los PG se puede predecir basándose en los antecedentes del paciente, las enfermedades concomitantes, el uso de medicamentos y las características endoscópicas de las lesiones como son la localización, el número de lesiones, el tamaño y el aspecto de la mucosa. Es importante realizar biopsias para la mejor caracterización del pólipo si el contexto así lo sugiere. La polipectomía debe realizarse en caso de lesiones sintomáticas o si existe displasia en el pólipo. Las nuevas tecnologías, como la NBI/magnificación, ayudan a predecir mejor la histología de los PG.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.