El ganglioneuroma es una neoplasia benigna derivada de la cresta neural, compuesta de células ganglionares maduras y células de Schwann1. La localización más frecuente es el mediastino posterior y, en segundo lugar, el retroperitoneo. Solo una pequeña proporción de ganglioneuromas se originan en la médula suprarrenal (15-30%)1.
El empleo sistemático de pruebas de imagen ha incrementado la frecuencia del diagnóstico de incidentalomas adrenales. La mayoría de estas lesiones son adenomas benignos no funcionantes. Otras lesiones menos frecuentes son el adenoma productor de cortisol, feocromocitoma, metástasis, carcinoma adrenal y mielolipoma. Con menor frecuencia encontramos lesiones como quistes, lesiones inflamatorias o infecciosas, hemorragia suprarrenal bilateral o, como en el caso que presentamos, ganglioneuroma2.
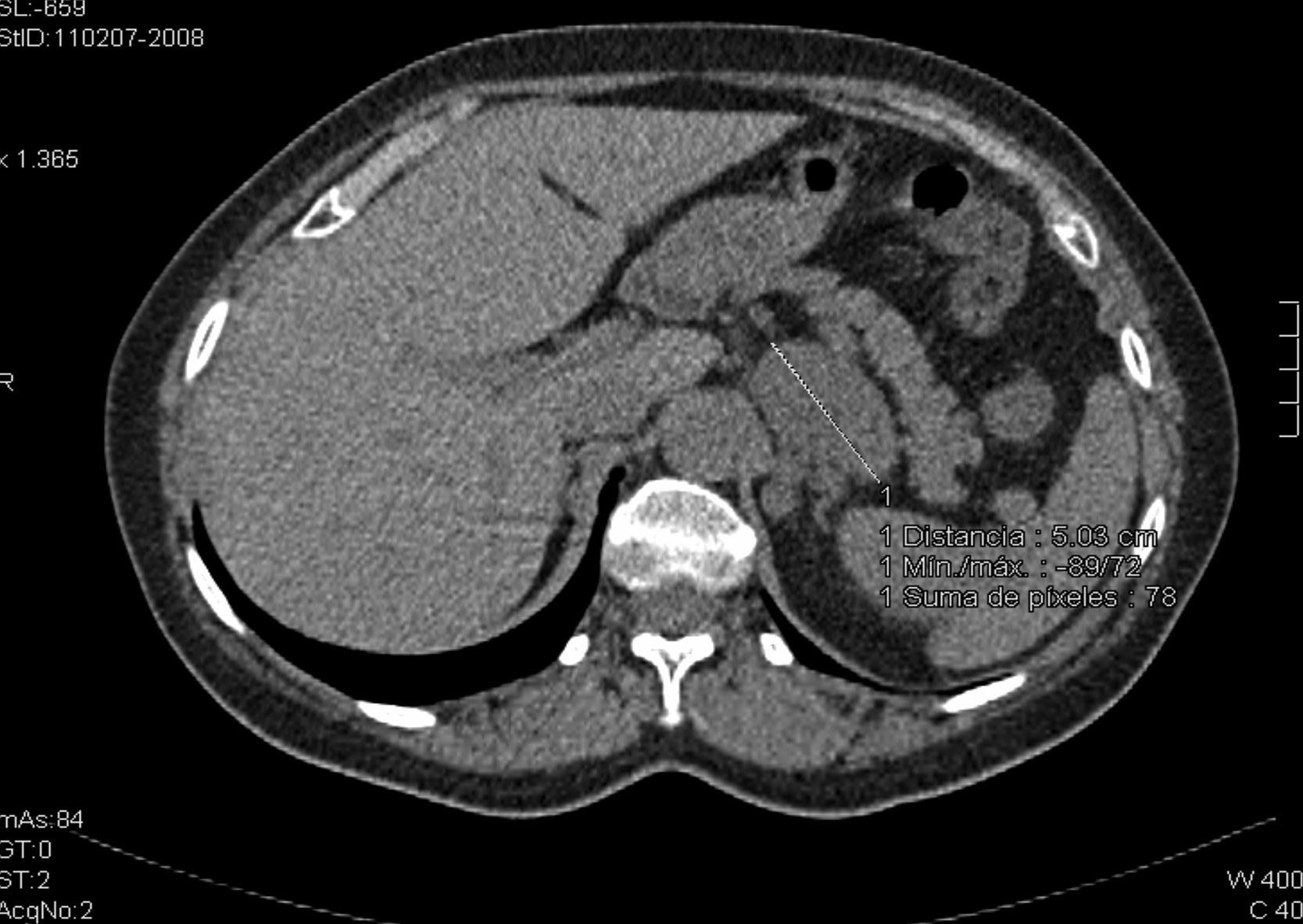
Nuestro caso clínico es una mujer de 61 años con antecedente de pénfigo vulgar en 1998 que precisó corticoterapia en dosis altas. No refería reacciones alérgicas medicamentosas conocidas, ni tampoco destacaban antecedentes de hipertensión arterial, diabetes mellitus ni dislipidemia. En el estudio de tos crónica se realiza tomografía computarizada (TC) torácica donde se detecta una masa suprarrenal izquierda de 61×47×37mm con contornos polilobulados y valores de atenuación de 20-30 Unidades Hounsfield (UH) en cortes basales (fig. 1; no se utilizó contraste oral ni intravenoso debido a que el radiólogo sospechó feocromocitoma al examinar las imágenes basales). Es enviada al servicio de endocrinología para estudio de incidentaloma suprarrenal izquierdo. En la anamnesis clínica la paciente refería dolor en región lumbar izquierda en reposo. En el interrogatorio específico no mostraba síndrome constitucional ni datos de hipercortisolismo (obesidad central, estrías, debilidad muscular, hematomas, cambios de humor, hirsutismo, acné), de hiperandrogenismo ni de hiperaldosteronismo (HTA, debilidad muscular, nicturia, poliuria, polidipsia), ni crisis indicativas de feocromocitoma.
En la exploración física se detectaron los siguientes datos: peso 57,5kg, talla 150cm, IMC 25,6kg/m2, circunferencia cintura 92cm, PA decúbito 155/95mmHg y bipedestación 145/90mmHg. Tiroides normal, no se observaban neurofibromas, lesiones indicativas de amiloidosis cutánea, ni datos clínicos de hipercortisolismo ni hiperandrogenismo aparentes. En la palpación abdominal no se observaban masas. En los análisis solicitados tanto el hemograma como la bioquímica general eran normales. En orina de 24h: creatinina 1,0g/24h (0,6-2,0), diuresis 1.800ml (1.000,0-1.800,0), cortisol 212,40μg/24h (42,0-218,0). En la segunda orina de 24h: adrenalina <4μg/24h (0,0-18,0), noradrenalina 31μg/24h (0,0-80,0), dopamina 166 μg/24h (0,0-400,0), metanefrina fraccionada 167μg/24h (74,0-297,0), normetanefrina fraccionada 164μg/24h (105,0-354,0), metanefrinas totales 331μg/24h (170,0-700,0). El cortisol libre urinario y las metanefrinas se repitieron siendo normales, en ausencia de fármacos con posible interferencia en la determinación de las mismas. El estudio de hormonas plasmáticas fue el siguiente: testosterona 0,28ng/ml (0,15-0,71), 17-OH-progesterona 0,2ng/ml (0,0-0,0), androstendiona 0,5ng/ml (0,9-3,0), DHEAS 42,7 μg/dl (59,0-296,0), ACTH 13,8 pg/ml (0,0-46,0), cortisol 11,8μg/dl (6,0-28,0), adrenalina < 20pg/ml, noradrenalina 392pg/ml, dopamina < 20pg/ml, renina < 0,10ng/ml/h (1,9-6,0), aldosterona 197pg/ml (35,0-275,0).
La resonancia magnética abdominal realizada con cortes axiales potenciados en T1 (fase y fuera de fase) y T2 detectó una masa suprarrenal izquierda de 56mm de diámetro anteroposterior por 56mm de diámetro craneocaudal y 35mm de diámetro transversal, que mostró una señal intermedia en las secuencias potenciadas en T1, sin focos de hiperintensidad de señal y sin pérdida de señal en secuencias fuera de fase, lo cual excluía contenido lipídico. En las secuencias potenciadas en T2 predominaba señal baja con zona superior y medial de hiperintensidad de señal. En el resto de la masa suprarrenal se mostraba hipocaptación de contraste, con un área central casi avascular. Desde el punto de vista radiológico indicaba tumor cromafín sin poder descartar metástasis suprarrenal o carcinoma adrenocortical. No se identificaron adenopatías en el resto del retroperitoneo ni lesiones hepáticas indicativas de metástasis.
Ante la sospecha de carcinoma por el tamaño y las características radiológicas se decidió la extirpación quirúrgica. La amplia experiencia del cirujano en vía laparoscópica hizo que esta fuera la primera opción, con un abordaje transperitoneal. El tiempo quirúrgico fue de 60 min y transcurrió sin complicaciones. La anatomía patológica informó una masa suprarrenal de 6×4,5×2,5cm y aspecto polilobulado que en la descripción microscópica estaba constituida por fascículos de células fusiformes de citoplasma ligeramente eosinófilo y núcleos sin atipia celular con morfología de células de Schwann, entremezcladas con neuronas sin signos de atipia celular, pero sin apreciarse células tumorales cromafines maduras. La tumoración fué positiva en la inmunohistoquímica para S100, enolasa neuronal específica, sinaptofisina y CD57, datos que confirmaban el diagnóstico de ganglioneuroma adrenal. En las TC abdominales realizadas 3 y 12 meses después de la cirugía no se observó recidiva de la lesión inicial ni datos de otras tumoraciones pancreáticas o tiroideas.
El ganglioneuroma es un tumor benigno derivado de la cresta neural que asienta en los ganglios simpáticos paravertebrales o en la médula adrenal. Está compuesta por células ganglionares maduras y células de Schawnn sobre fibras nerviosas1. La edad más frecuente de presentación es niños y adultos jóvenes1,3. La distribución por sexos es similar en hombres y mujeres (1,13:1) y la localización más frecuente es la retroperitoneal (35-52%), seguida del mediastino (39-43%) y la región cervical (8-9%)1.
Habitualmente son masas asintomáticas y si presentan clínica suele ser inespecífica y variable según la localización. Generalmente se detectan en pruebas de imagen realizadas por otro motivo no relacionado4. En ocasiones producen catecolaminas y una clínica adrenérgica similar a la de los tumores cromafines maduros5,6, particularmente si se trata de un tumor compuesto por células precursoras de los paraganglios (ganglioneuroma) y células cromafines maduras (feocromocitoma), en cuyo caso se denomina feocromocitoma compuesto7. Otras formas más infrecuentes de presentación incluyen el hirsutismo por hiperproducción de testosterona8, glomerulonefritis relacionada con el tumor y que desaparece tras su resección9 y la diarrea por la producción de péptido intestinal vasoactivo6.
Macroscópicamente son tumores bien circunscritos y encapsulados. Su tamaño es variable, con un promedio de 8cm, aunque se han descrito casos de hasta 5kg10.
En el estudio radiológico de un incidentaloma suprarrenal es importante valorar cuidadosamente las características predictoras de malignidad antes de decidirse por un seguimiento conservador: en la TC con contraste, en las lesiones con > 10 UH basales, un lavado absoluto del contraste < 50% tiene una sensibilidad y especificidad del 100% para detectar lesiones malignas o tumores cromafines. Asimismo, es importante considerar datos indicativos de malignidad, como un tamaño > 4cm, la necrosis y la hemorragia intralesional11. En los últimos años se han publicado estudios interesantes sobre el papel discriminativo de la tomografía por emisión de positrones ligados a fluorodesoxiglucosa (PET-TC) en el diagnóstico preoperatorio de lesiones adrenocorticales malignas: en una cohorte prospectiva de 77 pacientes con lesiones adrenocorticales confirmadas histológicamente, un ratio SUVmáx entre suprarrenal e hígado en la PET-TC mostró una sensibilidad del 100% y especificidad del 88% para diferenciar adenomas de carcinomas adrenocorticales12. Sin embargo, no hemos encontrado estudios que apoyen el valor discriminativo de la PET-TC con fluorodesoxiglucosa para distinguir ganglioneuromas de otras lesiones adrenales, tanto más dado que el ganglioneuroma es un tumor benigno, y a la fluorodesoxiglucosa se le atribuye un valor específico como marcador de desdiferenciación y progresión en la enfermedad tumoral13.
Los ganglioneuromas aparecen radiológicamente dentro del espectro de lesiones potencialmente malignas: en la TC la atenuación suele ser inferior a 40 UH, y en la resonancia magnética presentan una intensidad de señal baja en T1 y una intensidad mayor y heterogénea en T2. Por tanto, es fundamental distinguir los rasgos diferenciales de los ganglioneuromas14. Maweja et al. recomiendan sospechar ganglioneuroma ante lesiones con una atenuación en la TC entre 10 y 40 UH sin hiperproducción hormonal, invasión vascular ni calcificaciones finas. En la resonancia magnética, los ganglioneuromas son hipointensos en T1 e hiperintensos en T2 con patrón heterogéneo15, que contrasta con la hiperintensidad habitualmente homogénea de los feocromocitomas en T2, siempre que no presenten áreas necróticas ni hemorrágicas distinguibles en las secuencias T1.
El pronóstico es excelente. El tratamiento es la resección quirúrgica completa sin necesidad de quimioterapia o radioterapia dada la benignidad de la lesión.
Nuestro caso es peculiar por diferentes aspectos. Por una parte, la edad de la paciente es más tardía que en los diferentes casos publicados, y este aspecto recalca que la orientación diagnóstica de las masas adrenales debe basarse en sus características radiológicas y bioquímicas, mientras que los datos clínicos ayudan a orientar las sospechas pero en ningún caso son confirmatorios. Además, cada vez es mayor el empleo de PET-TC en el estudio de incidentalomas adrenales y en este caso habría sido de gran utilidad pero la paciente rechazó la realización del mismo para no demorar la intervención quirúrgica.
En cuanto a la indicación laparoscópica de la enfermedad maligna de la glándula suprarrenal, creemos que hay que distinguir entre las lesiones primarias (carcinoma adrenocortical) y las lesiones metastásicas de otros tumores primarios (pulmón, colorrectal, melanoma, riñón, mama). El carcinoma primario adrenal es un tumor poco frecuente, con una incidencia de 1-2 casos/1.000.000 habitantes/año, de naturaleza agresiva con una tasa de supervivencia a los 5 años entre 11-38% y cuyo tratamiento es la resección quirúrgica completa. El manejo inicial laparoscópico de este tipo de tumor fue un fracaso absoluto, con 5 casos entre 1997-1999 de recurrencia local, en puertos y carcinomatosis peritoneal16–20, lo que generó la sospecha de que la laparoscopia, probablemente por el neumoperitoneo, facilitaba la diseminación de las células tumorales. Series posteriores, aunque con tamaño muestral todavía reducido debido a la infrecuencia de dicha enfermedad, presentan unos resultados oncológicos mejores que los descritos inicialmente18,21–23.
En un metaanálisis publicado en 200524 sobre 420 adrenalectomías abiertas por enfermedad maligna encuentran una tasa de recidiva local y peritoneal muy similar a la descrita en series laparoscópicas (30% recidiva local, 67% a distancia, 14% recurrencias peritoneales). Por supuesto, parece obligatorio observar las reglas básicas de la cirugía laparoscópica oncológica: empleo de bolsa de extracción de la pieza, evitar la rotura de la pieza tumoral y resección completa con margen de seguridad de la masa. También es importante la selección del paciente; parece razonable evitar tumores de gran tamaño con sospecha radiológica de infiltración de estructuras vecinas. En estos casos, la posibilidad de reconversión a cirugía abierta, el riesgo de recidiva local, la diseminación peritoneal o la metástasis en puertos son mayores25–27.
Por último, la asociación del ganglioneuroma adrenal con síndromes de neoplasia endocrina múltiple hereditaria es excepcional, pero debe considerarse el estudio de RET o VHL en pacientes afectados de ganglioneuromas adrenales que asocien estigmas cutáneos u otros tumores más clásicamente asociados con dichos síndromes (feocromocitoma, carcinoma medular de tiroides o tumores neuroendocrinos pancreáticos), o bien en sujetos con ganglioneuromas adrenales bilaterales, particularmente si se presentan en las primeras décadas de la vida28–31. Dado que nuestra paciente no presentó ninguno de dichos estigmas, no solicitamos estudio genético de RET o VHL. Sin embargo, los tumores compuestos (ganglioneuroma-feocromocitoma o ganglioneuroma-paraganglioma) están sujetos en su estudio genético a las mismas consideraciones que los tumores de células cromafines aisladas. Por ello, es particularmente importante un examen cuidadoso de la pieza histológica antes de emitir el diagnóstico de ganglioneuroma.
En conclusión, en el estudio de incidentalomas adrenales deben considerarse etiologías menos frecuentes como el ganglioneuroma, y este debe sospecharse en masas con aspecto radiológico maligno sin hiperproducción hormonal asociada. Este caso muestra asimismo la importancia de la colaboración interdisciplinaria entre cirujanos, radiólogos y endocrinólogos con experiencia en procesos suprarrenales para optimizar el manejo clínico.