Debido a la necesidad de investigar nuevos marcadores de riesgo de nefropatía diabética, en este estudio se decidió evaluar la excreción en orina de 24 h de interleucina 6 (uIL-6) en pacientes con diabetes mellitus tipo 2 (DM2) y su relación con el daño tisular inducido por el aumento de presión arterial.
MétodosLa uIL-6, la excreción de albúmina y la presión arterial medida durante 24 h fueron evaluadas en 49 pacientes con DM2 y función renal normal. Comparamos a los sujetos con presión arterial sistólica (PAS) media de 24 h correcta, definida por PAS≤130 mmHg, con los pacientes con PAS no controlada (PAS>130 mmHg). Se calculó mediante estudio de regresión múltiple qué factores contribuían de manera significativa a la uIL-6.
ResultadosLa tasa de excreción de albúmina (AER) y la uIL-6 se asociaron de manera significativa (r=0,63; p<0,0001). Los pacientes con una PAS media de 24 h>130 mmHg (n=27) tenían una media de uIL-6 superior a la de los pacientes con PAS media de 24 h≤130 mmHg (n=22) (p=0,009). La fuerza de la asociación de la uIL-6 con la presión diastólica diurna y con la media (PAD) fue superior a la que presentaba con la AER. La PAS media (p<0,0001) contribuyó al 25% de la variancia de la AER tras ajustar por el índice de masa corporal, el sexo, la edad, la PAS media, la PAD media, la HbA1c y el tabaquismo. La PAS media de 24 h (p=0,005) y el tabaquismo (p=0,03) contribuyeron al 15 y el 9% de la variancia de la uIL-6, respectivamente.
ConclusionesEl aumento de uIL-6, quizá reflejando el daño y el remodelado tisular, podría ser un marcador de la elevación de la PAS en sujetos con DM2.
Research into new risk markers for diabetic kidney disease is required. We aimed to study 24-hour urinary interleukin- 6 excretion (uIL-6) in type 2 diabetic patients in relation to organ damage induced by increased blood pressure.
Methods24-hour uIL-6 and albumin excretion and 24-hour blood pressure recording were evaluated in 49 patients with type 2 diabetes and normal renal function. Patients with optimized mean 24-hour systolic blood pressure (SBP), defined as SBP ≤ 130 mmHg, and those with uncontrolled SBP (SBP > 130 mmHg) were compared. Multiple linear regression analysis was performed to study significant contributors to variance in the 24-hour uIL-6 excretion rate.
ResultsAlbumin excretion rate (AER) and uIL-6 were significantly correlated (r=0.63; p<0.0001). Patients with mean 24-hour SBP above 130 mmHg (n=27) had significantly higher mean uIL-6 excretion than those with a mean 24-hour SBP equal to or below 130 mmHg (n=22) (p=0.009). The strength of the association of uIL-6 with diurnal and mean diastolic blood pressure (DBP) was significantly greater than that with AER. Mean SBP (p<0.0001) contributed to 25% of AER variance after body mass index, age, sex, mean SBP, mean DBP, HbA1c and smoking status were accounted for. Mean 24-hour SBP (p=0.005) and smoking (p=0.03) contributed to 15% and 9%, respectively, of uIL-6 variance.
ConclusionsIncreased uIL-6, perhaps by reflecting significant tissue damage and remodelling, could be a marker for increased mean SBP in type 2 diabetes.
La excreción urinaria de albúmina es el predictor no invasivo más importante del riesgo de nefropatía diabética (ND) y debe determinarse de manera regular de acuerdo con las guías clínicas actuales. La microalbuminuria afecta al 20-40% de los pacientes con diabetes mellitus (DM) tipo 21. No obstante, el valor predictivo que tiene la microalbuminuria para determinar qué sujetos evolucionarán a nefropatía manifiesta es menor de lo que originariamente se pensaba. Se ha planteado que la tasa de excreción de albúmina (AER) no es capaz de definir qué sujetos están a salvo de padecer ND de manera precisa. Debido a ello se está investigando nuevos factores de riesgo que solos o en combinación sean capaces de mejorar la precisión que tiene la microalbuminuria sola2.
La interleucina (IL) 6 es una citocina multifuncional, cuya misión principal es la inducción de la respuesta inflamatoria aguda. La IL-6 promueve el crecimiento y la diferenciación de una amplia variedad de células, como las células mesangiales3.
La IL-6 en plasma se asocia a nefropatía y el grosor de la membrana basal glomerular (GBM) en los pacientes con DM2, lo que indica que la inflamación participa en el desarrollo de la glomerulopatía diabética4. En un estudio previo, el grosor de la GBM se correlacionó directamente con la concentración de IL-6, que era superior en los pacientes con aumento del grosor de la GBM que en los que tenían un grosor normal4. De hecho, el ARNm de la IL-6 se expresa en células glomerulares e intersticiales del tejido renal en sujetos con ND5. Muchas células del área de proliferación mesangial expresaban ARNm de IL-6. En el intersticio, se observó expresión de ARNm de la IL-6 en células de túbulos atróficos y células infiltrativas. La expresión intersticial de ARNm de IL-6 se correlacionó de manera significativa con el grado de daño intersticial5. La observación de que las células epiteliales del túbulo proximal demostraban activación antigénica para el factor nuclear kappa beta (NF-κβ) e IL-6 llevó a los autores a especular que el aumento crónico de las citocinas derivadas de genes proinflamatorios como el de la IL-6 podían ser clave en el daño del túbulo renal6.
El estudio de las concentraciones en orina de IL-6 (uIL-6) ha mostrado una clara asociación con la microalbuminuria7. Estos resultados indican que es posible que las concentraciones de uIL-6 fueran un buen indicador de ND.
Los estudios previos8 han descrito asociación entre las cifras de presión arterial y la excreción de albúmina en pacientes con DM1. En este estudio se pretende evaluar la asociación de la uIL-6 con la determinación de presión arterial ambulatoria de 24 h en pacientes con DM2.
PACIENTES Y MÉTODOSe reclutó de manera retrospectiva a 49 pacientes con DM2, según los criterios de la Sociedad Americana de Diabetes, valorados en las consultas externas de nuestro hospital y que presentaban un control metabólico estable en los últimos 6 meses, definidos por las cifras de glucohemoglobina (HbA1c). Los criterios de exclusión fueron: enfermedad hepática, neurológica, endocrina u otra enfermedad sistémica, incluido el cáncer; historia o evidencia clínica de hemocromatosis; historia de consumo de drogas o abuso de alcohol, definido por más de 80 g/día en varones y más de 40 g/día en mujeres, o concentraciones plasmáticas de transaminasas 2 veces por encima del rango de normalidad; elevación de cifras de creatinina; evento cardiovascular mayor en los 6 meses previos; enfermedad aguda y evidencia de enfermedad inflamatoria aguda o crónica o enfermedad infecciosa, y enfermedad mental. El tratamiento farmacológico de estos pacientes era: insulina (28%), hipoglucemiantes orales (61%), estatinas (52%), fibratos (13,7%), fármacos hipotensores –bloqueadores alfa (15,5%), antagonistas del calcio (51%), inhibidores de la enzima de conversión de angiotensina (2%)– y aspirina 27,5%. Todos los pacientes firmaron el consentimiento informado y el comité científico del hospital aprobó el protocolo.
El índice de masa corporal (IMC) se calculó como el peso (kg) dividido por el cuadrado de la estatura (m). La presión arterial ambulatoria fue medida mediante un Holter de presión arterial Spacelabs 90207 que recogía lecturas cada 15 min durante 24 h. La presión arterial diurna y la nocturna fueron calculadas usando intervalos horarios fijos (diurna entre las diez de la mañana y las diez de la noche, y nocturna entre la medianoche y las seis de la mañana).
Medidas bioquímicasLa concentración sanguínea de glucosa se midió por duplicado mediante le método de la glucosa oxidasa utilizando un Beckman Glucose Analyser II (Beckman Instruments, Brea, California). Las concentraciones de colesterol total fueron medidas mediante la reacción de esterasa/colesterol oxidasa/peroxidasa. La concentración de triglicéridos se midió mediante la reacción de glicerolfosfato oxidasa y peroxidasa. La HbA1c se determinó por el método de cromatografía líquida de alta resolución (Bio-Rad, Muenchen, Alemania, y autoanalizador Jokoh HS-10, respectivamente). Los coeficientes de variación intraanalítica e interanalítica fueron < 4% para todos los tests.
Para la IL-6 humana se utilizó un análisis de alta sensibilidad (Quantikine HS High Sensitivity; R&D systems, Lille, Francia). La concentración mínima detectable fue 0,039 pg/ml y el coeficiente de variación intraanalítica e interanalítica fueron < 7,8% y < 9,6%, respectivamente para la determinación sérica, y < 9,8% y < 11,2% para la determinación de orina.
Los pacientes recogieron la orina de 24 h. La correcta recogida de las muestras se evaluó por la determinación concomitante de la creatinina en orina. La excreción de albúmina se midió mediante los métodos de laboratorio habituales. La microalbuminuria se definió como una tasa de excreción de albúmina (AER) > 30 mg/24 h y < 300 mg/24 h; macroalbuminuria, si la AER era > 300 mg/24 h. La microalbuminuria se determinó por inmunoturbidimetría mediante analizador Cobas Integra 403 (Roche Diagostics, Alemania).
EstadísticaLos resultados descriptivos de las variables continuas se expresan mediante la media ± desviación estándar. Antes del análisis estadístico, la distribución normal y la homogeneidad de las variables fueron evaluadas mediante el test de Levene, y en caso necesario se realizó la transformación logarítmica de las variables. Estos parámetros (triglicéridos, IL-6 urinaria) se analizaron en una escala logarítmica y se estudió su significación estadística en esa escala. En las tablas se reflejan los antilogaritmos de los valores transformados. Las relaciones entre las variables fueron analizadas usando el test de Pearson, correlación parcial y análisis de regresión múltiple. Controlamos por la variable tabaquismo porque en estudios previos se comprobó que el tabaco influía la asociación entre la IL-6 y la presión arterial9. Usamos la prueba de la χ2 para la comparación de proporciones y la de la t de Student para datos no apareados para la comparación de variables cuantitativas. Los análisis se realizaron utilizando el programa SPSS (versión 11.0).
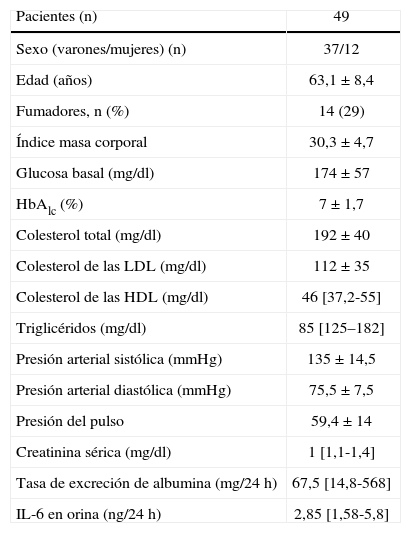
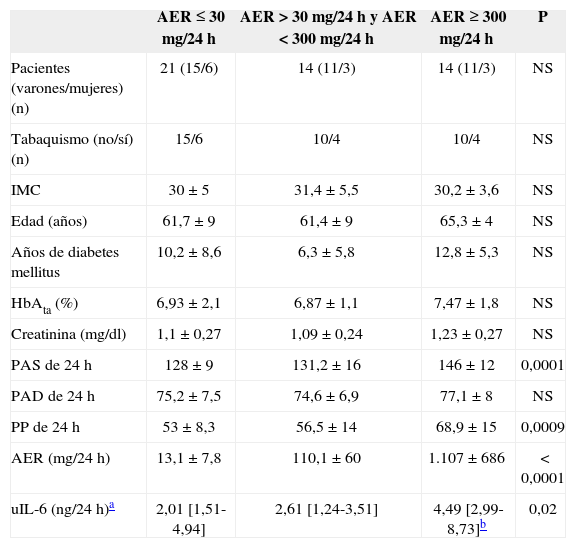
RESULTADOSLas tablas 1 y 2 muestran las características clínicas y bioquímicas de los sujetos de estudio tanto en el grupo completo (tabla 1) como según los diferentes grados de excreción urinaria de albúmina (tabla 2).
Variables antropométricas y bioquímicas de los sujetos del estudio
| Pacientes (n) | 49 |
| Sexo (varones/mujeres) (n) | 37/12 |
| Edad (años) | 63,1 ±8,4 |
| Fumadores, n (%) | 14 (29) |
| Índice masa corporal | 30,3 ±4,7 |
| Glucosa basal (mg/dl) | 174 ± 57 |
| HbAlc (%) | 7 ± 1,7 |
| Colesterol total (mg/dl) | 192 ±40 |
| Colesterol de las LDL (mg/dl) | 112 ±35 |
| Colesterol de las HDL (mg/dl) | 46 [37,2-55] |
| Triglicéridos (mg/dl) | 85 [125–182] |
| Presión arterial sistólica (mmHg) | 135 ±14,5 |
| Presión arterial diastólica (mmHg) | 75,5 ±7,5 |
| Presión del pulso | 59,4 ± 14 |
| Creatinina sérica (mg/dl) | 1 [1,1-1,4] |
| Tasa de excreción de albumina (mg/24 h) | 67,5 [14,8-568] |
| IL-6 en orina (ng/24 h) | 2,85 [1,58-5,8] |
HbA1c: glucohemoglobina; HDL: lipoproteínas de alta densidad; IL: interleucina; LDL: lipoproteínas de baja densidad.
Los datos expresan media ± desviación estándar o mediana [intervalo intercuartílico], salvo donde se indica otra cosa.
Comparación de las concentraciones de interleucina 6 en orina en diferentes grados de tasa de excreción de albúmina (AER) en pacientes con diabetes mellitus tipo 2
| AER ≤ 30 mg/24 h | AER > 30 mg/24 h y AER < 300 mg/24 h | AER ≥ 300 mg/24 h | P | |
| Pacientes (varones/mujeres) (n) | 21 (15/6) | 14 (11/3) | 14 (11/3) | NS |
| Tabaquismo (no/sí) (n) | 15/6 | 10/4 | 10/4 | NS |
| IMC | 30 ± 5 | 31,4 ±5,5 | 30,2 ±3,6 | NS |
| Edad (años) | 61,7 ±9 | 61,4 ±9 | 65,3 ± 4 | NS |
| Años de diabetes mellitus | 10,2 ±8,6 | 6,3 ±5,8 | 12,8 ±5,3 | NS |
| HbAta (%) | 6,93 ±2,1 | 6,87 ±1,1 | 7,47 ± 1,8 | NS |
| Creatinina (mg/dl) | 1,1 ±0,27 | 1,09 ±0,24 | 1,23 ±0,27 | NS |
| PAS de 24 h | 128 ±9 | 131,2 ±16 | 146 ± 12 | 0,0001 |
| PAD de 24 h | 75,2 ±7,5 | 74,6 ± 6,9 | 77,1 ± 8 | NS |
| PP de 24 h | 53 ± 8,3 | 56,5 ± 14 | 68,9 ±15 | 0,0009 |
| AER (mg/24 h) | 13,1 ±7,8 | 110,1 ±60 | 1.107 ± 686 | < 0,0001 |
| uIL-6 (ng/24 h)a | 2,01 [1,51-4,94] | 2,61 [1,24-3,51] | 4,49 [2,99-8,73]b | 0,02 |
AER: tasa de excreción de albumina; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PP: presión de pulso; uIL-6: excreción urinaria de interleucina 6.
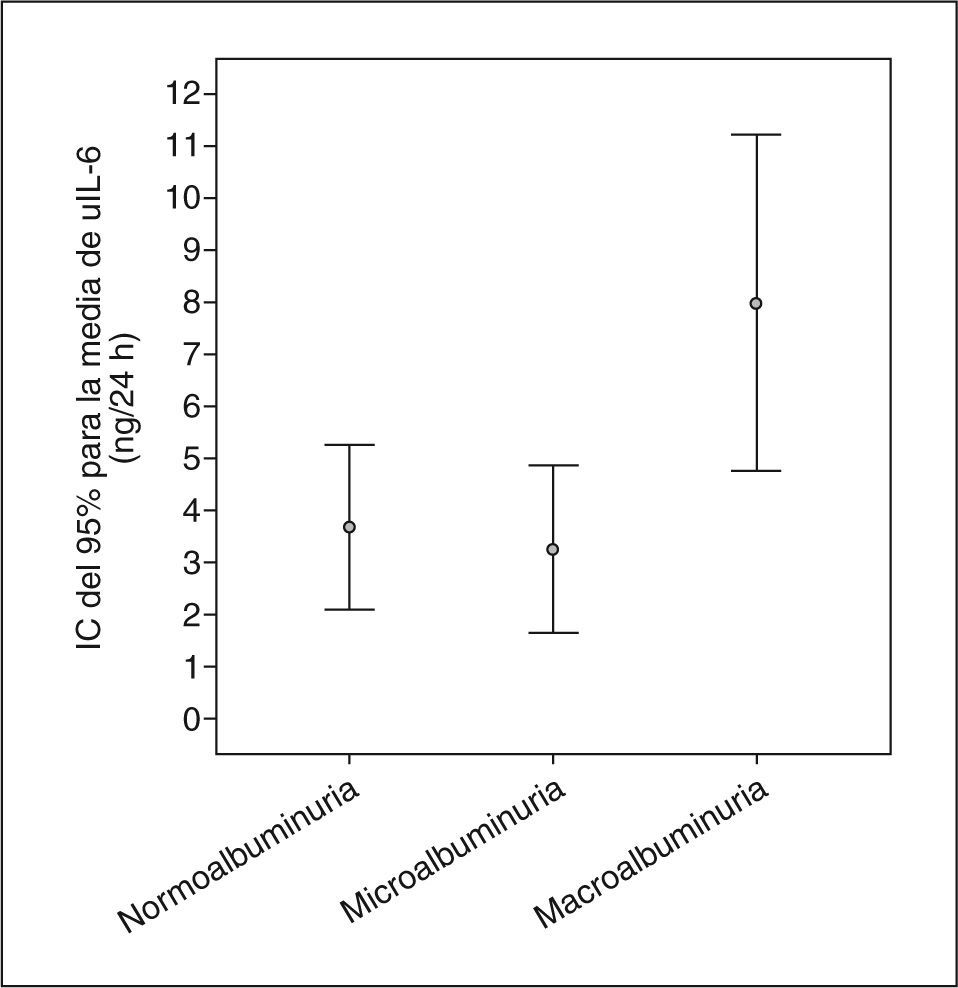
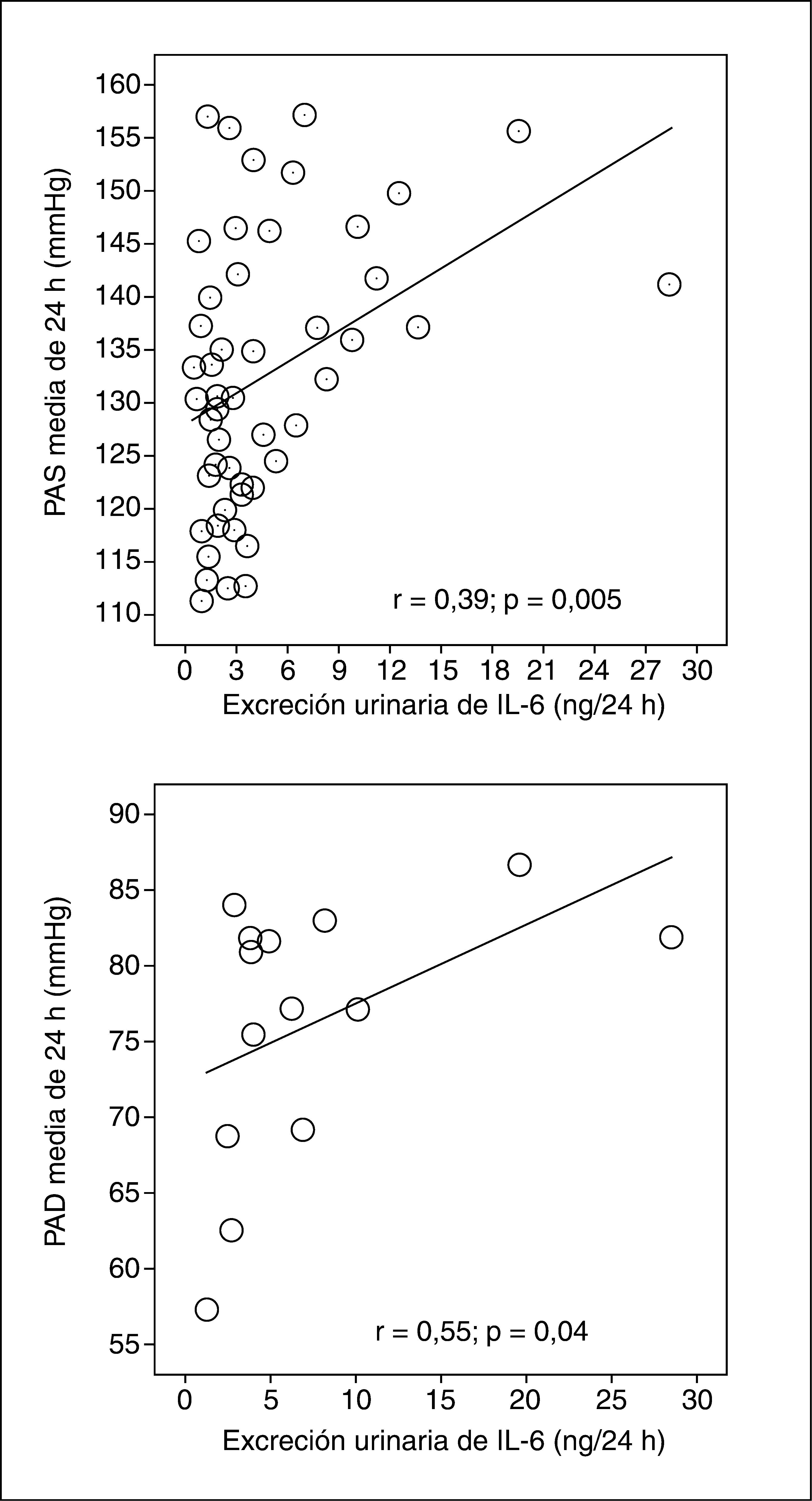
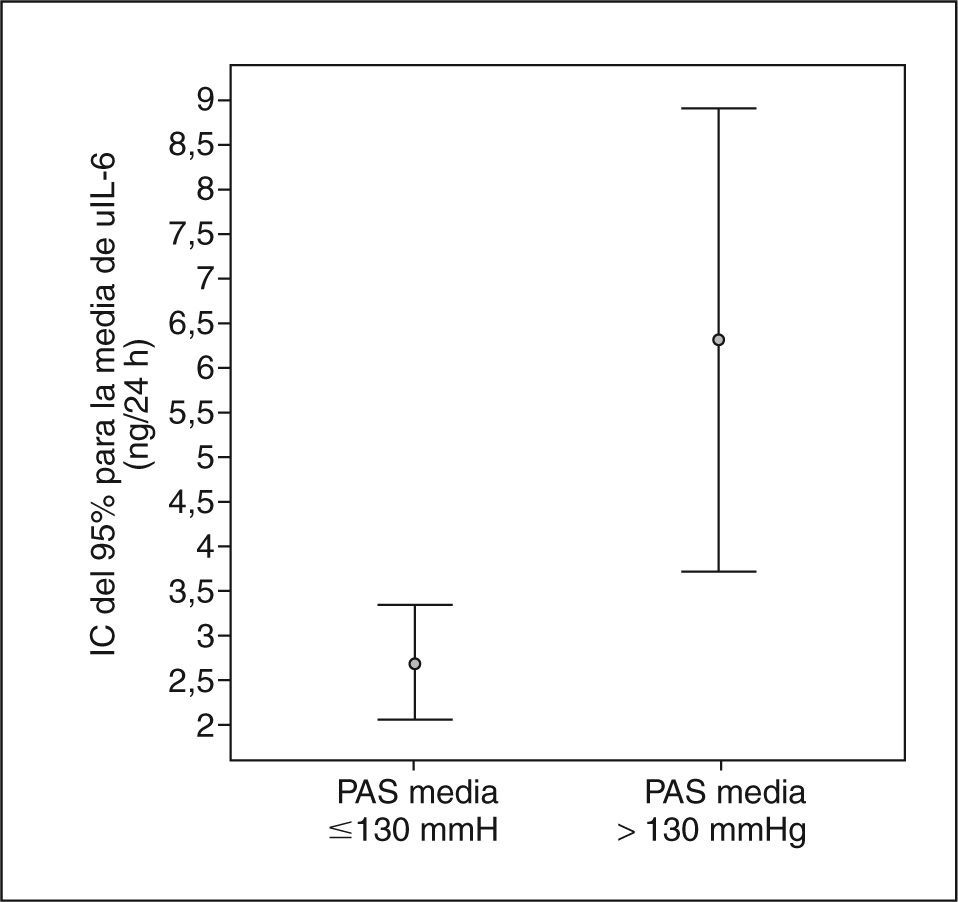
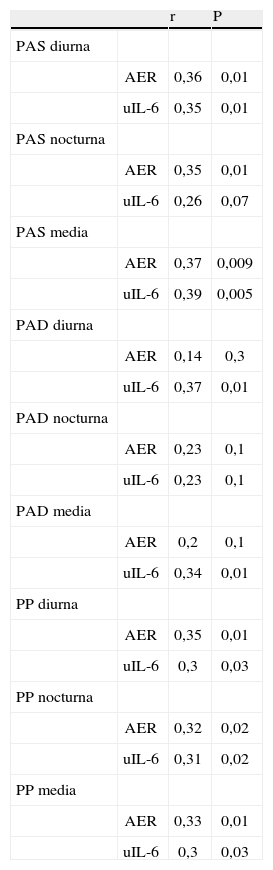
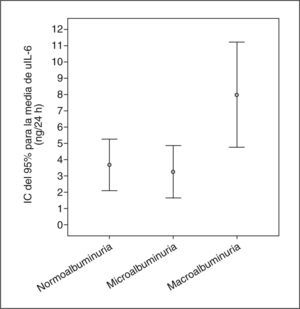
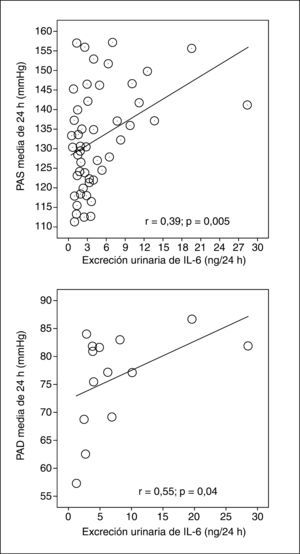
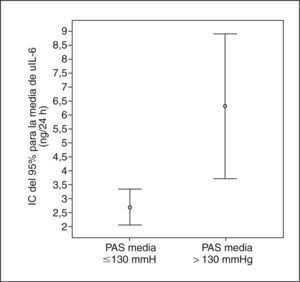
Los pacientes con macroalbuminuria presentaban tendencia a ser de mayor edad y tener más años de evolución de su DM, sin llegar a la significación estadística. La distribución por sexos, hábito tabáquico e IMC era similar en los tres grupos de pacientes. No observamos diferencias significativas en el consumo de medicamentos entre los grupos de pacientes con albuminuria. La media de la presión arterial sistólica (PAS) durante 24 h y de la presión del pulso (PP) fueron significativamente superiores en los pacientes con macroalbuminuria. La excreción urinaria de IL-6 era superior sólo en los pacientes con macroalbuminuria (fig. 1). De hecho, la AER y uIL-6 se correlacionaban positivamente (r = 0,63; p < 0,0001). La tabla 3 y la figura 2 muestran las asociaciones entre la AER, la uIL-6 y la presión arterial de 24 h y la PP. La AER y la uIL-6 se asociaban de manera similar a la presión arterial de 24 h y la PAS. La uIL-6 se asoció con la media de la PAS de 24 h en todos los sujetos (fig. 2, panel superior) y con la media de 24 h de la presión arterial diastólica (PAD) en los pacientes con macroalbuminuria (fig. 2, panel inferior). La fuerza de la asociación de la concentración en orina de IL-6 con la media de la PAD diurna y con la media de 24 h era superior que su relación con la AER. Los pacientes con una media de PAS de 24 h > 130 mmHg (n = 27) tenían una excreción urinaria media de IL-6 mayor (6,3 frente a 2,7 ng/24 h; diferencia media, 3,6; intervalo de confianza [IC] del 95%, 0,74-6,46) que los pacientes con una media de PAS de 24 h ≤ 130 mmHg (n = 22) (p = 0,009) (fig. 3).
Correlaciones entre la presión arterial de 24 h, tasa de excreción de albúmina e IL-6 en orina de los pacientes con diabetes mellitus tipo 2
| r | P | ||
| PAS diurna | |||
| AER | 0,36 | 0,01 | |
| uIL-6 | 0,35 | 0,01 | |
| PAS nocturna | |||
| AER | 0,35 | 0,01 | |
| uIL-6 | 0,26 | 0,07 | |
| PAS media | |||
| AER | 0,37 | 0,009 | |
| uIL-6 | 0,39 | 0,005 | |
| PAD diurna | |||
| AER | 0,14 | 0,3 | |
| uIL-6 | 0,37 | 0,01 | |
| PAD nocturna | |||
| AER | 0,23 | 0,1 | |
| uIL-6 | 0,23 | 0,1 | |
| PAD media | |||
| AER | 0,2 | 0,1 | |
| uIL-6 | 0,34 | 0,01 | |
| PP diurna | |||
| AER | 0,35 | 0,01 | |
| uIL-6 | 0,3 | 0,03 | |
| PP nocturna | |||
| AER | 0,32 | 0,02 | |
| uIL-6 | 0,31 | 0,02 | |
| PP media | |||
| AER | 0,33 | 0,01 | |
| uIL-6 | 0,3 | 0,03 | |
PAD: presión arterial diastólica; PAS: presión arterial sistólica; PP: presión del pulso.
Las concentraciones séricas de IL-6 se asociaron positivamente con la AER (r = 0,32; p = 0,02) y con la PAS nocturna (r = 0,37; p = 0,005) y la media de la PAS (r = 0,32; p = 0,02). Estas asociaciones se mantuvieron de manera significativa tras controlar por edad, IMC y sexo. Las asociaciones entre las concentraciones de IL-6 en suero con la PAS diurna y con la media diurna y nocturna de la PAD no llegaron a la significación estadística. No encontramos asociaciones significativas entre las concentraciones urinarias y séricas de IL-6 (r = 0,09).
Finalmente, realizamos un estudio de regresión lineal múltiple para predecir la uIL-6 y la AER. Tras considerar el IMC, la edad, el sexo, la PAS media, la PAD media, la HbA1c y el tabaquismo como variables independientes, sólo la media de la PAS (p < 0,0001) contribuyó de manera independiente al 25% de la variancia de la AER. La PAS media (p = 0,005) y el tabaquismo (p = 0,03) contribuyeron al 15 y el 9% de las concentraciones de IL-6 en orina, respectivamente.
DISCUSIONLos aumentos en la presión arterial a lo largo del día tienen un papel fundamental en la ND. El aumento de la presión arterial, cuando se transmite a la circulación del glomérulo, puede causar cambios hemodinámicos intraglomerulares, lo que lleva al aumento de AER, daño estructural renal, o ambos. Este estudio indica que la IL-6 en orina podría tomar parte e indicar alguna forma de daño en el órgano diana asociado al aumento de la presión arterial en la nefropatía de los pacientes con DM2. No obstante, la excreción urinaria de IL-6 se podría asociar al aumento de la formación de IL-6 o al deterioro en su captación tubular, por lo que estos hallazgos deberían ser investigados en futuros estudios. Se observó un aumento en la media de la PAS durante 24 h y en la media de la PP de 24 h de forma paralela al aumento de la concentración en orina de IL-6. A la vez es interesante observar que los sujetos con PAS media durante 24 h > 130 tenían un aumento significativo de los valores de IL-6 en orina. La correlación lineal entre la media de la PAS y las concentraciones en orina de IL-6 se mantuvieron significativas tras ajustar por edad, IMC y sexo. Estos hallazgos indicarían que la IL-6 en orina podría ser un marcador del aumento de PAS y de macroalbuminuria, situaciones en las cuales el daño y el remodelado tisular podrían requerir un aumento de la síntesis de IL-65,6.
También se muestra que la AER y la IL-6 en orina se asociaban de manera similar con la PAS. La fuerza de la asociación de la IL-6 urinaria con la PAD diurna era superior que su asociación con las AER. No se han encontrado en la literatura otros estudios que evalúen la asociación entre la presión arterial de 24 h con la excreción en orina de 24 h de IL-6. De manera similar a estudios previos10–12, se hallaron asociaciones bivariables entre la presión arterial media y la AER. Las asociaciones entre el aumento de la presión arterial ambulatoria, especialmente de la presión arterial nocturna, y la microalbuminuria en la DM han sido ampliamente descritas8.
Cada vez hay más evidencias de que el componente pulsátil de la presión arterial, que es la PP, la cual refleja la distensibilidad arterial, está fuertemente asociada al desarrollo de complicaciones cardiovasculares13. En el estudio que aquí se describe se encontró también un aumento en la PP en pacientes con macroalbuminuria y elevación de la IL-6 en orina.
En un estudio previo los valores de presión arterial se asociaron con las concentraciones en sangre de IL-6 en sujetos sanos9, hecho que se ha confirmado en series más amplias14. En este estudio se confirma la asociación entre los valores séricos de IL-6 y la presión arterial, especialmente la presión arterial media nocturna. Estos hallazgos confirman que la DM2 y sus complicaciones son enfermedades inflamatorias15.
Como la tasa de progresión de microalbuminuria en pacientes con DM2 difiere de manera considerable entre los sujetos16, se podría especular que la IL-6 en orina podría añadir información pronóstica en estos pacientes.
En resumen, la IL-6 en orina está elevada de manera significativa en pacientes con macroalbuminuria y está asociada a la media de la PAS de 24 h y con la PP. La excreción en orina de 24 h de IL-6 podría ser un marcador de pobre control de presión arterial en pacientes con DM2.
Este trabajo ha tenido el respaldo de las becas de investigación del Ministerio de Educación y Ciencia (BFU2004-03654) y del Instituto de Salud Carlos III (RCMN C03/08, RGDM G03/212, RGTO G03/028).