Actualizar las recomendaciones previas formuladas por el Grupo de trabajo de osteoporosis y metabolismo mineral de la Sociedad Española de Endocrinología y Nutrición (SEEN) para la evaluacio¿n y el tratamiento de la osteoporosis asociada a diferentes enfermedades endocrinas y alteraciones nutricionales.
ParticipantesMiembros del Grupo de trabajo de osteoporosis y metabolismo mineral de la SEEN.
MétodosLas recomendaciones se formularon de acuerdo al sistema Grading of Recommendations, Assessment, Development, and Evaluation (GRADE) para establecer tanto la fuerza de las recomendaciones como el grado de evidencia. Se realizo¿ una bu¿squeda sistemática en PubMed de las nuevas acerca de cada enfermedad usando las siguientes palabras clave asociadas al nombre de cada proceso patológico: AND osteoporosis, fractures, bone mineral density, bone markers y treatment. Se revisaron arti¿culos escritos en inglés con fechas de inclusio¿n comprendidas entre el 18 de octubre de 2011 y el 30 de octubre de 2014. Tras la formulacio¿n de las recomendaciones estas se discutieron de forma conjunta por el Grupo de trabajo.
ConclusionesEsta actualización resume los nuevos datos acerca de la evaluacio¿n y tratamiento de la osteoporosis en las enfermedades endocrinas y nutricionales que se asocian a baja masa o¿sea o a un aumento del riesgo de fractura.
To update previous recommendations developed by the Working Group on Osteoporosis and Mineral Metabolism of the Spanish Society of Endocrinology and Nutrition for the evaluation and treatment of osteoporosis associated to different endocrine and nutritional diseases.
ParticipantsMembers of the Working Group on Osteoporosis and Mineral Metabolism of the Spanish Society of Endocrinology and Nutrition.
MethodsRecommendations were formulated according to the GRADE system (Grading of Recommendations, Assessment, Development, and Evaluation) to describe both the strength of recommendations and the quality of evidence. A systematic search was made in MEDLINE (Pubmed) using the following terms associated to the name of each condition: AND “osteoporosis”, “fractures”, “bone mineral density”, and “treatment”. Papers in English with publication date between 18 October 2011 and 30 October 2014 were included. The recommendations were discussed and approved by all members of the Working Group.
ConclusionsThis update summarizes the new data regarding evaluation and treatment of osteoporosis associated to endocrine and nutritional conditions.
En el campo de la endocrinologi¿a y de la nutricio¿n hay numerosas enfermedades y situaciones en las que existe un riesgo aumentado tanto de osteoporosis como de fracturas por fragilidad. En muchas de estas entidades no existen recomendaciones especi¿ficas acerca de cuándo realizar una evaluacio¿n de la densidad mineral o¿sea, y tampoco del tratamiento y manejo indicados. En un documento previo del Grupo de trabajo de osteoporosis y metabolismo mineral de la Sociedad Española de Endocrinologi¿a y Nutricio¿n (SEEN)1 se proporcionaron unas recomendaciones prácticas para la evaluacio¿n y tratamiento de la osteoporosis asociada a diferentes enfermedades endocrinas y alteraciones nutricionales. Sin embargo, desde su realización en 2011, la publicación de nuevos datos hace necesaria una actualización de las recomendaciones previas. Además, se han incluido otras acerca de enfermedades como la acromegalia, debido a la creciente evidencia acerca del riesgo de fracturas vertebrales asociado a esta enfermedad.
En el presente documento, y para facilitar la lectura y consulta del mismo, aparece el listado completo de recomendaciones considerando los procesos endocrinos más frecuentes y/o con mayor repercusión sobre la salud ósea. Sin embargo, solo se incluye la evidencia correspondiente a los procesos y aspectos en los que se ha producido alguna actualización, por lo que remitimos al lector a la publicación previa1 para la consulta de la evidencia que sustenta las recomendaciones previamente formuladas.
Desarrollo de recomendaciones basadas en la evidenciaLas recomendaciones se formularon de acuerdo al sistema Grading of Recommendations, Assessment, Development, and Evaluation (GRADE) para establecer su fuerza y el grado de evidencia2. Este sistema establece una descripcio¿n gráfica de la calidad de la evidencia disponible y de la fuerza de la recomendacio¿n que se realiza en función de esta evidencia. Asi¿, en términos de fuerza de recomendacio¿n se distinguen recomendaciones fuertes, expresadas como «recomendamos» y el nu¿mero 1, y recomendaciones débiles expresadas como «sugerimos» y el nu¿mero 2. La calidad de la evidencia se expresa con si¿mbolos: ⊕ ○○○ indica evidencia muy baja; ⊕⊕○○ evidencia baja; ⊕⊕⊕○ evidencia moderada; y ⊕⊕⊕⊕ evidencia alta. Junto a cada recomendacio¿n se describe la evidencia que sustenta la misma.
Se realizo¿ una actualización a través de una bu¿squeda sistemática en Medline de la evidencia disponible para cada enfermedad usando las siguientes palabras clave asociadas al nombre de cada proceso patológico: AND osteoporosis, fractures, bone mineral density y treatment. Se revisaron arti¿culos escritos en inglés con fecha de inclusio¿n entre el 18 de octubre de 2011 y el 30 de octubre de 2014. Tras la formulacio¿n de las recomendaciones estas se discutieron de forma conjunta por el Grupo de trabajo.
Para cada entidad se revisan los siguientes aspectos de acuerdo a la evidencia disponible: evaluacio¿n de la densidad mineral o¿sea (DMO) por densitometri¿a dual de rayos X (DXA), evaluación de la presencia de fracturas vertebrales asintomáticas a través de radiologi¿a de columna dorsolumbar, recomendaciones acerca de medidas preventivas y de tratamiento.
Además de las medidas especificadas en cada epi¿grafe, el Grupo de trabajo recomienda de forma general asegurar una ingesta de calcio suficiente y unas concentraciones adecuadas de vitamina D en todos los procesos que cursan con descenso de la masa o¿sea y/o aumento del riesgo de fractura (1⊕○○○). Por su mejor tolerancia digestiva debe recomendarse aumentar la ingesta dietética de calcio, utilizando suplementos en caso de no alcanzar una ingesta adecuada (de 800 a 1.000mg/día) de calcio. En cuanto a las concentraciones de 25 OH vitamina D a alcanzar, y teniendo en cuenta que se trata de enfermedades con un riesgo elevado de masa ósea baja y/o fractura, sugerimos al menos 30ng/ml, en línea con las recomendaciones de otras sociedades3. Como norma general se recomienda aportar de 800 a 1.000UI/día de ergocalciferol o colecalciferol, o sus equivalentes semanales o mensuales4. En casos concretos, como los pacientes intervenidos de cirugía bariátrica, estas recomendaciones son superiores y se especifican en el apartado correspondiente.
Diabetes mellitus tipo 1Evaluación- -
Recomendamos evaluar la masa ósea mediante DXA, así como el riesgo de fractura no vertebral en los pacientes adultos con diabetes mellitus tipo 1 (DM1) (1⊕⊕⊕○).
- -
Sugerimos evaluar la presencia de fractura vertebral mediante radiografía convencional en pacientes con DM1 (2⊕⊕⊕○).
- -
Recomendamos que los pacientes con DM1 que tengan osteoporosis y/o fractura por fragilidad sigan las mismas recomendaciones generales y farmacolo¿gicas que la poblacio¿n sin diabetes (1⊕⊕○○).
- -
El déficit de funcio¿n osteoblástica en esta enfermedad hace atractivo el empleo de fármacos anabo¿licos en pacientes de alto riesgo o en prevencio¿n secundaria (2⊕○○○).
Un reciente metaanálisis de estudios de corte transversal confirma que los pacientes con DM1 tienen una menor DMO, medida mediante DXA, con respecto a la población no diabética. Esta disminución depende de la edad, del sexo y de la localización analizada5. La relación entre la pérdida de DMO y el grado de control metabólico continúa siendo controvertida6–8. A su vez, la prevalencia de fractura vertebral morfométrica parece ser mayor en este grupo de pacientes que en los sujetos no diabéticos9. Este riesgo es independiente de la DMO a nivel lumbar9, se ha relacionado con los niveles séricos de pentosidina10, podría estar incrementado en pacientes con hipoglucemias nocturnas severas11 y su relación con la HbA1c persiste contradictoria9,10.
Diabetes mellitus tipo 2Evaluación- -
Recomendamos evaluar el riesgo de fractura no vertebral, en particular en aquellos pacientes con complicaciones crónicas, insulinoterapia o tratamiento con glitazonas (1⊕⊕○○).
- -
Sugerimos medir la DMO y evaluar la presencia de fractura vertebral mediante estudio de radiologi¿a simple (2⊕⊕○○).
- -
Sugerimos estimar el riesgo absoluto de fractura mediante la escala Fracture Risk Assessment Tool (FRAX) (2⊕○○○).
- -
Sugerimos, si existe la disponibilidad, analizar la microarquitectura trabecular en la columna lumbar mediante Trabecular Bone Score (2⊕○○○).
- -
Recomendamos que en los pacientes con diabetes mellitus tipo 2 (DM2) la osteoporosis y la prevencio¿n de fracturas debe seguir las mismas recomendaciones que en poblacio¿n sin diabetes (1⊕⊕○○).
- -
Sugerimos valorar el tratamiento antiosteoporótico en pacientes con DM2 que no alcancen valores de intervención mediante FRAX, pero que presenten un cúmulo de factores de riesgo de fragilidad ósea (2⊕○○○).
- -
El déficit de funcio¿n osteoblástica en esta enfermedad hace atractivo el empleo de fármacos anabo¿licos en pacientes de alto riesgo o en prevencio¿n secundaria (2⊕○○○).
Se confirma que, tanto en varones como en mujeres, los pacientes con DM2 tienen una mayor DMO a nivel lumbar y femoral. Este aumento se relaciona positivamente con el IMC, el sexo masculino, la HbA1c, una menor edad y unos mayores niveles séricos de esclerostina12,13. La hiperhomocisteinemia14 y el tratamiento con rosiglitazona15 se asocian a una menor masa ósea en este grupo de pacientes. El análisis de la calidad ósea a nivel lumbar mediante Trabecular Bone Score puede tener un papel relevante en la predicción del riesgo de fractura de estos sujetos. En este sentido, la población con DM2 tiene un menor Trabecular Bone Score con respecto a los sujetos no diabéticos. Este descenso se relaciona, independientemente de la DMO, con un mayor riesgo de fractura por fragilidad, y parece estar condicionado por un mal control glucémico y la presencia de resistencia a la insulina16–18.
Con respecto a las fracturas por fragilidad, la enfermedad coronaria y la neuropatía periférica se confirman como factores de riesgo independientes19–21. A este respecto, diferentes marcadores bioquímicos se han asociado con un mayor riesgo de fracturas vertebrales. Así, la elevación de las concentraciones plasmáticas de esclerostina, y el descenso de los niveles séricos de 25 hidroxivitamina D, de los receptores de los productos finales de la glucosilación avanzada y de la IGF-1 se han asociado a un mayor riesgo de fractura vertebral en este grupo de la población22–25. Por último, recientes estudios muestran que la escala FRAX infraestima el riesgo de fractura en pacientes con DM226,27, por lo que se ha sugerido plantear el inicio del tratamiento antiosteoporótico en aquellos sujetos que no alcanzan el umbral de intervención, medido por FRAX, pero que acumulen factores de riesgo de fragilidad ósea28.
Hiperparatiroidismo primarioEvaluación- -
Recomendamos la evaluación de la DMO en el tercio distal del radio, además de la columna y el fémur, y la realización de radiografía lateral de columna dorsal y lumbar para evaluar la presencia de fractura vertebral en todos los pacientes con hiperparatiroidismo primario (HP) (1⊕⊕⊕○).
- -
Recomendamos la paratiroidectomía en la mayoría de casos, ya que aumenta la masa ósea y reduce el riesgo de fractura (1⊕⊕⊕○).
- -
Recomendamos considerar cirugía cuando exista una fractura por fragilidad (1⊕○○○).
- -
En caso de contraindicación o rechazo de la cirugía sugerimos tratamiento combinado con cinacalcet (para control de las concentraciones de parathormona y calcio) y un anticatabólico (bisfosfonatos o denosumab) para evitar la pérdida de masa ósea, aunque no existen datos sobre fracturas (2⊕○○○).
- -
Recomendamos alcanzar concentraciones de calcidiol superiores a 20ng/dl (50nmol/l) en pacientes con HP no candidatos o que estén en espera de cirugía (1⊕⊕○○).
- -
Recomendamos garantizar una ingesta de calcio adecuada para la edad en pacientes con HP, ya que no existe razón para limitarla (1⊕○○○).
Los cambios en el manejo del HP asintomático vienen expuestos en los artículos recientemente publicados a raíz del Fourth International Workshop on the Management of Asymptomatic Primary Hyperparathyroidism29–32. Debe realizarse una evaluación de la DMO por DXA en todos estos pacientes, siendo importante llevarlo a cabo en el tercio distal del radio, además de la columna y el fémur. Se indicará la cirugía cuando la calcemia sea superior a la normal en 1mg/dl, o cuando el T-score sea igual o inferior a –2,5 desviaciones estándar (DE) en la columna lumbar, cuello femoral, cadera o tercio distal del radio en mujeres posmenopáusicas y en hombres con edad superior a 50 años. La presencia de fracturas vertebrales detectadas por radiología, tomografía computarizada, resonancia magnética o Vertebral Fracture Assessment constituye un criterio de cirugía32. En pacientes menores de 50 años se considera el Z-score inferior a –2,5 DE en lugar del T-score en las mismas localizaciones29.
En caso de ser necesario realizar una suplementación con vitamina D se recomienda iniciar con dosis entre 800 y 1.000UI/día para alcanzar unas concentraciones de al menos 20ng/dl. En un estudio de intervención en el que sea administraron 2.800UI/día de colecalciferol a pacientes con HP primario, las concentraciones de vitamina D superiores a 30ng/ml se tradujeron en una reducción adicional de las concentraciones de parathormona antes de la cirugía, así como en un aumento de la DMO del 2,5%33. La ingesta de calcio en pacientes con HP debe ser la recomendada para la población general según edad, ya que no existen razones para limitarla.
Hipertiroidismo endógenoEvaluación- -
Sugerimos realizar una evaluacio¿n de la DMO y de la presencia de fracturas en pacientes con antecedentes de hipertiroidismo. El antecedente con hipertiroidismo debe considerarse un factor de riesgo de fractura de cadera (2⊕⊕○○).
- -
El tratamiento del hipertiroidismo con consecucio¿n rápida del eutiroidismo produce una mejori¿a, al menos parcial, de la masa o¿sea y una disminucio¿n del riesgo de fractura (1⊕⊕○○).
- -
Recomendamos asegurar la adecuada ingesta de calcio y vitamina D (1⊕○○○).
- -
Sugerimos considerar el tratamiento con anticatabo¿licos (aminobisfosfonatos o denosumab) de forma individualizada en mujeres posmenopáusicas y en ancianos de ambos sexos con alto riesgo de fractura osteoporo¿tica. Las pacientes con osteoporosis posmenopáusica y con antecedente de hipertiroidismo pueden beneficiarse de tratamiento anabo¿lico (parathormona o teriparatida) antes de recibir antirreabsortivos (2⊕○○○).
- -
En varones jóvenes el descenso de las concentraciones de testosterona se asocia a DMO baja y a aumento del riesgo de fractura (1⊕⊕⊕⊕).
- -
Recomendamos realizar DXA al diagnóstico del hipogonadismo y posteriormente cada 3 a 5 años (1⊕⊕○○).
- -
Recomendamos la medición anual de las concentraciones de vitamina D (1⊕⊕○○).
- -
Para aumentar la masa ósea y reducir el riesgo de fractura recomendamos: restaurar las concentraciones de testosterona (1⊕⊕○○), mantener un aporte adecuado de calcio y vitamina D y realizar actividad física regular (1⊕⊕⊕⊕).
- -
Recomendamos tratamiento con bisfosfonatos en varones con osteoporosis y/o fracturas por fragilidad (1⊕⊕⊕⊕). Si existe osteoporosis grave, masa ósea muy baja (inferior a 3 DE) o falta de respuesta a bisfosfonatos recomendamos usar teriparatida (1⊕⊕○○).
- -
Recomendamos realizar DXA y valorar la existencia de fracturas vertebrales mediante radiología al inicio del tratamiento con agonistas de GnRH o tras la orquidectomía, y posteriormente cada 12 meses mientras se esté utilizando el tratamiento con agonistas de GnRH (1⊕⊕⊕⊕).
- -
Recomendamos que todos los pacientes en tratamiento con agonistas de GnRH u orquidectomía reciban calcio (1.000-1.500mg) y vitamina D (800UI), se abstengan de fumar y realicen actividad física regular (1⊕⊕⊕⊕).
- -
En pacientes con un T-score inferior a –2 y/o con antecedentes de fractura osteoporótica recomendamos iniciar tratamiento con bisfosfonatos (como primera opción con ácido zoledrónico) (1⊕⊕⊕⊕) o con denosumab (1⊕⊕⊕⊕).
- -
En pacientes con T-score entre –1 y –2 recomendamos valorar la presencia de otros factores de riesgo para osteoporosis (1⊕⊕⊕○).
Los agonistas de GnRH (goserelina, triptorelina, leuprolida) utilizados en el carcinoma de próstata avanzado inducen una pérdida de DMO y un aumento del riesgo de fracturas de un 34%. Además, en los pacientes con fractura existe un mayor riesgo de mortalidad (Hazard ratio 2,05)34,35.
Un reciente metaanálisis36 ha demostrado que los bisfosfonatos tienen un efecto preventivo de fracturas (riesgo relativo [RR] de 0,80; p<0,01) y osteoporosis (RR de 0,39; p<0,001) en pacientes en tratamiento con agonistas de GnRH. El zoledronato es el que ha demostrado una mayor eficacia36.
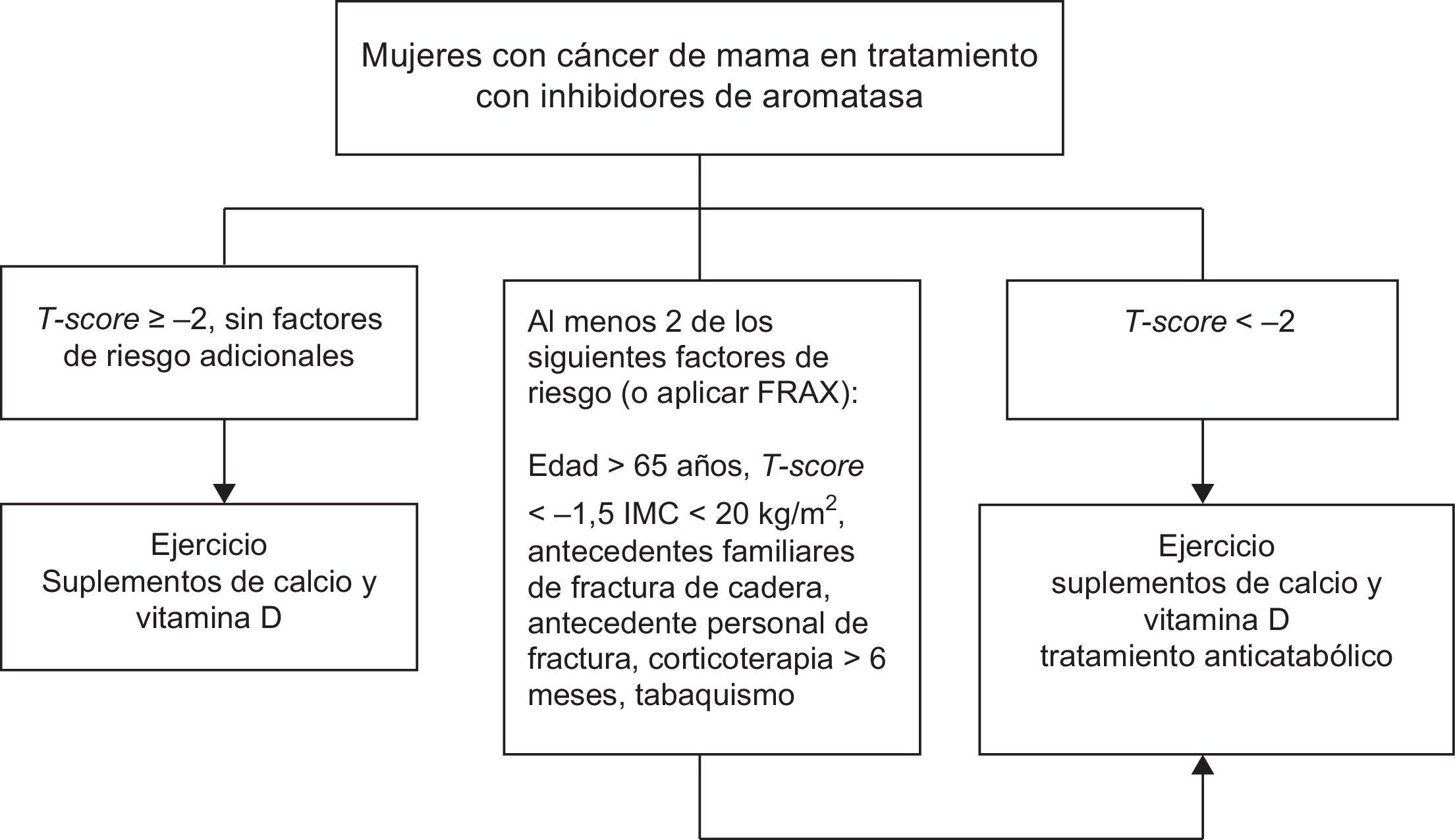
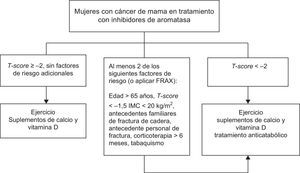
Cáncer de mama en tratamiento hormonalEvaluación- -
En mujeres con cáncer de mama que sufran fallo ovárico inducido por quimioterapia, o que reciban tratamiento con análogos de GnRH y/o inhibidores de la aromatasa, recomendamos realizar una evaluación de la masa ósea (1⊕⊕⊕○), así como descartar la presencia de fracturas vertebrales (1⊕⊕○○).
- -
Recomendamos suplementos de calcio y vitamina D (1⊕⊕○○) en todas las pacientes.
- -
Sugerimos consejos sobre actividad física en todas las pacientes (2⊕○○○).
- -
En las pacientes en las que esté indicado tratamiento anticatabólico (fig. 1) recomendamos emplear bisfosfonatos: zoledronato (1⊕⊕⊕⊕), risedronato (1⊕⊕○○), ibandronato (1⊕⊕○○) o denosumab (1⊕⊕○○).
- -
En mujeres que no son candidatas al tratamiento con bisfosfonatos, recomendamos alcanzar concentraciones de 25 OH vitamina D superiores a 30ng/ml para atenuar la pérdida ósea asociada a inhibidores de aromatasa (1⊕⊕○○).
En mujeres que no son candidatas al tratamiento con bifosfonatos y con concentraciones basales de 25 OH vitamina D inferiores a 30ng/ml, la mejoría del estado de vitamina D a través de la suplementación durante un año con 1.000mg de calcio y 800UI de vitamina D3 al día, junto a un aporte adicional de vitamina D2 (16.000UI) cada 2 semanas resulta en una menor pérdida ósea asociada a los inhibidores de aromatasa37.
Déficit de hormona de crecimiento en la edad adultaEvaluación- -
Sugerimos la evaluación de la DMO y de la presencia de fracturas vertebrales en pacientes con déficit grave de hormona de crecimiento (GH) (2⊕⊕○○).
- -
El tratamiento con GH en adultos con déficit de la misma mejora la masa o¿sea (2⊕⊕○○).
- -
Tras los primeros años de tratamiento (de 4 a 5 años), la asociacio¿n de alendronato induce un aumento adicional de masa o¿sea (2⊕○○○).
- -
Recomendamos la continuidad del tratamiento sustitutivo de la deficiencia de GH persistente tras alcanzar la talla adulta, para obtener una maduracio¿n o¿sea completa durante el peri¿odo de transicio¿n entre la adolescencia y edad adulta (1⊕⊕○○).
- -
Sugerimos tratar con GH para reducir el riesgo de fractura vertebral en pacientes con déficit de GH (2⊕○○○).
- -
En caso de respuesta terapéutica insuficiente sugerimos iniciar tratamiento anabo¿lico seguido de tratamiento anticatabo¿lico (2⊕○○○).
En adultos con déficit de GH tratados previamente en la infancia se observó una relación negativa entre el tiempo sin tratamiento sustitutivo y la DMO en el cuello femoral38. En cuanto al tratamiento del déficit adquirido en la edad adulta, se ha observado un aumento sostenido del 5% de la DMO en la columna lumbar tras 15 años de tratamiento sustitutivo, con efecto meseta a partir de los 10 años. En el cuello femoral hubo un aumento del 3% de la DMO tras 7 años de tratamiento, sin diferencias con los valores basales a partir de los 10 años39.
AcromegaliaEvaluación- -
Sugerimos realizar una evaluación de la DMO en pacientes con acromegalia (2⊕⊕○○).
- -
Sugerimos realizar una valoración individual del riesgo de fractura teniendo en cuenta la actividad de la enfermedad, la función gonadal, el sexo, la edad, la técnica y el lugar de medición de la DMO (2⊕⊕○○).
- -
Sugerimos evaluar la presencia de fracturas vertebrales mediante radiología convencional en pacientes con acromegalia, al diagnóstico y de manera periódica durante el seguimiento (2⊕⊕○○).
- -
Ante la falta de datos, sugerimos que los pacientes con acromegalia deben seguir las mismas recomendaciones de tratamiento que la población general (2⊕○○○).
El estudio de la DMO mediante DXA en la acromegalia muestra datos discordantes, reflejando aumento, estabilidad o descenso de la DMO, posiblemente debido a la presencia variable de hipogonadismo40–45, al limitado número de pacientes incluidos en algunos estudios y a la evaluación de diferentes localizaciones óseas. El papel del estado gonadal sobre la DMO es controvertido: algunos estudios objetivan una mejor DMO en situaciones de eugonadismo41,43,45, mientras que otros no observan diferencias según el estado gonadal42,46. Sin embargo, y como es esperable, un reciente metaanálisis ha demostrado una menor DMO en la columna lumbar y en el cuello femoral en pacientes con hipogonadismo47. Las principales limitaciones de la DXA son que la valoración bidimensional de la DMO no es fiable porque se puede ver modificada por el alargamiento óseo, y además no distingue entre los compartimentos cortical y trabecular. La valoración volumétrica de la DMO (radio distal y tibia) mediante tomografía computarizada cuantitativa periférica de alta resolución (HR-pQCT) muestra un beneficio sobre el hueso cortical, con un efecto deletéreo sobre la densidad trabecular y microestructura45,46.
Las fracturas vertebrales son más frecuentes en pacientes con acromegalia (odds ratio [OR]: 8,26 frente a la población general; 95% IC [Intervalo de confianza] 2,91-23,39; p<0,0001)47. Estudios transversales muestran una alta prevalencia (de 39% a 63%) de fractura vertebral, hasta el 80% en casos activos y entre el 33% y 63% en la enfermedad controlada48–53. La frecuencia de fractura vertebral es significativamente mayor cuando la enfermedad está activa (OR: 3,35; 95% IC: 1,61-6,96; p=0,001)47. La DMO no predice de forma clara el riesgo de fractura vertebral49,50,52, salvo en un estudio donde se relacionó con el descenso de la DMO en pacientes con enfermedad controlada48. Estudios prospectivos de hasta 3 años han encontrado una mayor incidencia de fractura vertebral (de 20-42%) frente a la población general, especialmente en pacientes con enfermedad activa y descenso de la DMO en el cuello femoral51,54; en pacientes controlados la incidencia de fracturas se relacionó con fracturas previas51,54, la presencia de hipogonadismo sin tratamiento y con el descenso de DMO en el cuello femoral51. Finalmente, un metaanálisis ha demostrado una mayor frecuencia de fractura vertebral en varones (OR: 2,19; 95% IC: 1,07-4,50; p=0,03) y en pacientes con hipogonadismo asociado (OR: 1,68; 95% CI: 1,02-2,78; p=0,04). No se ha demostrado mayor prevalencia de fracturas no vertebrales en acromegalia54.
Síndrome de CushingEvaluación- -
Sugerimos aplicar la herramienta FRAX a todos los pacientes con síndrome de Cushing (2⊕⊕○○).
- -
Sugerimos iniciar tratamiento farmacológico antiosteoporótico en mujeres posmenopáusicas o varones mayores de 50 años en caso de fracturas prevalentes (vertebrales o de cadera), o edad mayor a 70 años, o riesgo de fractura a 10 años igual o superior al 20% calculado mediante FRAX, o DMO igual o inferior a –1,5, o hipercortisolismo grave (síndrome de Cushing ectópico) (2⊕○○○).
- -
La opción más recomendable podría ser teriparatida (2⊕○○○).
- -
El tratamiento con fármacos antiosteoporóticos estaría más indicado en la enfermedad de Cushing, dado que la probabilidad de curación es menor que en las causas adrenales. En estas últimas el manejo sería más conservador con suplementos de calcio y vitamina D si se corrige el hipercortisolismo precozmente (2 ⊕○○○).
- -
Después de la corrección del hipercortisolismo la reevaluación del riesgo de fractura, basada en la escala FRAX y la DMO, podría ayudar al clínico en la decisión de continuar o no con el tratamiento farmacológico antiosteoporótico (2⊕○○○).
Existen escasos datos sobre la validez de la escala FRAX como método de estratificación del riesgo de fractura en pacientes con hipercortisolismo endógeno. En un estudio retrospectivo de 36 pacientes con síndrome de Cushing un FRAX mayor del 17% fue capaz de predecir la aparición de una nueva fractura vertebral tras la curación de la enfermedad durante el seguimiento55.
En un artículo reciente56 un grupo de expertos propone las posibles indicaciones de fármacos antiosteoporóticos en pacientes con hipercortisolismo endógeno en función de las características fisiopatológicas comunes con el hipercortisolismo exógeno, y ante la ausencia de guías específicas para el manejo de la osteoporosis inducida por el hipercortisolismo endógeno.
Hipercortisolismo subclínico por incidentaloma adrenalEvaluación- -
Sugerimos realizar una evaluación de la DMO y de la presencia de fracturas vertebrales en pacientes con incidentaloma adrenal e hipercortisolismo subclínico (2⊕⊕○○).
- -
El tratamiento con anticatabólicos puede inducir un aumento de la DMO en mujeres premenopáusicas con hipercortisolismo subclínico, aunque el efecto sobre las fracturas no se ha evaluado (2⊕⊕○○).
- -
Recomendamos el tratamiento anabólico en caso de muy baja masa ósea, fracturas vertebrales o ausencia de respuesta a tratamiento anticatabólico, especialmente en pacientes más jóvenes (1⊕○○○).
- -
La enfermedad de Addison puede asociarse a un descenso de la DMO y a una mayor prevalencia de osteoporosis debido a la terapia de sustitución con glucocorticoides y al déficit de andrógenos adrenales. Se ha descrito un aumento del riesgo de fractura de cadera (1⊕○○○).
- -
Sugerimos evaluar la DMO en pacientes con enfermedad de larga evolución o con una dosis sustitutiva alta de glucocorticoides, y también en mujeres posmenopáusicas o en amenorrea (2⊕⊕○○).
- -
Sugerimos la reducción de las dosis sustitutivas de esteroides para minimizar los efectos adversos sobre el hueso (2⊕⊕○○).
- -
Para el tratamiento sugerimos usar un glucocorticoide de acción corta (hidrocortisona) en lugar de los de acción intermedia o larga (2⊕⊕○○).
Un análisis reciente del Swedish National Patient Register57 ha mostrado un aumento del riesgo de fractura en pacientes con enfermedad de Addison. El riesgo es mayor en el año previo al diagnóstico y en el año posterior, así como en mujeres diagnosticadas antes de los 50 años de edad (RR: 2,7; 95% IC: 1,6-4,5).
Cirugía bariátricaEvaluación- -
Recomendamos realizar DXA para monitorizar la DMO basal precirugía y posteriormente cada 2 años en pacientes sometidos a técnicas malabsortivas (bypass gástrico en Y de Roux, derivación biliopancreática) (1⊕⊕○○).
- -
Recomendamos la realización basal y posteriormente cada 6 a 12 meses de parathormona, calcio, fósforo, 25 OH vitamina D y calciuria de 24h (1⊕⊕○○).
- -
En caso de déficit de vitaminas liposolubles, hepatopatía, coagulopatía u osteoporosis recomendamos la determinación de vitamina K (1⊕○○○).
- -
Recomendamos suplementar con 1.200-1.500mg/día de calcio elemento y hasta 2.000mg/día en técnicas malabsortivas (en dieta y como citrato cálcico en dosis divididas) (1⊕⊕⊕○) y al menos 3.000UI de vitamina D diarias (titulada hasta alcanzar concentraciones de 30ng/ml) (1⊕⊕⊕⊕).
- -
La hipofosfatemia es generalmente secundaria al déficit de vitamina D y recomendamos suplementar con fosfato oral en la hipofosfatemia moderada (1,5-2,5mg/dl) (1⊕○○○).
- -
Sugerimos considerar el tratamiento con bisfosfonatos en pacientes con osteoporosis una vez replecionados adecuadamente los déficits de calcio y vitamina D (1⊕○○○).
- -
Recomendamos utilizar la formulación intravenosa ante la duda de la absorción adecuada por vía oral y la posibilidad de producir ulceración de la boca anastomótica (1⊕⊕○○). Los fármacos recomendados son ácido zoledrónico 5mg una vez al año o ibandronato 3mg cada 3 meses (1⊕○○○). Si se considera que no hay riesgo de ulceración en la boca anastomótica, recomendamos considerar la administración vía oral de alendronato 70mg semanal, risedronato 35mg semanal o 150mg mensual o ibandronato 150mg mensual (1⊕⊕○○).
- -
Aunque la enfermedad inflamatoria intestinal (EII) se asocia con masa o¿sea baja y un aumento del riesgo de fractura, no recomendamos la evaluacio¿n rutinaria de masa o¿sea (1⊕○○○).
- -
Recomendamos realizar una valoracio¿n del riesgo de fractura mediante el método FRAX en la fase de remisio¿n de la EII (1⊕⊕○○).
- -
Recomendamos realizar una valoracio¿n con DXA a los pacientes en riesgo intermedio o alto segu¿n la herramienta FRAX, a los pacientes en tratamiento con glucocorticoides o en caso de que existan 2 o más factores de riesgo de osteoporosis (1⊕⊕○○).
- -
Recomendamos determinar las concentraciones séricas de vitamina D, parathormona y calcio (1⊕⊕○○).
- -
En funcio¿n del riesgo de fractura, sugerimos repetir la valoracio¿n por DXA cada 2 o 3 años o cada año en caso de tratamiento con glucocorticoides (2⊕⊕○○).
- -
Recomendamos la utilización de bisfosfonatos orales o intravenosos para mejorar la DMO en la EII, aunque su prescripción debe ajustarse a las recomendaciones generales (1⊕⊕⊕○). Su utilización reduce el riesgo de fractura vertebral, aunque no se ha demostrado efecto sobre la fractura no vertebral (1⊕⊕⊕○).
En un metaanálisis publicado recientemente, los bisfosfonatos son un tratamiento efectivo y bien tolerado en pacientes con EII y baja masa ósea, y han demostrado reducir el riesgo de fractura vertebral. El análisis conjunto de los 3 estudios que analizaron el efecto sobre el riesgo de fractura vertebral mostró una reducción del riesgo de fractura vertebral de 0,38 (95% IC: 0,15-0,96), aunque no se demostró efecto sobre las fracturas no vertebrales (OR: 0,35; 95% IC: 0,06-1,95)58.
Anorexia nerviosa- -
La anorexia nerviosa produce una disminución de la masa ósea y un aumento del riesgo de fractura (2⊕⊕○○).
- -
Recomendamos realizar una evaluación de la masa ósea y de la presencia de fracturas en estos pacientes (1⊕⊕○○).
- -
El diagnóstico de la osteoporosis en niños y adolescentes no debe hacerse sobre la base de criterios densitométricos solamente (Z-score menor o igual a –2,0), sino que requiere además la presencia de una historia de fracturas clínicamente significativa: fractura de huesos largos de las extremidades inferiores, fracturas vertebrales por compresión o 2 o más fracturas de huesos largos de las extremidades superiores (2⊕○○○).
- -
Recomendamos normalizar el peso y los ciclos menstruales para aumentar la masa ósea (1⊕⊕○○).
- -
Sugerimos aportar una ingesta cálcica diaria de 1.300 a 1.500mg/día y de 400UI/día de vitamina D o más en las pacientes con valores de vitamina D inferiores a 30ng/dl (2⊕⊕○○).
- -
Sugerimos no tratar de forma generalizada con bisfosfonatos (alendronato y risedronato) para aumentar la masa ósea en pacientes con anorexia nerviosa (2⊕○○○).
- -
Sugerimos valorar de forma individualizada el tratamiento con bisfosfonatos en pacientes adultos con muy baja masa ósea y con presencia de fracturas por fragilidad (2⊕○○○).
- -
Sugerimos no usar la terapia hormonal para prevenir la pérdida de masa ósea en las pacientes con amenorrea persistente y anorexia nerviosa (2⊕○○○).
- -
Sugerimos el uso de estrógenos transdérmicos a dosis bajas como opción terapéutica en adolescentes refractarias al aumento de peso y a la recuperación de las menstruaciones, a pesar de una intervención multidisciplinar (2⊕⊕○○).
- -
Sugerimos iniciar tratamiento anabólico si existen fracturas por fragilidad (2⊕○○○)
El tratamiento con estrógenos transdérmicos a dosis bajas ha demostrado un efecto positivo sobre la DMO en adolescentes con anorexia nerviosa que no conseguían aumento de peso ni el inicio de las menstruaciones, a pesar de una intervención multidisciplinar. Tras 18 meses de tratamiento se observó un aumento de la DMO en la columna lumbar del 2,06%59.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
El manuscrito final ha sido revisado y aprobado por todos los miembros del grupo de trabajo.