Las células ß-pancreáticas son susceptibles a la infección y replicación de SARS-CoV-2, lo que podría conducir a una diabetes relacionada con infección o precipitar el comienzo de una diabetes tipo 1. El objetivo de este estudio ha sido determinar la gravedad al diagnóstico, analizando características clínicas y epidemiológicas en el contexto de la pandemia por SARS-CoV-2 en menores de 16 años.
Material y métodosSe lleva a cabo un estudio multicéntrico observacional retrospectivo en 7 hospitales de la red pública de sanidad ubicados en el sur de nuestra comunidad. Se compara la gravedad al comienzo con la de los 2 años previos (2018 y 2019). Se fija el nivel de significación estadística en una p<0,05.
ResultadosEn 2020 comenzaron con diabetes 61 pacientes en los 7 centros hospitalarios. La edad media fue 10,1 años (DE: 2,6), un 50,8% mayores de 10 años. La forma clínica del comienzo fue cetoacidosis en el 52,5% frente al 39,5% y 26,5% en los 2 años previos (p<0,01). El pH medio (7,24 vs. 7,30/7,30) y exceso de bases (–11,9 vs. –7,43/–7,9) fue menor que en los 2 años anteriores y la hemoglobina glicada mayor (11,9 vs. 11/10.6), p<0.05. Al menos el 10% de los pacientes tenía antecedentes positivos de infección por SARS-CoV-2.
ConclusionesDurante el primer año de pandemia por la COVID-19ha habido un aumento en la frecuencia de cetoacidosis diabética como forma de comienzo.
ß-pancreatic cells are susceptible to SARS-CoV-2 infection and replication; this could lead to infection-related diabetes or precipitate the onset of type 1 diabetes. This study aimed to determine the severity at diagnosis, analyzing clinical and epidemiological features at onset in children under 16 years of age in the context of the SARS-CoV-2 pandemic.
Material and methodsA retrospective observational multicenter study was carried out in 7 hospitals of the public health network located in the south of our community. The severity at debut is compared with that of the two previous years (2018 and 2019). The level of statistical significance is set at P<.05.
ResultsIn 2020, 61 patients were diagnosed at the 7 hospital centres. The mean age was 10.1 years (SD: 2.6), 50.8% were older than 10 years. The clinical profile at diagnosis was ketoacidosis in 52.5% compared to 39.5% and 26.5% in the previous two years (P<.01). The mean pH (7.24 vs 7.30 / 7.30) and excess of bases (-11.9 vs -7.43 / -7.9) was lower than in the previous two years, and the glycated haemoglobin higher (11.9 vs 11 / 10.6)%, p<0.05. At least 10% of the patients had a positive history of SARS-CoV-2 infection.
ConclusionsThere has been an increase in the frequency of diabetic ketoacidosis in type 1 diabetes onset during the first year of the COVID-19 pandemic.
La diabetes tipo 1 (DM1) es una enfermedad autoinmune en la que intervienen diferentes factores desencadenantes: genéticos, socioeconómicos y ambientales1. En el contexto de la pandemia por la COVID-19 se han publicado diversos estudios en los que se ha demostrado la susceptibilidad de las células beta pancreáticas a la infección y replicación de SARS-CoV-22, lo que podría conducir a una diabetes relacionada con la infección según la clasificación de la OMS, o precipitar el comienzo de una DM13.
La cetoacidosis es una de las complicaciones más graves en la DM1, sobre todo en niños, y más aún en menores de 5 años4. Mundialmente las tasas de incidencia son muy diferentes entre países y oscilan entre el 15% y el 80% para nuevos diagnósticos5. En España los datos publicados previamente muestran una frecuencia del 40% de los nuevos pacientes diagnosticados menores de 15 años6. En Alemania e Italia7 se ha notificado un aumento en la incidencia de cetoacidosis en niños y adolescentes al comienzo de la DM18 y en nuestro país hay alguna publicación que sugiere los mismos hallazgos9. Entre las hipótesis que se sugieren estaría la relación con el confinamiento más estricto que se hizo en los primeros meses de la pandemia y el miedo de la población a acudir a los centros médicos, o al papel que la propia infección tendría actuando como acelerador o desencadenante10,11.
El objetivo de este estudio es determinar la gravedad clínica al comienzo de la diabetes de los pacientes menores de 16 años en el contexto de la pandemia por SARS-CoV-2, y compararlo con los 2 años previos, así como la posible relación con la infección por la COVID-19.
Material y métodosSe lleva a cabo un estudio multicéntrico observacional retrospectivo para determinar las características clínicas y epidemiológicas de los pacientes<16 años con comienzo de DM1 en 2020 coincidiendo con la pandemia por la COVID-19. Se compara la gravedad al inicio con la de los 2 años previos (2018 y 2019). Participan 7 hospitales de la red pública de sanidad ubicados en el sur de la Comunidad de Madrid: Hospital Universitario de Fuenlabrada, Hospital Universitario Severo Ochoa (Leganés), Hospital Universitario de Móstoles, Hospital Universitario Rey Juan Carlos (Móstoles), Hospital Universitario de Getafe, Hospital Universitario del Tajo (Aranjuez) y Hospital Universitario Infanta Cristina (Parla).
El primer caso de COVID-19 en España se notificó el 31 de enero de 2020 y en nuestra comunidad el 25 de febrero de 2020.
Criterios de inclusión
- -
Ser menor de 16 años al comienzo de la DM1.
- -
Residir en el área de influencia de los centros participantes en los 3 meses previos al inicio.
- -
Seguimiento clínico en alguno de los centros participantes en el estudio.
Criterios de exclusión: no cumplir alguno de los criterios de inclusión.
Se analizan la edad, la gravedad y la forma clínica de presentación, el tiempo de evolución de los síntomas cardinales, los parámetros analíticos (insulinemia, péptido C, hemoglobina A1c y pH venoso), asociación con otras enfermedades autoinmunes e infección por SARS-CoV-2 (PCR y/o serología IgG e IgM) en el momento del ingreso.
Los criterios para el diagnóstico de cetoacidosis diabética son los marcados por la Guía de consenso de la ISPAD12 (glucemia>200mg/dl, pH venoso<7,13 o bicarbonato<15 mmol/l, cetonemia [ß-hydroxibutirato en sangre≥3mmol/l] o cetonuria moderada o grave).
Se establecen 3 grupos de edad: 0-4 años, 5-9 años y 10-15 años.
Se utilizó el programa EPIDAT 4.0. Las variables cuantitativas se expresan como media y desviación estándar. Si la variable no se ajusta a una distribución normal se expresa como mediana y rangos intercuartílicos (RIC). Las variables cualitativas se expresan como frecuencias. Las variables cuantitativas se compararon mediante la prueba «t» de Student y análisis de la varianza (ANOVA) y las variables cualitativas mediante la prueba de la Chi-cuadrado, aplicando la prueba exacta de Fisher cuando fue requerido. Se fijó el nivel de significación estadística en una p<0,05.
El estudio recibió la aprobación del Comité de ética e investigación clínica del Hospital Universitario de Fuenlabrada, adscripción de la investigadora principal.
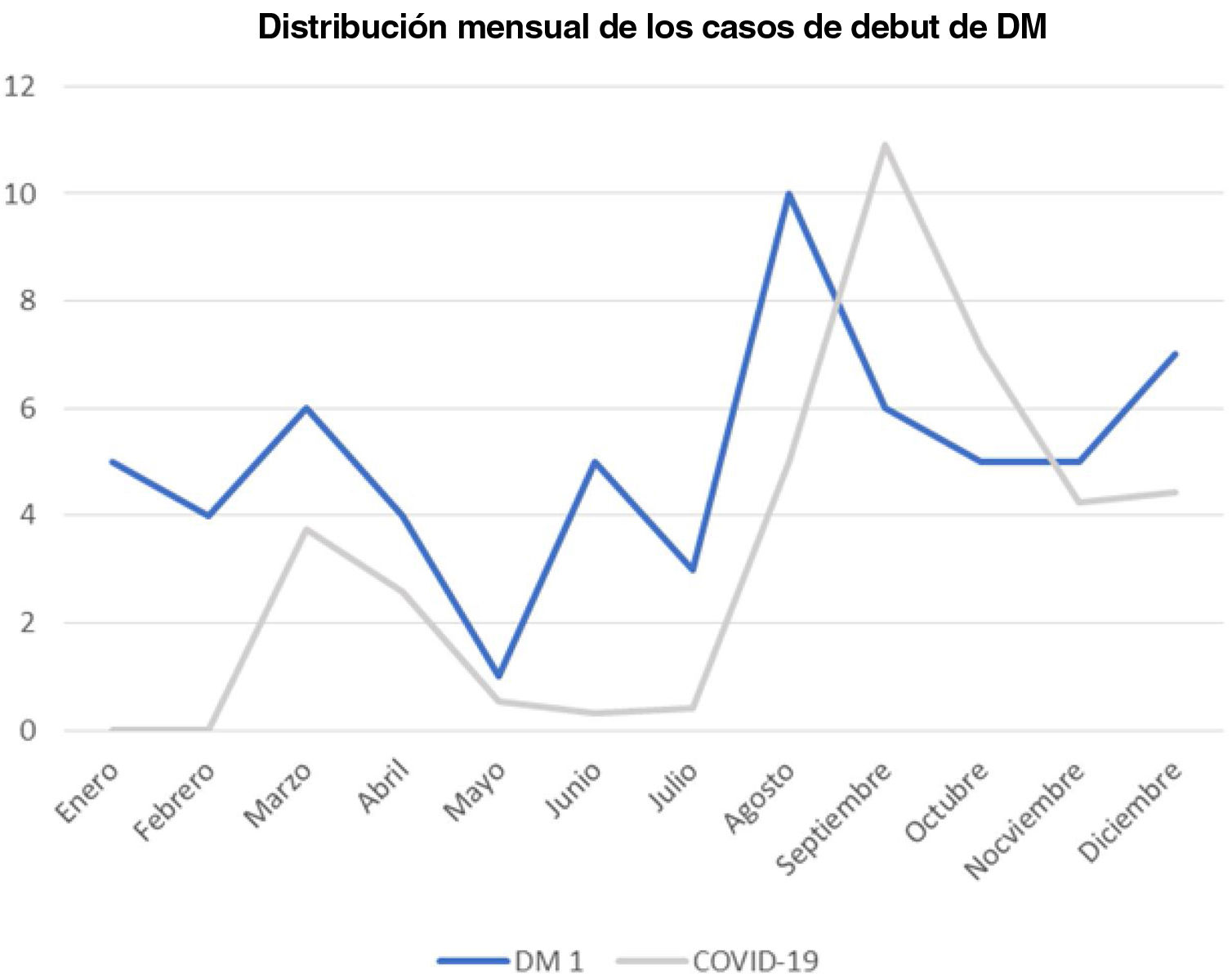
ResultadosEn el año 2020 se diagnosticaron de DM1 61 pacientes en los 7 centros hospitalarios. El 24,6% de los pacientes procedía del mismo centro. La edad media fue 10,1 años (DE: 2,6; RIC: 7,2-13,5). Por grupos de edad: 36,1% de 0 a 4 años, 13,1% de 5 a 9 años y 50,8%>10 años. El 54,1% eran mujeres. El 75,4% eran de origen español, el 11,5% de países del Norte de África, el 6,5% de Europa del Este y uno de Latinoamérica. El 31,1% de los casos ocurrió en el tercer trimestre del año y el 24,6% en el primero (fig. 1).
En 2018 y 2019 se recogen datos de 43 y 34 pacientes respectivamente, con edades medias de 8,7 (DE: 3,9) y 8,8 años (DE: 3,8), siendo la edad media menor que en 2020 (p<0,05), el 69,8% y 79,4% de origen español.
ClínicaEl síntoma más frecuente fue la poliuria (83,6%) seguido de la polidipsia (80,3%). En ambos casos aproximadamente la mitad de los pacientes refería una evolución menor o igual a 2 semanas (51% y 55% respectivamente). Un 59,2% refería pérdida de peso y el síntoma menos frecuente (34,4%) fue la polifagia.
La forma clínica del comienzo fue cetoacidosis en el 52,5% y en el 32,8% cetosis sin acidosis. El 16,4% precisó ingreso en la UCIP, no encontrando diferencias significativas en la forma de presentación por grupos de edad (tabla 1). Hay diferencias con respecto a los años anteriores en que los que la cetoacidosis estuvo presente en el 39,5% y 26.5% respectivamente (p<0,01). En la tabla 2 se expresan las formas clínicas al comienzo en 2020 y años previos.
Forma de presentación (comparativa por años)
| 2018 (n=43) | 2019 (n=34) | 2020 (n=61) | Sig est (p) | |
|---|---|---|---|---|
| Cetoacidosis | 17 (39,5%) | 9 (26,5%) | 32 (52,5%) | p=0,008 |
| Cetosis | 14 (32,6%) | 14 (41,2%) | 21 (34,4%) | |
| Hiperglucemia | 12 (27,9%) | 9 (26,5%) | 3 (4,9%) | |
| Otros | 0 (0%) | 2 (5,9%) | 5 (8,2%) |
Sig est: significación estadística.
Un 34,4% recibió insulina subcutánea desde el inicio, y en aquellos que precisaron perfusión iv el tiempo medio fue 13horas (DE: 9,3horas). En un 9,8% de los pacientes se mantuvo durante más de 24horas.
En 2018 y 2019 el síntoma más frecuente también fue la poliuria: 95,3% y 91,2%, y en el 45,2% y 55% de una duración menor o igual a 2 semanas de evolución. En la tabla 3 se detallan los síntomas y tiempo de evolución.
Síntomas cardinales y tiempo de evolución
| Poliuria | Polidipsia | Polifagia | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2020(n=61) | 2019(n=34) | 2018(n=43) | 2020(n=61) | 2019(n=34) | 2018(n=43) | 2020(n=61) | 2019(n=34) | 2018(n=43) | |
| No | 6 (9,8%) | 3 (8,8%) | 2 (4,7%) | 9 (14,7%) | 9 (26,5%) | 9 (21%) | 36 (59,1%) | 15 (44,1%) | 19 (44,2%) |
| Sí0-2 | 51 (83,6%) | 31 (91,2%) | 41 (95,3%) | 49 (80,3%) | 25 (73,5%) | 34 (79%) | 21 (34,4%) | 16 (47,1%) | 24 (55,8%) |
| semanas | 26 (51%) | 14 (45,2%) | 22 (55%) | 27 (55,1%) | 14 (56%) | 19 (55,9%) | 15 (71,4%) | 8 (50%) | 11 (45,8%) |
| 2-4 semanas | 16 (31,4%) | 8 (25,8%) | 9 (21,9%) | 14 (28,6%) | 5 (20%) | 7 (20,6%) | 3 (14,3%) | 5 (31,2%) | 4 (16,7%) |
| 1-2 meses | 7 (13,7%) | 5 (16,1%) | 8 (19,5%) | 5 (10,2%) | 4 (16%) | 7 (20,6%) | 2 (9,5%) | 1 (6,2%) | 8 (33,3%) |
| >2 meses | 0 | 2 (5,9%) | 2 (6,4%) | 0 | 1 (4%) | 1 (2,9%) | 0 | 1 (6,2%) | 1 (4,2%) |
Equilibrio ácido-base al diagnóstico: en el año 2020 el pH medio fue: 7,24 (DE: 0,01), el bicarbonato medio 14,7mEq/l (DE: 7,4) y el exceso de base medio –11,9 (DE: 9,33). La hemoglobina glicada media (DCCT) fue 11,9% (DE: 2,2) y el péptido C medio: 0,62ng/ml (DE: 0,5; mediana 0,5ng/ml y RIC: 0,3-0,7) (ver tabla 4).
Equilibrio ácido base y reserva pancreática
| 2018 (n=43) | 2019 (n=34) | 2020 (n=61) | Sig est (p) | |
|---|---|---|---|---|
| pH medio (DE) | 7,30 (0,11) | 7,30 (0,15) | 7,24 (0,01) | p=0,002 |
| Bicarbonato medio mEq/l (DE) | 17,5 (6,74) (n=42) | 16,99 (7,74)(n=31) | 14,7 (7,4)(n=54) | p=0,14 |
| EB mEq/l (DE) | (n=41)–7,9 (7,9) | (n=29)–7,43 (9) | (n=53)–11,9 (9,33) | p=0,035 |
| HbA1c media % (DE) | (n=32)10,6 (2,8) | (n=39)11 (2,5) | (n=57)11,9 (2,2) | p=0,04 |
| Péptido C medio ng/ml (DE) | (n=42)0,78 (0,55) | (n=30)0,8 (0,47) | (n=53)0,62 (0,5) | p=0,192 |
DE: desviación estándar; EB: exceso de base; HbA1c: hemoglobina glicada; Sig est: significación estadística.
En 2020 el pH medio al diagnóstico fue menor que en los 2 años previos (p<0,01), así como el exceso de bases (p<0,05) y mayor la hemoglobina glicada (p<0,05).
Los anticuerpos relacionados con DM1 fueron positivos en todos los casos excepto en uno en el que no se determinaron. Un 10% de los pacientes asociaban tiroiditis al diagnóstico (6/61) y 3 pacientes anticuerpos relacionados con enfermedad celiaca.
Coronavirus relacionado con el síndrome respiratorio agudo severoEn la figura 1 se muestran superpuestos los casos de comienzo de diabetes y la incidencia de la COVID-19 en la Comunidad de Madrid.
El 85,2% (n=52) de los pacientes diagnosticados en 2020 comenzaron después del primer caso de COVID-19 declarado en nuestra comunidad. Se realizó estudio de RT-PCR para SARS-CoV-2 al ingreso en 40 pacientes, siendo positiva en 3 casos. De los pacientes con RT-PCR negativa uno tenía IgG positiva y en otro caso ambos padres tenían la infección en ese momento. Por tanto, 5 pacientes tenían algún antecedente positivo (9,6%).
DiscusiónEn el año 2020ha habido un aumento de la gravedad en la forma de comienzo de la DM1 en menores de 16 años (mayor frecuencia de cetoacidosis, menor pH, menor EB y mayor hemoglobina glicada) tal y como se ha comunicado en otros países13,14. Si bien la relación con el confinamiento y el miedo a acudir a los centros sanitarios ha sido una de las hipótesis que se ha considerado para explicarlo8, el tiempo de evolución de los síntomas es menor de 2 semanas en algo más del 50% de los casos, sin diferencias respecto a los años previos, por lo que no parece que se haya demorado la atención sanitaria, y nos hace suponer que hay otros factores implicados en esta mayor gravedad al inicio. Por otro lado, no se ha demostrado que la duración de los síntomas difiera en aquellos que se presentan con o sin cetoacidosis4. Un hecho que ha marcado la atención sanitaria en nuestra comunidad autónoma es el cierre parcial de la atención primaria durante los primeros meses de pandemia para apoyar en la asistencia a enfermos con COVID en el Hospital de Emergencias Enfermera Zendal, y posteriormente la limitación en las consultas presenciales priorizando las telefónicas. Esta disfunción de la atención primaria15 ha podido influir en aspectos como la gravedad de presentación16.
Aunque no hemos encontrado diferencias significativas, sí que hay una tendencia a menores cifras de péptido C en el año 2020 frente a los 2 previos (0,62 vs. 0,78/0,8) (ng/ml), hallazgo que iría parejo a la mayor incidencia de cetoacidosis17 y que traduciría una menor capacidad residual de producción de insulina endógena.
Durante los meses de marzo, abril y mayo (21 de marzo a 6 de mayo) hubo una redistribución de la atención sanitaria urgente en pediatría, con centralización de los servicios en 2 hospitales de la comunidad; sin embargo, algunos pacientes siguieron acudiendo a sus hospitales de referencia más cercanos. De hecho, en el año 2020 en nuestra población se han registrado un mayor número de casos respecto a 2018 y 2019. El desplazamiento de los pacientes a otros hospitales podría ser una de las causas por las que, aunque en otras series, la edad al diagnóstico durante la pandemia de la COVID ha sido menor18, nosotros hemos encontrado una mayor edad en 2020 que en los 2 años previos (10,1 años frente a 8,7 y 8,8 años; p<0,05)9.
Los niños menores de 5 años son el grupo más susceptible a la cetoacidosis y a la necesidad de cuidados intensivos, hecho que se confirma en nuestros datos (75% de cetoacidosis), aunque por el tamaño muestral no podemos demostrar diferencias significativas.
Los datos en la literatura respecto a la precipitación de DM1 por SARS-CoV-2 en niños y adolescentes son contradictorios7,19,20; en nuestra serie, de los 40 pacientes que comenzaron durante la pandemia COVID-19 y a los que se hizo algún tipo de prueba diagnóstica de infección por SARS-CoV-2, hasta un 12,5% estaba relacionado de alguna manera con esta. En diciembre de 2020 la prevalencia global en España en menores de 16 años se situaba en torno al 5% según el estudio de seroprevalencia ENECOVID21, casi la mitad de lo observado en nuestra muestra. Aunque no podemos establecer conclusiones, ya que es una población reducida y circunscrita a una zona geográfica concreta, creemos que habría que analizar los datos en el conjunto nacional para confirmar este resultado. En contra de este hallazgo no vemos un paralelismo entre las gráficas de incidencia de COVID en la Comunidad de Madrid y las de nuevos diagnósticos de DM1 (fig. 1). Uno de los puntos a evaluar en estudios futuros es la gravedad de los casos de DM1 en aquellos pacientes con antecedente de infección; en nuestro trabajo, dado el escaso número, no hemos podido analizarlo.
Las limitaciones de este trabajo son las propias de un estudio retrospectivo, en el que hay datos perdidos o no recogidos. El tiempo de evolución de los síntomas previos es poco exacto debido al carácter subjetivo y retrospectivo de la recogida de datos; también desconocemos si estos síntomas han podido pasar desapercibidos o ser atribuidos al confinamiento, o incluso ser detectados más precozmente al estar más controlados. Aun así, dado que la mayoría de las variables analizadas son parámetros bioquímicos, no cabe el sesgo de interpretación ni de selección, haciendo válidos estos resultados. No podemos determinar la incidencia de comienzo de DM1 ya que hay casos diagnosticados que han acudido a otros centros, por lo que estos datos no serían reales y podríamos estar infraestimándolos.
ConclusionesEn 2020 hasta un 52,5% de los pacientes se presentaron como cetoacidosis al comienzo, lo que supone un incremento en esta forma de presentación, y por tanto de la gravedad.
Entre un 10% y un 12,5% de los pacientes tenían antecedentes positivos de infección por SARS-CoV-2.
Es necesario un registro nacional de los casos de nuevo diagnósticos de DM1, de su gravedad y de su posible relación con la infección por SARS-CoV-2 como una de las medidas a implementar dentro de las políticas de prevención de la cetoacidosis.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.