Presentamos el caso clínico de un paciente de 56 años de edad, en seguimiento desde 2009 en Hematología con diagnóstico de mieloma múltiple IgGλ asintomático, con citogenética de mal pronóstico (deleción gen P53).
Tras unos meses en observación sin tratamiento, se produce progresión con anemización (hemoglobina: 9,8g/dL), insuficiencia renal (creatinina: 2mg/dL) y aumento de la eliminación de cadenas ligeras λ en 10,8g/24 h. Se pone tratamiento con VTD (bortezomib/talidomida/dexametasona) sin obtener respuesta. Posteriormente presenta agravamiento brusco de su insuficiencia renal (creatinina 8,8mg/dl) por lo que se inicia tratamiento con hemodiálisis con filtro de HCO (Theralite). A su vez, Hematología cambia el tratamiento y pasa a utilizar lenalidomida.
Se inicia tratamiento con hemodiálisis diaria durante 6 días, para pasar posteriormente a días alternos, después de 53 días de tratamiento y 27 sesiones de diálisis, el nivel de cadenas ligeras libres (CLL) baja de 1.000mg/dl y la función glomerular (FG) se encuentra en 26 cc/min por lo que se suspenden las diálisis con filtro de HCO.
Conclusión, el filtro de HCO fue eficaz para tratar la IRA y eliminar las CLL del plasma.
We report the case of a 56-year-old man who had been monitored in the Hematology Department since 2009 with a diagnosis of asymptomatic IgG λ multiple myeloma and cytogenic findings of poor prognosis (a P53 gene deletion).
After several months under observation and without treatment, disease progression occurred with anemia (hemoglobin 9.8g/dL), renal failure (creatinine 2mg/dL) and increased urinary excretion of lambda light chains (10.8g/24h). Treatment with bortezomib/thalidomide/dexamethasone was initiated with no response. Subsequently, the kidney failure showed abrupt worsening (creatinine 8.8mg/dl) and consequently dialysis with a high cut-off filter (Theralite) was started. The Hematology Department decided to switch the treatment to lenalidomide.
Treatment was started with daily hemodialysis for 6 days, followed by alternate days. After 53 days of treatment and 27 dialysis sessions, the level of free light chains decreased to 1,000mg/dl, and glomerular function was 26 cc/min. Dialysis with the HCO filter was then withdrawn.
ConclusionThe HCO filter was effective in removing plasma free light chains and in treating the acute renal failure.
El mieloma múltiple (MM) consiste en una proliferación atípica de células plasmáticas que se acumulan en medula ósea y segregan una inmunoglobulina completa o parcial.
Representa la segunda neoplasia hematológica más común después del linfoma no Hodgkin. La incidencia anual es de 4 casos por 100.000 habitantes. Actualmente se considera una enfermedad incurable. A medida que la enfermedad avanza presenta una serie de manifestaciones clínicas como, por ejemplo, destrucción así como dolor, hipercalcemia y fracturas patológicas, anemia, insuficiencia renal, complicaciones infecciosas y neurológicas con gran morbimortalidad.
Criterios diagnósticos mieloma múltipleCriterios diagnósticos mayoresInfiltración plamocitaria en médula ósea (MO) superior al 30%; pico monoclonal IgG>35 gr/l; IgA>20g/l o PBJ>1g/l; plasmocitoma demostrado por biopsia.
Criterios diagnósticos menoresInfiltración plasmocitaria en MO10-30%; pico monoclonal IgG<35g/l IgA<20g/l o PBJ<1g/l; descenso de las otras Ig y presencia de lesiones osteolíticas.
Se precisan para el diagnóstico un criterio mayor y un criterio menor o 3 criterios menores que deben incluir el 1 y el 2.
Exploraciones complementariasPruebas de laboratorio. Podemos encontrar: hipercalcemia, anemia, uremia, aumento de la VSG, aumento de proteínas plasmáticas a expensas de elevación de las globulinas, proteinuria de Bence-Jones. La inmunoelectroforesis del suero pone de manifiesto solo una cadena monoclonal pesada en el 83% y una cadena monoclonal ligera en el 8% (proteinuria de Bence-Jones), además de niveles elevados de beta-2 microglobulina.
La insuficiencia renal suele afectar al 20-45% de los pacientes, siendo la segunda causa de muerte. Su presencia augura un pronóstico adverso (supervivencia media de MM con fallo renal, 20-25 meses)1 además, el 75% de los pacientes que precisaron diálisis no recuperó la función renal2–5.
La afectación renal puede ser de 3 tipos:
- 1)
Glomerular: la glomeruloesclerosis nodular es la lesión renal más característica, con la aparición de nódulos mesangiales y depósito de la cadena monotipo a lo largo de la membrana basal glomerular6.
- 2)
Tubular (riñón de mieloma): es el hallazgo más común, consiste en insuficiencia renal por obstrucción de túbulo distal ycolector por cilindros. Los cilindros contienen proteína de Bence-Jones y proteína de Tamm-Horsfall (proteína de secreción tubular). No todos los pacientes con MM tienen nefropatía por cilindros y la presencia de abundante cantidad de proteína de Bence-Jones no se asocia siempre con esta enfermedad. No hay una relación directa entre la severidad de la nefropatía y la clase de Ig, el tipo de cadena ligera, la cantidad de proteinuria de Bence-Jones o el nivel de ácido úrico7,8.
- 3)
Intersticial: puede haber una afectación intersticial. Los cilindros pueden estar rodeados por macrófagos y células gigantes multinucleadas que migran al túbulo desde el intersticio a través de rupturas de la membrana basal. En ocasiones puede verse material extratubular en el intersticio.
El tratamiento de la insuficiencia renal aguda se asienta en 3 pilares:
- 1)
Eliminar factores que agravan la nefrotoxicidad y la formación de cilindros: hidratación adecuada (2-3l de líquidos al día). La deshidratación ralentiza el flujo tubular y aumenta la concentración de cadenas ligeras libres (CLL), incrementando la formación de agregados. Evitar furosemida (solo con euvolemia).Evitar nefrotóxicos, sobre todo AINE, IECA, ARAII y la exposición a contrastes. Tratamiento de la hipercalcemia: si Ca<14mg/dl: líquidos y si persiste, bifosfonatos; si Ca>14mg/dl bifosfonatos de entrada. Tratar hiperuricemia.
- 2)
Eliminar o reducir la producción de CLL por las células neoplásicas.El régimen usual de quimioterapia empleado en el MM mejora la insuficiencia renal en aproximadamente el 50% de los casos.Las lesiones tubulares responden mejor que las glomerulopatías9.
- 3)
Eliminar o reducir las CLL circulantes. La recuperación renal está asociada a una reducción temprana de CLL en suero: diálisis con filtro de HCO. Hutchinson, utilizando filtros de HCO (alto cut-off) y hemodiálisis largas de 6 a 8h, ha conseguido buenos resultados, hasta un 60% de recuperación de la función renal10.
Se hace necesario realizar un estudio, comparando estas técnicas con las técnicas de diálisis convencional o plasmaféresis11.
Relato del caso clínicoSe trata de un paciente de 56 años de edad, exfumador desde hace 12 años y bebedor habitual, con antecedentes personales de asma y ulcus duodenal. Se remite a consultas de Hematología en noviembre de 2009 por aparecer en la analítica una gammapatía monoclonal de significado incierto (GMSI).
Destacan los siguientes parámetros en la analítica: hemoglobina, 15,8g/dl; leucocitos, 8,9×109/l; plaquetas, 238×109/l; creatinina, 0,7mg/dl; calcio, 8,7mg/dl; beta-2 microglobulina, 3,91 mcg/ml.
Estudio proteico: proteínas totales, 8,6g/dl; albúmina, 4,2g/dl; en el proteinograma se detecta gammapatía monoclonal IgGλ. Inmunoelectroforesis: componente monoclonal IgGλ de 2,8g/dl con mínima eliminación urinaria (0,06g/24h).
Aspirado medular: MO no normocelularidad y series hematopoyéticas conservadas, infiltración de un 17% de células plasmáticas atípicas. Inmunofenotipo: el 98% son patológicas. Estudio citogenético: el 88% de las células plasmáticas presentan traslocación del gen IgH (14q32), el 86% detección del gen RB (13q14) y el 82% del gen P53 (17p13).
Serie ósea: espondiloartrosis. No se detectan lesiones de mieloma.
Con todos estos datos se emite un diagnóstico de MM asintomático (smoldering). Se incluye en ensayo clínico QUIREDEX lenalidomida/dexametasona en pacientes con MM quiescente (MM smoldering) con alto riesgo de progresión a MM sintomático y se le adjudica la rama de abstención. Se controla clínica y analíticamente cada mes y el 28/02/2011 sale del ensayo por progresión.
El paciente ingresa en Hematología el 28/02/2011 con la sospecha de progresión de mieloma, presentando una clínica de insuficiencia respiratoria, durante el ingreso presenta una neumonía nosocomial que precisa ingreso en UCI.
La valoración del mieloma presenta anemización con hemoglobina, 9,8g/dl; ácido úrico, 13,6mg/dl; urea, 0,91g/dl; creatinina, 2mg/dL; LDH, 374 U/l; Ca, 9,2mg/dl y fósforo, 5,4mg/dl; proteínas totales, 8,2g/dl y albúmina, 2,7g/dl.
En el estudio de inmunoelectroforesis, aparece un componente monoclonal IgGλ, 3,4g/dl, con importante eliminación urinaria de cadenas de 10,8g/24h, proteína C reactiva, 3,53mg/dl; beta-2 microglobulina: 13,8 mcg/ml.
En la serie ósea se aprecian signos degenerativos vertebrales, imagen osteolítica a nivel de ilíaco izquierdo, escápula derecha y posiblemente rama mandibular derecha.
Rx de tórax: derrame pleural bilateral, sin poder descartar ocupación subyacente en la base pulmonar derecha.
TAC toracoabdominal: en diversas localizaciones del esqueleto axial fundamentalmente en el eje raquídeo, se reconoce la existencia de una alteración de la textura ósea consistente en patrón moteado y algunas formaciones osteolíticas concordantes con MM.
Después del cuadro agudo se inicia tratamiento, en el mes de abril de 2011, con: bortezomib+talidomida+dexametasona (VTD) recibiendo 3 ciclos, sin obtener respuesta, por lo que se decide cambiar de tratamiento. Posteriormente tiene 2 ingresos (junio y julio de 2011) por complicación infecciosa con neumonía. En el último ingreso de julio presenta un empeoramiento con un cuadro de insuficiencia renal aguda.
Analítica: hemoglobina, 8,6g/dl; creatinina, 8,8mg/dl; urea, 1,68mg/dl; filtrado glomerular, 10,54ml/min; Ca, 8,1mg/dl; LDH, 376 U/l; sodio, 141 mEq/l; potasio, 6,63 mEq/l; beta-2 microglobulina, 8,99 mcg/ml.
Estudio proteico: proteínas totales, 8,2g/dl; con albúmina de 2,9g/dl; componente monoclonal IgGλ, 2,8g/dl; con importante eliminación urinaria de cadenas λ de 52g/24h. Inmunoglobulinas: IgG 3.020mg/dl; IgA, 33mg/dl; IgM, 20mg/dl; CLL κ, 12,7mg/dl y λ, 12.900mg/dl. Ratio κ/λ: 0.
Se inicia tratamiento de 2.a línea con lenalidomida a dosis de 5mg, en ciclos de 28 días, con descansos de 7 días.
Ante el cuadro de insuficiencia renal aguda oligúrica con hiperpotasemia y acidosis metabólica, se contacta con Nefrología y se decide instaurar tratamiento de diálisis con filtro de HCO (Theralite).
Asimismo, se decide realizar biopsia renal, interpretándose como glomerulopatía nodular en fase incipiente con un 4,3% de pequeñas semilunas, compatible con una enfermedad por cadenas ligeras, tal y como se sospecha clínicamente.
Pauta de diálisis: se realiza diálisis diaria durante 6 días, de 6h de duración, con un flujo de sangre de 300ml/min, flujo de baño de 500ml/min, heparinización mediante heparina Na 1%, monitor Integra de Hospal y filtro de HCO Theralite de Gambro de 2,2 m2 de superficie, con un cut-off de 45KD. Se utilizó, en principio, un catéter yugular temporal, que más adelante fue sustituido por un catéter tunelizado tipo Tesio.
Se monitorizaron cifras de urea, creatinina y CLL pre- y postdiálisis. Se determinaron niveles de albúmina, Ca y magnesio a mitad de sesión, además se realizaron todas las analíticas que se pudieron considerar necesarias en cada momento, se continuó el tratamiento con diálisis a días alternos, con el objetivo de conseguir, por una parte, descensos de CLL y, por otra, una mejoría suficiente de filtrado glomerular (FG) que permitiera suspender la diálisis. Fueron precisos 57 días de tratamiento y un total de 27 sesiones de diálisis con HCO.
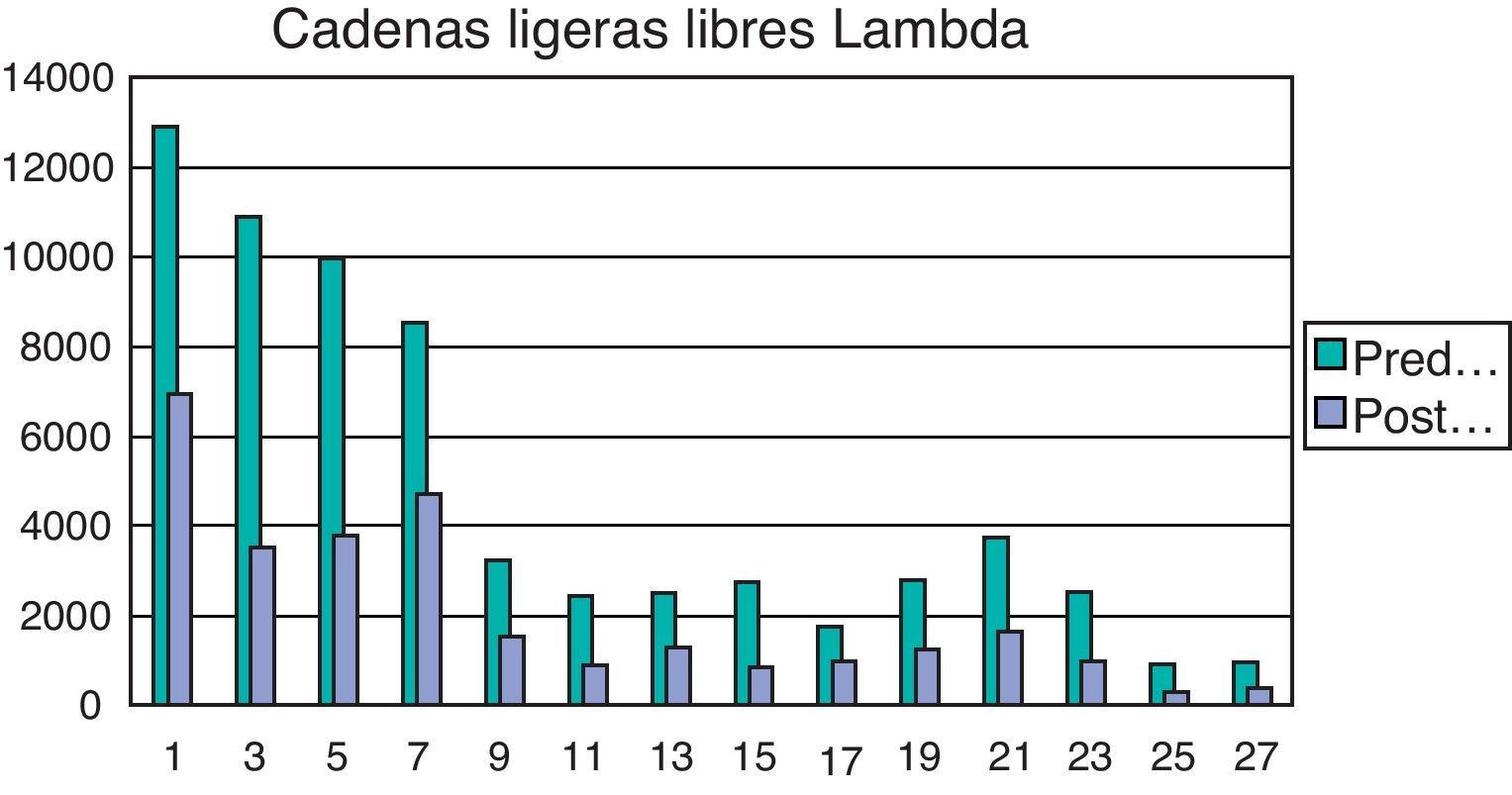
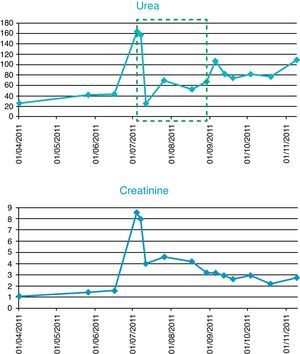
Evolución de las CLL durante el período de tratamiento con diálisis mediante filtro HCO (fig. 1).
La primera sesión de diálisis (7/7/2011) se inició con un nivel de CLL de 12.900mg/dl, descendiendo los niveles un 46%; la siguiente diálisis se obtuvo un descenso del 67,7%, siendo el descenso máximo en una sesión del 69,1% y la eliminación media de CLL en las 21 sesiones en que se obtuvieron datos fue del 57%.
Al inicio de la 7.° sesión los niveles de inicio de CLL eran de 3.230mg/dl, terminando en 1.530mg/dl.
El 5 de agosto, durante la sesión número 15, se observa un aumento en los niveles de CLL prediálisis, que pasan de 1.750mg/dl en la sesión anterior a 2.780mg/dl. Las diálisis continuaban siendo efectivas, pues los niveles finales fueron de 994mg/dl y 1.250mg/dl respectivamente. Pudimos comprobar que este hecho había coincidido con el fin del ciclo de tratamiento con lenalidomida, pues el protocolo utilizado por el Servicio de Hematología establecía ciclos de 28 días, con 21 días de tratamiento, seguidos de 7 días de descanso. Una vez reiniciado el tratamiento con lenalidomida, los niveles de CLL volvieron a descender, llegando en días posteriores a ser inferiores a 1.000mg/dl, en el control prediálisis, si bien fue conveniente suprimir el tratamiento dialítico con niveles inferiores a 500mg/dl, el hecho de presentar el paciente bajas cifras de creatinina (inferiores a 3mg/dl), junto a FG superior a 25ml/min, nos llevó a suspender las diálisis el 29/8/2011.
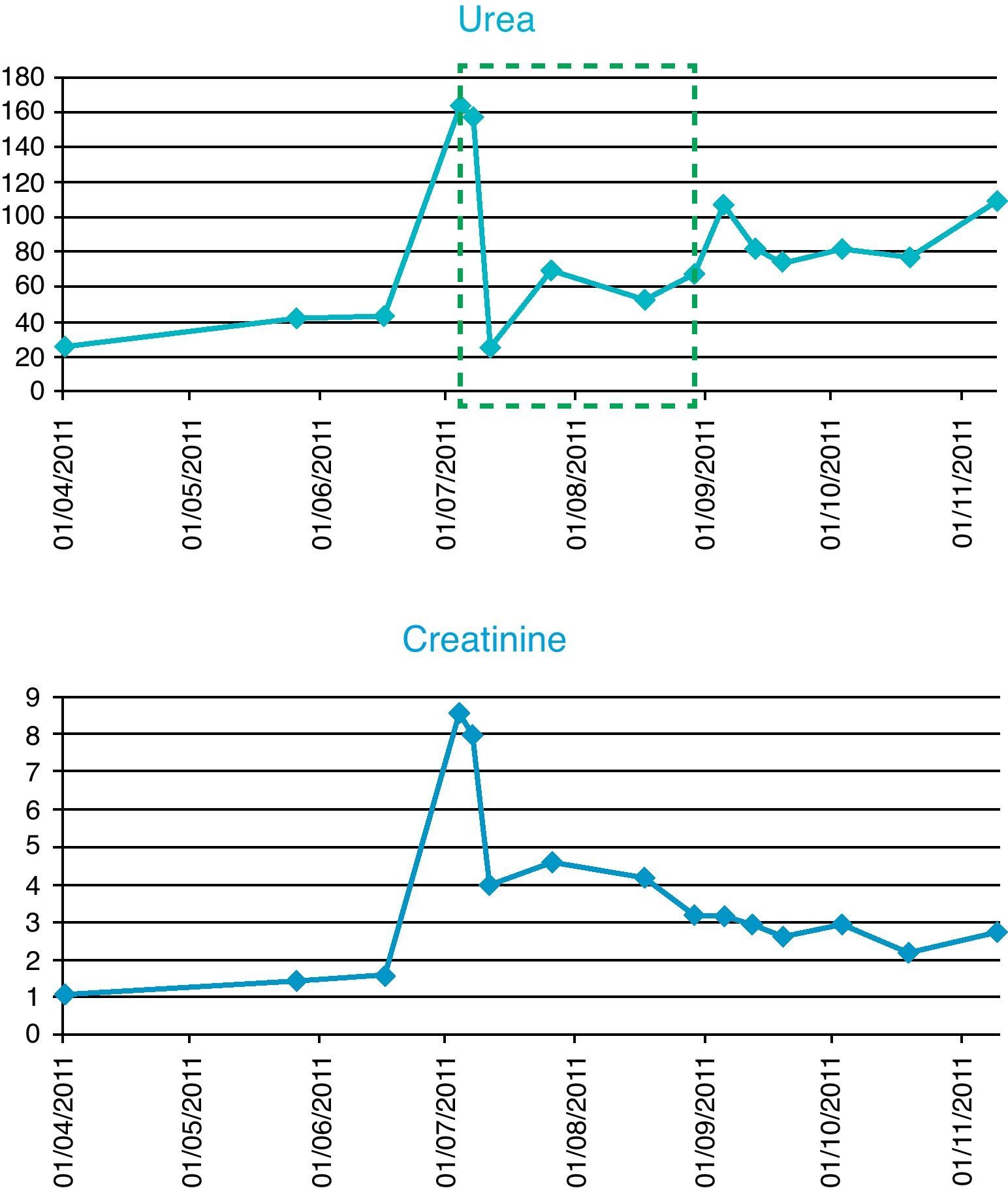
Evolución de la función renalCreatinina. El paciente presentaba en la primera sesión de diálisis unos niveles de creatinina de 8,8mg/dl y durante los días posteriores los niveles oscilaron entre 4 y 5mg/dl. Cuando se suspendió el tratamiento, los niveles habían bajado de los 2,98mg/dl (fig. 2).
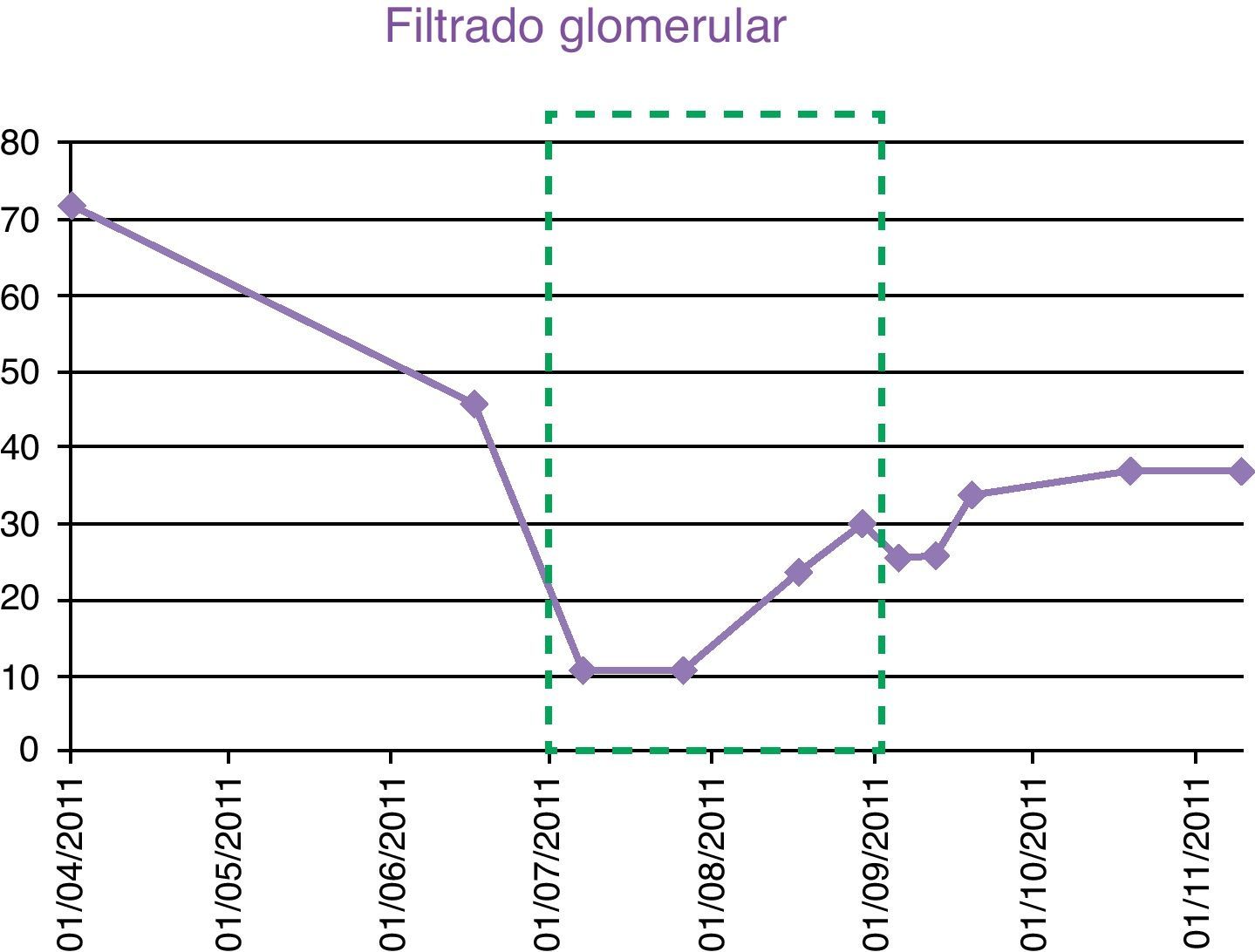
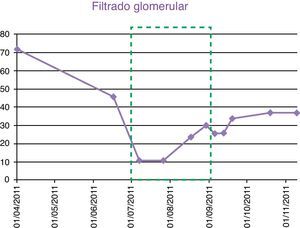
Filtrado glomerular. Cuando se iniciaron las diálisis con el filtro de HCO (7/7/2011), el paciente presentaba una FG de 10,54ml/min. El 9 de agosto, el FG había aumentado hasta 23,62ml/min. En el momento de suspender el tratamiento, la FG superaba los 25ml/min (fig. 3) y 3 meses después de haber terminado el tratamiento dialítico, el paciente mantuvo niveles de FG de 37ml/min y continuaba en tratamiento con lenalidomida 5mg y dexametasona 40mg.
Otros parámetros controladosLa albúmina sérica nunca llegó a bajar de 2,2g/dl, y lo habitual eran cifras de 2,6-3,2g/dl, a pesar de ello se infundieron a las 3h de diálisis, 2 viales de albúmina humana al 20% (10 g por vial), según las pautas marcadas por Hutchinson12.
El Ca osciló en niveles de 7-8mg/dl, utilizamos un baño de diálisis de 1,5 milimoles/litro y se infundieron 2 amp. de gluconato cálcico a mitad de sesión.
El magnesio no sufrió variaciones significativas que hicieran necesaria su reposición.
Anemia. Durante el tratamiento, el paciente precisó trasfusión de 2 concentrados de hematíes en 3 ocasiones, además, desde la primera diálisis, se administró tratamiento con EPO alfa a razón de 10.000 unidades 3 veces por semana. A partir de la última trasfusión las cifras de hemoglobina oscilaron entre 9 y 10g/dl, por lo que el paciente solo precisó ser tratado con EPO.
DiscusiónEn principio, la enfermedad de estos pacientes se trató con plasmaféresis, que parecía la opción más lógica, pero un estudio reciente demostró de forma concluyente que esta técnica no era suficiente para obtener algún beneficio clínico, debido a que las proteínas CLL son relativamente pequeñas y se presentan en concentraciones similares en el suero, en el compartimento extravascular y en el líquido del edema tisular, por lo que el compartimento intravascular puede contener únicamente del 15 al 20% de la cantidad total, por ello, la eliminación por plasmaféresis es solo un 65% de CLL intravascular y el intercambio de 3,5 l de plasma tendría un impacto global muy pequeño13,14.
Una alternativa a esta técnica es la de eliminar los FLC mediante hemodiálisis, pero debido a su alto peso molecular, no es posible hacerlo con filtros convencionales, siendo necesarios filtros que tengan un poro lo suficientemente grande.
El tratamiento con diálisis mediante el dializador Theralite de Gambro permite disponer de un dializador con alto cut-off 45KD, que va a permitir la eliminación de CLL en cantidad suficiente para evitar el bloqueo renal definitivo15.
Debido al alto cut-off del dializador a los pacientes se les tiene que infundir albúmina de forma rutinaria, así como Ca++ y en ocasiones Mg++ durante o al final de las sesiones de diálisis.
Para que la diálisis con HCO pueda ser eficaz, la enfermedad hematológica tiene que responder a la quimioterapia administrada; una quimioterapia eficaz reduce la producción de CLL y, por tanto, el nivel de CLL en sangre.
La diálisis debe iniciarse lo más pronto posible, antes de la aparición de una insuficiencia renal terminal, evitando así que las CLL provoquen que la insuficiencia renal sea irreversible16,17,13.
Para optimizar la duración optima y el calendario de sesiones de la diálisis con HCO, deben hacerse más estudios; pero según parece, es más útil la realización de sesiones largas (de 6 a 8h) y diarias, al menos durante la primera semana.
No se interrumpirá el tratamiento hasta que el descenso de CLL y la mejoría de la FG lo permita, siempre que la tolerancia a las diálisis sea buena.
Una de las limitaciones para emplear esta técnica es el elevado coste. Recientemente, algunos autores han presentado un modelo de coste-efectividad, comparando el tratamiento de riñón de mieloma con HCO y la hemodiálisis convencional. El tratamiento de la insuficiencia renal aguda con filtro de HCO se mostró muy superior a la hemodiálisis convencional, lo que se tradujo en una mayor esperanza de vida y ahorro de costes basado en evitar la hemodiálisis crónica18.
ConclusionesLa afectación renal en el MM es frecuente y tiene implicación en el pronóstico vital.
Es necesario instaurar el tratamiento lo más pronto posible.
Es imprescindible tratar de forma enérgica la producción de cadenas ligeras. El pilar básico del tratamiento es la quimioterapia.
La HD con filtro de HCO se mostró eficaz para eliminar las CLL, colaborando con la rápida recuperación de la función renal y presentando una buena relación coste eficacia.
No se presentaron complicaciones durante las diálisis con HCO y solo fue preciso infundir albúmina y Ca.