La nefropatía diabética origina un tercio de los casos de enfermedad renal terminal en España. Este proceso parece tener cierta susceptibilidad genética, tal y como han demostrado distintos estudios de agrupación familiar⋅ Dado que los fármacos inhibidores del sistema renina-angiotensina tienen efecto sobre dicha enfermedad, parece lógico estudiar polimorfismos pertenecientes a genes de este sistema como son: I/D de la enzima convertidora de angiotensina 1 (ACE1), p.M235T del angiotensinógeno (AGT), g.1166A>C del receptor de angiotensina 2 de tipo 1 (AGTR1) y tres polimorfismos de la enzima convertidora de angiotensina 2 (ACE2): rs4646124, rs2285666 y rs879922.
El objetivo de este trabajo fue estudiar la relación de los polimorfismos mencionados con el tiempo de supervivencia de pacientes diabéticos de tipo 2 en diálisis.
MétodosSe estudiaron 100 pacientes, de los cuales se recogieron las fechas tanto de entrada al programa de diálisis como de mortalidad, junto con otras características de interés clínico⋅ La genotipación de cada individuo se realizó mediante PCR a tiempo real.
ResultadosLas curvas de supervivencia halladas para cada polimorfismo no presentaron diferencias significativas entre los genotipos⋅ Sin embargo, las regresiones de Cox que permitieron la inclusión de otras variables clínicas evidenciaron diferencias significativas en el ACE1 (p=0,013) y el AGT (p=0,015).
De cada polimorfismo se escogió el alelo que se asociaba a una mayor mortalidad y se creó una nueva variable llamada “n° de alelos de riesgo”. Se observó que el riesgo relativo de muerte se multiplicaba por 1,42 (IC 95%:1,15-1,77; p=0,0009) por cada alelo de riesgo adicional que tenía el paciente —D (ACE1), M (AGT), A (AGTR1) y G (ACE2, rs4646124)—. Resultados similares se obtuvieron excluyendo el genotipo AGTR1 (1,46; IC 95%:1,16-1,84; p=0,0014).
ConclusionesLa presencia combinada de estas variantes de genes del sistema renina-angiotensina tiene un papel significativo en el riesgo de mortalidad de pacientes diabéticos de tipo 2 en diálisis.
Diabetic nephropathy causes one-third of cases of end-stage renal disease in Spain. Several familial clustering studies have shown that genetic susceptibility may be involved in this pathologic process. Since renin-angiotensin system inhibitors have an important effect on this disease, it seems rational to study polymorphisms belonging to genes of this system such as angiotensin-converting enzyme 1 (ACE1) I/D, angiotensinogen (AGT) p.M235T, type 1 angiotensin II receptor (AGTR1) g.1166A>C and three polymorphisms of the type 2 angiotensin-converting enzyme (ACE2): rs4646124, rs2285666 and rs879922.
The aim of this study was to evaluate the relationship between these polymorphisms and survival time of type II diabetic patients undergoing dialysis.
MethodsWe included 100 patients. We collected both the dates of entry in the dialysis program and death, along with other clinical features of interest. Individual genotypes were assigned by real-time polymerase chain reaction.
ResultsThe survival curves for each polymorphism showed no significant differences between genotypes. However, multivariate Cox regression analysis, which allowed inclusion of other clinical variables, revealed statistically significant differences in the ACE1 (p=0.013) and AGT (p=0.015) polymorphisms.
For each variant, we chose the allele that carried the highest mortality risk and created a new variable called “number of risk alleles”. The relative risk of death was multiplied by 1.42 (95%:1.15-1.77 p=0.0009) for each additional risk allele carried by the patient: D (ACE1), M (AGT), A (AGTR1) and G (ACE2, rs4646124). Similar results were obtained when the AGTR1 genotype was excluded (95% CI 1.46: 1.16-1.84 p=0.0014).
ConclusionsThe combination of these allelic variants of the renin-angiotensin system genes plays a significant role in the mortality risk of type II diabetic patients on dialysis.
La nefropatía es una de las complicaciones más graves de la diabetes mellitus y se asocia a un incremento del riesgo de mortalidad prematura por enfermedad cardiovascular. Es la primera causa de insuficiencia renal terminal en los países desarrollados1, con un notable incremento en las últimas décadas y con previsión de seguir creciendo en los próximos años2,3. En la actualidad, el acceso a hemodiálisis y trasplante renal han desplazado la insuficiencia renal al tercer lugar como causa de muerte del paciente diabético, después de la cardiopatía isquémica y del accidente vascular cerebral.
La supervivencia media a los dos años del paciente en diálisis es del 67%, mientras que a los 10 años es únicamente del 11%4. Las principales causas de muerte de estos pacientes son enfermedades cardiovasculares (50%), caquexia (22%) y septicemia (11%)5. Tanto la mortalidad como la comorbilidad de los pacientes con tratamiento renal sustitutivo es peor entre los diabéticos que entre los no diabéticos1.
El desarrollo de nefropatía diabética parece tener cierta susceptibilidad genética tal y como han demostrado distintos estudios de agrupación familiar6. Los genes del sistema renina-angiotensina (RAS) han tomado una gran importancia, dada la evidencia científica que adjudica a la angiotensina II una actividad esencial en la hipertensión intraglomerular, y dado que la progresión de la nefropatía se enlentece cuando este sistema es inhibido farmacológicamente7.
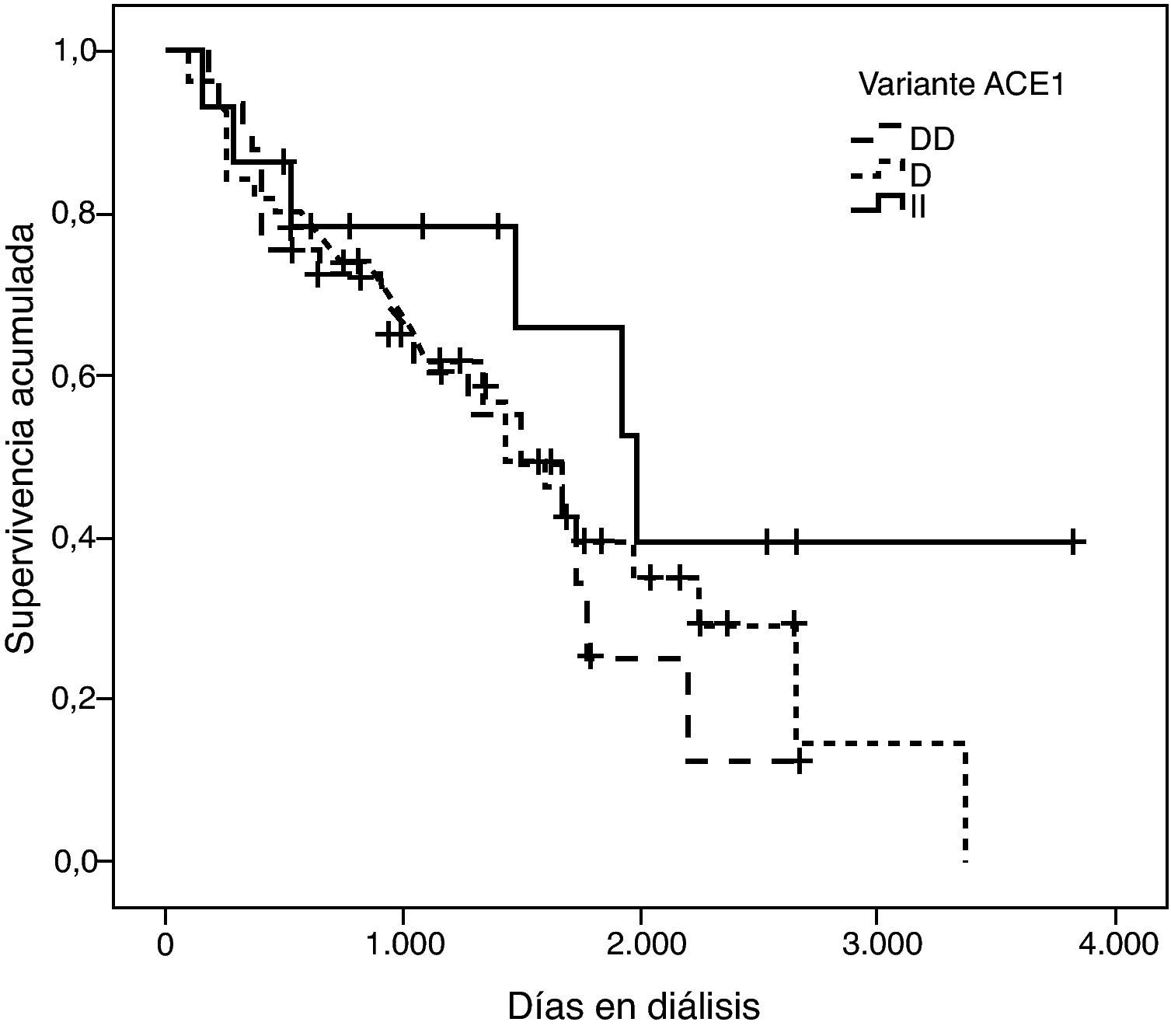
Las tres variantes más ampliamente estudiadas del RAS en la susceptibilidad y desarrollo de la nefropatía diabética son una inserción/ deleción (I/D) del gen que codifica para la enzima convertidora de angiotensina I (ACE1), la variante p.M235T del gen que codifica para el angiotensinógeno (AGT) y la variante g.1166A>C del gen que codifica para el receptor de angiotensina II de tipo 1 (AGTR1). Sin embargo, su estudio en relación con la mortalidad en diálisis es muy escaso. El alelo D de la variante del ACE1, que conlleva una síntesis más elevada de la enzima, se ha relacionado con un incremento del riesgo de mortalidad de los pacientes en diálisis8, pero no existen estudios concluyentes con respecto a las otras dos variantes9.
Por otro lado, el gen ACE2, de reciente descubrimiento y que codifica para la enzima convertidora de angiotensina I de tipo 2, se ha considerado como un factor protector del riñón, dado que en los pacientes sanos se ha encontrado una expresión en tejido renal superior a los pacientes con nefropatía diabética10. Algunas variantes pertenecientes a este gen han sido estudiadas en relación con la enfermedad cardiovascular, pero no se ha explorado su efecto sobre la mortalidad del paciente en diálisis.
En el presente trabajo hemos estudiado la asociación de las variantes de los genes ACE1 (I/D), AGT (p.M235T) y AGTR1 (g.1166A>C), y también tres variantes de haplotipos distintos del gen ACE2 (rs4646124, rs2285666 y rs879922) con la mortalidad en pacientes diabéticos tipo 2 en diálisis. Dado que el efecto de los genes sobre la mortalidad podría ser poligénico, fruto de la interacción entre distintas variantes, hemos valorado tanto el efecto individual como el combinado.
Pacientes y métodosEn el presente estudio se han seleccionado 100 pacientes diabéticos tipo 2 con nefropatía que han iniciado tratamiento con diálisis en nuestro centro hospitalario entre los años 1993 y 2008, y que han dado su consentimiento para participar en el trabajo. Los pacientes que murieron durante los primeros tres meses del inicio de diálisis fueron excluidos porque probablemente otros factores clínicos previos a la instauración del tratamiento contribuyeron al desenlace8. Se hizo un seguimiento de los pacientes desde la fecha en que iniciaron la diálisis hasta la fecha en que se produjo el evento estudiado, definido como “mortalidad”. Para los pacientes que no murieron durante el seguimiento se recogió la fecha de la pérdida, ya fuese por transferencia a otro centro de diálisis o por trasplante renal, o la fecha de fin de estudio para el resto.
Para cada paciente se recogieron los datos relativos a sexo, comorbilidad cardiovascular, historia de hipertensión no controlada y filtración glomerular renal a la primera visita en el hospital (MDRD basal) como características previas a la diálisis. En el momento de la instauración se recogieron adicionalmente los datos relativos a modalidad (hemodiálisis o diálisis peritoneal), filtración glomerular renal (MDRD residual), fracción de hemoglobina glucosilada, concentración de leucocitos y de hemoglobina en sangre y concentración de albúmina y de colesterol en plasma. Se ha utilizado la fórmula MDRD-4 para calcular la filtración glomerular renal11.
La genotipación de los pacientes se llevó a cabo con ADN extraído a partir de leucocitos presentes en sangre periférica siguiendo un procedimiento estándar (High Pure PCR Template Preparation Kit, Roche®).
La descripción metodológica para el estudio de las variantes ACE1 (I/D), AGT (p.M235T) y AGTR1 (g.1166A>C) está detallada en Padró et al12. Para la genotipación de las tres variantes del gen ACE2 se ha empleado la técnica de la reacción en cadena de la polimerasa (PCR) a tiempo real con sondas Taqman® (Applied Biosystems) alelo-específicas. Se ha amplificado el producto con la polimerasa iQTM Supermix (Bio-Rad) en un termociclador con detector de fluorescencia (iQ5 Cycler, Bio-Rad) siguiendo el protocolo recomendado.
Todos los análisis estadísticos fueron realizados con el programa SPSS statistical software (Version 15.0 for Windows; SPSS, Chicago, US). Se consideró significativa una p<0,05. Para la interpretación de los resultados de la PCR a tiempo real se trabajó con el programa Bio-Rad iQ5 Optical System Software v. 2.0.
Se llevó a cabo un análisis de la supervivencia mediante la comparación de curvas de supervivencia de Kaplan-Meier (prueba de log-rank). Se controló por otras variables mediante modelos multivariantes de regresión de Cox. Se utilizó la modalidad backward, y únicamente las variables que se mantienen en los modelos finales se muestran en las tablas de resultados.
El estudio de la interacción entre polimorfismos se hizo agrupando alelos de riesgo tal y como describen Jacobsen et al13.
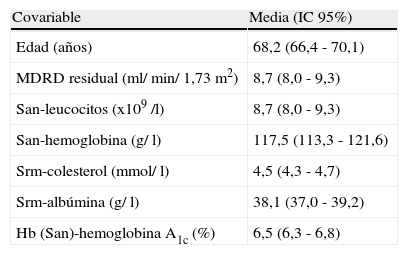
ResultadosEl estudio ha incluido 56 hombres y 44 mujeres, todos ellos diabéticos tipo 2 con insuficiencia renal terminal. El 56% de los pacientes estudiados sufrieron algún tipo de accidente cardiovascular previo a la instauración de diálisis, y el 54% presentaba historia de hipertensión previa no controlada. La media de la filtración glomerular a la primera visita al nefrólogo fue de 38,7 (35,1 - 42,4) ml/ min/ 1,73 m2. El 25% de los pacientes iniciaron diálisis peritoneal mientras que el resto optó por hemodiálisis. La tabla 1 muestra los datos que se recogieron en el momento de la instauración de la diálisis.
Media e intervalo de confianza del 95% (IC 95%) de las características recogidas en la instauración de la diálisis
| Covariable | Media (IC 95%) |
| Edad (años) | 68,2 (66,4 - 70,1) |
| MDRD residual (ml/ min/ 1,73 m2) | 8,7 (8,0 - 9,3) |
| San-leucocitos (x109 /l) | 8,7 (8,0 - 9,3) |
| San-hemoglobina (g/ l) | 117,5 (113,3 - 121,6) |
| Srm-colesterol (mmol/ l) | 4,5 (4,3 - 4,7) |
| Srm-albúmina (g/ l) | 38,1 (37,0 - 39,2) |
| Hb (San)-hemoglobina A1c (%) | 6,5 (6,3 - 6,8) |
La media del tiempo de seguimiento de estos pacientes fue de 1.147 días (994 - 1.300), con un máximo de 3.811 días (10,4 años), durante el cual 53 pacientes murieron, tres fueron sometidos a trasplante renal y 4 abandonaron el estudio.
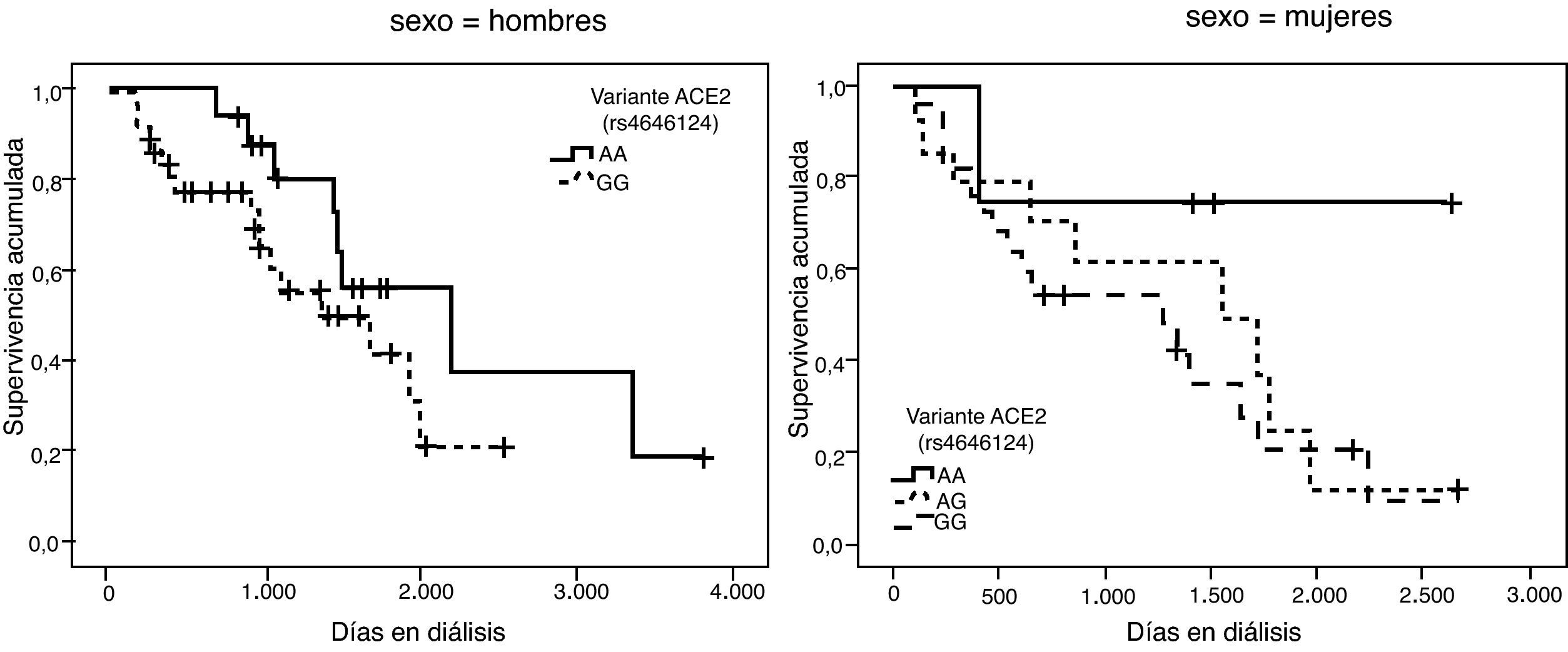
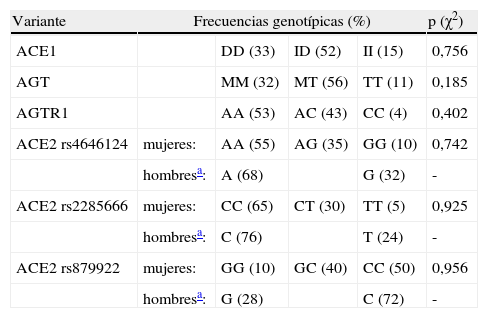
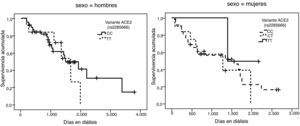
Las frecuencias genotípicas de las 6 variantes estudiadas se hallan resumidas en la tabla 2. En todos los casos se cumple el equilibrio de Hardy-Weinberg. Dado que el gen ACE2 se halla en el cromosoma X, las mujeres tienen 2 alelos, pero los hombres sólo tienen uno. Para simplificar la presentación de los resultados los hombres se han tratado como homocigotos cuando se analizan conjuntamente con las mujeres.
Frecuencias genotípicas —expresadas en porcentaje— de las 6 variantes, acompañadas de la significación estadística de la comparación de proporciones (prueba de χ2) obtenida al comprobar el equilibrio de Hardy-Weinberg
| Variante | Frecuencias genotípicas (%) | p (χ2) | |||
| ACE1 | DD (33) | ID (52) | II (15) | 0,756 | |
| AGT | MM (32) | MT (56) | TT (11) | 0,185 | |
| AGTR1 | AA (53) | AC (43) | CC (4) | 0,402 | |
| ACE2 rs4646124 | mujeres: | AA (55) | AG (35) | GG (10) | 0,742 |
| hombresa: | A (68) | G (32) | - | ||
| ACE2 rs2285666 | mujeres: | CC (65) | CT (30) | TT (5) | 0,925 |
| hombresa: | C (76) | T (24) | - | ||
| ACE2 rs879922 | mujeres: | GG (10) | GC (40) | CC (50) | 0,956 |
| hombresa: | G (28) | C (72) | - | ||
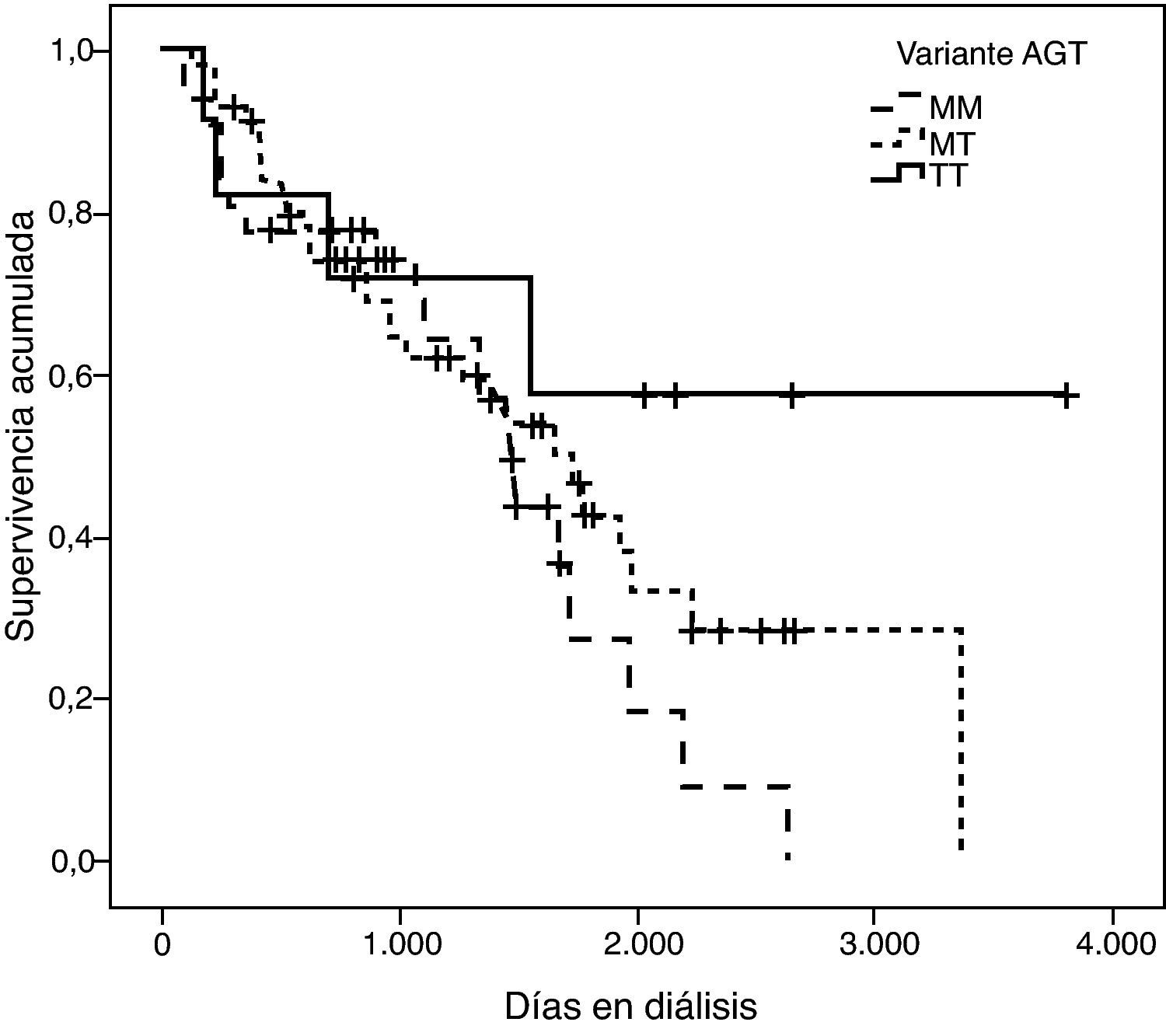
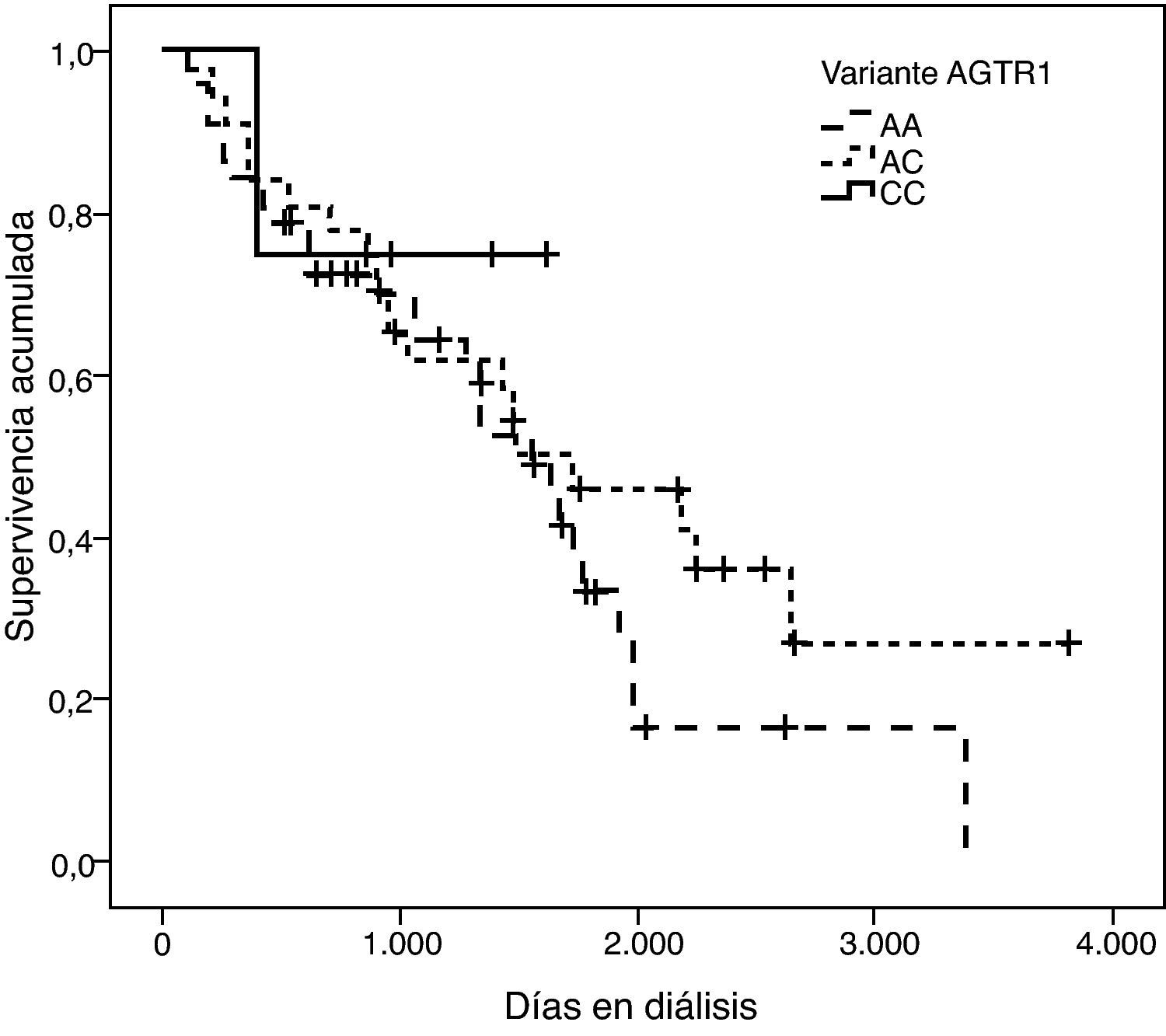
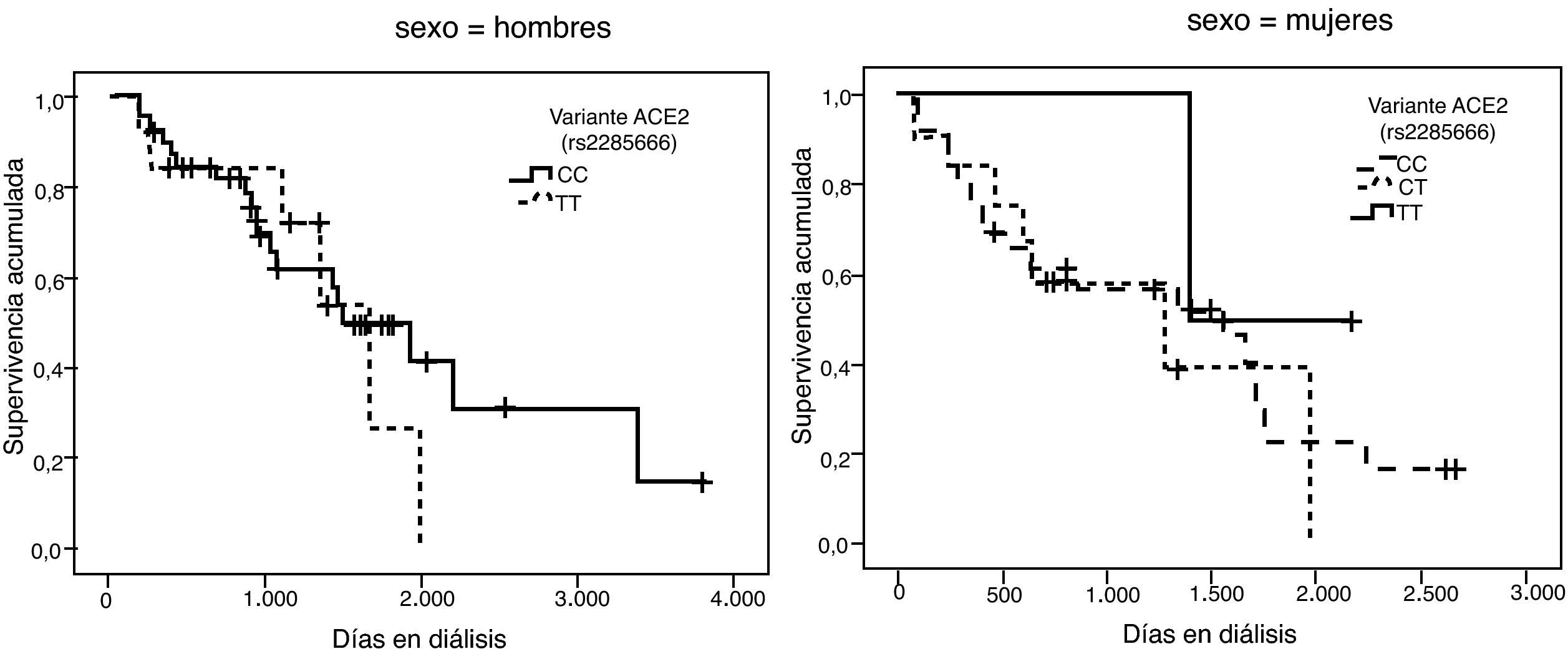
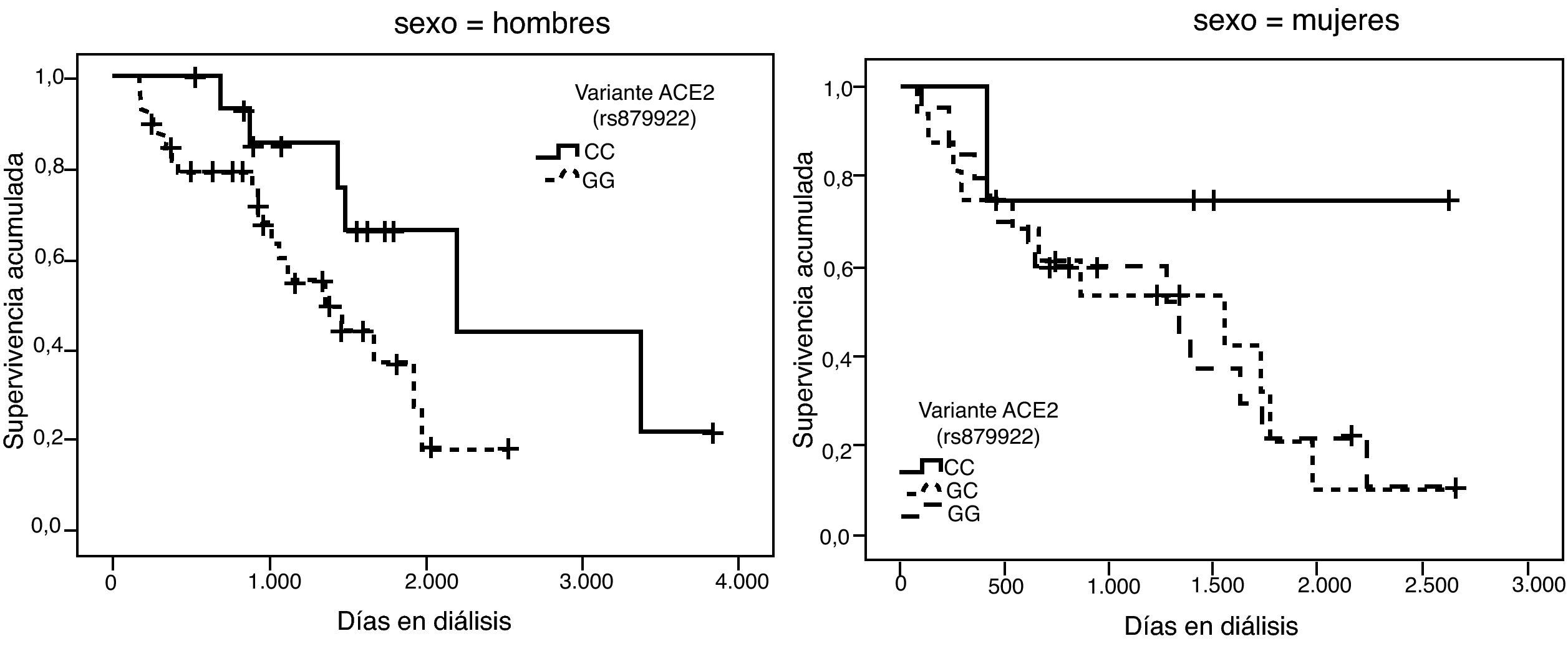
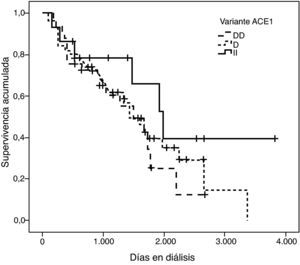
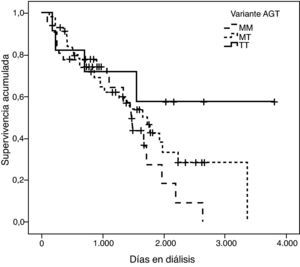
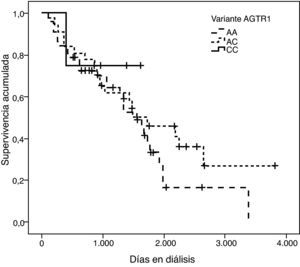
La representación gráfica de las curvas de supervivencia de Kaplan-Meier se puede ver en las figuras 1–6, junto con la significación estadística de la prueba de log-rank para la comparación de las curvas en función del genotipo. No se observaron diferencias estadísticamente significativas en ningún caso. Sin embargo, cuando se estudia el riesgo de mortalidad controlando por el resto de variables mediante regresiones de Cox, se hallaron diferencias tanto en la variante del ACE1 como en la del AGT. Los pacientes con genotipo DD (ACE1) muestran 3,5 veces más riesgo de mortalidad que los individuos II (HR=3,5; IC 95%=1,3 -9,9; p=0,017), mientras que los pacientes con genotipo MM (AGT) presentan 3,8 veces más riesgo de morir que los pacientes con genotipo TT (HR=3,8; IC 95%=1,2 - 12,4; p=0,025).
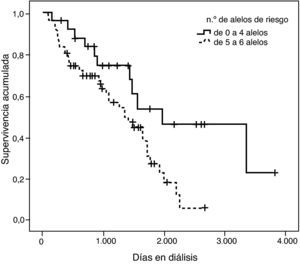
A partir de las tendencias observadas en las curvas de supervivencia para cada variante se seleccionó el alelo que parecía conferir un mayor riesgo de mortalidad, exceptuando la variante rs2285666 del gen ACE2, dado que las curvas se entrecruzan incluso parar los hombres. Se consideraron los siguientes alelos de riesgo: D (I/D), M (p.M235T), A (g.1166A>C), G (ACE2, rs4646124) y G (ACE2, rs879922). Se construyó una nueva variable denominada “número de alelos de riesgo” que se obtiene sumando los alelos de riesgo que tiene cada paciente. Por tanto, esta variable puede tomar valores entre 0 —para los pacientes con ningún alelo de riesgo— y 10 —para los pacientes que tienen los dos alelos de riesgo posibles para las 5 variantes—.
Se llevaron a cabo regresiones con todas las posibles combinaciones de 2, 3, 4 y 5 variantes. En el caso de combinaciones de dos variantes la combinación que mejor explicaba el riesgo de morir en diálisis era la formada por los genes ACE1 y AGT. Para combinaciones de tres variantes el modelo que mejor explicaba el riesgo de morir era el que añadía la variante rs4646124 del gen ACE2, mientras que para los modelos de 4 variantes se incorporó el gen AGTR1 (tabla 3). Ambas adiciones sucesivas mejoraban la estimación del riesgo de morir en diálisis. Sin embargo, el modelo con las 5 variantes no mejoró esta estimación.
Coeficientes de correlación de Cox de los modelos multivariantes que relacionan la variable “número de alelos de riesgo” con el riesgo de mortalidad en diálisis, acompañados del intervalo de confianza del 95% y de la significación estadística
| Combinaciones | Riesgo relativo | IC 95% | p |
| 2 variantes (ACE1+AGT) | 1,41 | 1,04 – 1,92 | 0,028 |
| 3 variantes (ACE1+AGT+ACE2 rs4646124) | 1,46 | 1,16 – 1,84 | 0,0014 |
| 4 variantes (ACE1+AGT+ACE2 rs4646124+AGTR1) | 1,42 | 1,15 – 1,77 | 0,0009 |
Se muestra únicamente la mejor de las combinaciones para cada número de variantes. La combinación de 5 variantes no mejoró el modelo con 4 variantes.
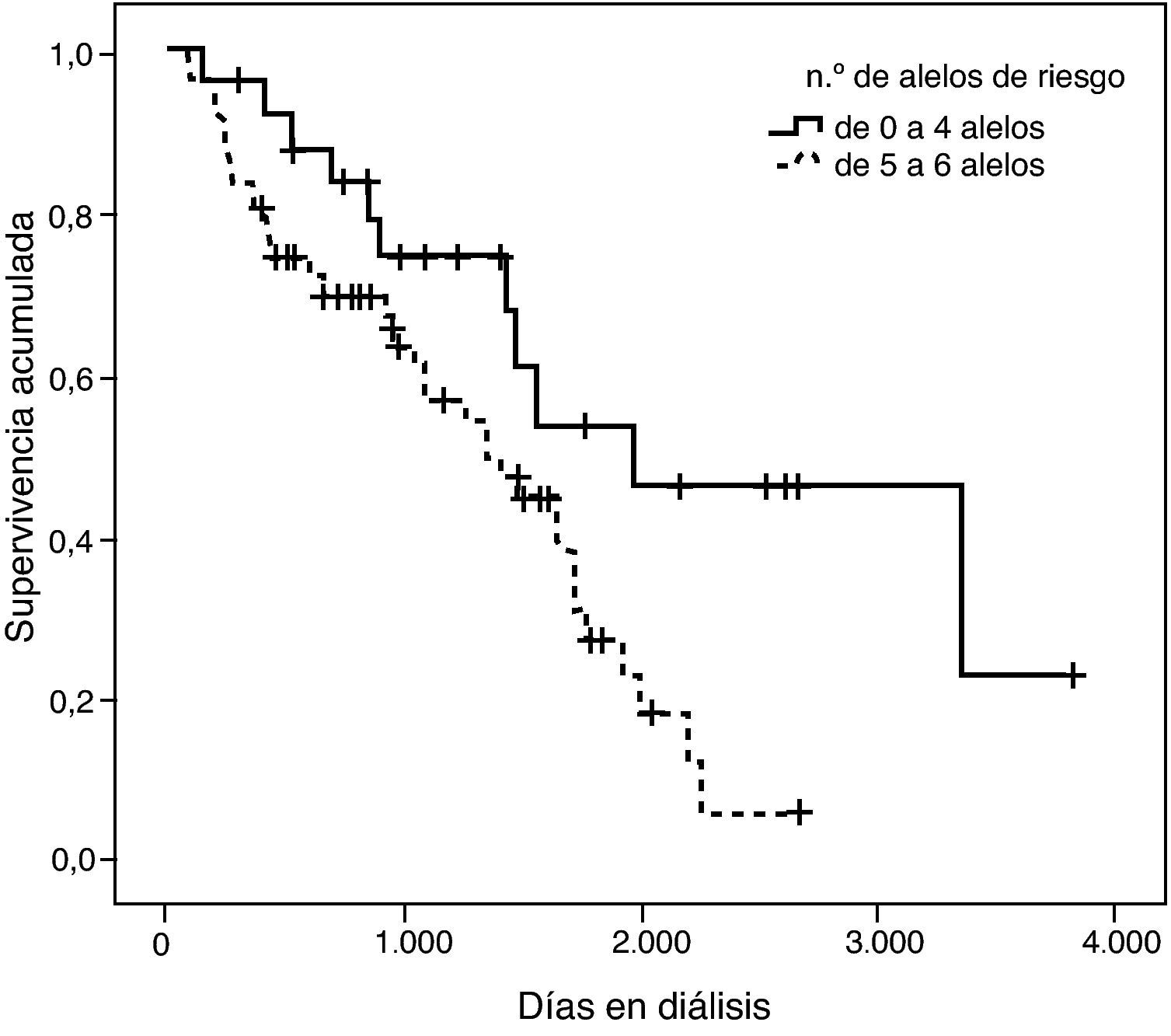
Tal como se puede observar en la tabla 3, para la combinación de 4 variantes el riesgo relativo de mortalidad en diálisis resultó ser un 42% mayor por cada alelo de riesgo de más que presentaba el paciente, de tal forma que un paciente que tuviera los 8 alelos de riesgo —DD (I/D), MM (p.M235T), AA (g.1166A>C) y GG (ACE2, rs4646124)— tendría un riesgo de morir 16,5 veces superior a un paciente que no tuviera ningún alelo de riesgo. Este efecto fue estadísticamente significativo (p=0,0009).
Con el fin de ejemplificar este hallazgo se confeccionó una curva de supervivencia clasificando los pacientes en dos grupos: los que tenían hasta 4 alelos de riesgo y los que presentaban entre 5 y 8 alelos de riesgo (fig. 7). La divergencia entre las dos curvas es notable y efectivamente queda demostrada con la significación estadística de la prueba de log rank (p=0,002).
DiscusiónLa existencia de factores genéticos en el desarrollo y progresión de la nefropatía en el paciente diabético se considera una realidad para la mayoría de autores. Se basan en estudios epidemiológicos que, por un lado, confirman que únicamente el 35% de pacientes diabéticos tipo 2 desarrollan nefropatía14, y por otro, demuestran agrupación familiar de los pacientes que sufren dicha complicación secundaria6,15.
El estudio de distintos genes pertenecientes a una misma vía metabólica minimiza el riesgo de obtener falsos positivos, confiere plausibilidad biológica a los resultados y permite el estudio de posibles asociaciones entre ellos. El RAS constituye un mecanismo muy importante en la patogénesis de la nefropatía del paciente diabético16,17. El RAS es el regulador mejor conocido de la tensión arterial y determina los órganos diana que se lesionan por causa de la hipertensión. La producción local —en las células renales— de angiotensina II incrementa la presión intraglomerular mediante la constricción de las arteriolas eferentes y, por tanto, contribuye al desarrollo y progresión de la glomeruloesclerosis observada en la enfermedad. La angiotensina 1-7, un heptapéptido descubierto recientemente, derivado de la angiotensina II por la acción de la enzima convertidora de angiotensina I de tipo 2, bloquea la acción vasoconstrictora, especialmente en situaciones de sobreactividad del RAS, dando lugar a una vasodilatación renal y aumentando enormemente la complejidad e interés de este sistema.
En el presente trabajo hemos examinado el efecto de 6 variantes de genes pertenecientes al RAS sobre la mortalidad de los pacientes diabéticos tipo 2 en tratamiento con diálisis: I/D de la ACE1, p.M235T del AGT, g.1166A>C del AGTR1 y tres polimorfismos de la ACE2: rs4646124, rs2285666 y rs879922. El efecto de dichas variantes se ha estudiado de forma individual y también combinada.
Existen muy pocos artículos que exploren el papel de estas variantes en la mortalidad en diálisis. La más ampliamente estudiada es la variante I/D del gen ACE1. El alelo D se ha relacionado con la mortalidad de origen cardiovascular en distintos metaanálisis; concretamente, la presencia de este alelo se ha asociado con un incremento de ateroesclerosis y de las complicaciones microvasculares renales, así como enfermedad coronaria, infarto de miocardio, ictus y nefropatía diabética18. Hadjadj et al han corroborado estos hallazgos mediante un estudio con 3.126 pacientes diabéticos de tipo 2 que les ha permitido relacionar el alelo D con una mayor probabilidad de muerte de origen cardíaco19. Sin embargo, estos resultados fueron cuestionados posteriormente en otro metaanálisis con población blanca20.
Los estudios que añaden el factor ‘diálisis’ presentan también cierta controversia: Higashiuesato et al evaluaron el riesgo relativo de muerte en 727 pacientes hemodializados de origen nipón, y concluyeron que la variante I/D no predice la supervivencia a corto término21. Contrariamente, Yoshida et al9, en un estudio con 168 pacientes, concluyeron que el genotipo DD incrementa el riesgo de morir una vez la diálisis ya ha sido iniciada. Este mismo estudio no pudo demostrar la existencia de relación entre la mortalidad en diálisis y las variantes p.M235T del AGT y g.1166A>C del AGTR1. Coincidiendo con este último autor se ha publicado que la mortalidad de los pacientes diabéticos con genotipo DD es 2,3 veces superior a los portadores del alelo I en diálisis22. Un riesgo similar ha sido descrito por van der Sman-de Beer et al8.
Böger et al estudiaron la asociación de la interacción entre las variantes I/D del ACE1, p.M235T del AGT y g.1166A>C del AGTR1 y el tratamiento farmacológico con IECA o ARA-II, con la mortalidad de 445 pacientes germánicos con nefropatía diabética y hemodializados. Únicamente encontraron un incremento estadísticamente significativo del riesgo de morir en el grupo en tratamiento con ARA-II, y a su vez, homocigotos AA de la variante g.1166A>C23.
No hay bibliografía disponible hasta el momento que explore el papel de variantes del gen ACE2 en la mortalidad de pacientes diabéticos en diálisis.
En el presente trabajo las siguientes covariables se introdujeron en los modelos de Cox: edad, sexo, comorbilidad cardiovascular, hipertensión, MDRD basal como indicador de remisión tardía al especialista, modalidad de diálisis, MDRD residual, san-hemoglobina; c. masa como marcador de anemia, srm-albúmina; c. masa como marcador del estado nutricional, san-leucocitos; c. núm. como marcador de septicemia, srm-colesterol; c. sust. como marcador de dislipemia y Hb (san)-hemoglobina A1c; fr. sust. como marcador del control glucémico24.
En una primera aproximación se ha estudiado el efecto individual de cada variante y se ha observado que la I/D del ACE1 y el p.M235T del AGT presentan efectos significativos sobre la mortalidad. Concretamente el genotipo DD explica un aumento del riesgo de mortalidad de 3,5 (1,3 - 9,9) veces el de los pacientes II, y el genotipo MM, a su vez, explica un aumento del riesgo de mortalidad de 3,8 (1,2 - 12,4) veces el de los pacientes TT. Es de destacar que estos coeficientes de regresión están estimados con un elevado error estándar, hecho que explica por qué los intervalos de confianza están tan pobremente acotados.
Con el fin de estudiar el efecto combinado de estas variantes e intentar mejorar la estimación del riesgo, definimos una nueva variable que cuantificaba el número de “alelos de riesgo” que tenía cada paciente. La definición de “alelo de riesgo” se basó en los patrones observados en las curvas de supervivencia individuales. De esta forma clasificamos los alelos D (I/D), M (p.M235T), A (g.1166A>C), G (ACE2, rs4646124) y G (ACE2, rs879922) como alelos de riesgo, mientras que la variante rs2285666 del gen ACE2 quedó fuera de la clasificación. A continuación llevamos a cabo modelos multivariantes con todas las posibles combinaciones de 2, 3, 4 y 5 variantes, y escogimos el modelo de cada grupo que estimaba el riesgo de mortalidad con una mayor precisión. La variante rs879922 del gen ACE2 no mejoró ningún modelo.
El principal hallazgo de este trabajo es que hemos encontrado una relación entre el efecto combinado de las variantes estudiadas y la mortalidad en diálisis. Más concretamente, por cada alelo adicional D (I/D), M (p.M235T), A (g.1166A>C) o G (ACE2, rs4646124) que tiene un paciente diabético de tipo 2 el riesgo de morir en diálisis se multiplica por 1,42 (IC 95%: 1,15 - 1,77). Es importante destacar que la estimación del riesgo es mucho más precisa. Resultados similares se encontraron cuando prescindimos de la variante AGTR1.
En conclusión, nuestros datos sugieren que algunas de las variantes aquí estudiadas (I/D, p.M235T) tienen un efecto individual sobre la mortalidad en diálisis de los pacientes diabéticos tipo 2. Por otro lado, el efecto derivado de su presencia combinada con la de otras variantes, cuya influencia individual no es concluyente (g.1166A>C, rs4646124), resulta incluso más notorio, lo que sugiere la existencia de una interacción entre los efectos y pone de relieve la importancia de estudiar conjuntamente diferentes variantes en situaciones patológicas cuya base genética es compleja.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.