Aunque la diálisis peritoneal (DP) intermitente se venía utilizando en régimen hospitalario para el tratamiento de la insuficiencia renal crónica (IRC) desde los años sesenta, no fue hasta el final de los años setenta y en la década de los ochenta que se produjo el desarrollo de la DP como modalidad de tratamiento domiciliario de la IRC. Este cambio fue posible gracias a algunas mejoras técnicas —entre las que destaca el envasado de los líquidos de diálisis en bolsas de plástico— y la introducción del concepto de DP continua ambulatoria (DPCA), que permitió el desarrollo de esquemas de diálisis compatibles con la calidad de vida de los pacientes. Los primeros tiempos de la DP domiciliaria fueron difíciles, ya que se trataba de una técnica todavía muy imperfecta y, además, con un fuerte componente de selección negativa, ya que se indicaba sobre todo a pacientes que habían agotado sus opciones de acceso vascular, habitualmente poco motivados y con tasas relativamente altas de comorbilidad. Como era de esperar, las tasas de peritonitis eran muy elevadas, y la supervivencia con la técnica, muy deficiente. A pesar de ello, la DP domiciliaria sobrevivió a este período, mejoró sus resultados y empezó a reclutar a cada vez más pacientes que la elegían como forma inicial de tratamiento de la IRC (selección positiva), lo que a su vez contribuyó notablemente a la mejora en sus resultados. A finales de los ochenta se produjo un nuevo empuje, con la aparición de los sistemas en Y para DPCA (que posibilitaron una notable reducción en las tasas de peritonitis) y el desarrollo de cicladoras manejables, que permitían realizar DP nocturna domiciliaria, con la consiguiente mejoría en la calidad de vida de muchos pacientes. Los años noventa fueron los de asentamiento de la DP como técnica de tratamiento de la IRC. Además, su menor coste económico que las técnicas de hemodiálisis permitió un gran desarrollo en países con limitaciones para el gasto sanitario1. El comienzo del nuevo milenio contempla a la DP como una técnica plenamente asentada, pero con dos importantes retos pendientes: conseguir una mayor penetración como técnica inicial de diálisis y aproximar, en durabilidad de la técnica, sus resultados a los de la hemodiálisis crónica.
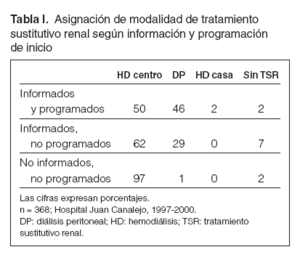
Implantación de la DP como modalidad inicial de tratamiento sustitutivo renalEl concepto de tratamiento integrado de la IRC, promovido por el grupo de Gante2, se basa en la consideración del tratamiento sutitutivo renal (TSR) —DP, hemodiálisis y trasplante renal— como un conjunto terapéutico, del que el paciente se puede beneficiar de manera consecutiva e indistinta, según las circunstancias clínicas y personales lo requieran. El cambio programado de modalidad de diálisis tendría, desde este punto de vista, importantes beneficios potenciales, oponiéndose a la visión tradicional de cambio in extremis (sólo si las circunstancias lo hacían inevitable), que se asociaba a una morbimortalidad significativa. Esta perspectiva flexible permite al paciente beneficiarse de lo mejor de cada técnica de diálisis en diferentes momentos de su evolución, y no ver los cambios de modalidad como una amenaza, sino como una ampliación de sus opciones. La visión de tratamiento integrado representa un fuerte apoyo a la DP como forma inicial de TSR, cuando el trasplante preventivo no es posible, ya que la DP parece proporcionar mayores beneficios en los primeros años de tratamiento. Así, múltiples estudios observacionales avalan que la DP rinde unos resultados superiores a los de la hemodiálisis, especialmente en la supervivencia, durante los primeros 2-3 años de TSR, para luego declinar de manera progresiva en sus resultados comparados3,4. Estos resultados permiten mantener en excelentes condiciones a los pacientes que esperan un trasplante renal, además con un coste significativamente inferior al de la hemodiálisis. El sustrato de esta diferencia probablemente sea complejo, pero el mantenimiento de la función renal residual (FRR) es esencial. Desde hace años sabemos que la DP permite una supervivencia más prolongada de la FRR que la hemodiálisis5 y se beneficia más de ello6. Es por ello que la DP obtiene sus mejores resultados en los primeros años de TSR, y el cese de la FRR probablemente sea la causa del declive posterior de sus resultados. El mejor mantenimiento de la FRR permite además una transición más favorable en caso de trasplante renal (tratamiento integrado), ya que la pervivencia de FRR al trasplante mejora sus resultados, en forma de menores tasas de disfunción inicial del injerto, ingreso más corto, menor coste e incluso mejor supervivencia del injerto7. Los registros de Estados Unidos8 y Francia9 muestran una preferencia clara por los pacientes en DP para la asignación de órganos para trasplante renal. Todas las consideraciones anteriores contrastan notablemente con la situación de la DP como modalidad de TSR en España, donde su penetración es casi testimonial en prevalencia (poco más del 5 %) y muy baja en incidencia (10-12 %). El trasfondo de esta aparente incongruencia es muy complejo, y España lo comparte con otros de nuestro entorno. Un factor esencial para optimizar la asignación de modalidad inicial de TSR es que existan infraestructuras estables de asistencia nefrológica en las fases previas al inicio de TSR, que permitan a los pacientes recibir información y educación sobre las distintas modalidades de tratamiento y elegir, de manera informada, la que mejor se ajuste a sus condiciones. Estudios en otros países han demostrado que la remisión tardía (menos de 3 meses de seguimiento por nefrólogo) y un menor número de visitas médicas antes de la diálisis influyen de manera muy negativa en la elección de DP como modalidad inicial de TSR10,11. En nuestro centro, la modalidad de TSR peor conocida por los pacientes es la DP (el 28 frente al 41 % de la hemodiálisis), y este desconocimiento tiene un impacto directo en la proporción de enfermos que comienzan cada modalidad (tabla I). De acuerdo con los resultados de una encuesta multicéntrica realizada en España, la proporción de pacientes que eligen la DP como modalidad inicial de diálisis baja del 25 al 5 % según hayan recibido o no información reglada sobre las opciones de TSR12. En resumen, conseguir que los pacientes con IRC reciban de manera sistemática información, educación y cuidados previos a la diálisis debe ser un objetivo esencial en la asistencia nefrológica. Su implementación daría lugar, con toda probabilidad, a un aumento de la penetración de la DP como forma inicial de TSR. Asimismo, es importante que existan criterios comunes dentro de los equipos nefrológicos en cuanto a las opciones de tratamiento sustitutivo renal y la posibilidad de utilizarlas de forma planificada, para que el paciente obtenga el máximo beneficio terapéutico en cada momento.
Tabla I. Asignación de modalidad de tratamiento sustitutivo renal según información y programación de inicio
Supervivencia a largo plazo con la DPAunque son varios los factores que limitan la supervivencia a largo plazo con la DP como modalidad de TSR, la preservación de la membrana peritoneal es un factor esencial para conseguir este objetivo, al permitir mantener las suficientes adecuación y ultrafiltración, con lo que se optimizan la supervivencia y la calidad de vida de los pacientes. Durante el tratamiento con DP la membrana peritoneal está permanentemente bañada por un líquido de diálisis no fisiológico. Tradicionalmente, la glucosa ha sido el único agente osmótico utilizado para obtener tasas adecuadas de ultrafiltración. Las altas concentraciones de glucosa utilizadas para conseguir este objetivo (entre 15 y 40 veces mayores que las normales en el fluido extracelular) tienen efectos adversos tanto directos como indirectos13, ya que desde el mismo proceso de esterilización de la solución se generan productos de degradación de la glucosa (PDG) en proporción a la concentración de glucosa en el líquido. Por otra parte, el tampón habitualmente utilizado ha tenido que ser el lactato, en lugar del natural bicarbonato, ya que éste precipita en forma de sales de calcio con los métodos tradicionales de fabricación. La acidez de los líquidos de diálisis resultantes y la presencia de residuos plásticos en ellos son otros factores con potenciales efectos negativos. En conjunto, los líquidos de diálisis clásicos son claramente bioincompatibles, y sus efectos negativos tanto locales (en la propia membrana peritoneal) como sistémicos (sobrecarga de volumen, hipertensión, enfermedad cardiovascular, alteraciones metabólicas, estados inflamatorios) están relativamente bien caracterizados. Los cambios en la membrana peritoneal afectan tanto al mesotelio como al espacio subendotelial, que se amplía y se fibrosa, y a los vasos sanguíneos vecinos (neoangiogénesis, hialinosis subendotelial con engrosamiento de la pared y reduccción de la luz vascular)14. La contrapartida clínica de estos cambios es una pérdida progresiva de la capacidad de ultrafiltración, asociada a cambios variables del transporte peritoneal de pequeños solutos. Así, el fallo de ultrafiltración puede acompañarse de una extracción inadecuada de solutos, y tiende a autoalimentarse, ya que la ultrafiltración insuficiente demanda un mayor aporte de glucosa como agente osmótico para mantener el control del volumen extracelular de los pacientes afectados15. ¿Cuál de estos factores es más lesivo para la membrana peritoneal? El sentido común nos dice que todos ellos lo son, y hay evidencia de los efectos lesivos independientes por glucosa, PDG, lactato, acidez y plásticos en el peritoneo. Estudios experimentales han mostrado que los primeros 3 factores son particularmente “eficaces” a la hora de reproducir los cambios observados en el peritoneo de pacientes con fallo de membrana (fibrosis intersticial y vasculopatía)16-18. El conocimiento de los factores que lesionan la membrana peritoneal ha permitido desarrollar alternativas menos lesivas en la última década. Así, se han introducido soluciones de aminoácidos (libres de glucosa y PDG) y polímeros de glucosa (isoosmolares y con pocos PDG), que permiten mantener la ultrafiltración con un aporte muy reducido de glucosa al peritoneo. Disponemos ya de evidencias clínicas sobre el efecto protector de la icodextrina en la membrana peritoneal, con estabilización de la capacidad de ultrafiltración y menor incremento de la permeabilidad peritoneal a medio plazo que en los pacientes que utilizan exclusivamente soluciones basadas en glucosa (estudio EAPOS)15. La posibilidad de envasar el líquido de diálisis en bolsas multicompartimentales ha permitido la introducción de líquidos de diálisis en los que se ha sustituido de manera total o parcial el tampón lactato por bicarbonato. Todos los disponibles comparten como características ventajosas un pH más fisiológico y un bajo contenido en PDG. Estudios de laboratorio han mostrado que estos líquidos mejoran los marcadores de daño de membrana (inflamación y neoangiogéne-16-18 y la capacidad defensiva antibacteriana en la cavidad peritoneal (reclutamiento leucocitario, activación macrofágica y actividad antibacteriana de los leucocitos peritoneales)16,19,20, por lo que podrían mejorar la prevención y la respuesta terapéutica a las peritonitis. Sin embargo, falta evidencia firme sobre el significado práctico de algunos de estos hallazgos. Así, el estudio Euro-Balance21 fue incapaz de demostrar efecto alguno, aunque más recientemente Ahmad et al22 han presentado datos retrospectivos que indican tasas inferiores de peritonitis en los pacientes tratados con soluciones más biocompatibles. La membrana peritoneal sufre agresiones infecciosas (peritonitis) que pueden comprometer su viabilidad a corto y largo plazo. No hay duda del efecto lesivo de las infecciones asociadas a una respuesta inflamatoria severa y prolongada (infecciones fúngicas, micobacterianas o entéricas). Por el contrario, las evidencias sobre el efecto de las peritonitis no complicadas son escasas y contradictorias, y hay estudios que muestran un escaso efecto negativo incluso de altas tasas de peritonitis con estas características23. La DP ha presenciado, pues, múltiples avances en los últimos años, que sin duda acercarán sus resultados de supervivencia a los de la hemodiálisis. ¿Y qué pasa con la supervivencia de los pacientes? En la segunda mitad de los años noventa, una interpretación sesgada de los resultados del estudio multicéntrico italiano24 y del CANUSA25 llevó al establecimiento de objetivos de adecuación en DP (estimados a través de Kt/V de urea y aclaramiento de creatinina totales) que un alto porcentaje de los pacientes no eran capaces de alcanzar. La consecuencia fue un declive de incidencia y prevalencia de la DP del que esta técnica aún no se ha recuperado en la actualidad. Afortunadamente, ensayos clínicos aleatorizados26,27, estudios observacionales bien enfocados28 e incluso el reanálisis de los datos de los estudios citados29 han establecido con claridad que la supervivencia de pacientes en DP no depende de los parámetros generales de adecuación (al menos en rangos habituales), y sí de la FRR. Esta aparente paradoja se derivaba del error conceptual inicial de sumar, como si fueran factores indistintos, los aclaramientos proporcionados por la FRR y la propia DP. El papel de la FRR nos proporciona, además, una explicación para la conocida relación variable en el tiempo entre la supervivencia en DP y hemodiálisis ya mencionada: la ventaja de la DP se mantendría en tanto se mantuviera la FRR. Una vez desaparecida ésta, la propia DP debería asumir un papel protagonista en los resultados de la técnica. Esta percepción la respaldan estudios como el multicéntrico turco30 y el estudio EAPOS31, que mostraron que, en pacientes con FRR mínima o ausente, la extracción de agua y sodio guardaba una estrecha correlación con la mortalidad. En resumen, los objetivos terapéuticos en DP se han reorientado en los últimos años, como muestran las recomendaciones de diferentes sociedades nefrológicas (EDTA, ISPD, DOQI). El mantenimiento de la FRR es ahora un objetivo prioritario, y la ultrafiltración ha entrado con fuerza como objetivo de adecuación, especialmente en pacientes oligoanúricos. En cambio, los objetivos de aclaramiento de moléculas pequeñas se han suavizado claramente respecto a las cifras propuestas previamente (incluso el aclaramiento semanal de creatinina ha desparecido como objetivo de adecuación en algunas guías). Los próximos años nos mostrarán el impacto de estas variaciones sobre los resultados globales de la DP, pero es esperable que la retirada de objetivos de adecuación innecesarios y poco realistas permitan un relanzamiento de la técnica. Desde hace algunos años sabemos que al hablar de extracción de agua en DP es preciso considerar también la extracción de sodio. Según el modelo de los tres poros desarrollado por Rippe32, la transferencia de agua a través de la membrana peritoneal generada por los líquidos de diálisis que utilizan glucosa como agente osmótico es máxima en las primeras 2 h del intercambio, a través de los poros ultrapequeños (acuaporinas). Estos poros transcelulares no permiten que el paso de agua se acompañe del de electrolitos u otros solutos y se produce un fenómeno de dilución de la concentración de sodio en el líquido de diálisis conocido como cribado (sieving) de sodio. Como consecuencia, cuando se programan intercambios en DP de corta duración (caso de la sesión nocturna en DP automática), la cantidad de sodio extraído por litro de ultrafiltrado es menor que la que se obtiene cuando los intercambios tienen una duración superior a las 4 h (caso de la DPCA). Nuestro grupo analizó este fenómeno en dos fases: inicialmente mediante un corte transversal de los pacientes incluidos en aquel momento en ambos programas de DP33 y posteriormente, de manera longitudinal, a todos los pacientes incluidos en ambos programas durante 2 años34. Este último trabajo demostró que los pacientes en DP automática eliminan de manera menos eficiente tanto el sodio como el agua durante toda su evolución. En los últimos años, diferentes estudios han abordado la cuestión de cómo mejorar la extracción de so-dio y agua en DP automática. El método más simple es introducir un cambio diurno con icodextrina, un cambio suplementario diurno o ambos33. Esta estrategia aumenta la eliminación de sodio y agua de manera progresiva, pero implica aumentar el número de cambios diurnos (con un efecto negativo en la calidad de vida) y puede ser insuficiente, sobre todo en pacientes sin FRR y con baja capacidad de ultrafiltración. Alternativamente, se ha propuesto el uso combinado de líquidos con glucosa e icodextrina en un solo cambio diurno, en un intento de optimizar la ultrafiltración a través de los gradientes osmóticos cristaloide (glucosa) y coloide (icodextrina). Así, Dallas et al35 añadieron 45 ml de glucosa al 70 % a una bolsa de 2 l de icodextrina al 7,5 %, con lo que consiguen una mezcla con concentraciones de glucosa del 1,36 % y de sodio de 133 mmol/l. Un estudio más reciente36 añadía 200 ml de glucosa al 30 % a una bolsa de 2 l de icodextrina al 7,5 %, para obtener una mezcla con concentraciones de glucosa del 2,61 %, de icodextrina del 6,8 % y de sodio de 121 mmol/l (por dilución del sodio de la bolsa de icodextrina).
En ambos estudios se consiguió un aumento muy significativo en la ultrafiltración y la extracción de sodio. Este tipo de mezclas ofrece evidentes posibilidades de optimización de la ultrafiltración y la extracción de sodio, y la industria podría sistematizar su uso en un plazo relativamente corto. Una estrategia distinta es apoyarse en la sesión nocturna para conseguir los objetivos de control de volumen. Un reciente ensayo aleatorizado ha demostrado la capacidad de la DP automática para conseguir este objetivo37, pero al precio de unas tasas elevadas de carga y absorción de glucosa peritoneal. Desde una perspectiva opuesta, es posible utilizar mezclas de líquidos en la sesión nocturna para, manteniendo la ultrafiltración, reducir la carga de glucosa. Un ensayo aleatorizado de nuestro grupo ha mostrado que la sustitución progresiva de solución de glucosa por soluciones de aminoácidos e icodextrina permite conseguir este objetivo38. Aunque la supervivencia de los pacientes y la persistencia con la técnica son objetivos primarios de la DP, como en cualquier forma de TSR, no se debe olvidar la gran importancia de optimizar la calidad de vida como objetivo de adecuación. Los pacientes que optan por modalidades domiciliarias de TSR muestran, en general, altos grados de satisfacción con su tratamiento, habitualmente superiores a los observados en pacientes en hemodiálisis, aunque la comparación no es fiable, pues no hay estudios con asignación aleatoria de la modalidad de TSR. Sí hay estudios aleatorizados que comparan la calidad de vida entre pacientes tratados con DPCA y con DP automática, con resultados claramente favorables a esta última39. No cabe duda de que la calidad de vida se entiende de distinta manera según la edad del paciente, sus comorbilidades y su contexto laboral y social, pero ello acentúa la necesidad de seleccionar la modalidad de TSR que, teniendo en cuenta todos estos aspectos, se adapte mejor a cada paciente. Tampoco debemos olvidar las necesidades de los familiares que atienden a los pacientes, máxime cuando, en los últimos años, la media de edad y las comorbilidades de nuestros enfermos han ido aumentando, con una disminución proporcional en su capacidad de cuidarse. En resumen, en los últimos años hemos conseguido avances diagnósticos y terapéuticos que deben permitir el relanzamiento de la DP como alternativa de TSR. Sus principales desafíos son, en la actualidad, su divulgación como forma inicial de tratamiento de la IRC y la optimización de sus resultados a medio y largo plazo. En la consecución de este objetivo será fundamental la utilización progresiva de líquidos de diálisis más biocompatibles y con mayor capacidad de ultrafiltración y extracción de sodio, que permitan compensar la pérdida de la FRR sin perjudicar la calidad de vida de los pacientes.
No existe conflicto de intereses.
Correspondencia: Dra. A. Rodríguez-Carmona. Servicio de Nefrología. Hospital Universitario Juan Canalejo. As Xubias, 84. 15006 A Coruña. España. Correo electrónico: acarmona@canalejo.org
Recibido el 18-6-2007; aceptado para su publicación el 10-8-2007.