El síndrome de hipotensión endocraneana (SHE) es una patología causada por el descenso del cerebro debido a fuga de líquido cefalorraquídeo a partir de lesiones durales diagnósticas, terapéuticas o espontáneas. Tanto la fisiopatología como el enfoque clínico y terapéutico son similares a la cefalea pospunción dural, siendo esta ultima considerada como una forma leve del SHE. Se describen 2 pacientes con cefalea ortostática y alteraciones neurológicas severas luego de anestesia epidural y espinal que fueron diagnosticados y tratados como cefalea pospunción dural, pero que por su evolución anormal debieron recibir atención adicional. El SHE constituye una complicación seria que puede llevar al deterioro clínico y a la muerte, motivo por el cual requiere de un abordaje integral sobre sus factores desencadenantes, cuadro clínico, métodos diagnósticos, fisiopatología y manejo
The intracranial hypotension syndrome (IHS) is a disorder caused by brain descent due to a CSF leak resulting from diagnostic, therapeutic or spontaneous lesions. The pathophysiology, the clinical and the therapeutic approach are similar as in post dural puncture headache, the latter being considered a mild form of IHS. This paper describes two patients with orthostatic headache and severe neurological involvement after epidural and spinal anesthesia, diagnosed and treated as post dural puncture headache, but who required additional care because of their abnormal course. IHS is a serious complication that may result in clinical decline and death; consequently, it requires a comprehensive approach to the various triggering factors, the clinical picture, diagnostic methods, pathophysiology and management.
Mujer de 24 años con hipoplasia mamaria, ASA I, a quien se le realizó mamoplastia de aumento bajo anestesia epidural y sedación. Se instauró un catéter peridural en T3-T4, con aguja calibre n.° 18, que requirió múltiples intentos para su ubicación, sin lesión evidente de duramadre; la prueba con 3ml de bupivacaína al 0,5% con epinefrina 1:200.000 fue negativa para administración subaracnoidea e intravenosa, luego se administró la mezcla anestésica. El procedimiento terminó sin complicaciones y continuó manejo ambulatorio.
Al tercer día postoperatorio, presentó mareo, vómito, cefalea ortostática y episodios pre-sincopales. Se inició manejo con AINE, y acetaminofén con codeína, reposo en cama, hidratación oral e intravenosa. Al día siguiente presentó nistagmo horizontal y diplopía, por lo cual se colocó un parche hemático.
Al quinto día persistía su cuadro clínico y se sospechó una lesión ocupante de espacio; la resonancia magnética nuclear (RMN) cerebral con gadolinio, fue normal. Se adicionó alprazolam y dimenhidrinato por vía oral.
A los 10 días siguientes mejoró su sintomatología, aunque persistía con mareo y vértigo leve con la deambulación. A las 4 semanas reinició sus labores cotidianas por completo, sin secuelas.
Caso 2Hombre de 24 años, sometido a cirugía de rodilla bajo anestesia espinal. Los días siguientes aparecieron gradualmente cefalea ortostática y diplopía horizontal. La RMN cerebral con gadolinio evidenció engrosamiento meníngeo difuso, y se inició tratamiento ambulatorio con analgésicos.
La cefalea progresó en intensidad y se asoció a náuseas y vómitos, síntomas que se exacerbaban con la deambulación.
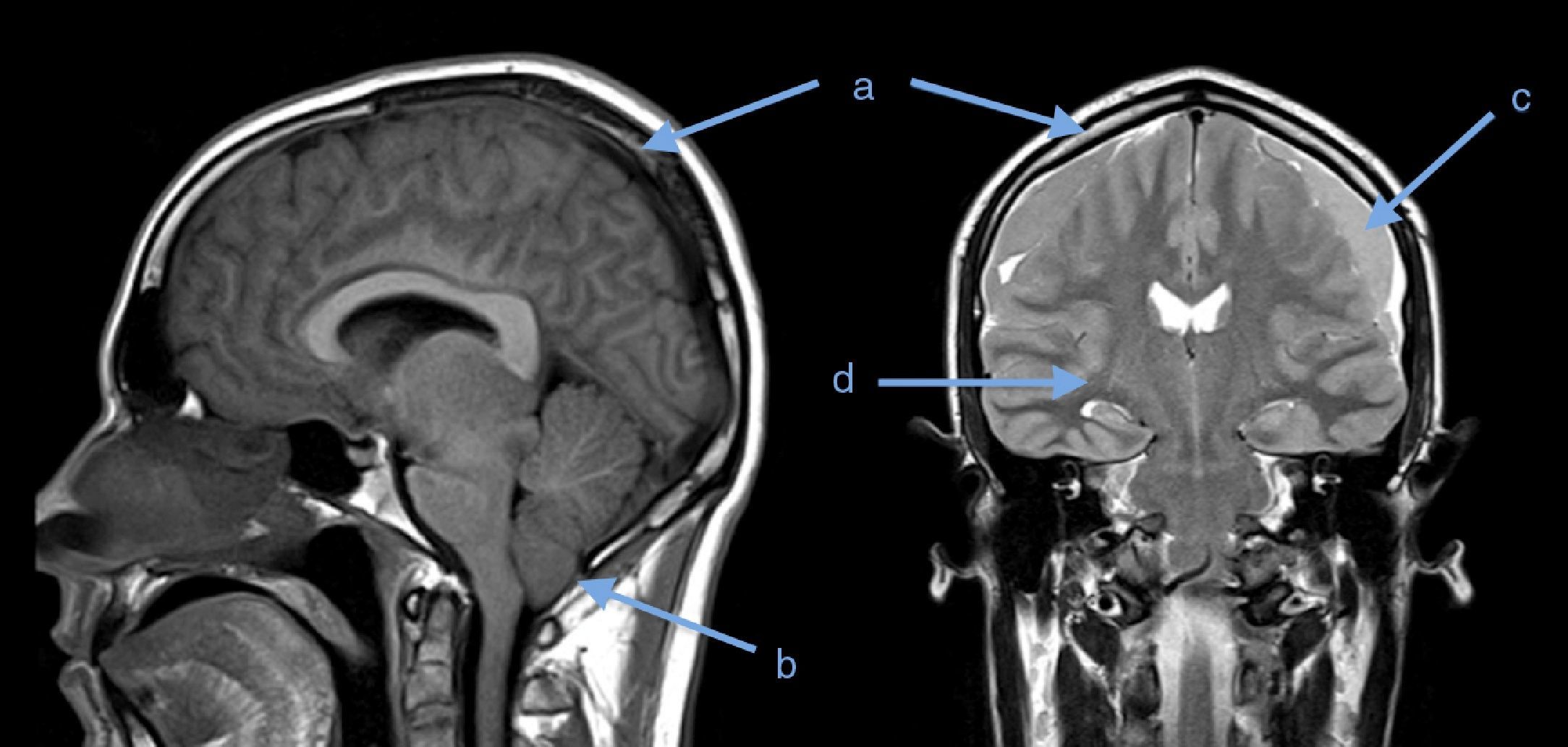
A los 20 días presentó somnolencia, episodios de desorientación y compromiso del sexto par craneal. Una nueva RMN cerebral evidenció edema cerebral difuso, hernia de amígdalas cerebelosas, inflamación meníngea difusa, colecciones subdurales frontotemporales bilaterales y algunos signos de sangrado en fase aguda (fig. 1).
Fue llevado a drenaje de hematoma subdural y tratamiento hospitalario postoperatorio durante 2 días con reposo absoluto e hidratación, con lo cual resolvió la totalidad de su sintomatología.
DiscusiónLos 2 pacientes desarrollaron cefalea ortostática y cambios neurológicos que fueron inicialmente evaluados y manejados como cefalea pospunción dural de presentación inusual o con complicaciones adicionales; sin embargo, el curso clínico de estos pacientes tiene una trasfondo mucho más importante, emergiendo el síndrome de hipotensión endocraneana (SHE) como el diagnóstico más acertado, que discutiremos a continuación.
¿Cuáles son los signos y síntomas del síndrome de hipotensión endocraneana?Comúnmente el cuadro clínico está caracterizado por cefalea ortostática, de características y localización variable, que se exacerba con la tos, la compresión yugular y las maniobras de Valsalva. Adicionalmente se puede experimentar compromiso de pares craneanos II, III, IV, VI y VIII y raíces nerviosas cervicales, todos de naturaleza ortostática, y en casos severos puede asociarse a deterioro de la conciencia y muerte1,2 (tabla 1).
Signos y síntomas según las estructuras afectadas
| Estructura afectada | Signos y síntomas |
| II par craneal | Fotofobia, amaurosis fugaz |
| Pares craneanos III, IV y VI | Diplopía, visión borrosa |
| VIII par craneal | Ataxia, mareo, vértigo, nistagmo, trastornos auditivos |
| Raíces cervicales | Dolor o rigidez cervical, dolor interescapular, síntomas radiculares |
| Misceláneos | Entumecimiento o debilidad facial, urgencia urinaria, galactorrea |
Fuente: autores.
El diagnóstico de este síndrome es eminentemente clínico, además del reconocimiento del factor desencadenante. Se pueden obtener algunas ayudas diagnósticas tal como la RMN cerebral y medular. La punción lumbar no se recomienda de rutina por el riesgo de deterioro neurológico ante el mayor déficit de líquido cefalorraquídeo (LCR)3.
¿Qué se encuentra en las imágenes diagnósticas?Aunque la RMN cerebral con gadolinio no se ha validado como prueba diagnóstica de SHE, se puede encontrar engrosamiento dural difuso con captación de gadolinio, aumento del volumen sanguíneo, descenso del cerebro, colecciones subdurales, hematoma subdural o hernia de amígdalas cerebelosas. Estos hallazgos tienen una correlación clínica: aparecen con mayor frecuencia e intensidad cuando los síntomas son severos y van desapareciendo a medida que estos disminuyen4,5.
La RMN medular con gadolinio puede mostrar colecciones de líquidos extra-aracnoideos, engrosamiento de paquimeninges espinales y venas epidurales dilatadas; en ocasiones identifica la fuga de LCR, e incluso si no está activa, puede mostrar acumulación de LCR6.
A nuestros pacientes se les realizó RMN cerebral. En el primer caso fue normal, probablemente por su baja sensibilidad para el diagnóstico de SHE; no obstante, una RMN medular podría haber ayudado a aclarar el diagnóstico o la ubicación de la probable fístula7. En el segundo caso, la primera RMN presenta un hallazgo sugestivo de este síndrome, y luego de 20 días ante un aumento de la sintomatología, la RMN de control evidencia progresión de los hallazgos imagenológicos y aparición de complicaciones: hernia de las amígdalas cerebelosas y colecciones subdurales.
¿Cuáles son las causas del síndrome de hipotensión endocraneana?La causa más frecuente es la fuga persistente de LCR, debida a punciones espinales diagnósticas o terapéuticas. También se ha descrito luego de craneotomía, cirugía espinal, trauma craneoespinal o colocación de un catéter ventrículo-peritoneal. En algunos casos puede aparecer espontáneamente8-10.
En los 2 pacientes hay un antecedente común de aplicación de anestesia conductiva, y aunque en el primer caso no hubo evidencia de lesión dural, no podemos descartar que haya ocurrido.
¿Cuál es la fisiopatología?El descenso del cerebro por fuga de LCR es la piedra angular de la fisiopatología, y explica su naturaleza ortostática. La tracción de meninges, venas cerebrales y cerebelosas, pares craneanos y raíces cervicales explica la mayoría de los síntomas. Esto también puede causar ruptura de venas cerebrales, lo que genera hematomas subdurales, como ocurrió con nuestro segundo paciente11-13.
La dilatación de las estructuras vasculares intracerebrales es otro mecanismo que ayuda a explicar la cefalea por cambios del tono vascular, galactorrea por hiperemia pituitaria y cambios en el LCR debidos a diapédesis de células y paso de proteínas al espacio subaracnoideo13,14.
¿Es la cefalea pospunción un síndrome de hipotensión endocraneana?La cefalea pospunción dural puede ser considerada una forma leve del SHE, en la cual el síntoma predominante es la cefalea ortostática; este y los otros signos y síntomas están incluidos en el SHE. En la RMN en ocasiones hay signos de engrosamiento dural. Asimismo los mecanismos fisiopatológicos y las estrategias de tratamiento son similares3. Sin embargo el límite entre la definición de cefalea pospunción y el grado de severidad para catalogar esta entidad como un SHE no está bien definido, convirtiendo esta discusión en una asignatura con múltiples aspectos pendientes por conocer.
¿Cómo es la evolución?La mayoría de reportes de caso y revisiones de la literatura refieren que el SHE con manejo adecuado es de curso clínico benigno, con recuperación total y sin secuelas15. Hay escasa información acerca del tiempo de inicio y duración; sin embargo, su similitud con la cefalea pospunción nos hace suponer que comienza dentro de los 3 primeros días luego de la lesión de duramadre, siendo poco frecuente su inicio inmediato, y la duración varía ostensiblemente de paciente a paciente16-18.
¿Cuáles son los diagnósticos diferenciales?La meningitis es un diagnóstico diferencial, debido a la cefalea, cambios neurológicos y antecedente de disrupción de la integridad meníngea; sin embargo, puede ser descartada mediante una punción lumbar con medición de la presión de apertura y análisis del LCR. Una presión de apertura menor a 6cmH2O es muy sugestiva de SHE3, a diferencia de la meningitis, donde frecuentemente se encuentra elevada.
El análisis de LCR puede ser normal en el SHE, pero puede haber proteinorraquia, pleocitosis linfocitaria, incremento de eritrocitos y/o xantocromía, niveles de glucosa y cultivos normales, hallazgos que no corresponden a meningitis3. Por tales motivos, es recomendado realizar punción lumbar cuando exista alta sospecha de meningitis.
Otro diagnóstico diferencial es una neoplasia intracerebral, entidad que se presenta con cefalea no ortostática y compromiso clínico localizado. En estos casos la RMN cerebral muestra la lesión ocupante de espacio.
¿Cómo debe ser el manejo?El manejo inicial es conservador, con descanso en decúbito para no desencadenar episodios de cefalea y disminuir la presión sobre el sitio de ruptura dural y así facilitar su cicatrización. Administrar cafeína o teofilina oral o intravenosa, terapia esteroidea y restaurar el volumen de LCR con hidratación oral o intravenosa, con incremento de la ingesta de sal e inhalación de CO2, pueden ayudar a la mejoría del SHE, aunque son pocos los estudios que han evaluado adecuadamente estas estrategias3,12,14-16.
Cuando estas medidas fallan, se debe considerar la aplicación del parche sanguíneo epidural, que tiene una efectividad del 85 al 90% y, en caso de no remisión de los síntomas, se puede repetir este procedimiento, con una probabilidad de éxito del 98%19. La perfusión continua de solución salina epidural durante 2-3 días es una opción terapéutica alternativa1.
Una opción a tener en cuenta es la corrección quirúrgica, especialmente si persiste la sintomatología a pesar de las estrategias previamente descritas y se ha evidenciado un defecto meníngeo o un hematoma subdural con afección clínica ostensible1,3.
En nuestro primer caso se pudo haber intentado un segundo parche sanguíneo ante la persistencia de sus síntomas, aunque mejoró progresivamente con indicaciones de reposo y manejo farmacológico.
En el segundo caso, el cuadro clínico se complicó con el desarrollo de un hematoma subdural intracraneano, probablemente por no seguir un plan de tratamiento adecuado para su estado. Es llamativa la mejoría luego del drenaje del hematoma subdural, lo cual probablemente disminuyó el descenso del cerebro; además, el reposo postoperatorio facilitó la corrección del probable defecto dural espinal.
En conclusión, el SHE es una entidad poco frecuente, probablemente subdiagnosticada y que complica el estado clínico de algunos pacientes sometidos a anestesia conductiva neuroaxial. La cefalea pospunción puede ser considerada una forma benigna de SHE. El diagnóstico y manejo adecuado favorecen la evolución y disminuyen la morbilidad asociada.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.