Durante el postoperatorio de cesárea se pueden utilizar diversas modalidades analgésicas, tanto farmacológicas como no farmacológicas. Este documento se centra en las diferentes estrategias farmacológicas disponibles.
ObjetivosEstablecer las ventajas y desventajas de las diferentes opciones farmacológicas usadas después de la cesárea para el control del dolor, mejorando la seguridad y la satisfacción de las pacientes.
MétodosSe realizó una búsqueda en Medline, Embase, Lilacs y The Cochrane Library con los términos «Cesarean section», «Cesarean pain», «Maternal risk» y «Analgesia for cesarean». Se revisaron artículos publicados en inglés y español en los últimos 20 años. Se excluyeron artículos duplicados, con contenido redundante o no pertinente, y aquellos con defectos metodológicos.
ResultadosLos opioides neuroaxiales son ampliamente utilizados para la analgesia postoperatoria en cesárea; sin embargo, deben usarse a dosis bajas para obtener el mejor perfil riesgo-beneficio. El uso de opioides sistémicos también es válido en estos pacientes, reduciendo la ocurrencia de algunos efectos adversos asociados a la administración intratecal. La analgesia multimodal ha demostrado ser efectiva para el control del dolor postoperatorio de cesárea, disminuyendo significativamente el consumo de opioides y los efectos adversos asociados.
ConclusionesEl pilar terapéutico analgésico en el postoperatorio de cesárea son los opioides, tanto en su administración neuroaxial como por vía parenteral, a pesar de los efectos adversos descritos en la literatura. El manejo multimodal con AINE o acetaminofén mejora el perfil de seguridad y la calidad de la analgesia, disminuyendo el requerimiento de opioides.
Several analgesic modalities –pharmacological and non-pharmacological– may be used during the cesarean section postoperative period. This document focuses on the different pharmacological strategies available.
ObjectivesTo establish the advantages and disadvantages of the various pharmacological options used to control pain following a C-section, improving safety and patient satisfaction.
MethodsA search was done in Medline, Embase, Lilacs, and The Cochrane Library using the terms “Cesarean section”, “Cesarean pain”, “Maternal risk”, and “Analgesia for cesarean”, reviewing articles published in both English and Spanish during the last 20 years. Duplicated articles, redundant or irrelevant content, and articles with methodological flaws were excluded.
ResultsNeuraxial opioids are widely used in postoperative cesarean section analgesia. However, they have to administered at low doses to ensure the best risk-benefit profile. The use of systemic opioids is also appropriate in these patients, reducing the occurrence of some adverse events associated with intrathecal administration. Multimodal analgesia has proven its effectiveness in postoperative pain control after cesarean delivery, significantly reducing the use of opioids and their associated adverse effects.
ConclusionsNotwithstanding the adverse effects described in the literature, the cornerstone of analgesia therapy after cesarean section are opioids, both neuraxial or parenteral administration. Multimodal management using NSAIDs or paracetamol, improves the safety profile and the quality of analgesia, reducing the opioid requirements.
La Organización Mundial de la Salud propone una tasa ideal de cesáreas menor del 15%1; sin embargo, recientemente el número de cesáreas ha aumentado, convirtiéndose en la cirugía abdominal más realizada en Estados Unidos2,3. En el 2008 la tasa de cesáreas en este país superó el 32% y en Colombia pasó del 24,9% en 1988 al 45,7% en 20134,5. En América Latina y el Caribe las tasas se incrementaron notoriamente del año 1990 al 2014 y permanecieron por encima de las de cualquier otra región6. En Brasil, en los sectores privados, pueden alcanzar hasta un 80-90%7.
El alivio del dolor en el postoperatorio de cesárea es sumamente importante, con el fin de optimizar el bienestar materno y neonatal8. La siguiente revisión expone la evidencia actual con respecto a las herramientas disponibles para el abordaje analgésico farmacológico durante el postoperatorio de cesárea.
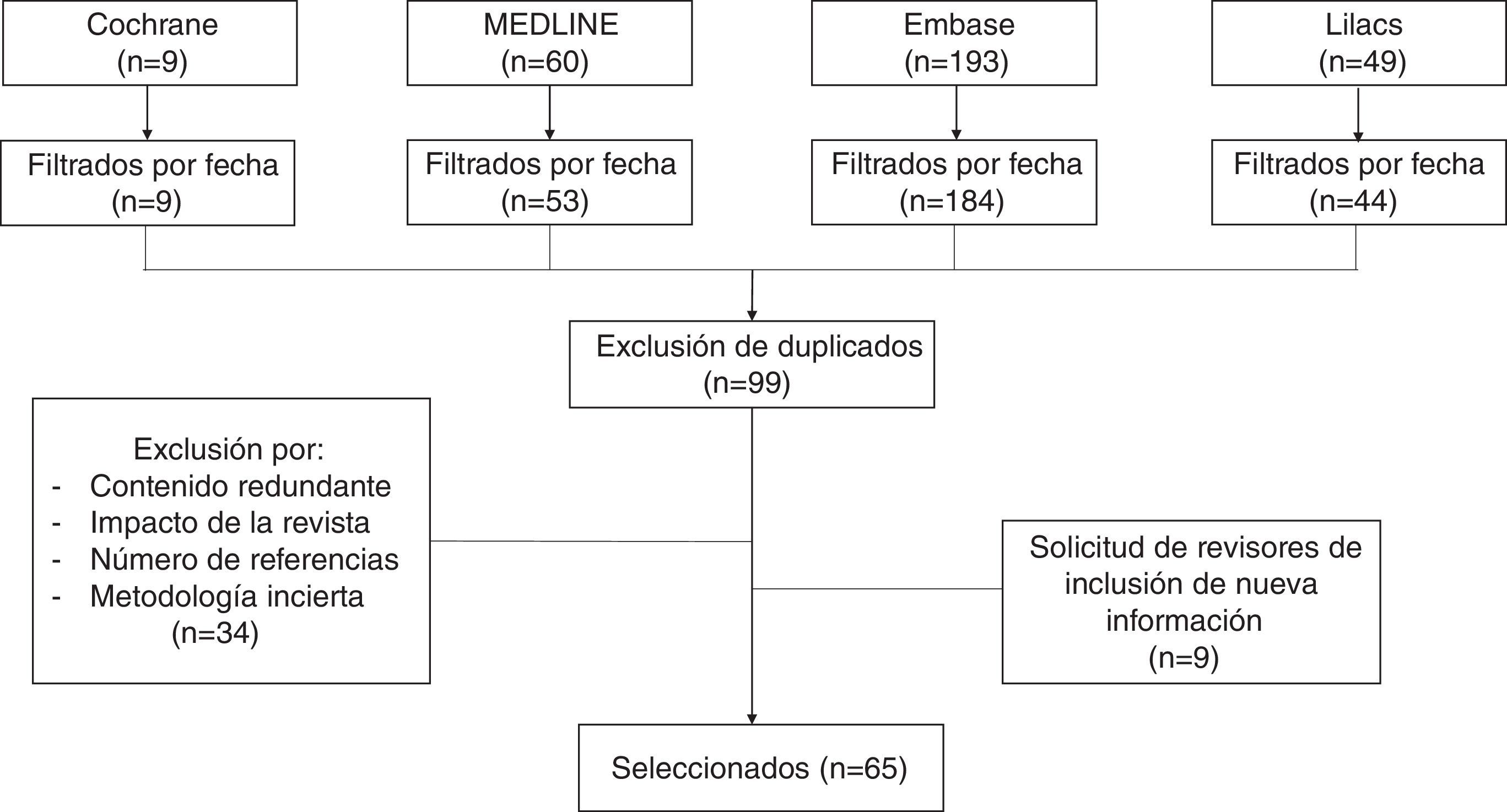
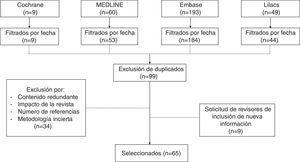
MétodosPara esta revisión no sistemática se consultaron las bases de datos Medline vía PubMed, The Cochrane Library, Embase y Lilacs con los términos «Cesarean section», «Cesarean pain», «Maternal risk» y «Analgesia for cesarean». Se revisaron ensayos clínicos, estudios de cohorte, casos y controles, e integrativos publicados en los últimos 15 años en inglés y español. Se eliminaron los artículos duplicados, con enfoque primario en el manejo analgésico durante el pre y el intraoperatorio, y aquellos con fallas metodológicas importantes (fig. 1). La revisión comenta estrategias farmacológicas con opioides intratecales y sistémicos, así como analgesia multimodal, estableciendo ventajas y desventajas de cada alternativa.
Opioides neuroaxialesEl uso de técnicas anestésicas neuroaxiales se ha relacionado con una disminución en la mortalidad materna asociada a la anestesia9. Sin embargo, el uso de morfina intratecal puede producir efectos secundarios como náuseas, vómitos, prurito, sedación y depresión respiratoria10. Las guías de anestesia obstétrica de la Asociación Americana de Anestesiología recomiendan considerar el uso de opioides neuroaxiales en lugar de bolos intermitentes parenterales con o sin rescates11. Aunque la administración por vía neuroaxial no está exenta de la aparición de efectos secundarios, estos son por lo general leves y autolimitados, considerando que los beneficios de la analgesia y la anestesia por esta vía de administración sopesan los riesgos12,13. Por otro lado, Carvalho y Butwick recomiendan que el manejo inicial para el dolor moderado sea basado en opioides orales (oxicodona, hidrocodona y tramadol) y que los opioides intravenosos sean reservados únicamente para casos de dolor severo o pacientes con intolerancia a la vía oral14, ya que, aunque los opioides intravenosos no proporcionan mejor control que los orales, tienen la desventaja de presentar una mayor incidencia de efectos adversos14,15.
La evidencia sobre la relación entre la dosis de morfina intratecal y el efecto analgésico es contradictoria, ya que la dosis necesaria para proporcionar una analgesia postoperatoria óptima en cesárea, con la menor incidencia posible de efectos secundarios, aún no se ha determinado16. Wong et al. demostraron que 200μg de morfina intratecal proporcionaban una mejor analgesia postoperatoria que 100μg. No obstante, las pacientes que recibieron la dosis más alta tuvieron una mayor incidencia de náuseas17.
Sultan et al. mostraron que en pacientes sometidas a cesárea bajo anestesia espinal con dosis bajas (50-100μg) y altas (>100-250μg) de morfina, las dosis altas prolongaban el tiempo de analgesia después de la cesárea en comparación con las dosis bajas, sin diferencias significativas en desenlaces neonatales establecidos por el Apgar o en la incidencia de náuseas y vómitos maternos18.
Otro estudio evidenció que una dosis de 50μg de morfina intratecal proporcionaba una analgesia de igual calidad que una dosis de 100μg, pero con menor incidencia de efectos secundarios. Adicionalmente, propuso que todas las pacientes intervenidas de cesárea deben tener acceso a medicación analgésica suplementaria sistémica, debido a que un número importante de pacientes refería dolor entre moderado y severo, independiente de la dosis de morfina utilizada19.
Efectos adversos de los opioides neuroaxialesSi bien la morfina intratecal se considera el opioide neuroaxial «gold standard»20, aún se reportan numerosos efectos adversos relacionados con su dosis.
Uno de los efectos adversos más graves asociado al uso de opioides neuroaxiales es la depresión respiratoria. Las pacientes obstétricas con un alto índice de masa corporal, administración previa de opioides, infusión de sulfato de magnesio y comorbilidades respiratorias tienen mayor riesgo de desarrollar depresión respiratoria en este contexto. De igual manera, las concentraciones elevadas de progesterona en el embarazo otorgan cierta protección frente a la misma, pues la progesterona es un estimulante del centro respiratorio21. La Asociación Americana de Anestesiología publicó una actualización sobre el abordaje de depresión respiratoria asociada a los opioides neuroaxiales22:
- 1.
Monitorizar a los pacientes, asegurando una adecuada ventilación, oxigenación y estado de conciencia.
- 2.
Asegurar monitorización adicional en pacientes con un mayor riesgo de depresión respiratoria (condición médica inestable, obesidad, apnea obstructiva del sueño, administración concomitante de analgésicos opioides o hipnóticos por otras vías, edades extremas).
- 3.
Fentanilo:
- a.
Monitorizar durante un mínimo de 2h después de la administración.
- b.
Monitorizar continuamente durante los primeros 20min, y después al menos una vez por hora hasta completar 2h.
- c.
Después de 2h, la frecuencia de monitorización depende de la condición clínica del paciente y de los medicamentos adicionales administrados.
- a.
- 4.
Morfina:
- a.
Monitorizar durante un mínimo de 24h después de la administración.
- b.
Monitorizar al menos una vez por hora durante las primeras 12h, y luego al menos una vez cada 2h durante las 12h siguientes.
- c.
Después de 24h, la frecuencia de monitorización depende de la condición clínica del paciente y de los medicamentos adicionales administrados.
- a.
En caso de presentarse la depresión respiratoria, se recomienda lo siguiente:
- 1.
Administrar oxígeno suplementario si hay alteración del estado de conciencia, frecuencia respiratoria menor de 10rpm o saturación de oxígeno menor de 90%. Continuarlo hasta que el paciente esté alerta, sin signos de depresión respiratoria o hipoxemia.
- 2.
Mantener los accesos venosos.
- 3.
Tener disponibilidad inmediata de agentes reversores.
- 4.
Considerar la ventilación no invasiva con presión positiva.
Frente a otras alternativas analgésicas como los opioides sistémicos, los opioides administrados por vía neuroaxial tienen una mayor incidencia de efectos adversos. En cuanto a las náuseas postoperatorias, el riesgo de presentarlas es significativamente mayor al usar opioides neuroaxiales (RR 1,95; IC 95% 1,17-3,26; p=0,01), al igual que el riesgo de prurito (RR 2,71; IC 95% 2,05-3,58; p<0,00001)23.
Analgésicos no opioides por vía neuroaxialEl uso de medicamentos no opioides coadyuvantes a nivel neuroaxial ha sido tema de gran interés, al disminuir la dosis de opioide y, por ende, sus efectos secundarios. Se ha demostrado que pueden prolongar el efecto analgésico de los mismos. No obstante, los efectos secundarios asociados son importantes, lo que limita su uso de rutina24. La clonidina está asociada a una sedación considerable y labilidad hemodinámica25, mientras que la neostigmina produce náuseas y emesis severas al administrarse por vía intratecal. Con la administración epidural, además de disminuir la dosis requerida de analgésico local, disminuye el prurito y no aumenta significativamente el riesgo de hipotensión, sedación o de efectos adversos fetales26.
Khezri et al. observaron que la administración de ketamina junto con la bupivacaína a dosis de 0,1mg/kg en cesárea electiva prolongaba el tiempo de solicitud de analgésicos y disminuía el consumo total en las primeras 24h27.
La administración de dexmedetomidina por vía intratecal prolonga la duración del bloqueo motor y sensitivo con una disminución de los requerimientos analgésicos28. La dexmedetomidina ha demostrado superioridad frente al fentanilo, ya que facilita la propagación y brinda una mayor duración de la analgesia, con una menor incidencia de náuseas y vómitos29,30. Magdy et al. estudiaron su efecto en la cesárea electiva, describiendo una adecuada analgesia postoperatoria, sin presencia de efectos adversos maternos y neonatales31,32. Se recomiendan dosis entre 5 y 10μg, ya que dosis superiores a 15μg se relacionan con hipotensión y bradicardia28,33,34.
La gabapentina disminuye algunos efectos adversos de los opioides, como el vómito y el prurito, pero a costa de una mayor sedación y potencial transferencia a la leche materna. Por esta razón solo se recomienda su uso como manejo de última línea o en el contexto de la paciente con dolor crónico14.
Opioide sistémicoLa analgesia controlada por el paciente (PCA) es un sistema de autoadministración del medicamento que evita el circuito paciente-enfermera-inyección, ahorrando un tiempo valioso en el control del dolor agudo y reduciendo los picos y valles en las concentraciones plasmáticas del fármaco, obteniendo una mayor satisfacción del paciente35. Sin embargo, el grado de satisfacción parece ser mayor con el uso de PCA36.
La Asociación Americana de Anestesiología recomienda el uso de opioides neuroaxiales en lugar de bolos intermitentes parenterales para la analgesia postoperatoria en la cesárea, pero su uso rutinario suele estar limitado por la disponibilidad del personal necesario para monitorizar los posibles efectos secundarios37.
La analgesia epidural tiene un mejor control del dolor que la PCA, pero es más costosa, por lo que la segunda se considera la alternativa más costo-efectiva38. Patel et al. demostraron una reducción en los costos respecto a la PCA usando opioide neuroaxial, con una mayor costo-efectividad asociada al uso de morfina intratecal39.
En cuanto a los efectos adversos de los opioides por PCA, parece ser que los más frecuentes son la sedación excesiva, la cual suele ser transitoria y presentarse al comienzo del trabajo de parto, y episodios de desaturación leve y autorresolutivos en pacientes que no recibieron oxígeno suplementario. Aun cuando estos efectos suceden, no suelen afectar el desarrollo del trabajo de parto ni la satisfacción materna40,41.
Existe poca información relacionada con el perfil de seguridad de la oxicodona durante la lactancia, a pesar de que su uso es común en este contexto15. Lam et al. concluyeron que no brinda mayor seguridad respecto a la codeína42. Seaton et al. estudiaron la administración oral de oxicodona, obteniendo un adecuado control del dolor con un riesgo bajo para los lactantes. Sin embargo, este estudio se limitó a las 72h posparto43. No se recomienda el uso de codeína, ya que la variabilidad metabólica y farmacogenómica puede afectar la eficacia del medicamento y los efectos secundarios neonatales44.
Edwards et al. demostraron la utilidad de la hidromorfona, con una potencia 7 veces mayor a la de la morfina y la posibilidad de múltiples vías de administración. No se ha estudiado detalladamente su uso en el postoperatorio de cesárea; sin embargo, se considera que dosis bajas no afectan al lactante. Aunque su paso a la leche materna es menor que el de otros agentes narcóticos, se recomienda precaución en su uso45,46.
El opioide que pasa a la leche materna en mayor medida es la morfina, llegando a dosis relativas que pueden llegar a ser perjudiciales para el recién nacido. En segundo lugar está la oxicodona, con dosis cercanas a las nocivas. El que tiene menor paso es el fentanilo. Por otra parte, durante los primeros días posparto el calostro producido por la madre es muy poco, lo que limita el posible paso de opioides al neonato14. Aunque los eventos neonatales adversos secundarios al uso de opioides maternos son poco frecuentes, Hendrickson y McKeown recomiendan su uso racional durante la lactancia, administrando el fármaco más seguro disponible47. Anderson et al. concluyen que aunque los opioides se encuentran entre los medicamentos con mayor tasa de efectos adversos para el lactante (25%), si se utilizan a bajas dosis, por cortos periodos de tiempo y evitando su combinación con otros depresores del sistema nervioso central es improbable que se produzcan efectos adversos48. La Organización Mundial de la Salud recomienda que al usar morfina y codeína se utilicen dosis bajas, se eviten las dosis repetidas, se monitoricen los efectos secundarios del lactante (apnea, bradicardia y cianosis) y que se suspendan ante la presencia de alguno de ellos49.
Otros analgésicos sistémicosLos AINE utilizados para analgesia multimodal disminuyen el consumo de opioides y sus efectos secundarios, y en algunos casos se ha demostrado que reducen el puntaje en la escala visual análoga del dolor50,51.
Berger et al. compararon 3 dosis de morfina intratecal (50 -100-150μg) combinadas con ketorolaco por horario, determinando la relación dosis-respuesta, la eficacia analgésica y los efectos secundarios. No se encontraron diferencias en el consumo de morfina durante las primeras 24h, ni en los desenlaces de dolor y náuseas. Hubo una mayor incidencia de prurito en los grupos de dosis altas que en el grupo de 50μg. No se produjo depresión respiratoria o sedación significativa. Los resultados evidencian que 50μg de morfina intratecal producen una analgesia similar a la producida con dosis de 100 o 150μg cuando se utilizan concomitantemente con ketorolaco intravenoso por horario52.
Bozkurt et al. compararon diclofenaco y meperidina para la analgesia postoperatoria de cesárea. Los pacientes que recibieron solamente diclofenaco no presentaron un adecuado control del dolor. Sin embargo, al combinarlo con meperidina el puntaje de la escala visual análoga de dolor fue similar al del grupo que era tratado únicamente con dosis más altas de meperidina, demostrando la eficacia del diclofenaco como parte de un esquema de analgesia multimodal53.
Hyllested et al. describieron el uso de acetaminofén en pacientes de alto riesgo debido a su baja incidencia de efectos adversos54. El uso combinado de acetaminofén con diclofenaco demostró una disminución del 38% en el consumo de morfina en comparación con pacientes que solo recibían acetaminofén55. En otro estudio, la administración de acetaminofén por horario resultó en una disminución en el consumo de opioides por PCA56. Ozmete et al. comprobaron que 1g de acetaminofén preoperatorio era efectivo en la reducción del dolor y de los requerimientos de opioides57.
La analgesia multimodal tiene beneficios para el lactante, ya que tanto el acetaminofén como el ibuprofeno se consideran seguros y compatibles con la lactancia materna, y al disminuir los requerimientos de opioides, reduce los efectos adversos atribuibles al paso de estos a la leche materna42,43,58,59.
Fosbøl et al. hallaron un aumento en la morbimortalidad por causas cardiovasculares asociado al uso de AINE, particularmente diclofenaco y rofecoxib60. Fernández-Liz y Romero Suau proponen el naproxeno y el ibuprofeno a dosis bajas (hasta 1.200mg/día) como la alternativa más segura61. Olsen et al. describieron un aumento estadísticamente significativo en la mortalidad con el uso de todos los AINE, independiente de la duración del tratamiento. Un estudio de seguimiento de esta cohorte describió que el riesgo cardiovascular permanece elevado al reiniciar el manejo con AINE, incluso después de 5 años de ocurrido un evento coronario62. Varios metaanálisis concluyeron que el naproxeno es el más seguro, aun a dosis altas63,64. Es importante mencionar que el riesgo no se limita a pacientes con historia previa de enfermedad cardiovascular, ya que aquellos previamente sanos pueden verse afectados por el uso indiscriminado de AINE65.
Los AINE selectivos, en particular el parecoxib, son útiles para el manejo del dolor, causando menos úlceras gastrointestinales que los no selectivos. Tampoco afectan la agregación plaquetaria, disminuyendo el sangrado postoperatorio. No inducen broncoespasmo en pacientes sensibles, como tampoco aumentan la incidencia de eventos tromboembólicos. No obstante, no hay diferencias respecto a los efectos adversos a nivel renal66. Inthigood et al. estudiaron los efectos del parecoxib como complemento al opioide neuroaxial, encontrando que el grupo que recibió parecoxib tenía puntajes de dolor más bajos, sin diferencias en el requerimiento de opioides postoperatorios67. El paso a la leche materna del metabolito activo del parecoxib es mínimo, siendo improbable que afecte al lactante68.
La Sociedad Americana de Dolor desarrolló una guía de manejo del dolor postoperatorio en la cual se destaca la importancia del uso de ketamina intravenosa en el manejo analgésico multimodal en las cirugías realizadas con mayor frecuencia. Sin embargo, no se cuenta con evidencia suficiente en el uso de ketamina en el manejo postoperatorio de cesárea69. Laskowski et al. describieron un menor consumo de opioides y un mayor tiempo entre rescates en cirugías de tórax, abdomen superior y ortopédicas70, pero Han et al. no encontraron ninguna disminución en el consumo de opioides al utilizar ketamina intravenosa como coadyuvante al uso de PCA de fentanilo71. Senapathi et al., en pacientes intervenidas de cesárea de urgencia no evidenciaron diferencias significativas en el puntaje de la escala visual análoga del dolor, pero observaron que el uso de ketamina intravenosa a dosis bajas, previa a la colocación de anestesia espinal, disminuía la respuesta inflamatoria al estrés quirúrgico evidenciado por los niveles de proteína c reactiva72. Rahmanian et al. describieron una disminución en dolor, consumo de opioides y efectos adversos al usar ketamina a dosis bajas (0,2mg/kg)73. Cabe anotar que el Apgar del recién nacido no se ve afectado por el uso de ketamina a bajas dosis72.
Una revisión sistemática de Cochrane sobre analgesia oral durante el postoperatorio de cesárea concluyó que los estudios disponibles eran escasos y con una población reducida, por lo que no era posible establecer el analgésico oral más efectivo para el alivio del dolor con la menor incidencia de efectos adversos. Los estudios no reportaban consistentemente desenlaces neonatales, días de hospitalización o costos del tratamiento, por lo que no se puede concluir al respecto74.
ConclusionesExisten múltiples modalidades para el manejo farmacológico del dolor postoperatorio en cesárea. El pilar terapéutico son los opioides. Por la frecuencia con que se presentan efectos adversos después de su administración, y por la severidad de los mismos, toda paciente que reciba manejo analgésico con opioides debe estar adecuadamente monitorizada y tener fácil acceso a oxígeno y a medicamentos reversores22. En caso de no contar con los medios para administrar de manera segura opioides por vía neuroaxial, es posible inyectarlos de forma parenteral obteniendo un adecuado control del dolor y satisfacción de la paciente36–38.
Las recomendaciones actuales incluyen la terapia multimodal, la cual mejora la calidad de la analgesia, disminuye el requerimiento de opioides, reduce efectos adversos y aumenta la seguridad materna y neonatal51,52,55–57.
FinanciaciónLa realización de esta revisión fue financiada en su totalidad con recursos propios del Departamento de Anestesia de la Fundación Santa Fe de Bogotá.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses para la publicación de este artículo.